miR-153-3p 对于腰退行性病变调节机制的初步探讨
2023-09-23龚东平梁楼峰梁安伟许夏懿梁华新
庾 珊,肖 林,龚东平,梁楼峰,梁安伟,许夏懿,林 杰,梁华新
(广西中医药大学附属国际壮医医院 疼痛科,南宁 广西 530200)
我国不同地区报道的成人腰痛患病率为7.21%~39.0%,年患病率为 20.88%~29.88%,已经成为我国一个非常严峻的公共卫生问题[1],而腰椎间盘退变(lumbar disc degeneration,LDD)是导致下腰痛的重要因素[2]。椎间盘是人体最大的乏血管神经的组织,当椎间盘发生退变 时血管神经向椎间盘内延伸,极易诱发椎间盘退变,进而出 现腰痛,但其具体的发病机制有待深入探讨。髓核(nucleus pulposus,NP)细胞是椎间盘中主要的细胞,其异常增殖或过度凋亡是LDD 中最明显的细胞和生化变化之一。而H2O2和miR-153-3p可能是调节这一过程的重要因素之一。本研究旨在阐明H2O2对于腰椎髓核细胞的影响及初步探讨miR-153-3p 对于腰退行性病变的调节机制。
1 材料与方法
1.1 标本来源
本实验研究标本采用从Sciencell 公司购买正常腰椎髓核细胞:Human Nucleus Pulposus Cells,Catalog #4800。
1.2 实验分组
实验分为:(1)对照组;(2)H2O2组;(3)miR-153-3p inhibitor NC(以下简称inhibitor-NC 组);(4)miR-153-3p inhibitor(以下简称inhibitor 组)。总例数n=48,每组例数n=12。
1.3 标本处理方法
对照组:采用髓核细胞培养基(DMEM 细胞培养液、品牌:GIBCO)体外培养;H2O2组:髓核细胞培养基体进行体外培养,并予200 μmol/L H2O2处理6 h;inhibitor 组:加入miR-153-3p inhibitor,是一段序列跟miR-153-3p 序列互补的抑制序列miRNA;inhibitor-NC 组:miR-153-3p inhibitor NC 是一段无功能序列的miRNA,起对照作用。实验时,按照要求将加入对应分组的RNA。
1.4 检测方法
1.4.1 RT-qPCR 检测miR-153-3P、COL-Ⅱ、MMP3、Nrf2 总RNA 提取后,反转录cDNA,根据试剂盒说明书进行9PCR。反应条件95℃,30 s 预变性,95℃ 5 s,60℃ 35 s 共40 个循环。相对表达量用2-△△Ct法计算,引物序列见表1。

表1 RT-qPCR 引物序列Tab.1 Rt-qPCR primer sequence
1.4.2 WesternBlot 检测Nrf2 表达加入裂解液提取总蛋白,蛋白浓度用BCA 法测定。随后进行电泳,转膜,封闭1.5 h,4 ℃加封闭液稀释的一抗过夜后,TBST 洗膜,加封闭液稀释的二抗37 ℃孵育90 min,加入显影液显影,利用蛋白条带的吸光度计算蛋白表达量。
1.5 检测指标
实验分两部分进行:(1)采用CCK8 检测对照组及H2O2组细胞活力,流式检测两组细胞活性氧及线粒体膜电位,另外采用qPCR 检测上述两组的基质金属蛋白酶3(MMP3)、Nrf2、miR-153-3p、Ⅱ型胶原(COL-Ⅱ)表达含量。(2)采用qPCR 检测对照组、miR-153-3p inhibitor-NC 组及miR-153-3p inhibitor 组的Nrf2、miR-153-3p表达含量;采用Westernblot 检测对照组、miR-153-3p inhibitor-NC 组及miR-153-3p inhibitor 组的Nrf2 表达含量。
1.6 统计学处理
2 结果
2.1 H2O2 对髓核细胞活性影响
用CCK8 检测对照组、H2O2组的细胞活力进行检测,结果提示经H2O2处理的腰椎髓核细胞活力较对照组明显下降,差异具有统计学意义(P< 0.05),见表2。
表2 C CK8 检测对照组、H2O2 组细胞活力比较[()%]Tab.2 Comparison of cell viability between CCK8 control group and H2O2 group [()%]
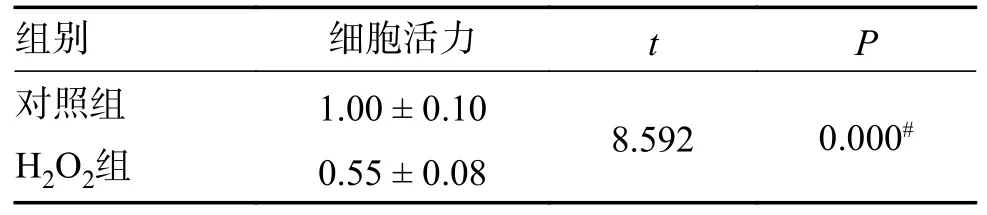
表2 C CK8 检测对照组、H2O2 组细胞活力比较[()%]Tab.2 Comparison of cell viability between CCK8 control group and H2O2 group [()%]
2.2 用流式细胞检测对照组、H2O2 组的细胞活性氧、线粒体膜电位
结果提示经200 μmol/L H2O2处理的腰椎髓核细胞活性氧含量明显增加(P< 0.05,差异具有统计学意义);H2O2组细胞线粒体膜电位较对照组明显降低(P< 0.05,差异具有统计学意义),提示H2O2处理的腰椎髓核细胞线粒体膜电位降低,见表3,表4。
表3 流式检测对照组、H2O2 组细胞活性氧()Tab.3 Flow detection of reactive oxygen species in control group and H2O2 group()

表3 流式检测对照组、H2O2 组细胞活性氧()Tab.3 Flow detection of reactive oxygen species in control group and H2O2 group()
表4 流式检测对照组、H2O2 组细胞线粒体膜电位()Tab.4 Flow cytometry detection of mitochondrial membrane potential in control group and H2O2 group()

表4 流式检测对照组、H2O2 组细胞线粒体膜电位()Tab.4 Flow cytometry detection of mitochondrial membrane potential in control group and H2O2 group()
注:经正态性检验,两样本符合正态分布,采用两独立样本的t检验。*P < 0.05。
2.3 采用qPCR 检测对照组、H2O2 组的miR-153-3p、COL-Ⅱ、MMP3、Nrf2 表达含量
结果提示对照组、H2O2组Nrf2 表达量无明显差异(P> 0.05),H2O2组的miR-153-3p、MMP3表达量较对照组明显减少,而其COL-Ⅱ表达量较对照组明显减少(P< 0.05,差异具有统计学意义),见表5。
表5 qPCR 检测对照组、H2O2 组相关miRNA 或mRNA 相对表达量()Tab.5 Relative expression levels of miRNA or mRNA in control group and H2O2 group detected by qPCR()
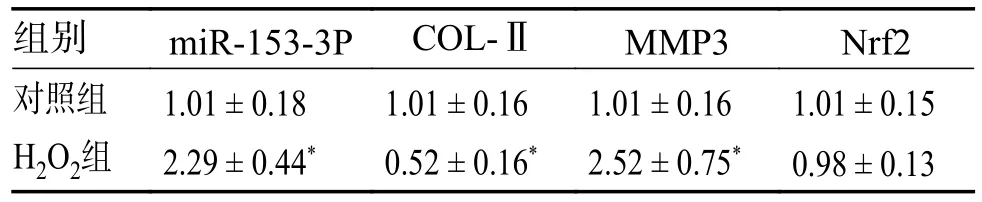
表5 qPCR 检测对照组、H2O2 组相关miRNA 或mRNA 相对表达量()Tab.5 Relative expression levels of miRNA or mRNA in control group and H2O2 group detected by qPCR()
与对照组相比,*P < 0.05。
2.4 采用qPCR 检测对照组、miR-153-3p inhibitor-NC 组 及miR-153-3p inhibitor 组的Nrf2、miR-153-3p 相对表达量
结果提示:与对照组、inhibitor-NC 组相比,inhibitor 组 的miR-153-3p 表达量降低、Nrf2 表达量增高(P< 0.05,差异具有统计学意义);而inhibitor-NC 组与对照组的Nrf2、miR-153-3p 表达量无明显差异(P> 0.05),见表6,图1。
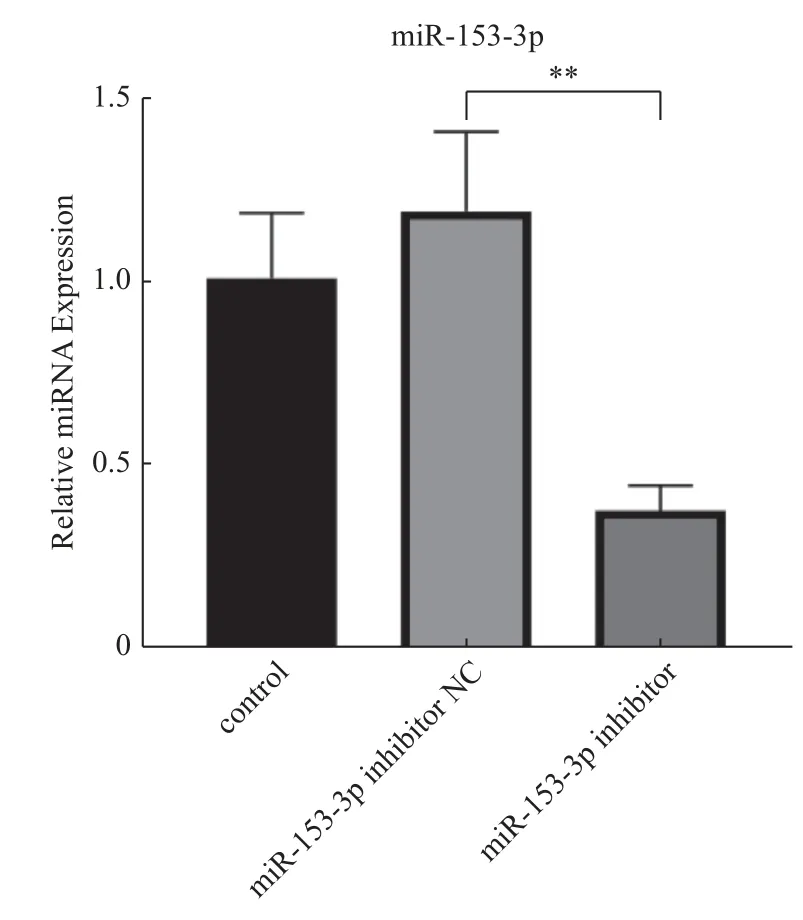
图1 qPCR 检测3 组miR-153-3p 相对表达量图Fig.1 Relative expression of miR-153-3p in the three groups detected by qPCR
表6 qPCR 检测3 组的Nrf2、miR-153-3p 相对表达量()Tab.6 Relative expression levels of Nrf2 and miR-153-3p in the three groups detected by QPCR()

表6 qPCR 检测3 组的Nrf2、miR-153-3p 相对表达量()Tab.6 Relative expression levels of Nrf2 and miR-153-3p in the three groups detected by QPCR()
*P < 0.05。
2.5 采用Westernblot 检测对照组、inhibitor-NC 组及nhibitor 组的Nrf2 表达含量
结果提示,与对照组、inhibitor-NC 组相比,inhibitor 组胞质及胞核中Nrf2 表达量增高(P<0.05,差异具有统计学意义),而inhibitor-NC 组胞质及胞核中Nrf2 表达量与对照组无明显差异(P> 0.05),见表7。
表7 Westernblot 检测3 组的Nrf2 相对表达量()Tab.7 Relative expression of Nrf2 in the three groups detected by Westernblot()
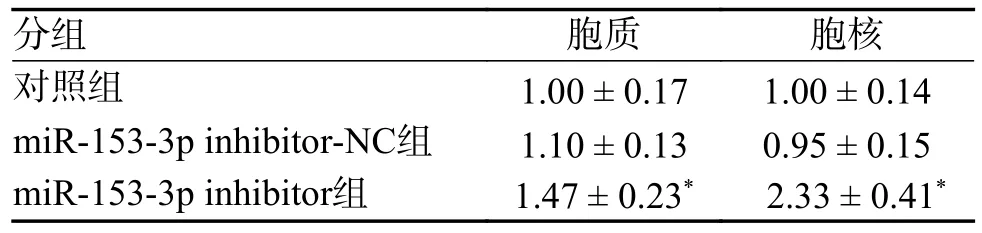
表7 Westernblot 检测3 组的Nrf2 相对表达量()Tab.7 Relative expression of Nrf2 in the three groups detected by Westernblot()
与对照组,inhibitor-NC组相比,*P < 0.05。
inhibitor-NC 组胞质及胞核中的Nrf2 表达量与对照组比较,P> 0.05,差异无统计学意义,见图2。
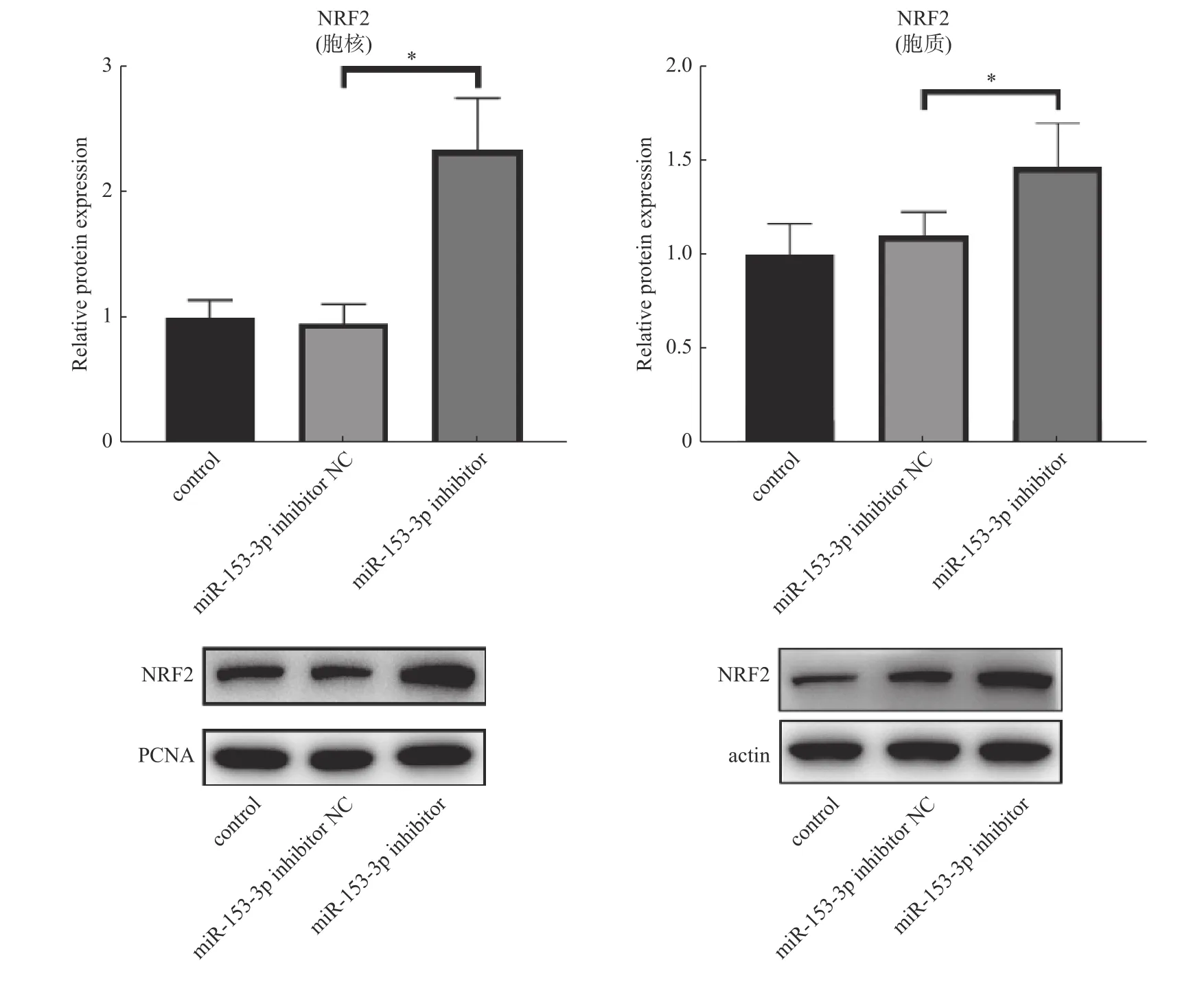
图2 Westernblot 检测3 组的Nrf2 相对表达量Fig.2 Relative expression levels of Nrf2 detected by Western blot in the three groups.
3 讨论
3.1 NPCs 退变和ECM 代谢失衡是LDD 的主要病理特征
椎间盘主要由外周的纤维环、中央的髓核和上下终板组成。髓核和纤维环的细胞数量较少,但细胞外基质(ECM)丰富,约占整体的99%,后者主要由胶原(Ⅰ、Ⅱ型)和蛋白聚糖组成。髓核细胞(NPCs)可产生蛋白聚糖、Ⅱ型胶原和其他ECM 因子,有利于维持椎间盘完整性。LDD 是一个复杂的过程,典型特征是ECM 成分的丢失。LDD 的早期退变出现在NPCs 中,表现为水和蛋白聚糖的丢失,NPCs 功能退化,合成分泌Ⅱ型胶原及蛋白聚糖的能力减弱,ECM 合成与分解代谢失衡,使椎间盘结构与成分发生变化,导致椎间盘功能减弱或丧失[3],引起神经痛甚至功能障碍。
在正常椎间盘中,ECM 合成和降解处于动态平衡状态,其代谢依赖于基质金属蛋白酶(MMPs)、蛋白聚糖酶与基质金属蛋白酶组织抑制剂(TIMPs)之间的平衡调节[4]。MMPs 是一类蛋白水解酶,可降解除多糖外的几乎所有ECM 成分。蛋白聚糖酶是解聚素样金属蛋白酶家族的重要成员(ADAMTSs),主要降解蛋白聚糖。MMPs 和ADAMTSs 的活性可被内源性特异性的TIMPs 所抑制。研究发现,在不同退变程度的人髓核组织样本中,MMPs 和ADAMTSs 表达明显升高,TIMPs 表达与椎间盘退变程度呈负相关[5],因而会导致ECM 成分降解增强,引起椎间盘结构和成分的改变,最终导致LDD。故MMPs、ADAMTSs与TIMPs 之间的失衡在LDD 的发病机制中发挥重要作用。
3.2 氧化应激通过激活多种通路影响NPCs 功能以及ECM 代谢,进而介导LDD
LDD 病因复杂,越来越多的证据表明年龄、性别、环境、行为影响、氧化应激、炎症和遗传与LDD 风险相关[6]。其中,氧化应激能够通过加速椎间盘细胞的衰老、凋亡,调节细胞自噬以及ECM 的合成与降解等多种途径介导椎间盘的退变,被认为是引起LDD 的主要因素之一。活性氧簇(ROS)是细胞氧化代谢过程中的必然产物,广泛参与信号转导,代谢调节、程序性细胞死亡,衰老和椎间盘的表型转换等[7]。当各种原因造成机体内ROS 产生增多或机体对抗ROS 能力下降时,机体处于氧化应激状态,此时ROS 可通过细胞膜直接造成DNA、蛋白质、脂质的氧化损伤,从而引起NPCs 功能损伤。在本实验中,H2O2组中腰椎髓核细胞活性氧含量增加、MMP3 表达增加、Col Ⅱ含量下降,可以说明氧化应激可以影响NPCs 功能以及ECM 代谢,进而介导LDD。而这一进程可能与ROS 可激活p38MAPK、Wnt/βcatenin 等多种可引起炎症反应的信号通路有关[8-9]。
3.3 线粒体自噬清除受损线粒体,减少ROS 积聚,miR153/Nrf2/PINK1 通路在其中发挥重要作用
在本实验中,H2O2处理的腰椎髓核细胞线粒体膜电位下降,说明H2O2诱导的NPCs 衰老和凋亡与线粒体功能障碍有关。线粒体是产生ROS 的能量工厂,线粒体自噬是神经退行性疾病中重要的细胞抗氧化途径,通过自噬途径对受损线粒体的选择性降解,在氧化应激过程中改善线粒体功能障碍,维持线粒体质量控制。大量研究表明,线粒体自噬可以保护NPCs 免受线粒体途径诱导的氧化应激、衰老、细胞凋亡[10-12]。
Nrf2 作为一种可以调节含有细胞保护基因的抗氧化反应元件(ARE)的表达的转录因子,可进入细胞核并与包含靶基因的ARE 序列结合,可激活靶基因的转录,参与氧化应激和ROS 代谢过程。最近研究证实,在神经元中,Nrf2 通过激活PINK1 启动子的ARE 序列,进而上调PINK1,PINK1 通过清除受损的线粒体和减少ROS 等多种机制参与线粒体稳态的维持,使细胞在细胞存活方面具有优势[13-14]。此外,通过Nrf2/PINK1 途径可调节和减弱管状细胞的氧化应激损伤和凋亡以维持线粒体质量,由此激活PINK1/Parkin 诱导的线粒体自噬,影响下游Drp1 和Mfn2 表达量,最终可改善ROS 的生成。
microRNA(miRNAs)是一类非编码小RNA,参与细胞增殖、ECM 代谢、自噬、炎症反应、氧化应激、凋亡、线粒体功能调节等多种细胞活动,介导多种生理和病理反应。其中,miR-153 被认为是一种神经富集miRNAs,在中枢神经系统的发育和功能以及神经退行性疾病的发病机制中均发挥重要作用。研究发现,miR-153 靶向Nrf2 3’UTR,上调miR-153 表达可影响Nrf2 及其活化功能,进而削弱了神经元的抗氧化防御,使神经元死亡增多[15],还可升高ROS 水平,通过ROS 激活p38MAPK 通路[16]。大量证据已表明,miRNAs在退行性和正常NPCs 之间存在差异表达,可通过调节MMPs 的表达,进而影响ECM 代谢,参与LDD 进程[17]。本实验结果已显示miR-153-3p可调控Nrf2 表达,而调节miR-153-3p 对于LDD进程的影响及相关机制,需要进一步地深入研究。
H2O2可引起腰椎髓核细胞活性氧含量增加、细胞活力下降、线粒体膜电位下降、MMP3 增加、Col Ⅱ含量下降、miR-153-3p 表达增加,说明了H2O2可引起腰椎髓核细胞线粒体功能障碍,导致ROS 增加,引起腰椎髓核细胞外基质成分改变,从而加速腰椎间盘细胞的衰老、凋亡,促进LDD进程。Nrf2 是PINK1 基因转录调控因子,PINK1通过清除受损的线粒体和减少ROS 等多种机制参与维持线粒体稳态,抑制miR-153-3p 表达,可上调腰椎髓核细胞Nrf2 表达水平,提示miR-153-3p 参与存进LDD 进程的过程可能与其调控Nrf2表达、调节线粒体自噬过程有关,但是相关机制有待进一步深入研究。