禽腺病毒血清2 型分离鉴定及感染SPF 鸡发病模型建立
2023-09-21胡鑫宇孙敏华曾庆航谢梓民袁朝霞
胡鑫宇,孙敏华,曾庆航,谢梓民,袁朝霞,廖 明
(1.仲恺农业工程学院动物科技学院,广东 广州 510225;2.广东省农业科学院动物卫生研究所/广东省畜禽疫病防治研究重点实验室/农业农村部禽流感等家禽重大疾病防控重点实验室,广东 广州 510640)
【研究意义】禽腺病毒(Fowl adenovirus,FAdV)属于腺病毒科(Adenoviridae)禽腺病毒属(Aviadenovirus),是一种无囊膜的双股DNA病毒。禽腺病毒属Ⅰ群可根据病毒结构特征分为5 个种(以A~E 表示),根据血清交叉中和反应可分为12 种血清型(FAdV1~7、8a、8b、9~11)[1]。禽腺病毒Ⅰ群所有血清型均可引发包涵体肝炎(Inclusion body hepatitis,IBH)[2],其中FAdV-4 被认为是引发心包积液-肝炎综合征(Hydropericardium hepatitis syndrome,HHS)的特定病原,发病禽可见明显的心包积液和肝炎、肾炎,致死率高,其流行给我国养禽业造成巨大损失[3]。目前接种疫苗仍是FAdV 防控的有效手段[4],但禽腺病毒Ⅰ群血清型较多,且不同血清型之间没有或只有微弱的的交叉保护力[5]。FAdV-4 能够中和FAdV-11,但不能中和 FAdV-8a 和FAdV-8b,FAdV-8a 和FAdV-8b 不能交叉中和,FAdV-8b 和FAdV-11 能够相互中和[6]。研究FAdV 不同血清型的致病性可以进一步认识禽腺病毒的危害,为科学有效防控奠定基础。
【前人研究进展】2007—2018 年调查表明,我国占据主导地位的禽腺病毒流行型为FAdV-4,其次为FAdV-8a、-8b、-11。近年来,同属于FAdV-D 的FAdV-2、-8a、-8b、-11 在我国南方省份被分离发现的占比不断上升[7-8],其中FAdV-2 的分离率逐年上升。FAdV-2 已在中国、加拿大[9]、日本[10]和波兰[11]等许多国家检出,主要感染3~5 周龄肉鸡,导致严重的IBH,平均死亡率为5%~10%[12]。目前,有关FAdV-2 的致病性尚不清楚,发病禽的病理变化等仍不明确。
【本研究切入点】通过对养殖场鸡群健康状况调查发现,免疫过鸡新城疫、禽流感(H9 亚型)、禽腺病毒病(I 群FAdV-4)三联灭活疫苗的鸡群出现死亡,剖检可见典型的HHS 症状。该情况说明除FAdV-4 外可能还存在同样能引发HHS 的病毒,因此对该病死鸡的组织样品进行病毒分离鉴定,明确疑似腺病毒的血清型,并通过动物回归试验建立发病模型。
【拟解决的关键问题】FAdV-4 被认为是导致HHS 症状的主要病原,其发病模型稳定。为建立稳定的FAdV-2 发病模型,本研究从HHS 发病鸡组织样品中分离出KM 株,对其基因序列进行分析,通过比较不同攻毒途径和不同攻毒剂量的致病性差异,筛选出建立发病模型的最佳攻毒途径和攻毒剂量,并对发病评价指标进行验证,为FAdV-2 的免疫原性评价和疫苗效果评价提供参考。
1 材料与方法
1.1 试验材料
1.1.1 样品来源 云南昆明某养殖场鸡群出现不明原因死亡,剖检可见肝炎、肾炎和心包积水等HHS 样临床症状。该养殖场鸡群已经免疫过两次鸡新城疫、禽流感(H9 亚型)、禽腺病毒病(I群FAdV-4)三联灭活疫苗。为了明确导致此次疾病的病原,采集病死鸡的肝脏、脾脏和肾脏样本,冷藏保存,送至实验室检查。
1.1.2 试验动物 6 周龄SPF 鸡70 只,购自北京梅里亚维通公司,于动物隔离器中饲养。
1.1.3 试剂和引物 DMEM-F12 培养基、胎牛血清、胰酶购自赛默飞世尔科技有限公司;鸡肝癌细胞(LMH 细胞)购自广州市华南农大生物药品有限公司;DL2000 Marker、2×Taq Master Mix、磷酸缓冲溶液(PBS)购自南京诺唯赞生物科技股份有限公司;DNA 提取试剂盒购自宝日医生物技术(北京)有限公司。
参照文献[13]设计FAdV 鉴定通用引物(上游引物5' CAARTTCAGRCAGACGGT 3',下游引物5' TAGTGATGMCGSGACATCAT 3',目的片段大小为897 bp);将GenBank 登记的GX01 株作为参考序列,分别设计FAdV-2Fiber序列扩增引物(上游引物5' ATGGCAAAATCGACTCCTTTC 3',下游引物5' TTAGGGTTGTGTTAATTTATT 3',目的片段大小约为1 700 bp)和FAdV-2Hexon序列扩增引物(上游引物5' CGTCGCATGTGTTATTGACC 3',下游引物5' GTCCCAGCCATTATAAGCAG 3',目的片段大小约为3 000 bp)。引物由生工生物工程(上海)股份有限公司合成。
1.2 病毒分离鉴定
1.2.1 病原鉴定 将病死鸡组织样本置于研钵,研磨匀浆加PBS 后放入5 mL EP 管中,反复冻融3 次,5 000 r/min 离心5 min,按照Takara DNA 提取试剂盒说明书的操作步骤抽提上清液DNA 作为模板,用FAdV 通用引物进行鉴定。PCR 体系为:2×Taq Master Mix 5 μL、FAdV 上下游引物各1 μL、模板DNA 1 μL、ddH2O 2 μL。反应程序为:95 ℃ 5 min;95 ℃ 30 s、55 ℃ 30 s、72 ℃ 50 s,30 个循环;72 ℃ 5 min。PCR 产物经1%琼脂糖凝胶电泳分析,出现预期条带则视为样本禽腺病毒阳性。
1.2.2 病毒分离 取LMH 细胞生长至密度达90%~95%的T25 细胞瓶,弃去瓶中培养基后加入无菌PBS,平铺润洗后弃去洗液,重复2 次。加入经孔径0.22 μm 滤膜过滤后的1.2.1 阳性样本液200 μL 和 DMEM-F12 培养基300 μL,晃动平铺后置于37 ℃、5%CO2培养箱中孵育2 h,弃接毒液后加入5 mL 含5% FBS 的DMEM-F12 培养基,放于细胞培养箱中培养72 h,每天观察,培养结束时反复冻融后收获。按照上述接毒方法盲传3 代。
1.2.3 病毒鉴定 取盲传3 代后的培养液,用DNA 提取试剂盒抽提病毒DNA,作为PCR 特异性扩增的模板。PCR 体系和反应程序按照1.2.1操作。PCR 产物经1%琼脂糖凝胶电泳分析,出现预期条带则送测序,并对序列进行比对。
1.3 分离株KM 的Fiber 和Hexon 序列分析
以1.2.3 制备的病毒DNA 作为模板,分别用Fiber、Hexon引物进行PCR 扩增。PCR 体系为:2×Taq Master Mix 25 μL、上下游扩增引物各2 μL、模板DNA 2 μL、ddH2O 19 μL。反应程序为:95 ℃ 5 min;95 ℃ 50 s、55 ℃ 50 s、72 ℃ 1 min 20 s,30 个循环;72 ℃ 7 min。PCR 产物经1%琼脂糖凝胶电泳分析,出现预期条带则送测序。
在GenBank 中下载14 株禽腺病毒参考株(表1)的全基因组序列,利用MegAlign 软件的Clustal W 方法将本研究的分离株KM 与参考株进行核苷酸序列比对和相似性分析,采用MEGA7.0软件构建核苷酸系统发育树(算法NJ 邻接法,Bootstrap 值设为500)。应用生物软件DNAStar中的Editseq 推导分离株的主要结构基因Hexon和Fiber的氨基酸序列,并与 GX01 株相应蛋白的氨基酸序列进行比对分析。
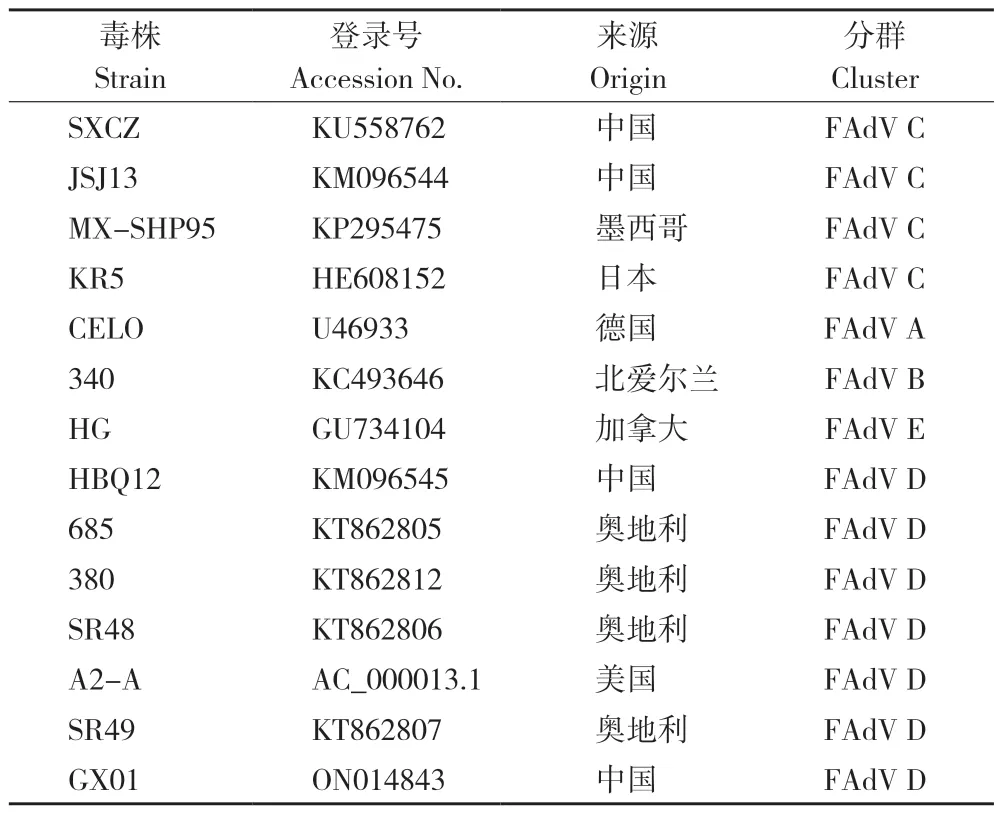
表1 FAdV 代表毒株信息Table 1 Information of representative FAdV strains

表2 KM 株不同攻毒途径发病统计Table 2 Statistics on the incidence of KM strain with different infection routes
1.4 KM 株扩增及TCID50 测定
将KM 株F2代病毒液接种于T75 细胞瓶中孵育2 h,弃去接种液并用PBS 润洗2 次,37 ℃下观察,出现80%以上病变则将细胞瓶置于-80℃下繁毒冻融3 次使病毒充分释放,分装,-80℃保存待测TCID50。将LMH 细胞铺于96 孔板中,待其生长至密度达85%~95%时进行试验。用DMEM-F12 培养液将病毒液进行10 倍稀释,使病毒液浓度为原液的10-10~10-1,分别取100 μL接种于96 孔细胞板中,每个稀释度8 个重复,第11 列为空白对照,第12 列为阳性对照。置于37℃温箱中孵育2 h 后弃去病毒液,加入含1% FBS的DMEM-F12 细胞维持液。将细胞板放入37 ℃培养箱中,观察7 d,记录病变孔数,按照 Reed-Muench 法计算病毒TCID50。
1.5 KM 株发病模型建立
1.5.1 KM 株纯净性检测 分别用试剂盒抽提两代感染毒KM 株病毒液中的DNA,并用常见的禽病病毒特异性检测引物进行PCR 特异性扩增检测,供检测的病毒包括鸡传染性喉气管炎病毒(ILTV)、减蛋综合征病毒(EDSV)、禽支原体(MS/MG)、马立克病病毒(MDV)、新城疫病毒(NDV)、传染性法氏囊病毒(IBDV)、禽传染性脑炎病毒(AEV)、禽呼肠孤病毒(ARV)、鸡传染性病病毒(CAV)、鸡白血病(ALV)、传染性支气管炎(IBV)。PCR 体系为:2×Taq 5 μL、上下游引物各1 μL、DNA 模板1 μL、ddH2O 1 μL。反应程序为:95 ℃ 5 min;95 ℃30 s、55℃ 30 s、72 ℃ 50 s,30 个循环;72 ℃5 min,PCR 产物用1%琼脂糖凝胶电泳进行分析。
1.5.2 不同攻毒途径的KM 株致病性分析 以F3代病毒作为感染毒,将30 只6 周龄SPF 鸡随机分成3 组(a、b、对照),每组10 只。对a、b组SPF 鸡分别经静脉注射和肌肉注射两种方式注射107.2TCID50的病毒液,空白对照组中5 只经静脉注射1 mL DMEM-F12(CK1),另外5 只经肌肉注射1 mL DMEM-F12 培养基(CK2)。攻毒后3 组SPF 鸡分别在隔离器中饲养,每天观察并记录鸡群状态。攻毒1、3、5、7 d 后用棉签采集泄殖腔拭子,-80 ℃保存;攻毒7 d 后处死全部鸡,剖检观察脏器病变情况,并采集心、肝、脾、肾组织样品,-80 ℃保存。
1.5.3 不同攻毒剂量的KM 株致病性分析 以F3代作为感染毒,将40 只6 周龄SPF 鸡随机分成4组(A、B、C、对照),每组10 只。对A、B、C 组SPF 鸡分别静脉注射108.0TCID50、107.0TCID50和106.0TCID50病毒液,空白对照组(CK)静脉注射1 mL 培养基。攻毒后4 组SPF 鸡分别于隔离器中饲养,每天观察并记录鸡群状态。攻毒1、3、5、7 d 后用棉签采集泄殖腔拭子保存于添加PBS的EP 管中,-80 ℃保存;攻毒7 d 后处死全部鸡,剖检观察脏器病变情况,采集心、肝、脾、肾组织样品,-80 ℃保存。
1.5.4 组织样品核酸检测 将心、肝、脾、肾组织样品置于室温下融化、研磨制成匀浆,置于5 mL EP 管中,加入3 mL 灭菌PBS,反复倒置混合均匀,放入-80 ℃冰箱中反复冻融3 次,5 000 r/min离心5 min,取上清液,用试剂盒抽提上清液中的核酸,PCR 体系和反应程序同1.2.1,PCR 产物经1%琼脂糖凝胶电泳分析。
1.5.5 泄殖腔拭子核酸检测 将泄殖腔拭子于室温中融化,用试剂盒抽提核酸,PCR 体系和反应程序同1.2.1,将PCR 产物置于1%琼脂糖凝胶中电泳分析。
2 结果与分析
2.1 病毒鉴定结果
本研究分离的病毒盲传3 代后,LMH 细胞出现CPE,表现为变圆、脱落(图1),抽提核酸后经PCR 鉴定(图2)为禽腺病毒。经测序并比对序列,所分离的病毒Hexon基因核苷酸序列与GX01 株相似度达99.64%,鉴定为禽腺病毒Ⅰ群D 种中的禽腺病毒血清2 型(FAdV-2),将该毒株命名为KM 株。

图1 KM 株感染LMH 细胞引起的细胞病变Fig.1 LMH cell pathological changes after KM strain infection
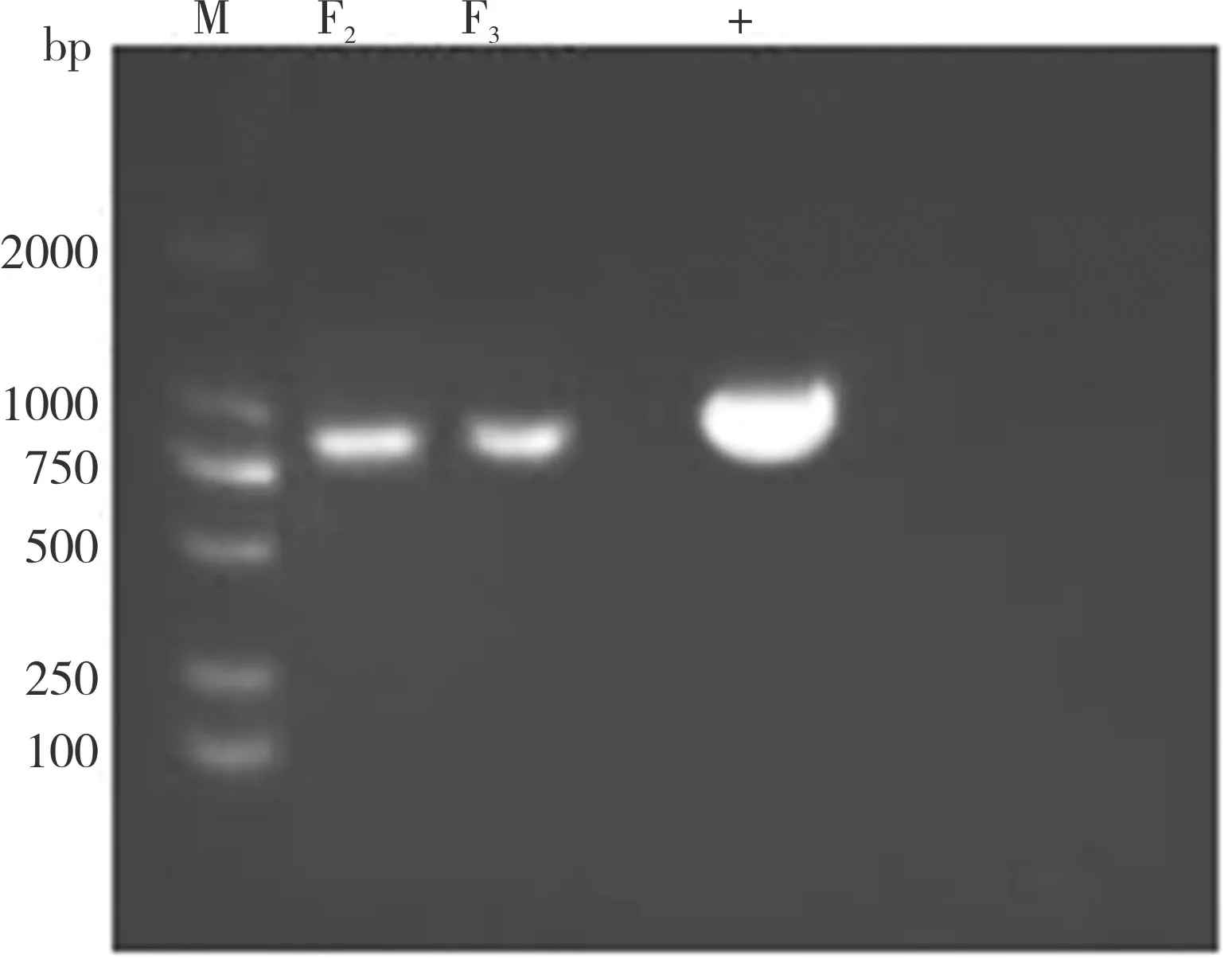
图2 FAdV-2 的PCR 鉴定Fig.2 Identification of FAdV-2 by PCR assay
2.2 KM 株Fiber 基因和Hexon 基因的进化分析
采用MEGA 7.0 软件的Clustal W 方法将KM株与5 个群共14 株FAdV 毒株的Fiber基因和Hexon基因核苷酸序列进行分析。根据Fiber遗传进化树(图3A)来看,KM 株与国内分离的FAdV-2 血清型GX01 株距离最近,同属于禽腺病毒Ⅰ群D 种,与其他的A、B、C、E 群距离较远;根据Hexon遗传进化树(图3B)来看,KM 株与GX01 株距离也最近,同属于禽腺病毒Ⅰ群D 种。
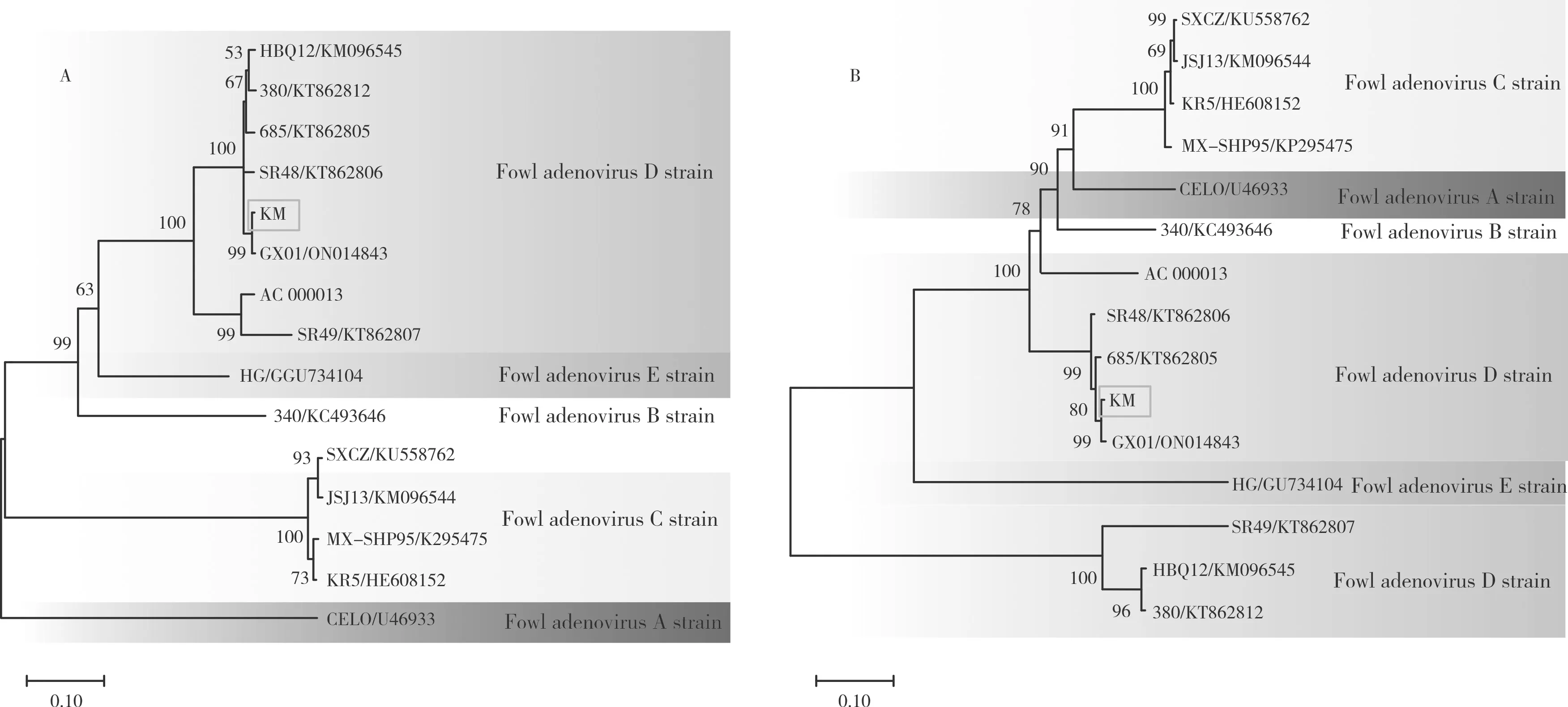
图3 KM 株基于Fiber 基因(A)和Hexon 基因(B)的系统遗传进化树Fig.3 Phylogenetic tree of KM strain based on Fiber gene (A) and Hexon gene (B)
采用MegAlign 对15 株FAdV 的Fiber和Hexon基因序列进行核苷酸同源性分析,结果显示,KM 株Fiber基因核苷酸序列与GX01、380、685、A-A2、HBQ12、SR48、SR49 病毒核苷酸序列同源性为71.8%~98.9%,其中与GX01 株同源性为98.9%,该8 株病毒同属于禽腺病毒Ⅰ群D 种(图4);KM 株Hexon基因核苷酸序列与GX01、380、685、A-2A 病毒核苷酸序列同源性为79.9%~99.6%,与380、SR49、HBQ12 病毒核苷酸序列同源性为39.0%~39.1%,其中KM与GX01、685、SR48 病毒核苷酸序列同源性为97.8%~99.6%(图5)。
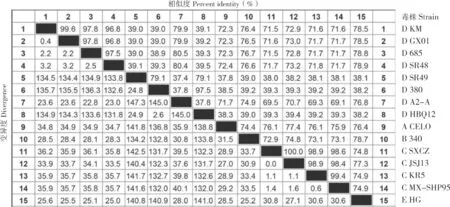
图5 KM 株Hexon 基因核苷酸序列同源性分析结果Fig.5 Homology analysis result of nucleotide sequence of Hexon gene from KM strain
利用DNAStar 中的Editseq 软件将分离株KM的主要结构基因Hexon和Fiber翻译为氨基酸序列,采用MegAlign 对15 株FAdV 的Fiber 氨基酸序列和Hexon 氨基酸序列分别进行同源性分析。结果显示,KM 株Fiber 氨基酸序列与GX01、685、380、HBQ12 的同源性为94.8%~98.9%,其中与GX01 株的同源性最高、为98.9%(图6);KM 株Hexon 氨基酸序列也与GX01 株同源性最高、为98.8%,与685、SR48 同源性为33.1%和47.9%,表明KM 株与国外分离的毒株同源性较低(图7)。
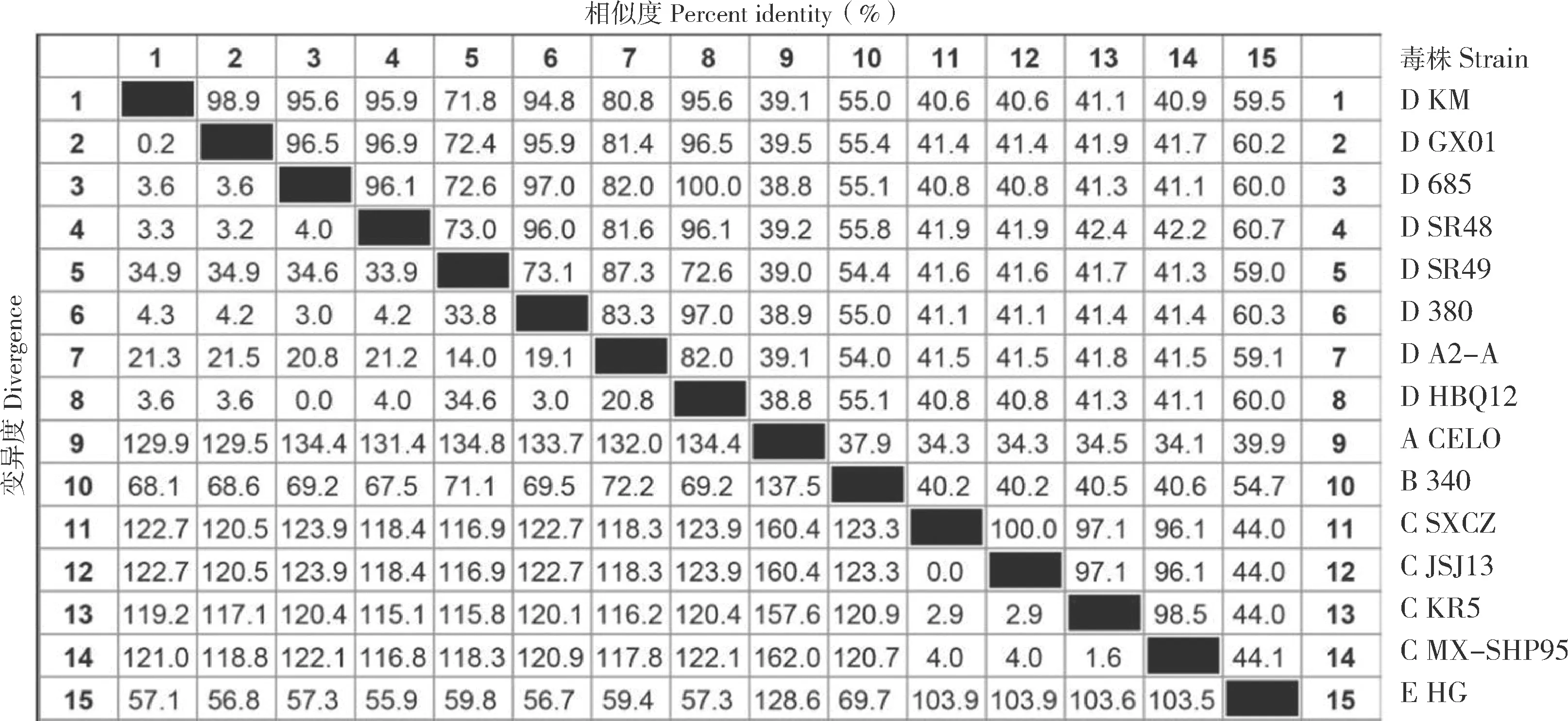
图6 KM 株Fiber 氨基酸序列同源性分析结果Fig.6 Homology analysis result of the deduced amino acid sequence of Fiber from KM strain
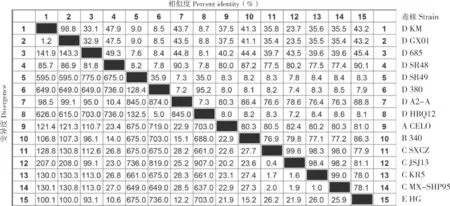
图7 KM 株Hexon 氨基酸序列同源性分析结果Fig.7 Homology analysis result of the deduced amino acid sequence of Hexon from KM strain
2.3 KM 株的TCID50 效价
分别记录病毒液不同稀释度(10-10~10-1)出现CPE 的孔数,计算每个稀释度出现CPE 的占比,按照Reed-Muench 计算可得,KM 株F3代滴度为1×107.2TCID50/0.1 mL。
2.4 KM 株纯净性检测
经PCR 特异性扩增后,凝胶电泳结果显示KM 株未检测到外源病毒可疑条带,可见KM 株F3代 无ILTV、EDSV、MS/MG、MDV、NDV、IBDV、AEV、ARV、CAV、ALV、IBV 病毒污染。
2.5 不同攻毒途径的KM 株致病性
a 组SPF 鸡通过静脉注射107.2TCID50KM 株,感染后2 d 出现排黄绿色稀粪、站立困难、食欲下降等临床症状;攻毒3 d 后死亡1 只,5 d 后死亡1 只,死亡率为20%;7 d 后处死并剖检每只鸡,可见心包积液、肝脏肿大带出血点、肾肿大等病理变化。b 组SPF 鸡通过肌肉注射107.2TCID50KM株,感染后3 d 出现少许黄绿色稀粪,无食欲下降、趴卧不起等临床症状,无死亡;攻毒7 d 后处死剖检无发现肝炎、肾炎等症状。对照CK1、CK2的鸡精神状态良好,食欲正常,7 d 后处死剖检无发现肝炎、肾炎等症状。
2.6 不同攻毒剂量的KM 株致病性
KM 株经静脉注射剂量为106.0TCID50(C 组)时,鸡群未出现精神沉郁、排黄绿色稀粪等临床症状,剖检无发现心包积液、肝炎症状。静脉攻毒剂量为107.0TCID50(B 组)时,在7 d 内5 只SPF 鸡出现精神沉郁、趴卧不起、羽毛凌乱、食欲下降等发病症状,但未出现鸡只死亡的情况(表3),但剖检可见3 只出现明显肝炎、肾炎症状。静脉攻毒剂量达108.0TCID50(A 组)时,10 只SPF 鸡发病,出现黄绿色稀粪、精神不振、食欲下降等临床症状,且在攻毒3 d 内死亡2 只,攻毒后7 d 内死亡5 只,死亡率为50%(表3);剖检可见明显的心包积液、肝炎、肾炎症状,肌胃、腺胃无变化(图8);攻毒死亡的鸡组织病理切片(图9)显示,心脏组织间隙增宽、心肌纤维增粗、间质性水肿,肝脏炎性细胞和嗜碱性包涵体浸润,肾脏炎性细胞浸润,间质充血;对照组鸡的心脏、肝脏和肾脏组织病理切片显示正常(表3)。为保证KM 株感染模型中同时存在发病和死亡的情况,选择静脉注射感染途径为宜,感染剂量为108.0TCID50。
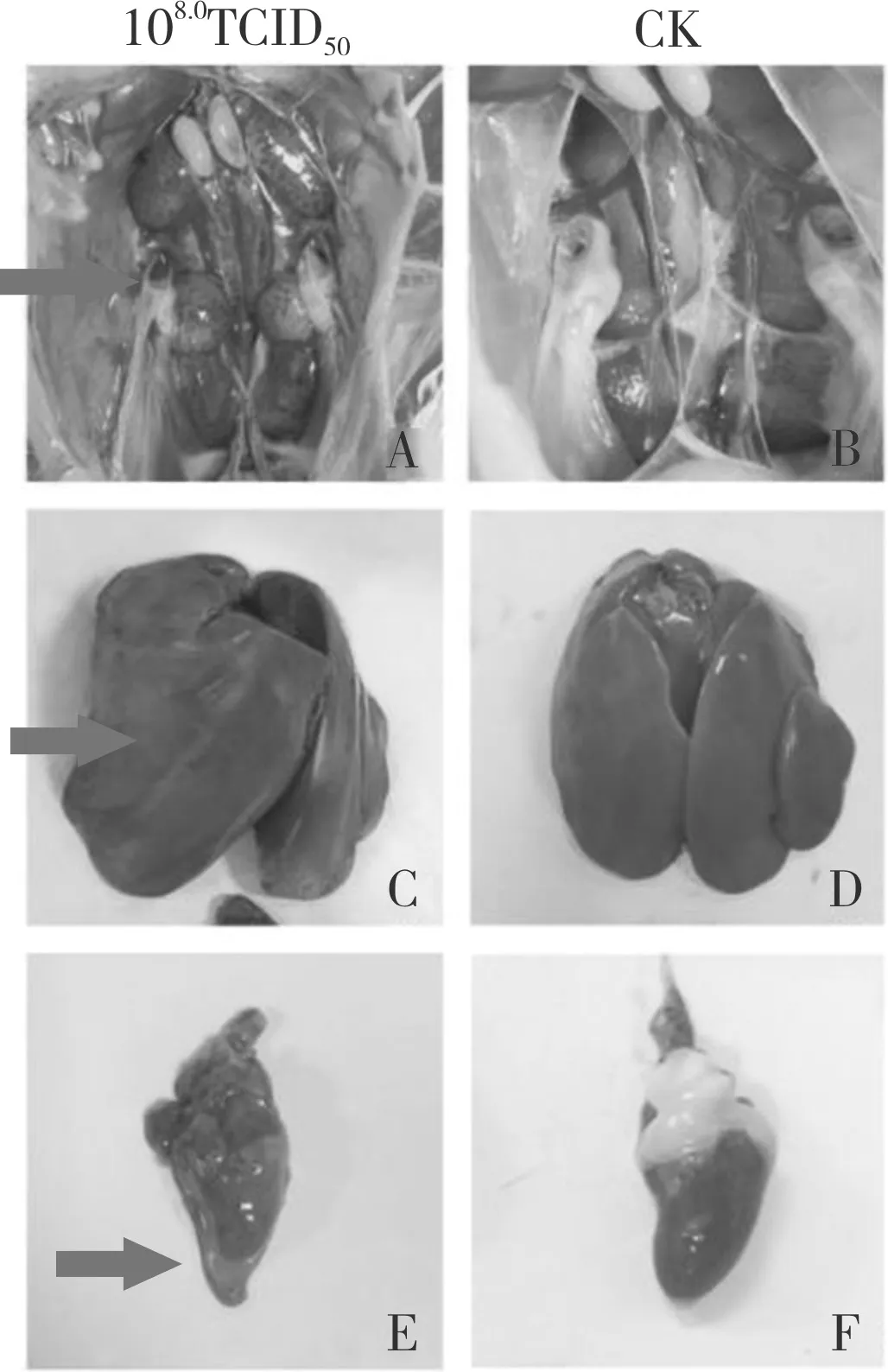
图8 KM 株静脉注射108.0 TCID50 死亡鸡只的剖检结果Fig.8 Necropsy examination of dead chickens infected with KM strain 108.0 TCID50 in intravenous route

表3 KM 株不同病毒剂量静脉注射发病统计Table 3 Statistics on the incidence of KM strain by intravenous route at different doses
2.7 脏器组织核酸检测
采集KM 株静脉注射108.0TCID50死亡的5 只鸡和攻毒7 d 后统一处死的5 只鸡的肝脏、肾脏样本,提取核酸并利用FAdV-2 特异性引物进行PCR 扩增,均检出大小符合预期的条带,约897 bp(图10),确认为KM 株感染。
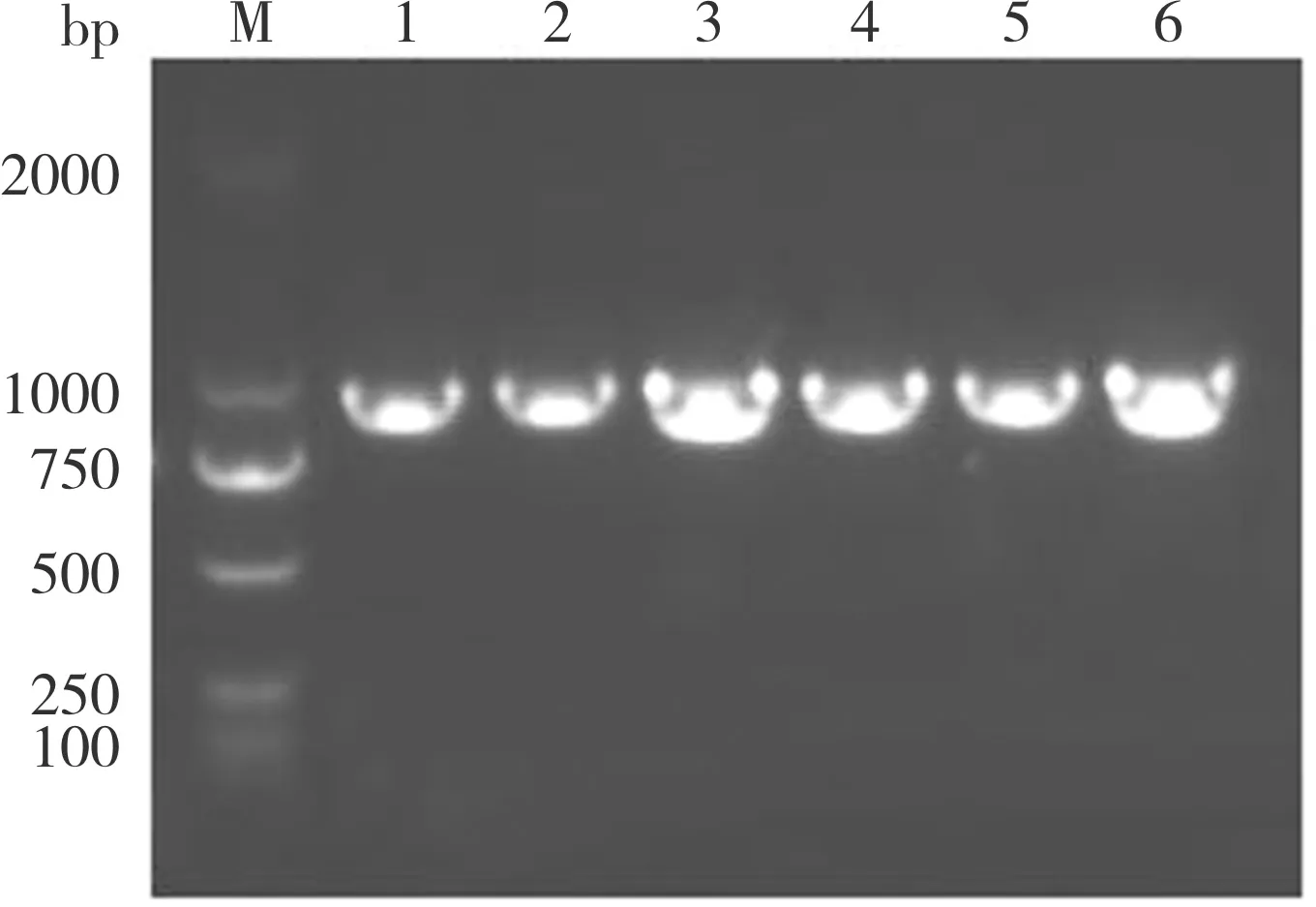
图10 组织样本的FAdV-2 PCR 核酸检测Fig.10 PCR detection of FAdV-2 in tissue samples
2.8 泄殖腔拭子核酸检测
A、B、C 试验组攻毒前泄殖腔拭子核酸检测均无目标条带检出,静脉注射KM 株,攻毒后1 d的检测结果显示均有目标条带,攻毒后3~7 d 各组全部鸡均检出目标条带(表4)。
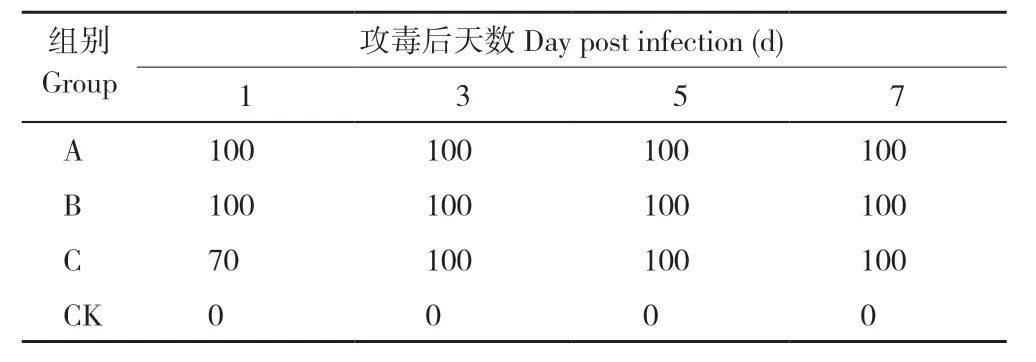
表4 泄殖腔拭子核酸阳性率Table 4 Positive rate of cloaca swab nucleic acid
3 讨论
我国是畜禽养殖大国,规模化畜禽养殖业为社会带来巨大经济效益[14]。2015 年发现禽心包积液-肝炎综合征[15],2016 年各地均有病例报告。随着对该病的认识逐渐深入,以及各种疫苗、防控手段应用,2019—2020年该病呈下降趋势[16]。3~5 周龄的种鸡和蛋鸡是心包积液-肝炎综合征最为易感的鸡群,致死率为30%~90%[17]。FAdV-4 被认为是引发心包积液-肝炎综合征的特定病原[18]。本研究结果显示,高剂量(108.0TCID50)的FAdV-2 经静脉感染也可引发心包积液-肝炎综合征典型症状进而导致动物死亡,说明FAdV-2 对禽类养殖存在较大威胁,研发针对FAdV-2 的疫苗仍然是防控的第一选择。
Xie 等[19]对FAdV-2 的致病性进行研究,经肌肉注射感染3 日龄和10 日龄SPF 鸡后,试验鸡虽无死亡,但出现明显的体重下降。目前未有报道进行过静脉注射感染大日龄SPF 鸡的致病性研究,无法明确在静脉感染途径下大日龄SPF 鸡感染FAdV-2 的临床症状。为验证不同攻毒途径下FAdV-2 的致病性差异,本试验分别通过静脉注射和肌肉注射107.2TCID50的病毒液,发现经静脉注射107.2TCID50剂量,6 周龄SPF 鸡出现死亡,剖检可见心包积液和肝炎,死亡率为20%,对未死亡鸡剖检可见明显病理变化。
实验动物、剂量选择、发病症状通常是建立发病模型最为关键的参数。本研究在进行不同攻毒剂量致病性试验设计时分别选择108.0TCID50、107.0TCID50、106.0TCID503 个攻毒剂量,感染途径为静脉注射,结果表明,静脉攻毒剂量达到107.0TCID50时,6 周龄SPF 鸡出现黄绿色稀粪,无死亡,泄殖腔拭子攻毒后1 d 全部阳性;攻毒剂量达到108.0TCID50时,试验鸡死亡率达50%,剖检可见明显病理变化,泄殖腔拭子攻毒后1 d 全部阳性。
本研究结合不同攻毒途径和不同攻毒剂量致病性分析结果,建立了FAdV-2 KM 株感染6 周龄SPF 鸡的发病模型:攻毒途径为静脉注射,剂量为108.0TCID50,试验鸡可见黄绿色稀粪临床症状,死亡率为50%,剖检脏器可见明显病理变化,攻毒1 d 内泄殖腔排毒阳性。本试验分别在感染途径和感染剂量两个方面进行了最优剂量筛选,并通过动物回归试验验证了发病模型的结果。该发病模型证明FAdV-2 是引发心包积液-肝炎综合征的病原之一。
4 结论
本试验成功分离出1 株FAdV-2 野毒株,并将其命名为KM 株,通过生物信息学软件对其Hexon和Fiber基因进行遗传演化分析,结果表明,KM 株与FAdV-2 GX01 株的同源性最高;此外,通过动物实验分析KM 株在不同感染途径和不同感染剂量下对6 周龄SPF 鸡的致病性,发现FAdV-2 也可以引发心包积液-肝炎综合征并导致SPF 鸡死亡,同时验证了静脉注射途径感染导致的发病严重程度高于肌肉注射。本研究建立了FAdV-2 KM 株感染SPF 鸡的动物发病模型,为研究FAdV-2的免疫原性和评价疫苗效果提供参考。
