涠洲岛霜鹿角珊瑚共生虫黄藻群落的季节变化特征
2023-09-21许勇前覃良云陈金妮牛天祎粱甲元
许勇前,陈 飚,2,3,覃良云,陈金妮,牛天祎,粱甲元,2,3
(1.广西大学海洋学院,广西 南宁 530004;2.广西南海珊瑚礁研究重点实验室,广西 南宁 530004;3.广西大学珊瑚礁研究中心,广西 南宁 530004)
【研究意义】珊瑚礁生态系统是海洋四大生态系统之一,分布于热带和亚热带寡营养浅水区,极具生物和功能多样性,具有重要的生态价值和经济价值[1-2]。然而,在过去几十年里,活珊瑚覆盖率大幅度下降,全球珊瑚礁持续退化[3]。据Loya 等[4]、Hoegh-Guldberg 等[5]预测,到21 世纪中叶,全球活珊瑚覆盖率会继续下降70%~90%。“珊瑚-虫黄藻”共生体是珊瑚礁生态系统的基础[6],虫黄藻为珊瑚提供了超过95%的光合能量,促进珊瑚钙化和生长[7];同时,珊瑚宿主也会为虫黄藻提供二氧化碳、氮、磷以及其他无机物,以维持虫黄藻的光合作用[8]。然而,受全球气候变化和人类活动干扰,珊瑚与虫黄藻的共生关系易破裂,进而导致珊瑚白化、死亡[9]。因此,了解“珊瑚-虫黄藻”共生体的环境适应能力具有重要意义。【前人研究进展】珊瑚的环境适应能力与其共生虫黄藻的群落结构有关。一般而言,在一定范围内,虫黄藻密度与珊瑚的耐受性存在正相关。基于我国南海珊瑚礁区大空间尺度的调查表明,具有较高虫黄藻密度的珊瑚宿主一般也表现出较强的抗逆性[10]。室内模拟实验也证实,霜鹿角珊瑚(Acropora pruinosa)的热耐受性与共生虫黄藻密度呈正相关[11]。此外,虫黄藻的群落组成也影响珊瑚的环境耐受性。例如,主导系群分别为Cladocopium和Durusdinium的Pocillopora珊瑚,两者的热耐受性显著不同[12]。Berkelmans 等[13]将多孔鹿角珊瑚(Acropora millepora)移植到温度较高的海域后,占据主导优势的C2 亚系群逐渐被Durusdinium属所取代,且珊瑚的耐热性增加了1~1.5 ℃。因此,了解虫黄藻的群落结构对于评估珊瑚的环境适应能力十分必要。【本研究切入点】“珊瑚-虫黄藻”共生体对环境的响应是一个动态变化的过程,多种环境因素均会引起虫黄藻群落结构的变化,而目前的研究多聚焦于空间尺度上。例如,Chen等[14]基于两个气候带73 个调查站位的研究发现,南海珊瑚共生虫黄藻群落组成整体呈现出由高纬度的Cladocopium主导转变为中、低纬度Cladocopium+Durusdinium主导的空间分布模式。而在时间尺度上,Gong 等[15]比较了霜鹿角珊瑚(Acropora pruinosa)和鹿角杯型珊瑚(Pocillopora damicornis)共生虫黄藻密度的昼夜变化情况,发现白天的虫黄藻密度显著高于晚上。基于昼夜节律变化的监控数据已对虫黄藻响应短时间尺度的变化特征有了初步的认识,而跨越季节和偶发性极端气候的生态调查则可以更好的解析虫黄藻对环境变化的响应特征。因此,亟待补充长时间尺度,特别是季节性的生态调查。【拟解决的关键问题】本研究以涠洲岛一种代表性的热敏感枝状霜鹿角珊瑚为研究对象,分别在2019—2020 年连续4 个季节定点采集珊瑚样品,同时收集了采样期间的遥感卫星环境数据,通过分析4 个季节的虫黄藻密度、群落组成、群落结构与环境变量的相关性来揭示季节性环境变化驱动虫黄藻的生态效应。
1 材料与方法
1.1 样品标记与采集
珊瑚样品于2019 年7、10 月以及2020 年1、4 月在涠洲岛珊瑚礁区固定苗圃(21°8.27' N,109°12.6' E)采集。每次采集5 个霜鹿角珊瑚枝(长约5 cm),采样深度为6~7 m,共计20 个样品。珊瑚出水后用无菌海水冲洗3 遍,避免外源虫黄藻的干扰[16],随后立即装入无菌密封袋并置于液氮速冻,回到实验室进行后续实验操作。
1.2 涠洲岛珊瑚礁区环境数据
通过Giovanni Ocean Color tool(https://giovanni.gsfc.nasa.gov/giovanni)获取涠洲岛珊瑚礁区从2019 年7 月至2020 年7 月的遥感数据(MODISAqua 4 km)。获取的遥感数据类别包括:表层海水温度(Sea surface temperature,SST,℃)、光合有效辐射(Photosynthetically active radiation,PAR,E/m2·d)、海水叶绿素a 浓度(Chlorophyll a,mg/m3)、490 nm下的入射光漫射衰减系数(Kd490,Kd/m)和颗粒有机碳(Particulate organic carbon,POC,mg/m3)。
1.3 虫黄藻密度和叶绿素a 测定
用无菌海水高压冲洗霜鹿角珊瑚样品,直至珊瑚组织全部脱落,确保将虫黄藻全部冲洗下来。收集全部冲洗液,测量并记录体积,吸取1 mL 冲洗液,8 000 r/min 离心10 min 后去上清,加入4%甲醛1 mL 进行固定。虫黄藻计数参考朱昔恩等[17]的方法。剪取锡箔纸包裹珊瑚骨骼表面,称量锡箔纸重量,以5 cm × 5 cm的锡箔纸称量作为标准,根据锡箔纸重量与表面积的相关性计算珊瑚表面积[18]。单位面积的虫黄藻密度根据Xu 等[19]的方法进行计算。
取适量珊瑚组织(约100 g)浸泡于90%丙酮中,在4 ℃黑暗条件下萃取24 h。然后在酶标仪内分别读取波长664、647、630 nm 处的吸光值,并参考赵永平等[20]的方法计算叶绿素a 浓度。
1.4 DNA 提取、高通量测序和数据分析
每枝珊瑚剪取3 份组织用于生物学重复,每份组织90 mg,包含碳酸钙骨骼、组织和黏液成分,用于基因组DNA 的提取,4 个季节20 个珊瑚枝共计60 份样品。DNA 提取参照海洋动物基因组DNA 提取试剂盒(TIANGEN,DP324)说明书操作。以质检合格的DNA 为模板,使用特异性引物ITSintfor2(5'-GATTGCAGAACTCCGTG-3')[21]和ITS2-reverse(5 '-GGGATCCATATGCTTAAGT TCAGCGGGT-3')[22]对虫黄藻的ITS2 区域进行扩增。PCR 反应体系、反应条件和高通量测序流程参考Liang 等[23]的方法。测序完成后,对二代测序下机数据进行严格的数据拆分和质控拼接,通过DADA2 和Deblur 对优化后的数据进行降噪处理,去除高通量测序数据中可能存在的错误,获得ASV 代表序列和丰度表。将ASV 丰度表与Chen 等[14]建立的虫黄藻数据库比对,获得亚系群的代表序列及丰度表,并用于后续虫黄藻群落统计分析。原始数据保存于NCBI 的SRA 数据库(Accession number:PRJNA880748)。
1.5 统计分析和绘图
对4 个季节的虫黄藻密度和叶绿素a 浓度进行单因素方差分析,采用Tukey' s HSD 多均值比较进行事后检验,显著性水平设为0.05,数据均以平均值±标准差表示。基于虫黄藻数据库比对后的丰度表,通过冗余分析(Redundancy analysis,RDA)计算4 个季节虫黄藻群落结构之间的统计差异,检验环境参数和虫黄藻群落结构之间的相关性。群落组成所展示的数据为3 个生物学重复合并为1 个样本。RDA 分析在软 件R(version 4.2.1) 中通过vegan 和ggplot2 完成。其他绘图在origin2023 中完成,统计分析在SPSS27.0 中进行。
2 结果与分析
2.1 涠洲岛珊瑚礁区环境参数的季节变化
涠洲岛珊瑚礁区环境参数的季节波动显著,几乎所有环境参数的极值均出现在夏季或冬季(图1)。其中,SST 和PAR 的变化趋势较为类似,最低值均出现在冬季,最高值分别出现在夏季和春末,且两者随季节交替平稳变化,表现出较强的共线性;而Chlorophyll a、Kd490 和POC 的极值也出现夏季或冬季,但这3 种环境参数的最高值均出现在冬季,最低值均在夏季,且这3 种环境参数与季节变化并未表现出较强的关联性。整体来看,在采样时间范围内,涠洲岛气候表现出夏季高温强光和冬季低温弱光的环境特征。
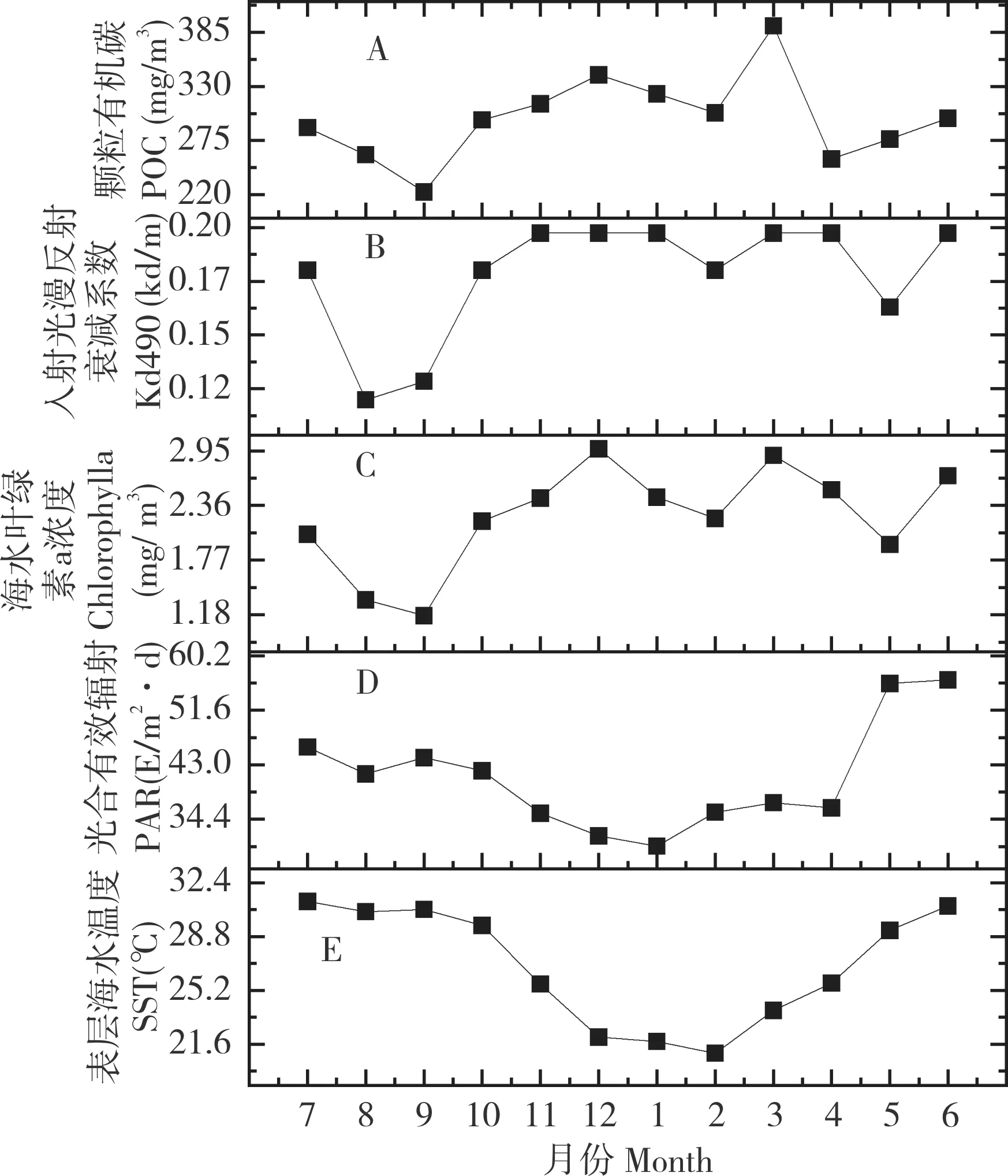
图1 涠洲岛珊瑚礁区2019—2020 年各月环境参数Fig.1 Environmental parameters of Weizhou Island coral reef area in each month from 2019 to 2020
2.2 涠洲岛珊瑚礁区虫黄藻密度的季节变化
由图2 可知,不同季节珊瑚共生虫黄藻的密度在0.56×106~2.33×106cells/cm2之间,夏、秋、冬、春的平均虫黄藻密度分别为1.04(±0.33)×106、1.17(±0.37)×106、1.58(±0.49)×106、1.14(±0.27)×106cells/cm2,以冬季虫黄藻密度最高、夏季最低,冬季虫黄藻密度约为夏季的1.5 倍。对4 个季节的虫黄藻密度进行单因素方差分析,冬季虫黄藻密度显著高于夏季(F=4.431,P<0.01)。总体而言,虫黄藻密度表现出夏季低冬季高的特点。
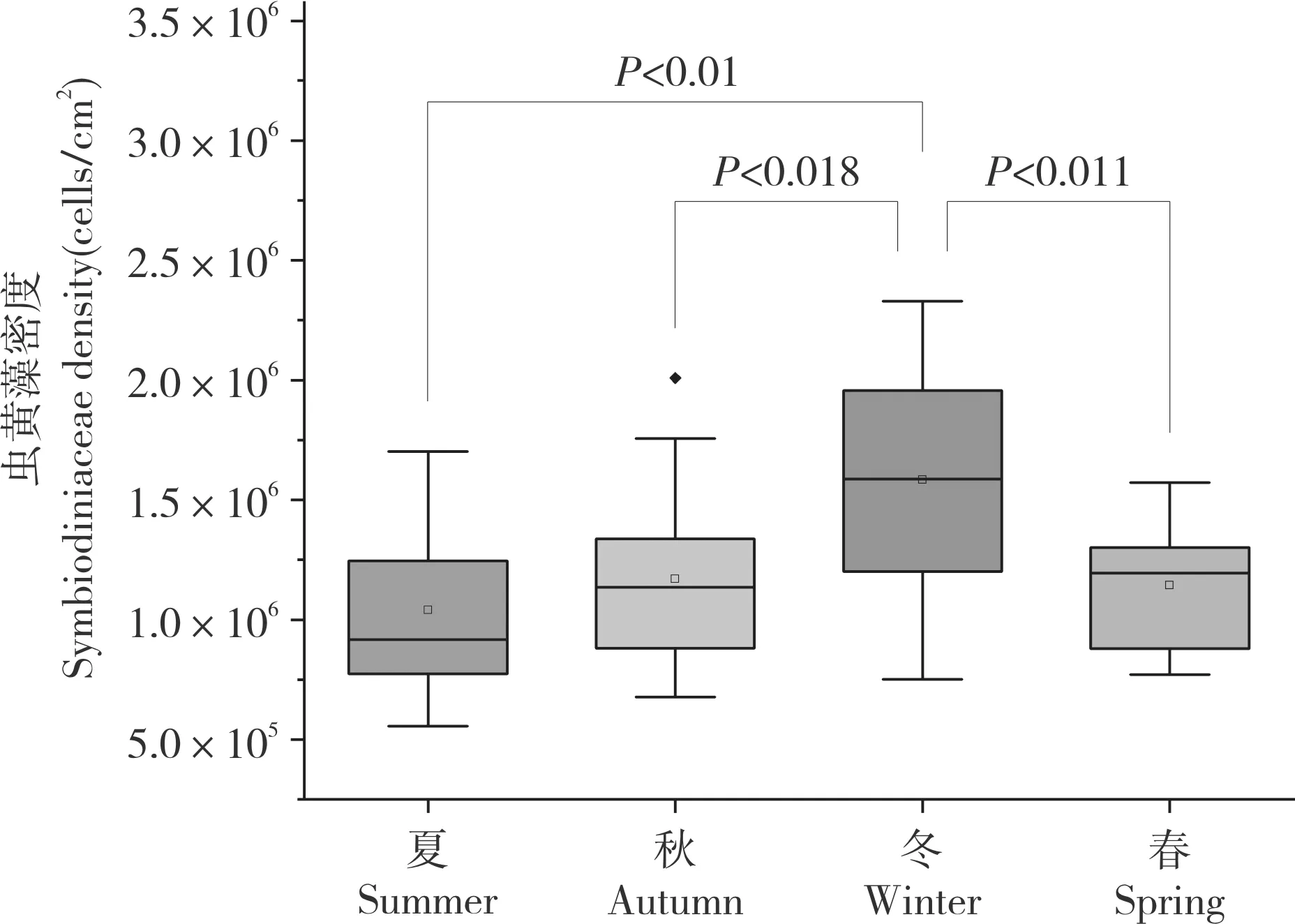
图2 霜鹿角珊瑚虫黄藻密度的季节变化Fig.2 Seasonal variation of density of Symbiodiniaceae in Acropora pruinose
2.3 霜鹿角珊瑚叶绿素a 浓度的季节变化
由图3 可知,不同季节霜鹿角珊瑚叶绿素a的浓度为9.53~13.67 μg/cm2。夏、秋、冬、春的平均叶绿素a 浓度分别为10.55(±0.81)、11.17(±0.75)、13.05(±0.48)、11.36(±0.91)μg/ cm2。其中,叶绿素a 浓度最高,其次为春季和秋季,夏季最低。冬季叶绿素a 浓度约为夏季的1.24 倍。对4 个季节的叶绿素a 浓度进行单因素方差分析,冬季显著高于其它3 个季节(F=10.02,P<0.05)。总体而言,叶绿素a 浓度变化趋势类似于虫黄藻密度,同样表现出夏季低冬季高的特点。
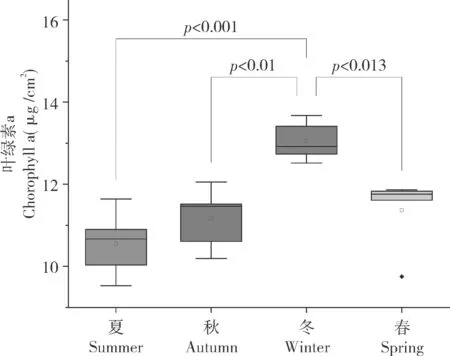
图3 霜鹿角珊瑚叶绿素a 浓度的季节变化Fig.3 Seasonal variation of concentration of chlorophyll a in Acropora pruinose
2.4 涠洲岛珊瑚礁区虫黄藻群落组成的季节性变化
虫黄藻多样性分析结果(图4)显示,共检测到117 种ASVs 且均为Cladocopium属。亚系群水平上,4 个季节的虫黄藻组成较为相似,C1亚系群的相对丰度介于79.35%~82.97%之间,在4 个季节的霜鹿角珊瑚中占据绝对主导优势,其相对丰度无明显变化;C1ca、C1p、C72 和Cspc等亚系群的相对丰度分别介于3.10%~6.19%、2.81%~3.95%、2.15%~2.93%、1.62%~2.64%之间,但其相对丰度随季节交替而显著变化(F=2.107,P<0.01)。
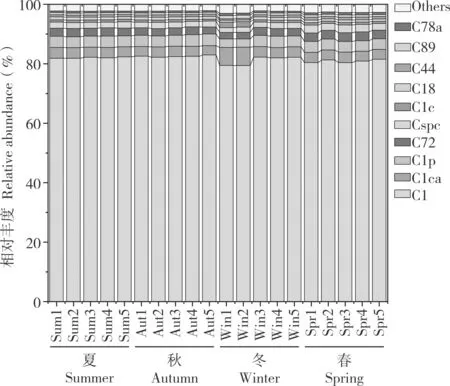
图4 霜鹿角珊瑚虫黄藻群落组成的季节变化Fig.4 Seasonal variation of composition of Symbiodiniaceae communities in Acropora pruinose
2.5 涠洲岛珊瑚礁区环境因子与虫黄藻群落结构的相关性
RDA 分析(图5)显示,SST、PAR、Kd490、Chlorophyll a 和POC 均与虫黄藻群落结构变化存在关联性(Permutation test,P<0.05),其中RDA1、RDA2 分别解释虫黄藻群落结构变化的54.97%和18.50%。整体来看,春季和秋季虫黄藻群落结构相似度较高,而夏季和冬季的差异较大。此外,夏季虫黄藻群落结构与SST 和PAR 呈正相关,与Kd490、Chlorophyll a、POC 则呈负相关,且环境参数对于冬季虫黄藻群落结构的影响与夏季相反,PAR、SST、Kd490、Chlorophyll a、POC 对于虫黄藻群落结构的影响依次减弱,SST和PAR 对虫黄藻群落结构的影响高于Kd490、Chlorophyll a、POC。
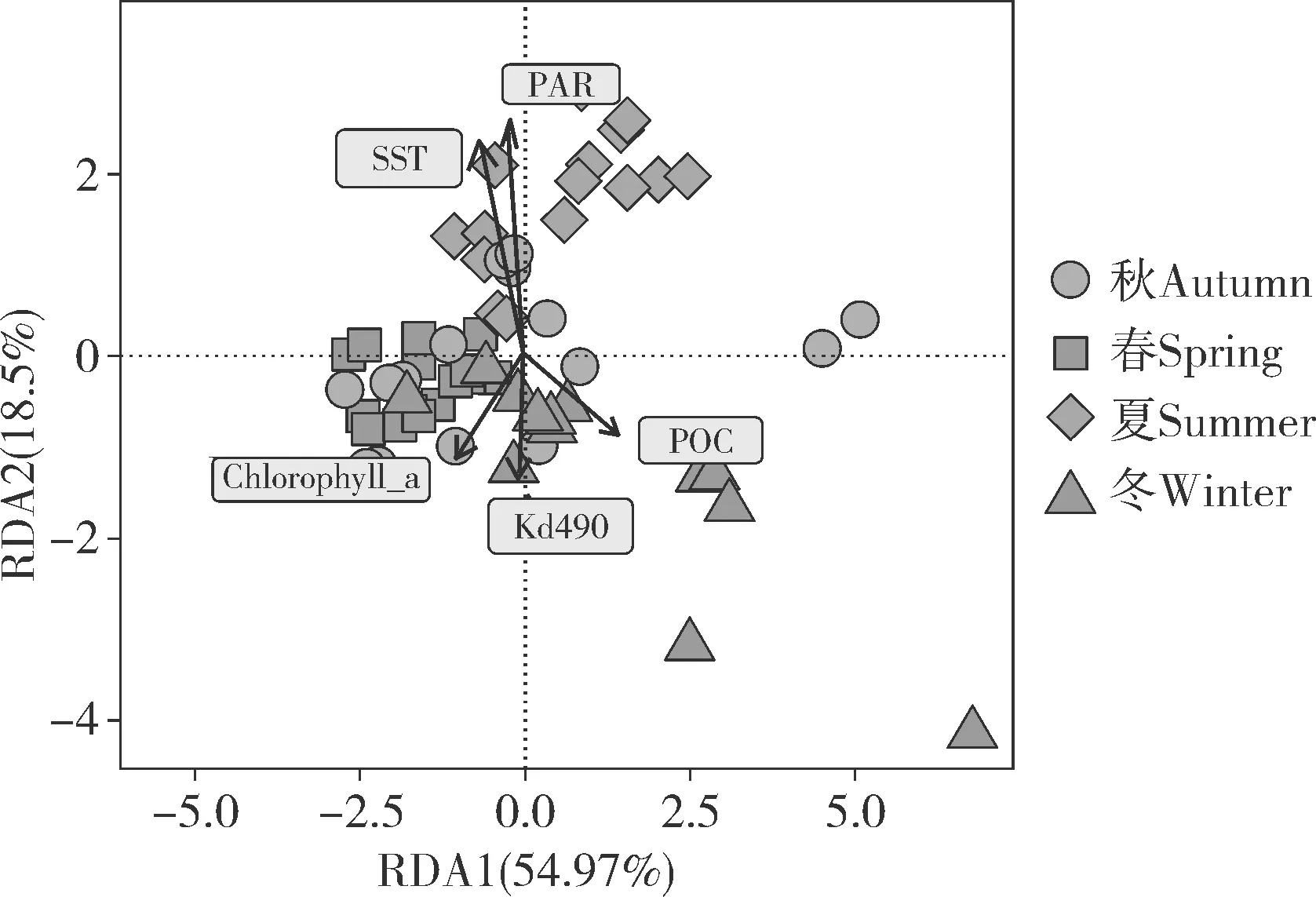
图5 虫黄藻群落结构与季节环境参数之间的关联性分析Fig.5 Correlation analysis between community structure of Symbiodiniaceae and seasonal environmental parameters
3 讨论
3.1 虫黄藻密度和叶绿素a 浓度的季节变化模式
虫黄藻密度和叶绿素a 是珊瑚的重要生理参数,常用于评估珊瑚的环境适应能力[24]。本研究分析了涠洲岛珊瑚礁区4 个季节的霜鹿角珊瑚共生虫黄藻密度和叶绿素a 浓度变化情况,两者均呈现出夏季低冬季高的规律。这与其他野外调查的结果一致[25-32],但影响虫黄藻密度和叶绿素a 浓度的因素较多,如表层海水温度、光合有效辐射、营养盐浓度、洋流等[19]。这两种生理参数的变化情况不能用一种或几种变量来解释,需要综合考虑研究区域的总体季节变化。
涠洲岛地处南海北部的高纬度地区,与其他海域相比,表层海水温度和光合有效辐射是影响珊瑚生长的主要因素[33],同时也可能是驱动虫黄藻密度和叶绿素a 浓度季节变化的重要因素。有研究通过控制温度和光照等变量,探究珊瑚共生虫黄藻的密度变化情况。Nielsen等[34]对多孔鹿角珊瑚(Acropora millepora)进行了为期10 周的温度胁迫,证实23.0 ℃低温胁迫后虫黄藻密度显著上升,而高温29.5 ℃胁迫后虫黄藻密度显著降低。此外,体外培养的虫黄藻在高温和强光胁迫下,密度也会降低[35]。上述研究发现,高温和强光会降低虫黄藻密度,同时涠洲岛夏季高温强光和冬季低温弱光的季节特征可能是造导致虫黄藻密度和叶绿素a 浓度变化的重要因素。
高温和强光会破坏虫黄藻的叶绿体光合系统Ⅱ,导致活性氧过量合成[36]。活性氧是光合作用的正常产物,但浓度过高时会泄漏到珊瑚组织中,破坏珊瑚细胞和DNA,进而导致虫黄藻细胞死亡或被排出珊瑚体外[37-38]。而在温度较低的冬季,珊瑚为了提高对光的捕获效率,虫黄藻由单层排列转变为多层排列,虫黄藻密度和叶绿素a 浓度间接增加[39]。因此,表层海水温度和光合有效辐射的季节性波动可能通过影响虫黄藻的光合作用,进而驱动其密度变化。
3.2 珊瑚共生虫黄藻主导系群的季节响应特征
本研究发现,C1 亚系群虫黄藻与霜鹿角珊瑚稳定共生,且始终占据主导地位。一般情况下,成体珊瑚与多种虫黄藻共生,且只有一种虫黄藻系群能占据主导地位[6,40-42]。中国南海低纬度珊瑚礁区[43]、中国香港[44-45]、日本冲绳[46]、韩国济州岛[47]以及大堡礁南部[48]等亚热带低纬度地区的珊瑚几乎均由C1 亚系群主导,而其他类型的虫黄藻相对丰度较低,这与本研究在涠洲岛的调查结果一致。C1 亚系群虫黄藻与霜鹿角珊瑚高度稳定的共生关系可能是长期自然选择和演化的结果。珊瑚受到外界环境胁迫时,其共生虫黄藻可通过重组[12,49]或者替换[50-51]两种机制来适应环境。但也有研究表明,新的共生关系并不稳定,当外界环境胁迫消除后,虫黄藻会恢复为原始群落组成[52-56]。因此,长期野外调查发现,珊瑚共生虫黄藻的主导系群基本不变[57]。这进一步表明,尽管环境变化会短暂影响珊瑚与虫黄藻的共生关系,但在长时间尺度上,珊瑚依旧会与最适应环境的虫黄藻形成共生关系。
C1 亚系群虫黄藻对高温敏感[43],广泛分布于印度-太平洋和大西洋-加勒比海域[58]。在受低温胁迫的珊瑚礁区,C1 亚系群占据了主导地位[46-47]。而C15、C3u、D1.a 等耐热型虫黄藻则更常见于SST 较高和频繁发生热白化的热带低纬度礁区[59]。耐热型虫黄藻提高了珊瑚在高温环境中的存活率[53],却也减少了向珊瑚宿主转移的有机碳,降低了珊瑚宿主的钙化率和骨骼生长速率[60-62],甚至会使珊瑚更容易感染疾病[63]。在采样期间,涠洲岛的最高SST 约为31 °C,尚未达到C1 亚系群的温度上限,耐热型虫黄藻并没有竞争优势[43]。另一方面,C1 亚系群的温度适应范围较广,能够适应低温与富营养化环境,光合效率较高[64],而C1 亚系群在低温下的强光合速率可保证珊瑚在冬季正常生长和碳酸钙骨骼形成[44]。因此,表层海水温度可能是驱动C1 亚系群虫黄藻与霜鹿角珊瑚稳定共生的主要原因。
3.3 季节变化对虫黄藻群落结构的影响
本研究中,涠洲岛珊瑚礁区霜鹿角珊瑚共生虫黄藻不同季节的群落结构主要受SST 和PAR 影响。已有研究表明,表层海水温度和光合有效辐射是影响虫黄藻群落结构的关键因素[43]。室内模拟实验也证实,杯型珊瑚(Pocilloporasp.)在受到温度胁迫的时候,虫黄藻群落结构随温度升高而发生转变,主导系群C42 的相对丰度由76%下降至25%[65]。此外,光合有效辐射强度也会影响珊瑚共生虫黄藻群落结构的转变。例如,红海萼形柱珊瑚(Stylophora pistillata)和加勒比海的山地星珊瑚(Orbicella faveolata)的主导类型虫黄藻随光合有效辐射减弱由Symbiodinium转变为Cladocopium[66-67]。可能受限于采样频率,本研究未发现主导系群发生替换的情况,C1 亚系群始终占据主导地位,不随季节交替而显著变化,但次主导系群变化显著。
虫黄藻群落由相对丰度高于5%的主导系群和低于5 %且高度多样化的背景系群组成[68-69],两种类型的虫黄藻共同决定整体群落对环境变化的响应[70]。低丰度的背景虫黄藻比主导系群更活跃,在环境胁迫下取代主导系群后,“珊瑚-虫黄藻”共生体的抗干扰能力增加,有助于珊瑚在极端环境下生存[71]。例如,在2005 年东加勒比海域的珊瑚白化事件中,虫黄藻D1.a 由背景系群转变为主导系群,提高了白化珊瑚的生存率,增强了珊瑚抵御热白化的能力[54]。因此,在涠洲岛表层海水温度和光合有效辐射季节性波动的环境下,背景系群虫黄藻相对丰度的显著上升可能有助于霜鹿角珊瑚生存。
4 结论
本研究通过对涠洲岛霜鹿角珊瑚共生虫黄藻进行调查和分析,揭示了其密度变化、叶绿素a浓度、群落组成、群落结构的季节变化规律。结果表明,夏季高温强光致使虫黄藻密度和叶绿素a浓度显著降低,光合作用受损;而在冬季低温弱光下,为提高光捕获率,虫黄藻密度和叶绿素a 浓度显著增加。并且,C1 亚系群始终为4 个季节的主导系群,可能与其高光合效率、较宽的温度耐受范围以及富氮环境耐受等生理特性有关。此外,表层海水温度和光合有效辐射通过影响虫黄藻背景系群丰度变化,进而导致群落结构差异显著。整体来看,季节性的表层海水温度和光合有效辐射波动是影响虫黄藻群落结构变化的主要因素。本研究以涠洲岛霜鹿角珊瑚为例,解析了低纬度礁区珊瑚共生虫黄藻群落的季节变化特征,有助于进一步揭示珊瑚微生物组的时空分布模式。
