兔出血症2型研究进展
2023-09-21张乐颖董青花朱婉月刘佐民梁春南
董 浩,张乐颖,左 琴,董青花,朱婉月,刘佐民,梁春南
(中国食品药品检定研究院 国家啮齿类实验动物资源库,北京 102629)
兔出血症(Rabbit hemorrhagic disease,RHD)又称兔瘟、兔出血性肺炎,是由杯状病毒科(Caliciviridae)兔出血症病毒属(Lagovirus)兔出血症病毒(Rabbit hemorrhagic disease virus,RHDV)引起兔的一种急性、败血性、高度致死性传染病,该病于1984年首次在我国江苏无锡等地暴发[1]。兔出血症2型(Rabbit hemorrhagic disease type 2,RHD2)又称兔瘟2型,是由兔出血症病毒2型(Rabbit hemorrhagic disease virus type 2,RHDV2)引起的危害家兔和野兔的一种新型高度传染性、急性致死性疫病,该病是世界动物卫生组织(WOAH)法定通报疫病。2022年6月农业农村部修订发布的最新版本的《一、二、三类动物疫病病种名录》中,将兔出血症列为二类动物疫病。
RHDV2与RHDV的主要不同之处在于,RHDV主要引起成年家兔感染,而RHDV2感染的宿主范围更广,不仅可以感染成年家兔和幼年家兔,而且对多个品种的野兔造成感染。此外,RHDV的病死率可高达80%~90%,而RHDV2的病死亡稍低,但其跨度较大。
1 国内外流行情况
RHD2于2010年4月在法国首次发现,随后RHD2呈现出向外蔓延趋势,意大利、西班牙、德国、葡萄牙、英国、挪威等多数西欧国家和亚速尔群岛,以及北非和南非一些国家陆续报道了该病的发生[2-3]。自从2016年传入加拿大的魁北克以来,在北美洲地区发生了多起RHD2疫情。2018-2021年,美国的华盛顿、俄亥俄州、加利福尼亚州、以及纽约等地区发生了多起疫情。该病在美国已经呈现出扩散势态[4]。2019年5月,日本爱媛县暴发了首起RHD2疫情,10只1~2岁的兔在2周内陆续死亡[5]。2020年9月,新加坡从发病的欧洲兔群中首次分离到RHDV2病毒[6]。
2020年4月,我国四川省首次出现疑似病例,经多种检测方法最终确定病原为RHDV2[7-8]。2020年5月21日,我国农业农村部畜牧兽医局发布消息称,四川成都金堂县2个养兔场发生兔出血症疫情,经四川省动物疫病预防控制中心确诊为兔出血症2型。根据四川省动物疫病预防控制中心2020-2021年对兔场中RHDV2的流行病学调查显示,2020年监测的432个规模场,场点阳性率为8.56%,而2021年监测了273个规模场,场点阳性率已经到达了39.93%,这说明RHDV2已经在四川省流行[9]。2021年初,河南省某地区一兔场出现患病家兔急性死亡病例,经鉴定也是发生了RHDV2感染,基于VP60基因的核苷酸序列测序和遗传进化分析表明该流行株与国内首株分离株SC2020/04的相似性高达98.2%[10],由此可见RHDV2已在我国的多个省份发生了流行。
2 病原学
对兔出血症病毒毒株的系统发育分析表明,存在3个不同的类群,从1984年起分离出基因类群G1-G5的“经典RHDV”,1996年鉴定出的抗原变体RHDVa /G6,以及2010年鉴定出的RHDV2。其中,RHDV和RHDVa是系统发育相关的,二者的致病性无差别,但是呈现出不同的抗原性和遗传差异,目前市售的疫苗对RHDV和RHDVa具有优良的保护力[11]。然而RHDV2与RHDV/RHDVa衣売蛋白VP60的核苷酸多样性差异超过15%,我国的RHDV疫苗无法对RHDV2提供足够有效的保护力。
RHDV2无囊膜,病毒结构呈20面体对称结构,病毒颗粒直径为32~44 nm。RHDV2为单股正链RNA病毒,基因组全长为7 442 bp,长于经典RHDV。RHDV2与RHDV基因组结构完全相同,核苷酸一致性达82.4%,RHDV2基因组包含2个开放阅读框,即ORF1和ORF2,其中ORF1编码1个多聚蛋白,该多聚蛋白由病毒编码的蛋白酶酶解成多个非结构蛋白p16、p23、p29、2C样蛋白、3C样蛋白、VPg、RNA依赖RNA聚合酶(RdRp)和结构蛋白VP60,ORF2编码衣壳蛋白VP10[12]。其中RHDV2的VP60蛋白是建立该病原分子诊断方法和血清学诊断方法的主要靶标,目前已经有较多相关的研究报告[13-15]。
我国首次发生RHD2疫情的2个兔场中分离的RHDV2毒株的VP60基因核苷酸序列与荷兰RHDV2分离株RHDV2-NL2016同源性最高,分别为98.01%和97.95%。与经典型RHDV毒株的同源性为79.0%~80.0%,亲缘关系较远[16]。
2020-2021年,李丽等[9]对四川省收集的12份阳性样品的RHDV2 VP60基因序列进行了测序分析,发现12份阳性样品的VP60基因序列与我国首起RHD2疫情的分离株RHDV2 SC2020-04株单独成簇,与国内外参照毒株的VP60基因核苷酸序列同源性为93.7%~100%。通过系统发生进化树发现,国内RHDV2分离株流行时期不同,所处的分支也不同,提示RHDV2毒株在我国很可能随着时间和地区的改变出现新的变异现象。
3 理化特性
对于RHDV2的理化特性的研究比较有限。根据世界动物卫生组织(WOAH)公布数据显示,RHDV/RHDVa可以在50℃下存活1 h,对反复冻融具有抗性;pH4.5~10.5时稳定,pH3.0的环境下可存活,而pH>12时病毒会失活;10 mg/mL的氢氧化钠、10~20 mL/L的福尔马林、酚类消毒剂(One-stroke Environ®)、5 mg/mL的次氯酸钠都可以灭活病毒,乙醚、氯仿和胰蛋白酶处理不会影响病毒的传染性。《陆生动物卫生法典》中推荐使用30 mL/L的福尔马林进行皮毛的消毒。在4℃用10~14 mg/mL甲醛或2~5 mL/L丙内酯处理可使病毒失去活性,而保留免疫原性,适用于疫苗生产。
RHDV/RHDVa病毒可能在冷藏或冷冻兔肉、动物尸体中存活数月。在4℃的组织悬浮液中可以存活7个月以上。室温下,干燥布匹上可以存活至少3个月。22℃时,在动物尸体中可以存活20 d。60℃的组织悬浮液或者干燥状态下的病毒,可以存活至少2 d。由于WOAH尚未公布RHDV2的理化特性数据,且RHDV2的相关研究比较有限,RHDV/RHDVa的相关数据具有一定的参考价值。
陈婉婷等[17]用PMA-RT-qPCR技术研究了不同pH、不同温度、常用兽用消毒剂、不同浓度甲醛与RHDV2共同作用后,对病毒活性的影响(表1)。RHDV2的活性随pH降低或升高而降低;83℃处理5 min后,病毒杀灭率可达95.10%;聚维酮碘对RHDV2杀灭作用最好,作用30 min后,病毒杀灭率达88.78%;3 mg/mL甲醛作用30 min后杀灭率可达82.22%。
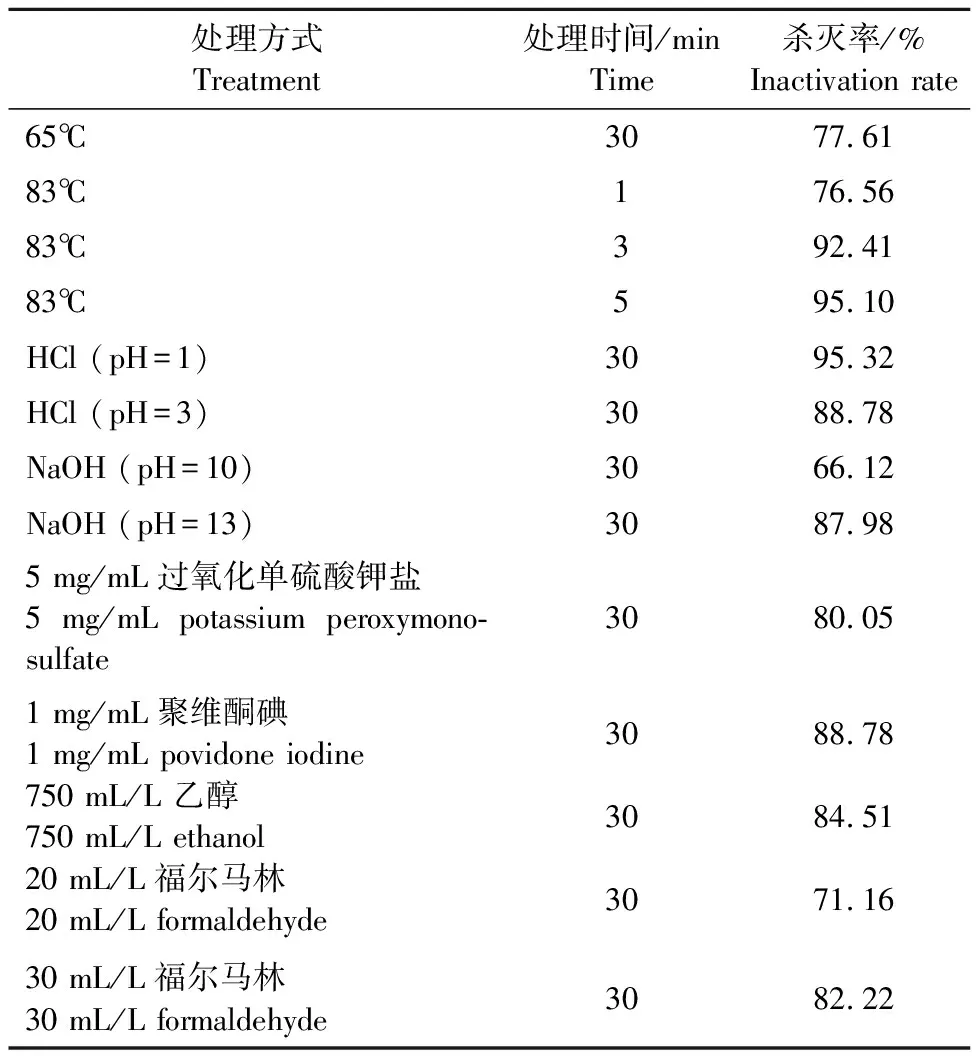
表1 RHDV2在不同理化条件下的存活能力
4 流行病学
4.1 传染源
感染了RHDV2的家兔和野兔为RHD2的主要传染源。
4.2 易感动物
对于6~8周龄以下的动物,典型的RHDV/RHDVa通常呈亚临床的感染,而RHDV2可以感染15日龄以上的家兔和野兔。在易感动物种类方面,除家兔外,撒丁海角兔(L.capensisvarmediterraneus)、意大利野兔(L.corsicanus)、欧洲褐兔(L.europaeus)和山地野兔(L.timidus)等品种的野兔均对RHDV2易感。
4.3 传播途径
通过口腔、鼻腔或结膜途径直接接触受感染动物,感染动物的尸体以及被污染的饲料、垫料和水等均可造成感染。野生动物和苍蝇等昆虫也是病毒的机械传播媒介。在动物感染试验中,可以通过口腔、鼻腔、皮下、肌肉或静脉注射等途径进行攻毒。值得注意的是,因为兔血液中的病毒在低温保存的兔肉中可以长时间保持感染性,进口受感染的兔肉是该病跨境传播的重要途径。
Qi R等[18]首次报道了人工感染RHDV2的兔精液中可检测到高浓度的病毒核酸。进一步对暴发RHD2疫情养殖场附近市场中售卖的兔冻精产品进行检测,从10份冻精样品中7份检出RHDV2病毒核酸,由此推断兔精液也是RHDV2传播的重要途径。
5 临床症状
根据病程的不同,可以分为最急性型、急性型、亚急性型和慢性型。最急性型发病时通常没有临床症状,主要的临床表现出现在急性感染的动物,亚急性型的特征类似于急性型但症状相对较温和。根据病原体的类型,潜伏期在1~5 d之间。在出现发热(>40℃)症状后12~36 h发生死亡。在此阶段,可以观察到各种临床症状,例如厌食、呆滞、反应迟钝、虚脱、神经症状(抽搐、共济失调、瘫痪、角弓反张、划水状)、尖叫、呼吸症状(呼吸困难、鼻孔流出带血的泡沫)和黏膜发绀。
在疫情暴发期间,若病原为RHDV/RHDVa则有5%~10%比例被感染动物可能表现为慢性或亚临床症状,其特征为严重的全身性黄疸、体重减轻和嗜睡,这些动物通常会在1~2周后死亡,部分存活下来的动物会出现抗体阳转。如果病原为RHDV2,发生慢性或亚临床症状的比例要显著增加。
与经典RHDV/RHDVa相比,RHDV2有与之相似的病变特征,即呼吸道出血和实质脏器水肿、出血、淤血。两者的不同之处在于,RHDV/RHDVa主要引起成年家兔感染,而RHDV2的感染宿主范围更广,不但感染成年家兔,还会感染15~20日龄幼年家兔。此外,经典RHDV/RHDVa的死亡率可高达80%~90%,而RHDV2型的死亡率稍低,但其跨度较大(5%~70%)。表2中展示了使用我国RHDV2分离株SC20-01人工感染SPF级新西兰白兔后,不同组织和体液中病毒的载量[18]。
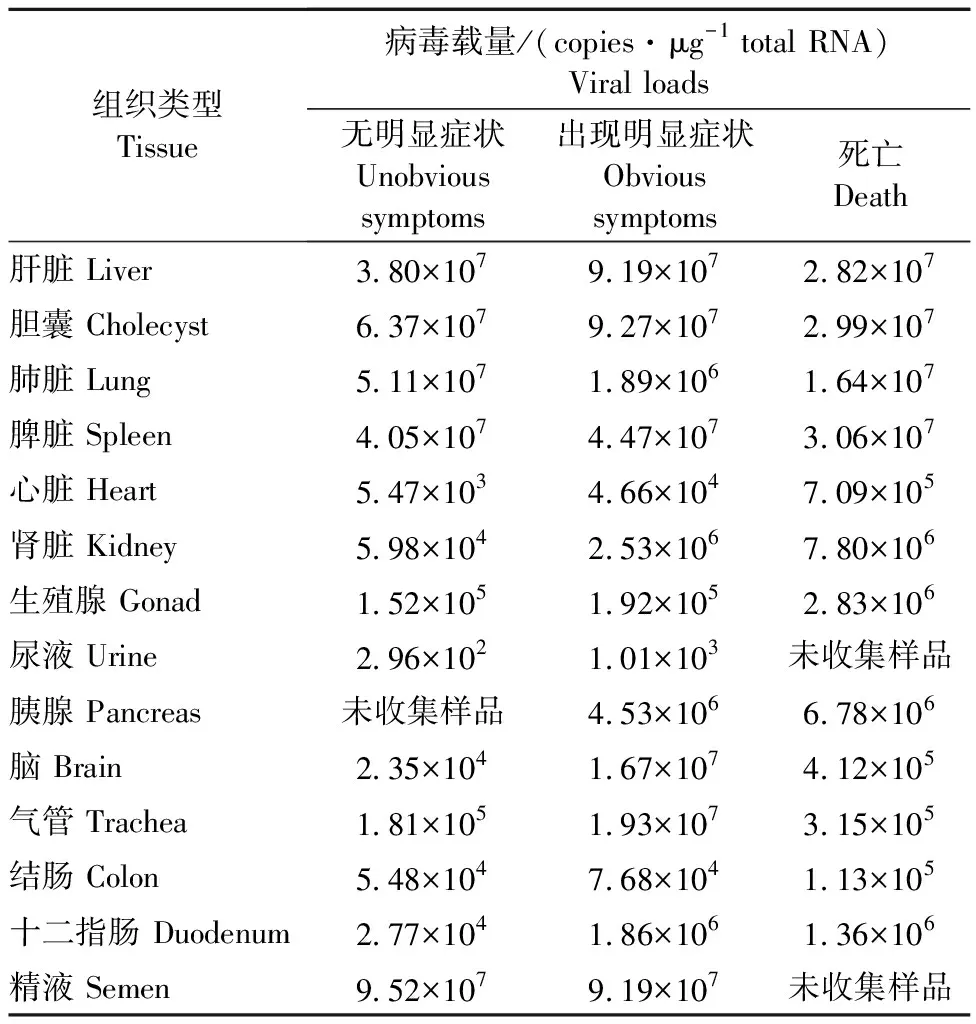
表2 RHDV2感染新西兰白兔后不同组织的病毒载量
6 剖检病变
RHDV2感染引起的兔出血症以实质器官出血、淤血为主要特征。肝脏呈黄棕色,质脆和变性。气管黏膜充血,含有大量泡沫液体,肺部水肿和充血。脾脏肿大,边缘变钝。弥漫性血管内凝血通常是患病动物出现多种器官出血和猝死的原因。在亚急性和慢性病例中,耳朵、结膜和皮下组织明显出现黄疸变色。
7 诊断方法
目前尚无合适的细胞系用于RHDV2的分离培养,只能采用接种试验兔的方式进行病毒的分离、传代和确定传染能力。用RHDV2发病死亡兔的100 mg/mL的肝匀浆液,通过颈部皮下注射成功感染25日龄仔兔和4月龄成年兔。感染的试验兔72 h内全部死亡,剖检和实验室检测均证明上述试验兔死于RHDV2感染[19]。用RHDV2发病死亡兔的100 mg/mL肝匀浆液,通过肌肉注射感染了5只1月龄的SPF级试验兔,18~24 h内试验兔也全部死亡[20]。死亡试验兔的临床症状和剖检变化与发病兔场中的死亡病例类似,对人工感染动物进行实验室检测,也均为RHDV2阳性。
病原学检测技术方面,《陆生动物诊断试验和疫苗手册》中推荐了RHDV的通检方法和专门针对RHDV2的RT-PCR方法。用RT-PCR可以在多种器官、尿液、粪便或血清中检测到病毒的RNA。其中,肝脏是病毒载量最高的器官,其次是脾脏。在慢性或亚急性感染的兔中,可能在脾脏中比肝脏中更容易检测到病毒。针对RHDV2的VP60序列建立了多种RT-PCR检测方法和双重RT-PCR方法[21-23],用于对RHDV和RHDV2进行鉴别检测。除此PCR类检测方法外,血凝试验、免疫电镜、病毒捕获ELISA、免疫染色以及Western blot也是WOAH推荐的病原检测方法。
血清学检测技术方法,《陆生动物诊断试验和疫苗手册》推荐血凝抑制试验、间接ELISA和竞争ELISA方法应用于RHDV、RHDVa和RHDV2自然感染或者免疫抗体的测定。
中国畜牧业协会团体标准《兔病毒性出血症2型诊断技术规程》(T/CAAA 028-2019)中规定了应用于RHDV2检测的红细胞凝集试验、RT-PCR、免疫印迹等病原学诊断方法,以及红细胞凝集抑制试验和竞争ELISA等血清学诊断方法[24]。目前在实验动物领域的限行标准中,只有《实验动物 兔出血症病毒检测方法》GB/T 14926.21-2008中规定了RHDV/RHDVa的抗原和抗体检测方法,尚缺乏RHDV2检测的相关标准。
8 防控措施
我国用RHDV/RHDVa疫苗已经对RHDV感染实现了有效的控制。但是,RHDV/RHDVa疫苗对于RHDV2没有交叉保护力[25]。目前在世界范围内,法国和西班牙已经注册了预防RHDV2感染的疫苗,而我国国内尚无针对RHDV2的商业化疫苗。严格控制动物引种,应从无RHDV2病原感染的养殖场购买活兔,加强活兔调运检验检疫,严防病原引入。针对兔肉制品和兔冻精具有携带RHDV2病原进行远距离传播的风险,相关部门也应该加强对于这类商品的检验检疫工作。加强针对RHDV2防控知识的宣传培训,提升广大从业者对该病的知晓率和重视程度。还应加强养殖场生物安全防控工作,对养殖场周围环境的蚊虫进行杀灭,人流、物流及车流同样需要严格控制,防止病毒的机械携带传播[26]。根据《中华人民共和国动物防疫法》的要求,发现动物感染RHDV2或疑似感染时,应当立即向所在地农业农村主管部门或者动物疫病预防控制机构报告,并迅速采取隔离等控制措施,防止动物疫情扩散[27]。动物疫病预防控制机构也应加强对家兔RHDV2的监测力度,及时掌握我国不同区域的RHDV2的流行情况和抗原变异情况,为疫病的防控、诊断试剂和疫苗的研发提供数据支撑。RHDV2病毒在环境中的存活能力较强,一旦出现感染病例,应该用病毒敏感的消毒剂对死亡兔的尸体、污染的笼架、饲料、垫料等进行严格消毒和无害化处理,严防病毒扩散。
9 小结
RHD2作为一种高度传染性、急性致死性疫病,严重危害着家兔养殖业的发展。自2020年4月RHDV2传入我国四川省后,在仅2年的时间已经传播至我国的多个省份,病原的传播速度十分惊人。同时,RHDV2的宿主范围比RHDV和RHDVa更广,传播途径多,在自然环境下抵抗力强,使得该病毒难以被消灭。而当前缺乏没有商品化的疫苗和诊断试剂对于该病的防控极为不利。因此,相关部门应提高RHDV2防控的重视程度,加大宣传培训力度,加强科技力量投入,破解RHD2防控的关键技术瓶颈,有效降低RHDV2对养兔业的危害。
