猪塞内卡病毒A、猪水疱病毒和口蹄疫病毒三重荧光定量PCR检测方法的建立与应用
2023-09-21吴志敏张馨月张添琪张嘉钰梁湘雨孟凡茹胡桂学
苏 博,吴志敏,张馨月,赵 涵,鲍 迪,张添琪,张嘉钰,梁湘雨,孟凡茹,王 开,胡桂学
(吉林农业大学动物医学院,吉林长春 130118)
塞内卡病毒A(Senecavirus A,SVA)、猪水疱病毒(Swine veslcular disease virus,SVDV)、口蹄疫病毒(Foot-and-mouth disease virus,FMDV)均为小RNA科病毒[1-5],都能引起感染猪产生水疱症状[6-9],仔猪病死率较高,仅凭临床症状难以鉴别3种病毒感染猪[10-13]。已报道的引起猪出现水疱症状的病毒多为二重荧光定量检测方法[14-16]。为了实现快速鉴别有水疱症状的病毒感染猪,本试验建立一种可以鉴别3种病毒的三重荧光定量检测方法,为临床诊断鉴别提供科学方法。
1 材料与方法
1.1 材料
1.1.1 病毒、质粒 SVA纯培养物由四川农业大学动物生物技术中心惠赠,FMDV水疱液为确诊来自四川、重庆病猪。含有SVA、FMDV、SVDV病毒部分保守序列的重组阳性质粒由上海生工生物工程有限公司合成。猪流行性腹泻病毒(PEDV)、经典猪瘟病毒(CFSV)、猪繁殖与呼吸综合征病毒(PRRSV)由本实验室保存,伪狂犬病病毒(PRV)、猪圆病毒环2型(PCV2)病料来自吉林省2020-2021年送检的阳性组织样本。
1.1.2 主要试剂 ProTaqHS premix probe qPCR kit和ROX reference dye (4 μmol/L),Accurate公司产品;DEPC treated water、Trizol,Sangon公司产品;2×EsTaqmaster mix(dye),CWBIO公司产品;反转录试剂盒、DNA Marker DL 1 000、6×Loading buffer,TAKARA公司产品;病毒DNA提取试剂盒,OMEGA生物技术公司产品;50×TAE,Coolaber公司产品;Gel red,Bio sharp公司产品。
1.1.3 主要仪器 Applied biosystemTM7500荧光PCR仪和Nano Drop微量核酸蛋白浓度测定仪,赛默飞世尔科技(中国)有限公司产品;EP Mastercycler nexus PCR仪和台式高速冷冻离心机,Eppendorf公司产品;凝胶成像系统,Bio red公司产品。
1.2 方法
1.2.1 引物探针的设计与合成 用Primer5/Oligo7软件对比GenBank数据库中3种病毒不同毒株基因序列,在3种病毒的高度保守区域分别设计多对候选引物和探针,FMDV引物探针设计区间为(GenBank:AF308157.1)5′UTR区域(571-1 069 bp),SVDV引物探针设计区间为(GenBank:MK038999.1)3D序列(6 459-6 875 bp),SVA引物探针设计区间为(GenBank:MK802890.1) 3D序列(6 999-7 149 bp)。引物用Primer Blast工具进行序列比对,预测特异性。确认序列后将其发送至Sangon公司进行合成,探针发送Takara公司合成(表1)。
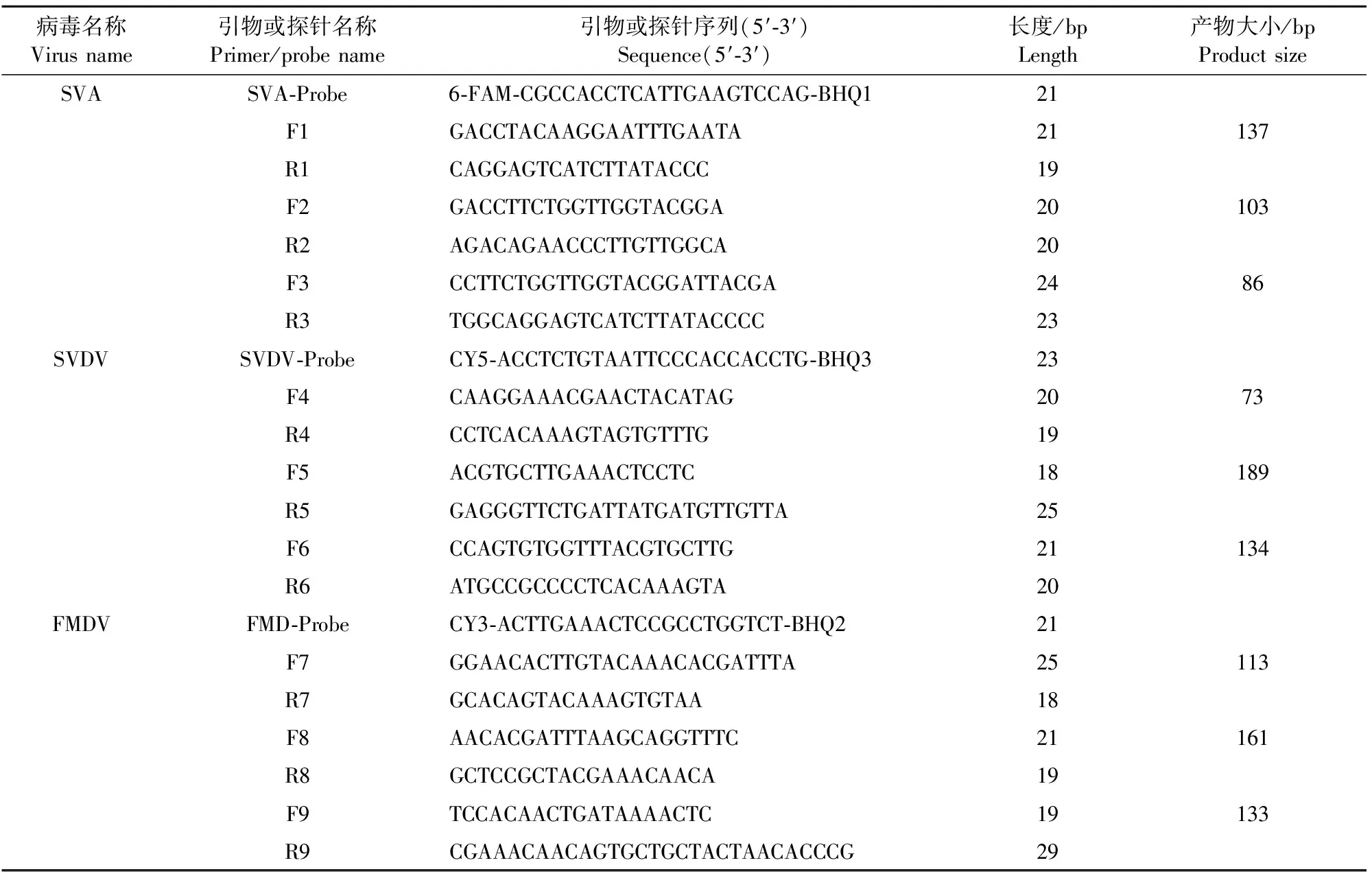
表1 荧光定量PCR候选引物和探针
1.2.2 重组质粒的合成与稀释 质粒的合成选择覆盖试验设计引物扩增区间的碱基序列,由Sangon公司合成。3种病毒的合成质粒分别为FMDV-plasmid (499 bp)、SVDV-plasmid (417 bp)、SVA-plasmid (451 bp)。使用NanoDrop微量核酸蛋白浓度测定仪对合成的质粒进行浓度测定,根据拷贝数计算公式得出3种质粒标准品的拷贝数。按对应比例加入Elution buffer稀释至1×1010copies/μL,再10倍梯度稀释至101copies/μL,分装后置-20℃保存备用。
1.2.3 核酸提取 按照试剂盒说明书提取对照DNA病毒的DNA,保存在-20℃冰箱备用。RNA病毒提取RNA并反转录成cDNA,放入-20℃冰箱备用。
1.2.4 引物筛选 在探针序列固定的条件下,使用每种病毒提前设计的3组候选引物对阳性质粒进行扩增,反应体系为2×ProTaqHS Probe Premix 10 μL,RO×Reference Dye(4 μmol/L)0.4 μL,上、下游引物(10 μmol/L)各0.4 μL,探针(10 μmol/L)各0.2 μL,模板共2 μL,DEPC水补足20 μL;反应程序为95℃ 30 s,95℃ 5 s,60℃ 30 s,40个循环。扩增对应病毒106~101copies/μL梯度浓度阳性质粒,每个浓度梯度设置3个重复孔,取平均值,以扩增效率高、不出现非特异性信号时循环数小的条件作为优先选择因素,筛选灵敏度高的引物对。
1.2.5 反应条件的优化
1.2.5.1 温度优化 使用普通PCR方法对筛选出的引物对进行退火温度的优化。将浓度为103copies/μL的3种病毒质粒作为模板,分别在56.5、57.7、58.5、59.5、60.8、61.5℃退火进行 PCR反应,结束后在反应管内加入6×Loading buffer,琼脂糖凝胶电泳,确定反应温度。
1.2.5.2 引物和探针含量优化 结合荧光定量试剂说明书,在确定退火温度的条件下,引物(10 μmol/L)添加量分别为0.1、0.2、0.3、0.4、0.5、0.6 μL。探针(10 μmol/L)添加量分别为 0.1、0.2、0.3、0.4、0.5 μL筛选最佳浓度。
1.2.6 特异性、灵敏性、重复性试验
1.2.6.1 特异性试验 以SVA、FMDV、PRRSV、CFSV、PEDV、PCV2、PRV阳性样品cDNA或DNA以及SVDV的阳性质粒作为模板,观察实时荧光定量PCR扩增结果。
1.2.6.2 灵敏性试验 筛选出引物后使用梯度浓度为106~101copies/μL的SVA、SVDV、FMDV阳性质粒作为模板,DEPC H2O为阴性对照模板,进行TaqMan荧光定量PCR和普通PCR扩增,测试对比两种PCR的灵敏性差异。SVA、SVDV和FMDV普通PCR产物大小分别为103 bp、73 bp和133 bp。
1.2.6.3 重复性试验 选取浓度为106~104copies/μL的SVA、SVDV、FMDV阳性质粒作为模板,以DEPC水作为阴性对照,进行3次独立且重复的实时荧光PCR试验作为批间重复试验,每次试验的每个模板做3个重复作为批内重复试验。记录检测的Ct值及变异系数,测试并评价实时荧光定量PCR方法的重复性。
1.2.7 三重荧光定量PCR方法的标准曲线建立 将梯度稀释浓度为106~101copies/μL的SVA、SVDV、FMDV质粒作为模板,DEPC H2O为阴性对照,使用筛选的引物及优化后的反应条件进行TaqMan荧光定量PCR扩增,绘制标准曲线。
1.2.8 三重荧光定量PCR方法的初步应用 采用本试验建立的SVA、SVDV、FMDV三重荧光定量PCR方法对吉林省部分地区送检死亡仔猪或流产死胎的肝、肾、脾、肺、肠、血清、口腔鼻腔拭子以及本实验室保存的猪血清进行检测。
2 结果
2.1 质粒浓度测定
测得3种质粒的浓度分别为146.8 ng/μL(FMDV)、62.9 ng/μL(SVDV)、166 ng/μL(SVA),经计算得出3种质粒的拷贝数分别为4.17×1010(FMDV)、1.83×1010(SVDV)、4.79×1010(SVA),再分别将3种质粒梯度稀释成1010~101copies/μL。
2.2 引物的筛选
在探针序列固定的条件下用3种病毒对应的3组候选引物进行实时荧光定量PCR反应。F2R2(SVA)在同灵敏度条件下Ct值较小,F4R4(SVDV)能达到101copies/μL,F9R9(FMDV)灵敏度能达到101copies/μL。Ct值小于32时,结果判定为有效。选择灵敏度高的引物,灵敏度相同时选择Ct值较小的引物对(表2)。因此,选择F2R2作为SVA荧光定量PCR引物,F4R4作为SVDV荧光定量PCR引物,F9R9作为FMDV荧光定量PCR引物。
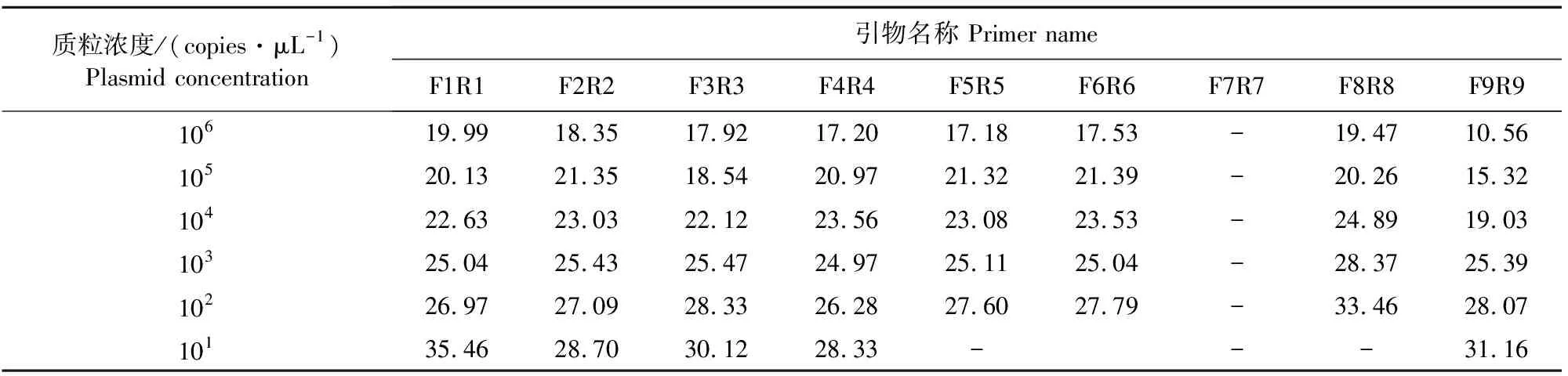
表2 使用不同引物检测对应各浓度梯度质粒标准品的Ct值
2.3 反应条件的优化
2.3.1 反应温度优化 筛选出的引物对在56.5、57.7、58.5、59.5、60.8、61.5℃退火温度下进行PCR扩增相应病毒103copies/μL标准品,SVA引物在60.8℃和61.5℃时条带较为明显,SVDV引物在56.5℃和60.8℃、61.5℃时条带较为明显,FMDV引物在56.5~60.8℃退火温度条件下未见明显差异(图1)。选择60.8℃作为最佳退火温度。
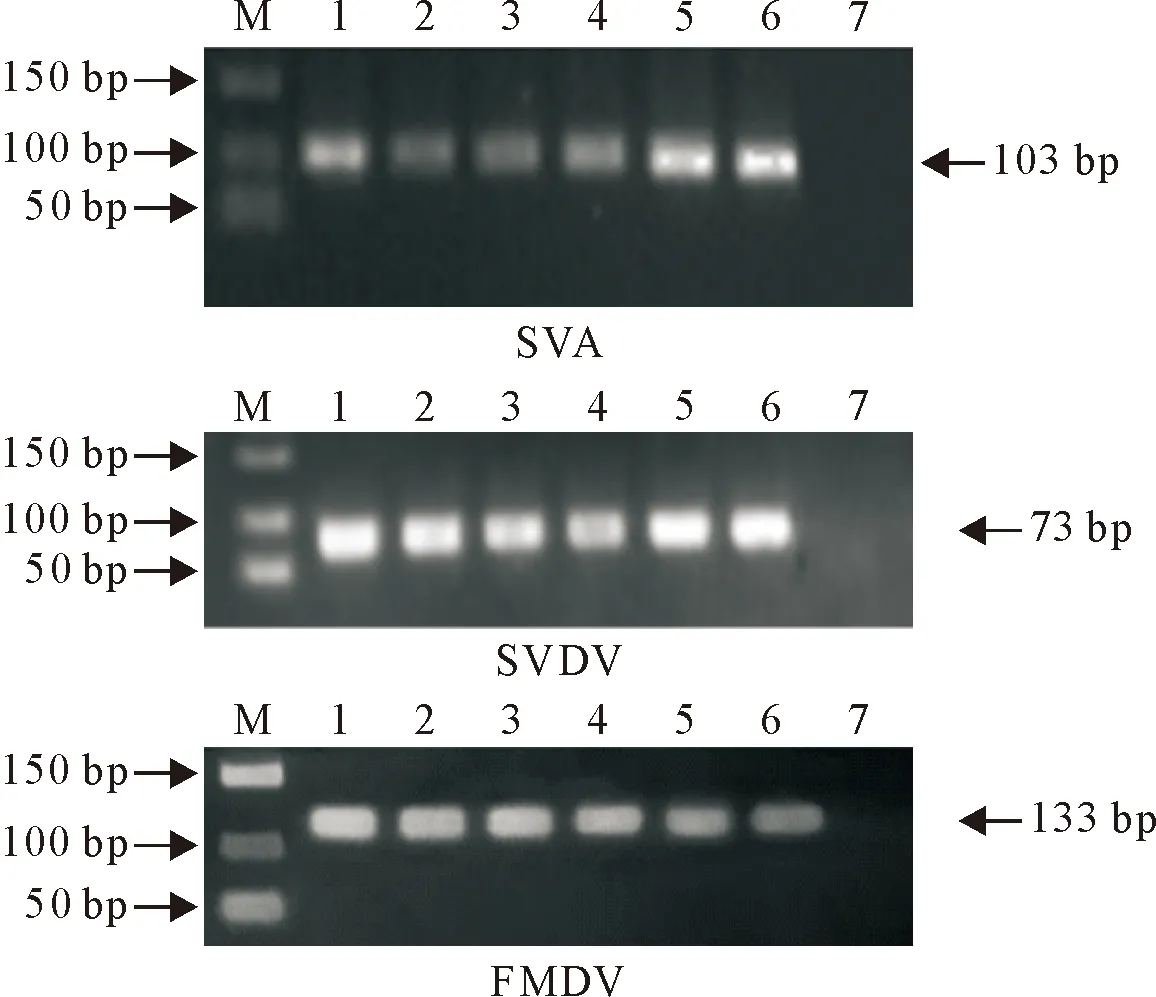
M.DNA标准DL 150;1~6.56.5℃、57.7℃、58.5℃、59.5℃、60.8℃、61.5℃;7.阴性对照
2.3.2 引物探针含量优化 在确定退火温度的条件下,随着引物浓度的增加,荧光定量PCR的Ct值有轻微变化,但无明显规律(表3~表5,表中列出的Ct值为批内重复孔的平均Ct值)。以未检出异常扩增信号时Ct值较小的组合作为筛选的优先选择条件,出现近似数据时选择荧光强度高且引物探针添加量少的条件。多重荧光定量PCR除了上述条件外还应将扩增效率高的引物和和扩增效率低的引物在添加量方面进行平衡,以保证体系内3对引物的均等扩增。在20 μL体系下,选择SVA引物添加量为0.4 μL,探针添加量为0.2 μL;SVDV引物添加量为0.5 μL,探针添加量为0.4 μL;FMDV引物添加量为0.5 μL,探针添加量为0.2 μL作为最佳引物探针添加量。
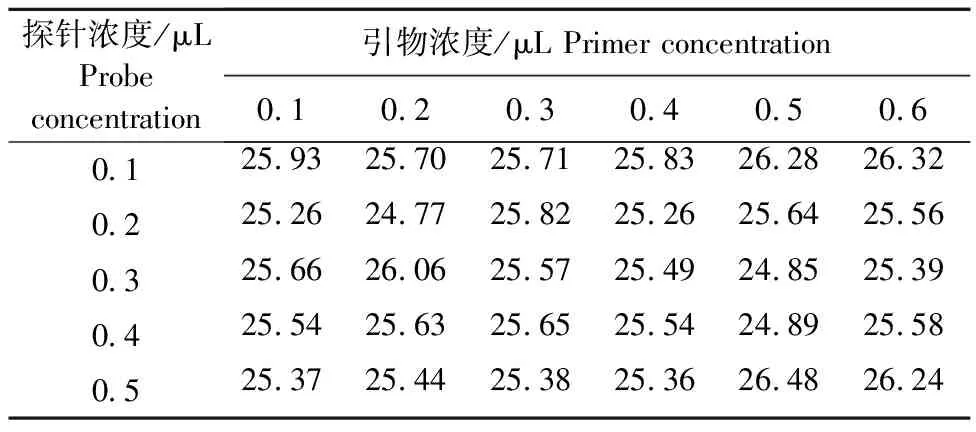
表3 不同浓度引物和探针检测SVA质粒的Ct值

表4 不同浓度引物和探针检测SVDV质粒的Ct值

表5 不同浓度引物和探针检测FMDV质粒的Ct值
2.4 特异性灵敏性重复性试验
2.4.1 特异性试验 利用荧光定量PCR方法分别检测SVA、FMDV、PRRSV、CFSV 、PEDV、PCV2、PRV阳性样品cDNA或DNA以及SVDV的阳性质粒(图2),只能扩增对应阳性病毒样品或质粒,SVA、SVDV、FMDV的Ct值分别为24.4、24.9、25.3,其他结果均显示阴性,表明该实时荧光定量PCR方法具有良好的特异性。
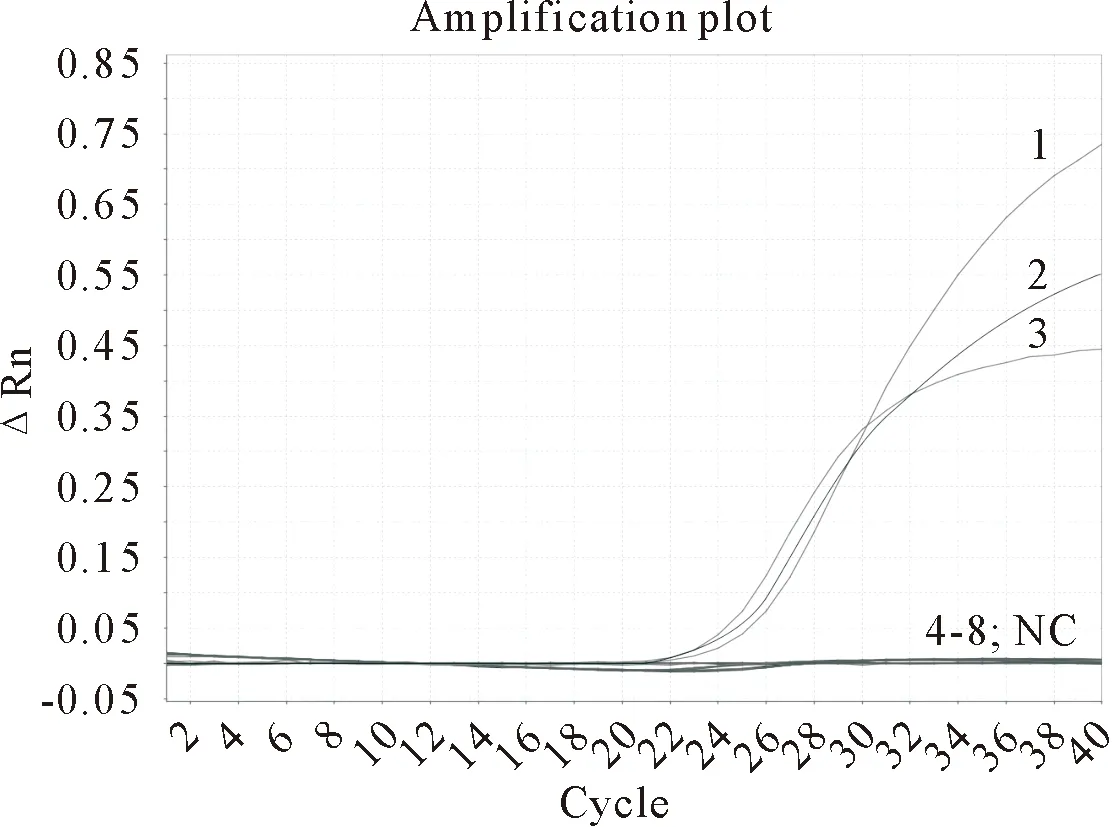
1.SVA;2.SVDV;3.FMDV;4.PRRSV;5.CSFV;6.PEDV;7.PCV2;8.PRV;NC.阴性对照
2.4.2 灵敏性试验 使用浓度梯度为106~101copies/μL的质粒进行普通PCR扩增,3种病毒普通PCR最低检出极限处核酸条带与预期大小相符(图3),SVA普通PCR最低检出极限为103copies/μL,SVDV普通PCR最低检出极限为104copies/μL,FMDV普通PCR最低检出极限为104copies/μL。根据普通PCR的扩增结果,选择标准浓度为1×101copies/μL的3种病毒标准质粒进行TaqMan荧光定量PCR扩增,本方法对3种病毒的灵敏度均达到1×101copies/μL(图4)。

M.DNA标准DL 150;1~6.106~101copies/μL质粒普通PCR扩增产物;7.阴性对照
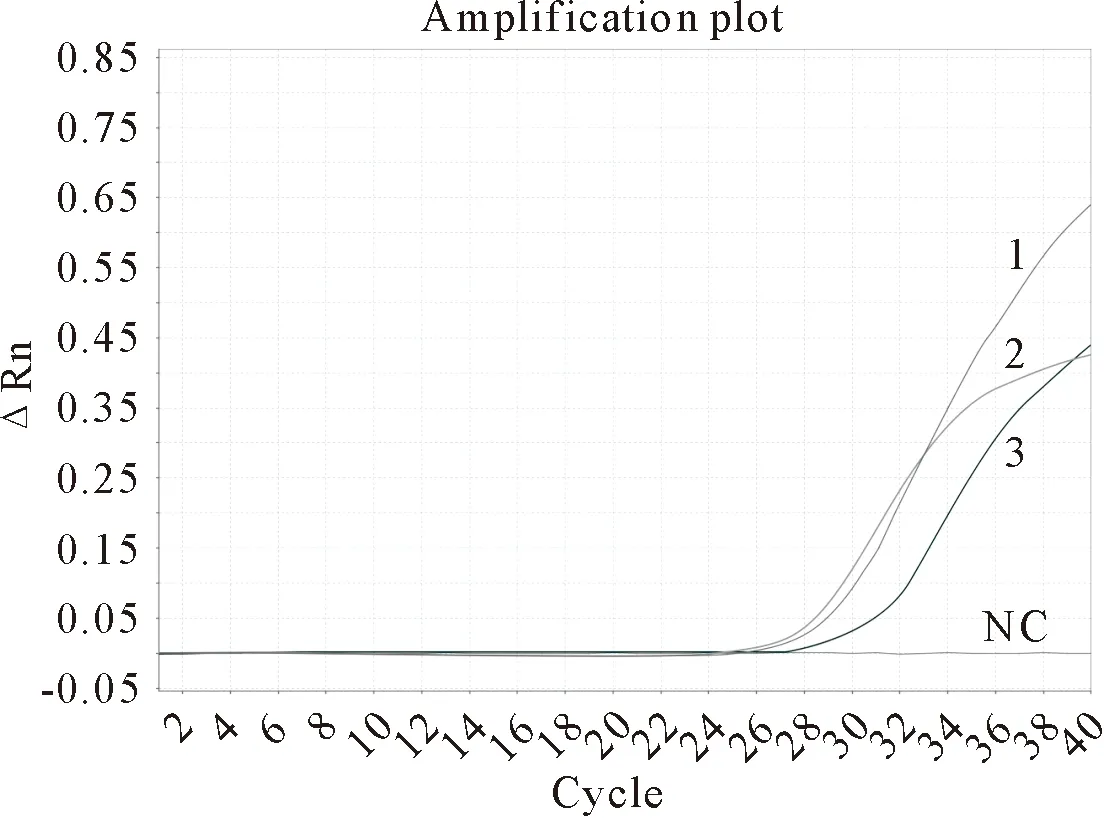
1~3.1×101 copies/μL标准模板的SVA、SVDV、FMDV TaqMan多重实时荧光定量PCR扩增曲线;NC.阴性对照
2.4.3 重复性试验 以106~104copies/μL的病毒质粒为模板,以DEPC水作为阴性对照,进行批间和批内重复试验,Ct值及变异系数均低于4%(表6)。
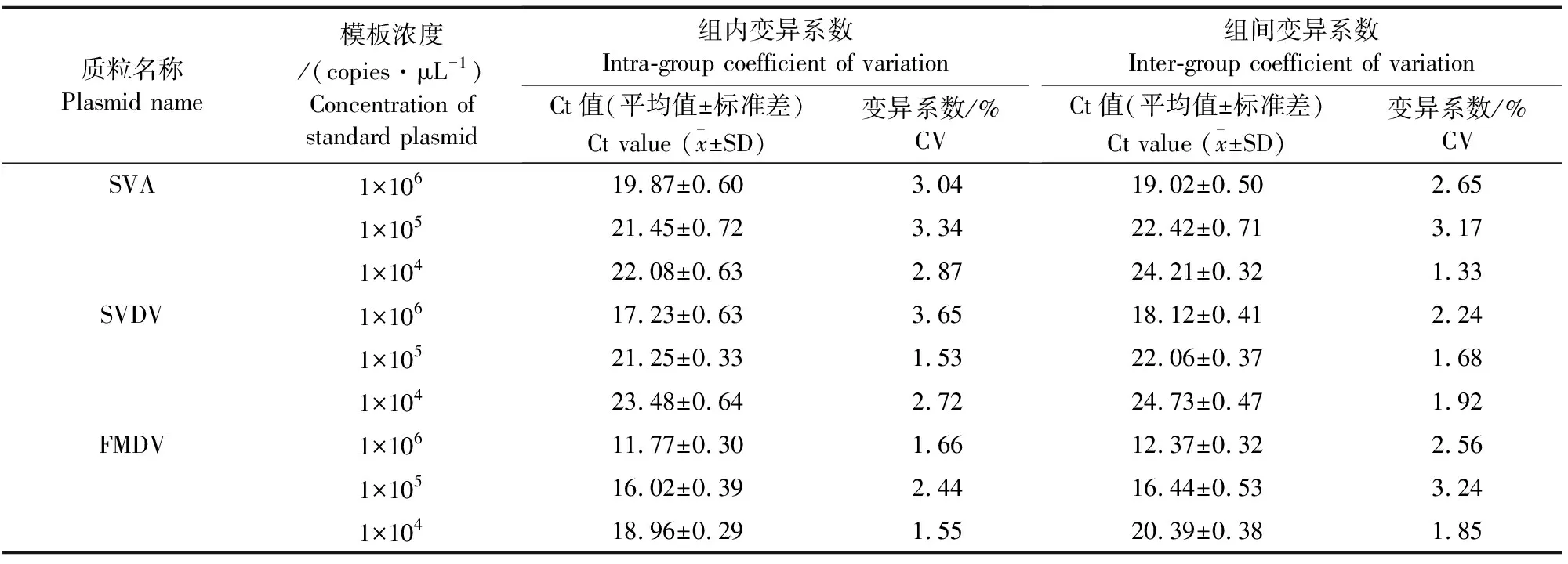
表6 TaqMan多重实时荧光定量PCR重复性试验
2.5 标准曲线的建立
在106~101copies/μL的梯度浓度区间内,根据扩增曲线绘制3条标准曲线的相关系数接近1(表7),符合预期结果。3种病毒对应的扩增曲线都呈现较为标准的“S型”曲线。
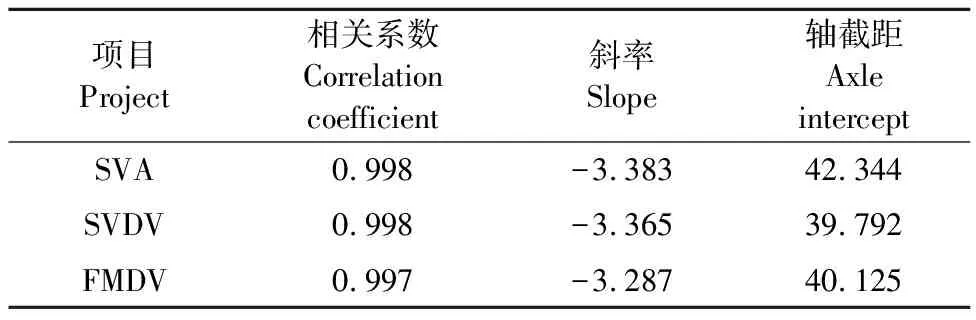
表7 标准曲线相关参数
2.6 临床样品检测结果
使用本试验建立的三重荧光定量PCR方法,检测临床病料305份,检出7份FMDV核酸阳性样品,1份SVA核酸阳性样品,未检测到SVDV核酸。7份FMDV阳性样品均为确诊样品,1份SVA样品为病毒分离培养物,吉林省送检的297份病料和实验室保存的猪血清未检出SVA、FMDV、SVDV核酸。
3 讨论
SVA、SVDV和FMDV感染猪在临床上的症状高度相似,鉴别诊断困难。多重荧光定量 RT-PCR技术能同时检测多种核酸扩增,非常适合快速鉴别不同病原[17]。但多重荧光定量需要考虑现有实验室荧光定量仪器支持同时检测的信号,除此之外包括引物与引物、引物与探针的匹配、竞争和错配都需要进行优化[18-19]。3种病毒都是小RNA科病毒,容易产生变异,因此本试验大量对比国内已报道的3种病毒序列,结合国外学者的研究成果[20-22],选择口蹄疫病毒的非编码区域和塞内卡病毒A、猪水疱病毒的3D序列并覆盖口蹄疫O、A和亚洲Ⅰ血清型设计引物以及探针并合成质粒。通过引物筛选和反应条件优化,建立了三重荧光定量PCR方法,并用于临床样品的检测,实现了单管同时检测SVA、FMDV、SVDV。
为了鉴别引起猪出现水疱症状病毒,国内外已有不少学者建立了多重荧光定量RT-PCR检测方法,但鲜见SVA与FMDV及SVDV的三重TaqMan 荧光定量RT-PCR方法。史喜菊等人建立了CSFV、ASFV和SVDV多重荧光PCR检测方法以及SVDV、VSV和FMDV的多重实时荧光PCR检测方法,并比对了单重荧光定量与多重荧光定量检测结果的差异以及RNA和质粒检测结果的区别,结果显示两项对比的扩增效率、特异性、敏感性并无明显差异[23]。施开创等人建立的SVA与O型、A型及亚洲Ⅰ型FMDV多重荧光定量方法能对国内流行的FMDV血清型和SVA进行区别[24]。
在验证检测方法的过程中,应用本研究建立的三重荧光定量PCR方法对来自四川、重庆的7份FMDV确诊水疱液核酸样品和1份SVA病毒纯培养物核酸样品进行验证,100%符合。
资料显示,吉林省也属于口蹄疫免疫无疫区,2018年1月-2022年1月中国农业农村部也未发布任何有关吉林省发生口蹄疫疫情的相关信息。对吉林省部分地区的调查显示,该地区O型口蹄疫抗体水平最低时超过国家标准11.6%[25]。猪水疱病已很多年未见大陆报道,有研究建立了猪病四重普通PCR方法,其中包含SVDV,将其建立的方法对48份临床样品进行检测也未检出SVDV[26]。对河北省及周边部分地区进行过SVA的流行病学调查,其结果显示在河北省规模猪场采集的总样品中,SVA阳性率仅为0.5%,表明SVA并未在其调查区域大面积流行[27]。对吉林省塞内卡病毒A流行病学调查后再无学者对吉林省水疱病毒进行流行病学相关调查研究[28]。本试验收集了2020-2022年吉林省辖区内的长春市九台区、双阳区、农安县、德惠市、公主岭市、双辽市、吉林市、永吉县、磐石市、蛟河市、通化市、梅河口市和四平市地区的不明原因死亡仔猪和流产死胎组织检测样本共计267份和实验室冻存血清检测样本30份。对297份样品进行检测,未检测到3种致猪水疱症状病毒的核酸,与国内报道的吉林省3种病毒的流行病学调查情况一致,提示SVA、SVDV和FMDV 3种致猪水泡症状病毒未在吉林省猪群中流行。
