糜子黄、黑果皮遗传及转录组学分析
2023-09-21郭世华高志军
李 强,白 璐,郭世华*,高志军
(1 内蒙古农业大学 农学院,呼和浩特010019;2 鄂尔多斯市农牧业科学研究院,内蒙古鄂尔多斯 017200)
糜子(PanicummiliaceumL.)禾本科黍属,一年生禾谷类作物[1],糜子作为短日照C4植物,具有水肥利用率高、耐高温、抗盐碱、抗旱等特点[2]。糜子起源于中国,据考古资料显示,其在中国的栽培历史悠久,最早可追溯至距今8 000~10 000年前[3-4],在中国古代的农业体系中具有重要地位,被称为“五谷之长,百谷之王”[5-6],是干旱半干旱地区的重要粮食作物,可作为储备作物或赈灾粮,是典型性的环境友好作物[7]。糜子去壳后为黄米或糜米,富含膳食纤维、蛋白质、多酚、钙、铁、钾等多种营养元素[8]。
相关研究表明,糜子具有预防心血管、糖尿病和治疗乳糜泻等功效[9],可预防老年高血压、冠心病、高血脂等疾病[10],是一种药食同源的作物[11]。糜子果皮颜色常见有黄色、黑(褐)色、红色、白色、灰色和复色,以黄、白、红、褐4种颜色居多。糜子籽粒外壳皮层中含有的大量天然色素,可作为天然着色剂[12]。糜子果皮颜色还与营养、加工品质密切相关。
琦明玉等[13]研究表明,黑色果皮糜子的碳水化合物含量显著高于白色果皮糜子,氨基酸含量显著低于白色籽粒糜子和红色籽粒糜子;柴岩等[14]研究表明,糜子果皮颜色不同,皮的薄厚有所差异,果皮越厚越不易脱落,导致出米率低粒色深的品果皮厚,果皮不易脱落,出米率低,浅色的品果皮薄,果皮极易脱落,出米率高;臧盛等[15]研究表明,糜子品种的果皮颜色越深,糜子壳粉中的总黄酮、总酚、结合黄酮、自由黄酮和自由酚含量就越高。 黄酮类化合物是造成植物种子、叶、果实和花颜色变化的主要物质[16]。吕丹[17]通过测定不同粒色苦荞籽粒中黄酮含量,发现黄色苦荞籽粒的黄酮含量明显低于灰色、褐色和黑色。刘靖崧等[18]研究表明,绿色籽粒小豆总黄酮含量明显高于红色籽粒,亮色种皮小豆总黄酮含量明显高于暗色。曲存民等[19]研究表明,基因BnTT3和BnTT18可能是导致甘蓝型油菜种皮黄黑籽差异的形成原因。Jiang等[20]研究表明,转录因子TaPpb1和TaPpm1通过形成复合体调节花青素合成,从而影响小麦种皮颜色。蒋宝鑫等[21]研究表明,DFR基因与比利时杜鹃花花瓣的颜色有关。
综上所述,果皮颜色对作物的品质密切相关,除此之外,可作为田间杂交育种的重要农艺性状标记,可作为杂种F1代田间真假杂种鉴定的指示性状,极大减少田间工作量,可有效提高育种效率,研究其颜色形成的机理,对田间育种具有重要指导意义。基于此,本研究以黄粒糜I和2016106I 2个不同颜色的亲本配制遗传群体,利用杂种F1、F2代分析糜子籽粒颜色的遗传规律,以F3代不同果皮颜色糜子籽粒为材料,通过转录组测序挖掘调控糜子籽粒颜色形成的相关基因,为明确糜子果皮颜色形成的机理和糜子新品种的选育提供理论基础。
1 材料和方法
1.1 试验材料
研究所用材料为鄂尔多斯市农牧业科学研究院提供的黄粒糜Ⅰ和2016106Ⅰ(表1、图1),杂交后所获得的F1、F2和F3籽粒。

图1 亲本‘黄粒糜Ⅰ’和‘2016016 Ⅰ’果皮颜色

表1 供试材料
1.2 材料种植、取样与指标测定
将课题组前期杂交的糜子组合“黄粒糜Ⅰ×2016106Ⅰ”种植于试验田,试验行长6 m,行距0.4 m,株距0.15 m,在生育后期进行田间真假杂种鉴定,待成熟后,收获真杂种(F1)。次年将上年收获的真交种和亲本同时播种,待成熟后,共获得196个F2单株;第3年将第2年选择的单株种植成株行,选择与第2年颜色一致且果皮颜色未分离的穗行进行标记,黄色果皮和黑色果皮各选3个穗行,剥取果皮装入冻存管中,编写对应编号,黄籽标为Y1、Y2、Y3,黑籽标为B1、B2、B3,液氮速冻后转移至-80 ℃保存。
使用目测法对F1代和F2代收获的种子进行表型鉴定,观察其果皮颜色并记录。统计F2果皮颜色,并根据孟德尔遗传定律预测相对应的基因型,使用SPSS 24.0对各F2果皮颜色表型的实际值和预测值进行卡方检验。χ2公式为:
χ2=∑(|A-T|)2/T
1.3 文库构建及数据分析
提取6个参试样本的总RNA,构建文库,经转录组测序,将下机数据进行过滤后与参考基因组进行比对(https://www.ncbi.nlm.nih.gov/genome/?term=Panicum+miliaceum),根据比对结果进行基因表达水平定量、差异显著性分析、功能富集分析。
1.4 实时荧光定量(qRT-PCR)验证
为验证转录组数据的可靠性,选择10个候选基因用于验证糜子籽粒RNA-seq数据,用Primer 6.0软件设计特异性引物如表2所示,用SYBR GREEN染料法。两步法荧光定量PCR扩增条件的设置:扩增曲线:95 ℃ 5 min,循环1次;95 ℃ 10 s,60 ℃ 30 s,循环40次,72 ℃单点检测信号。溶解曲线:95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s,连续检测。以Actin为内参基因,基因相对表达量用2-ΔΔCT计算。

表2 qRT-PCR引物
2 结果与分析
2.1 糜子果皮颜色的遗传分析
通过对糜子果皮颜色进行统计分析,F1代糜子杂交种籽粒的果皮颜色均呈现为黑色。F2代群体籽粒的果皮颜色发生明显分离(表3),黑色果皮糜子与黄色果皮糜子的分离比例约为3∶1。

表3 糜子F2代籽粒果皮颜色分离表现
2.2 糜子果皮颜色转录组分析
2.2.1 测序数据质控
所有样本经转录组测序后,对原始数据进行质控,结果(表4)如下:测序共获得264 240 538条原始数据的reads,过滤后最终获得260 993 226条clean reads和39.13 G的clean bases。

表4 6个样品的转录组测序情况
Q20比例在97.38%~97.92%之间,Q30比例在93.4%~94.27%之间,将过滤后的样本与参考基因组的序列进行比对(表5),结果表明,6个样本比对率在94.98%~95.70%之间,比对率较高。数据整体测序质量合格,可以满足后续转录组分析。
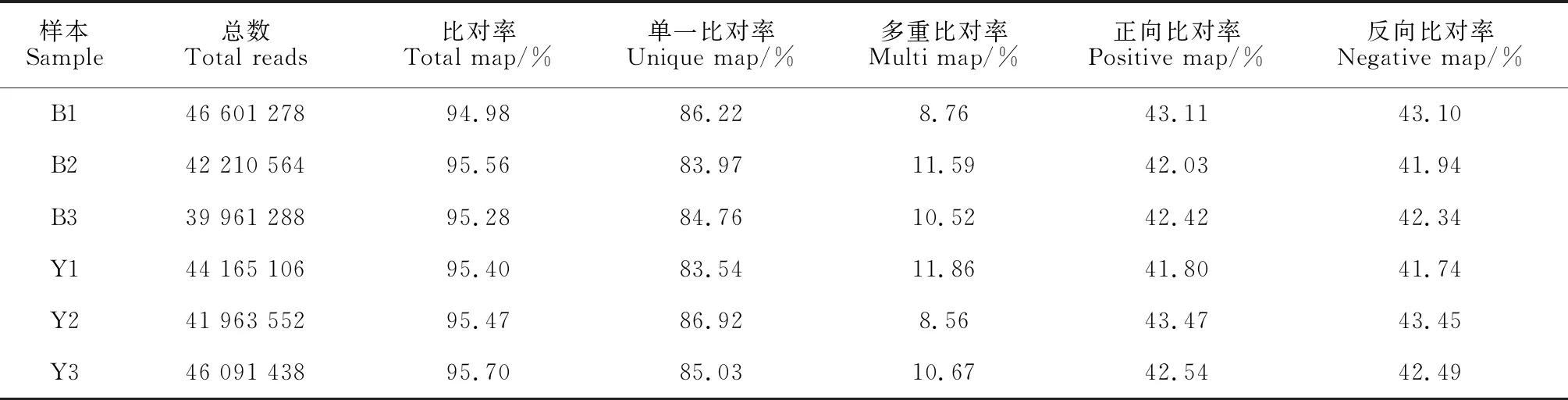
表5 样品与基因组比对统计
以P≤0.05且差异基因阈值。差异比较组合差异基因数目统计(图2)黄粒糜子与黑粒糜子相比,差异基因共有1 493个,其中,显著上调的差异基因数为495个,显著下调的差异基因数为998个。
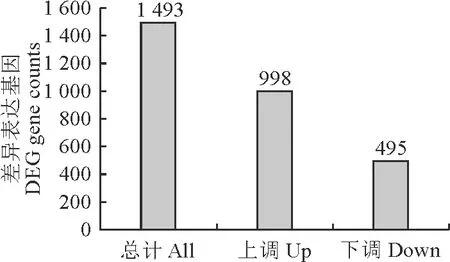
图2 比较组合差异基因数目统计
2.2.2 不同果皮颜色糜子GO功能注释和富集分析
以P<0.05为阈值,共筛选出166条显著性富集GO Term,其中差异最显著的为烟酰胺核苷酸生物合成过程、吡啶核苷酸生物合成过程和一元羧酸代谢过程;差异基因最多的功能为一元羧酸代谢过程、水化合物分解代谢过程和核苷二磷酸代谢过程(图3)。

图3 差异表达基因的GO富集分析
2.2.3 不同果皮颜色糜子KEGG功能富集分析
对差异基因进行KEGG富集分析,共富集到101条通路,选取显著的前20条KEGG通路绘制散点(图4),富集的通路主要为脂肪酸生物合成,糖酵解/糖异生,脂肪酸代谢,光合生物中的碳固定,生物素固定,光合作用—天线蛋白,二萜生物合成,亚油酸代谢,丙酮酸代谢,果糖和甘露糖代谢,氨基酸的生物合成,甘氨酸、丝氨酸和苏氨酸代谢,磷酸戊糖途径,乙醛酸盐和二羧酸盐代谢,AGE-RAGE 信号通路在糖尿病并发症中的作用,柠檬酸盐循环,脂肪酸降解,嘌呤代谢,吞噬体、精氨酸和脯氨酸代谢。其中差异最显著的代谢通路为脂肪酸降解,嘌呤代谢,吞噬体、精氨酸和脯氨酸代谢;富集到差异基因最多的途径为脂肪酸生物合成、糖酵解/糖异生、脂肪酸代谢、光合生物中的碳固定。

图4 差异表达基因的 KEGG 富集分析
2.2.4 不同果皮颜色糜子差异表达基因筛选与分析
根据KEGG分析可知,通路中与类黄酮生物合成相关的代谢途径包括苯丙氨酸、酪氨酸和色氨酸生物合成,苯丙烷类和类黄酮生物合成等途径中富集到的基因进行筛选,以P≤0.05且|log2(αFC)|≥1为阈值,共筛选到13个差异较大可能与糜子果皮颜色有关的差异显著基因(表6),其中C2845_PM02G08740等3个基因显著上调,C2845_PM06G12530等10个基因呈显著下调。
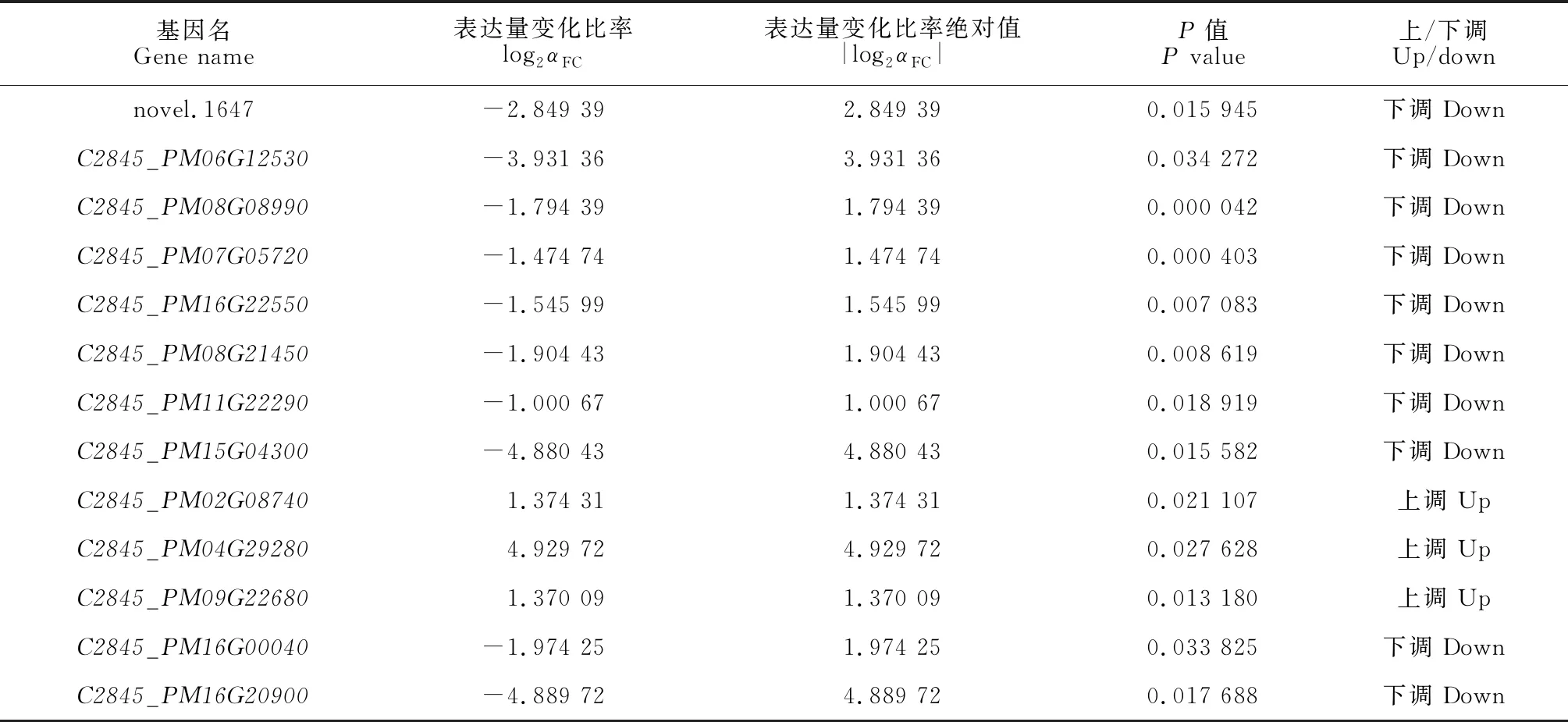
表6 差异表达基因
2.2.5 实时荧光定量PCR分析
为确认RNA-seq结果的可靠性,从筛选出的13个差异表达基因中随机选取10个进行qRT-PCR验证分析。qRT-PCR结果(表7)显示,这10个基因的表达趋势与测序结果一致,说明 转录组数据真实可靠。

表7 候选基因的qRT-PCR验证
3 讨 论
糜子的果皮颜色繁多,目前,生产上常用的糜子果皮颜色主要以黑色、黄色、红色、白色为主[22]。本研究以黄色果皮的糜子品种黄粒糜Ⅰ为母本,以黑色果皮的糜子品种2016106Ⅰ为父本进行杂交,对获得的杂交组合表型进行分析,F1果皮颜色均为黑色,F2代群体中黑色果皮∶黄色果皮约为3∶1,说明糜子黑色与黄色果皮受1对等位基因控制,黑色相对于黄色为显性性状。
果皮颜色不仅是重要的形态学标记,还与籽粒的营养品质有关。张慧等[23]研究发现,不同粒色小麦间的可溶性蛋白、氨基酸、微量元素、花青素、叶绿素和黄酮等含量差异显著,彩色小麦相比于普通小麦抗逆性更强、营养价值更高。杨希娟等[24]研究发现,不同粒色青稞的抗氧化活性和酚类化合物含量与籽粒颜色有关。Tang等[25]研究表明,黑色籽粒藜麦中维生素、叶黄酸以及不饱和脂肪酸等含量显著高于其他颜色。本研究以杂交组合黄粒糜Ⅰ×2016106Ⅰ的F3代中同一时期的黑色果皮和黄色果皮的糜子籽粒作为试验材料,进行转录组测序,通过GO和KEGG功能富集分析,共筛选到13个可能与糜子果皮颜色调控有关的的候选基因。
POD是植物体内参与花青素氧化的候选酶,与花青素代谢密切相关,富含花青素较多的组织中POD含量均较高,植物体内花青素主要为天竺葵素-3-葡糖苷及其衍生物,合成POD的底物阿魏酸、香豆酸和咖啡酸等有机酸在POD活性下降时降解速度也相应减慢,有利于形成酰化天竺葵苷,抑制POD可以增加酰化花青苷的积累量,从而调控花青素的合成[26]。本研究中C2845_PM06G12530、C2845_PM08G08990、C2845_PM07G05720、C2845_PM16G22550、C2845_PM08G21450、C2845_PM04G29280和C2845_PM09G22680等基因编码过氧化物酶(POD),其中差异表达基因仅有2个上调,其他差异表达基因均下调,说明在黄色果皮糜子中编码该酶的差异表达基因低于黑色果皮糜子,即过氧化物酶含量较高的品种,果皮中花青素含量也较高,粒色较深与王丽等[27]的研究结果基本一致。
C2845_PM11G22290基因编码肉桂酰CoA还原酶(CCR),在植物体内,苯丙烷代谢的中间产物对-香豆酸在4-香豆酸辅酶A连接酶(4CL)的催化下形成对-香豆酸CoA,经过羟基化可转化为木质素和类黄酮素等前体物质阿魏酰CoA和咖啡酰CoA,在CCR1等酶催化作用下形成木质素单体,木质素含量升高,类黄酮素前体物质减少,从而抑制类黄酮素合成。在本研究中基因C2845_PM11G22290呈显著下调,导致糜子果皮颜色的差异。C2845_PM15G04300基因编码肉桂醇脱氢酶(CAD),CAD作用于黄酮类化合物发生苯丙烷代谢途径之后,是木质素单体形成最后一步,通过氧化还原反应催化香豆醛、芥子醛、松柏醛等3种肉桂醛变成相对应的肉桂醇,即木质素单体,由于木质素形成与类黄酮素形成需要共同的前体物质,所以CAD活性降低,木质素合成减少,有利于类黄酮素的合成[28],本研究中该基因在黄色果皮中表达量高于黑色果皮糜子材料,可能间接导致糜子果皮颜色改变。C2845_PM02G08740基因编码4-香豆酸辅酶A连接酶(4CL),类黄酮生物合成的最初前体苯丙氨酸通过4CL催化生成类黄酮前体物质4-香豆酰CoA,本研究筛选出的编码4CL基因的表达上调有利于类黄酮物质生成,与李文建等[29]的研究一致。C2845_PM16G00040基因编码细胞色素P450(CYP450),CYP450是一大类位于膜上的血红素蛋白,广泛参与植物中许多天然代谢产物苯丙烷类、脂肪酸及生物碱的生物合成,在植物苯丙烷途径中起着重要作用,CYP450可通过催化苯丙烷生物合成途径,从而调控类黄酮类化合物的形成[30-31]。C2845_PM16G20900基因编码花青素合成酶(ANS),ANS是原花青素特异合成途径的关键酶,在NADPH协助下,可催化花青素如飞燕草素、花葵素和矢车菊素等还原为表没食子儿茶素EGC和表儿茶素EC,推测由于ANS含量的升高,可降低花青素含量[32]。
综上,本研究分析了糜子颜色的遗传规律,初步筛选出影响糜子果皮颜色的候选基因,为深入研究糜子果皮颜色奠定理论基础。
