激活CB2R抑制凋亡减轻肺缺血再灌注损伤的机制研究
2023-09-21李雪寒王儒蓉
马 琪,黄 伟,李雪寒,王儒蓉
肺缺血再灌注损伤(lung ischemia-reperfusion injury,LIRI)是指肺组织在缺血缺氧一段时间后,当肺部血流恢复时发生肺功能损害的病理现象。LIRI是临床上常见的并发症,可对病人预后产生不良影响,当前仍缺乏有效的治疗方法。LIRI是一个复杂的病理生理过程,涉及多种细胞及分子机制,仍有待进一步研究[1-2]。内源性大麻素系统存在于人体内多种器官组织中,如肺脏、心脏、肝脏和脑组织等,肺组织中的许多细胞类型都表达大麻素受体2(cannabinoids 2 receptor,CB2R)[3],内源性大麻素系统在LIRI过程中可能发挥着至关重要的作用。CB2R广泛分布于外周免疫组织和细胞,与免疫炎症反应密切相关[4-5],调节CB2R在治疗疼痛、关节炎和癌症等疾病中广泛应用[6]。研究[7]结果表明,通过给予内源性大麻素降解酶抑制剂URB602可以增加小鼠内源性大麻素2-花生四烯酸甘油水平,减轻LIRI。2-花生四烯酸甘油主要通过激活CB2R发挥其生理功能,在心、脑、肝和脊髓等肺外器官中的研究显示,激活CB2R能够减轻因缺血缺氧导致的器官损伤[8-11],因此,我们推断激活CB2R可能会减轻因缺血缺氧导致的肺组织损伤。本实验基于C57BL/6小鼠LIRI模型,在肺缺血再灌注前给予高选择性的CB2R激动剂JWH-133和拮抗剂AM-630,通过检测氧合指数、肺湿干比、肺损伤和凋亡相关蛋白等指标,明确激活CB2R是否会通过影响细胞凋亡对缺血再灌注后小鼠产生肺保护作用。
1 材料与方法
1.1 实验动物选择及分组 本实验动物均为健康雄性、体质量20~25 g、6~8周龄的C57BL/6野生型小鼠,全部由四川大学动物实验中心提供。所有小鼠随机分为4组,假手术组(Sham组)、缺血再灌注组(I/R组)、JWH133组和AM630+JWH133组,每组各12只。每组小鼠再随机分为2个亚组,分别用于血气分析和肺组织湿干比测定、肺组织病理学检查和凋亡相关蛋白(Bcl-2、Bax、caspase-9)的检测。
1.2 主要实验器材 小动物呼吸机(美国,Harvard),小动物操作台,电子天平(中国,沈阳龙腾),血气分析仪(美国,雅培),LEICA切片刀(德国,Leica),24G静脉留置针(德国,贝朗),一次性无菌注射器,无菌0.9%氯化钠溶液,黑色医用缝合线(慕丝),戊巴比妥钠(德国,MErck),JWH-133试剂(美国,Cayman Chemical),AM-630试剂(美国,Sigma),Bcl-2抗体(美国,Proteintech),Bax抗体(美国,Proteintech),caspase-9抗体(美国,Proteintech),BCA蛋白浓度测定试剂盒(中国,碧云天)。
1.3 模型制备及指标检测
1.3.1 麻醉方式 将C57BL/6小鼠称体质量,然后放入鼠笼,通过在小鼠腹腔内注射1%戊巴比妥钠60 mg/kg对其进行麻醉,麻醉效果每30 min评估一次,视情况单次追加戊巴比妥钠5~10 mg/kg维持麻醉深度。
1.3.2 气管插管及机械通气 麻醉结束后,将小鼠妥善固定在小动物操作台上,依次完成备皮、75%乙醇消毒气管颈部区域、铺无菌洞巾等步骤,用解剖刀沿正中切开小鼠颈部气管,以24G静脉留置针代替气管导管插入小鼠气管切口,置管深度为0.5~1.0 cm,然后连接HARVARDA小动物呼吸机进行机械通气,使用缝合线固定留置针以防脱落或移位。机械通气参数如下:吸入氧浓度21%(压缩空气),潮气量8 mL/kg,呼吸频率100次/分,吸呼比1∶2。
1.3.3 建立LIRI模型 根据本小组既往研究建立所需小鼠LIRI模型[12],气管插管操作完成后常规消毒手术区域,沿小鼠左侧胸骨旁3~4或4~5肋间切开,撑开器撑开并暴露左侧肺门,双肺通气10 min后,腹腔注射500 U/kg肝素钠进行抗凝,1%利多卡因注射液0.05~0.1 mL滴于肺门表面实施表面麻醉,5 min后调整呼吸机参数,潮气量减为6 mL/kg、呼吸频率增加为120次/分,吸呼比维持不变。使用微血管钳夹闭小鼠左侧肺门(包括左主支气管和左肺动静脉)。右肺进行单肺通气(通气参数同上)1 h后,松开血管钳,使左肺恢复通气和血流,然后把呼吸机参数重新调整至缺血前,对双肺行肺复张后恢复双肺通气,左肺再灌注2 h。实验进行过程中使用纱布覆盖切口部位以防液体蒸发丢失,使用保暖毯对小鼠实施保温,使小鼠直肠温度维持于36~37 ℃。实验结束时,在小鼠腹腔内注射超量(100 mg/kg)戊巴比妥钠致死并采取标本。
1.3.4 标本的检测 血气分析:因C57BL/6小鼠体型较小,抽取外周血液操作困难,容易干扰检测结果。在实验结束后,我们采用开胸获取小鼠左心室动脉血行血气分析的方式计算氧合指数(PaO2/FiO2)。肺湿干比测定:在实验结束时,取小鼠左肺放在滤纸上,擦干肺组织表面血迹,然后使用分析天平重复称重3次,计算平均值记为总湿重,所得测量数值精确到小数点后1位。然后再把肺组织标本放置在烤箱(60 ℃)中烘干,48 h后每24 h称量一次,直至标本重量恒定不变,记为总干重。肺组织湿干比=总湿重/总干重。肺组织病理学检测:使用4 ℃预冷PBS溶液对小鼠肺组织进行灌洗,然后切取小鼠左肺中段相同位置约0.5 cm3大小肺组织放入甲醛溶液固定液中,固定24~48 h,然后依次完成脱水透明、浸蜡包埋、切片与贴片、脱蜡、苏木精-伊红(HE)染色及脱水程序后,将切片自然晾干并封片保存。本实验采用美国胸科学会肺损伤病理学评分评估肺组织损伤程度,在显微镜下选取每张切片的4个400倍视野进行评分,其中肺泡上皮细胞至少占据每个视野的50%,主要由大气管或血管腔构成的区域应当排除,然后计算平均值为所得分数。Bax、Bcl-2和caspase-9蛋白检测:首先取C57BL/6小鼠肺组织样本,加入RIPA裂解液后进行离心,取上清液提取肺组织总蛋白。然后采用BCA法测定样本蛋白浓度,在样本蛋白变性后依次进行电泳、转膜、封闭、孵化抗体、显色、曝光等程序,最后通过凝胶图像分析成像系统进行扫描分析,分析结果以目标蛋白相对表达量表示。计算目标蛋白积分吸光度值与β-actin积分吸光度值的比值作为目标蛋白相对表达量。
1.4 统计学方法 采用单因素方差分析和q检验。
2 结果
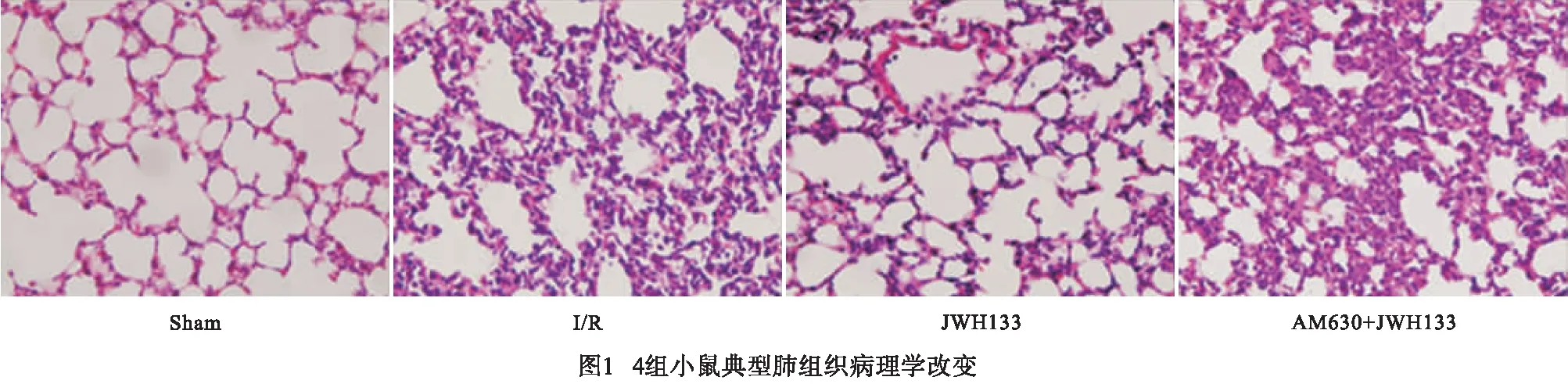
与Sham组比较,I/R组小鼠氧合指数显著降低,肺湿干比、肺损伤病理学评分、Bax和caspase-9蛋白表达水平均显著增加(P<0.01),而Bcl-2蛋白差异无统计学意义(P>0.05),肺组织结构紊乱,镜下可见透明膜和蛋白碎片形成,肺间隔显著增厚,肺泡和肺间质中呈现出明显的炎性渗出,同时伴有出血、肺水肿和肺不张;与I/R组比较,JWH-133组小鼠氧合指数明显改善,肺湿干比显著下降,肺损伤病理学评分明显降低,Bax和caspase-9表达水平显著降低,Bcl-2蛋白表达水平显著增加(P<0.01),肺组织形态结构较前改善,光镜下可见肺泡和肺间质中中性粒细胞少量渗出;AM630+JWH133组与JWH133组比较,小鼠氧合指数显著降低,肺湿干比显著增加(P<0.01),而与I/R组小鼠比较差异均无统计学意义(P>0.05);给予AM-630预处理后,JWH-133引起的上述病理学改变被逆转,小鼠肺损伤病理学评分增高,Bax和caspase-9表达水平显著增加,Bcl-2蛋白表达水平显著降低(P<0.05~P<0.01)(见表1、图1)。4组小鼠的凋亡相关免疫印迹见图2。

表1 4组小鼠的各指标检测结果
3 讨论
当前较常用的LIRI模型有以下3类[13]:(1)离体模型,即切除单侧肺后,将其离体灌注保存,肺组织完全缺血,无气体交换,此模型在心肺移植研究领域应用较多;(2)手术过程中阻断肺动脉,但保留主支气管、肺静脉和支气管动脉,较多应用于肺动脉栓塞研究;(3)手术过程中将肺动脉、肺静脉和主支气管全部阻断,使单侧肺处于完全缺血缺氧的状态,从而达到完全阻断单侧肺门的目的,该方式在外科手术中较多见。本实验采用第3种方式来模拟术中阻断肺门所致LIRI的病理生理过程,通过检测多项肺功能学和形态学指标,我们观察到缺血再灌注后I/R组小鼠肺氧合指数显著降低,肺湿干比显著增高,光镜下可见肺组织结构紊乱,肺间质和肺泡中出现明显的炎性渗出,伴有出血、肺水肿、肺不张、透明膜及蛋白碎片形成等病理改变,肺损伤病理学评分显著增高,说明我们的肺I/R模型构建成功。
JWH-133和AM-630为研究CB2R较理想的试剂,二者分别为高选择性的CB2R激动剂和拮抗剂[14-16]。CHENG等[17]对大鼠的研究发现,激活CB2R可减轻H2O2诱导的氧化应激损伤,抑制体内的炎症反应;同时,DEFER等[18]研究发现,在缺血再灌注前给予JWH-133可显著减轻缺血再灌注引起的心肌损害;CAKIR等[19]证实了使用JWH-133预处理可不同程度地降低缺血再灌注导致的肾功能损害;WANG等[20]研究结果显示,在给予选择性CB2R激动剂HU308 前,使用AM-630预处理逆转了前者对小鼠心肌的保护作用。本研究采取缺血1 h、再灌注2 h的方案来构建C57BL/6小鼠LIRI模型,采用缺血前5 min腹腔内注射JWH-133(5 mg/kg)、使用JWH-133前30 min腹腔内注射AM-630(2 mg/kg)的方案验证激活CB2R是否具有肺保护作用。
本研究中,缺血再灌注后小鼠肺氧合指数显著降低,肺湿干比显著增高,肺损伤病理学评分显著增高。氧合指数反映肺换气功能,肺湿干比可通过测定肺组织中的含水量反映肺水肿的程度。因此,缺血再灌注严重损害了小鼠的肺换气功能,导致小鼠肺水肿的发生,同时引起凋亡相关蛋白caspase-9、Bax表达水平显著增加。然而,在使用JWH-133激活CB2R后,小鼠的LIRI得到明显改善。当我们在给予JWH-133前使用AM-630预处理,从而阻断CB2R和JWH-133的作用时,研究结果显示上述作用被逆转,说明AM-630可消除JWH-133的肺保护效应,进一步证明JWH-133是通过激活CB2R而发挥了肺保护作用。
凋亡是细胞的一种死亡方式,可在缺血导致的低氧应激和再灌注损伤期活性氧生成时被激活[21]。缺血时间较短或轻微的再灌注损伤可以通过激活细胞生存机制,减少细胞活性氧的产生,从而减轻细胞损伤,但缺血再灌注损伤较严重时可能会导致细胞凋亡、坏死[22]。肺组织内皮细胞是缺血再灌注损伤的主要靶点,可导致严重的肺功能损害,肺移植过程中不可避免地会发生LIRI[23-24]。有研究[25]表明,在人体肺移植过程中,再灌注2 h内肺组织中即可出现大量凋亡细胞。再灌注前使用胱天蛋白酶抑制凋亡可明显减轻肺移植术后的缺血再灌注损伤[26-27]。Bcl-2、Bax均为凋亡调节蛋白,是凋亡转导通路中的主要靶分子,Bcl-2通过减少细胞色素C和凋亡诱导因子等的释放,降低线粒体的通透性和减少内质网上Ca2+的跨膜流动发挥抑制细胞凋亡的作用,而Bax可促进细胞凋亡。caspase-9被称为凋亡启动子,处于信号转导的上游,启动子被激活后进而激活下游的凋亡执行蛋白caspase-3,后者介导最终的细胞死亡[28]。
HERRERA等[29]证实了CB2R通过神经酰胺依赖的线粒体内在途径激活凋亡信号。同时,LI等[30]研究发现,在大鼠心肌缺血再灌注模型中使用JWH-133激活CB2R后,caspase-9和caspase-3表达减少,细胞色素C向胞浆释放减少,减轻了心肌缺血再灌注损伤。还有学者[31]研究结果表明,小鼠体内CB2R缺乏可降低巨噬细胞对氧化低密度脂蛋白/羟甾醇诱导凋亡的易感性。本实验结果显示,与Sham组比较,I/R组促凋亡蛋白caspase-9和Bax的表达水平明显增加,凋亡抑制蛋白Bcl-2的表达水平差异无统计学意义,说明缺血再灌注诱导了细胞凋亡的发生。腹腔内注射JWH-133预处理后,caspase-9和Bax表达显著减少,Bcl-2表达显著增加,提示JWH-133发挥了抗凋亡作用。给予JWH-133前使用AM-630预处理时,上述抗凋亡作用消除,表明JWH-133通过激活CB2R干扰Bcl-2、Bax和caspase-9蛋白的表达,抑制细胞凋亡。因此,细胞凋亡可能参与了CB2R激活所介导的肺保护作用。
本研究采用术中完全阻断单侧肺门的方法成功构建了C57BL/6小鼠LIRI模型,在小鼠腹腔内注射高选择性CB2R激动剂JWH-133后可以抑制肺组织细胞凋亡,LIRI明显减轻。然而,注射JWH-133前给予AM-630预处理可逆转上述抗凋亡作用,因此,我们推断激活CB2R可能通过抑制凋亡机制减轻小鼠LIRI。
