个体化营养干预对维持性血液透析患者肌少症及生存质量的影响
2023-09-21程红娟王建平陈其明吴晓蓉
程红娟, 周 威, 查 白, 王建平, 陈其明, 吴晓蓉
(江苏省南京市高淳人民医院 肾内科, 江苏 南京, 211300)
终末期肾病(ESRD)是全球范围内日益严重的公共健康问题之一,血液透析是其主要替代治疗方式[1]。随着血液净化技术的提升,维持性血液透析(MHD)患者的寿命已明显延长,然而MHD所致慢性并发症仍会显著降低患者的生存质量[2]。肌少症是尿毒症患者的常见合并症,主要表现为骨骼肌质量、力量和功能的进行性下降[3]。目前,尿毒症肌少症尚无统一诊断标准,不同检测方法、目标人群和诊断标准下的研究结果差异较大[4]。随着透析时间的延长、尿毒症毒素的累积及相关并发症的发生, MHD患者骨骼肌肌量减少及功能下降会加速,容易引发肌少症,并导致身体功能障碍、生活质量下降和死亡风险增加[5]。相关研究[6]证实,与无肌少症的MHD患者相比,患有肌少症的MHD患者表现出更高的死亡风险和住院率。本研究调查MHD患者肌少症发生现状,并观察个体化营养干预对患者肌少症及生存质量的影响,旨在为临床防治肌少症和提高MHD患者生存质量提供参考依据。
1 对象与方法
1.1 研究对象
选取2022年1—12月在南京市高淳人民医院血透中心行规律血液透析治疗的102例患者作为研究对象。纳入标准: ① 年龄18~80岁者; ②血液透析治疗时间≥6个月(3次/周, 4 h/次),抗凝剂为低分子肝素,血管通路为动静脉内瘘或长期导管者; ③ 具有一定理解能力并能较好地配合治疗者; ④ 对本研究知情并签署知情同意书者。排除标准: ① 近1个月发生急性感染、腹泻、心血管意外或手术等事件者; ② 伴自身免疫病或使用激素治疗者; ③ 伴消化性溃疡、严重肝病或恶性肿瘤等疾病者; ④ 不能配合营养干预者。本研究经南京市高淳人民医院伦理委员会审核批准后实施。
1.2 研究方法
1.2.1 一般资料收集: 记录患者的年龄、性别、原发病、透析龄等资料,嘱患者透析结束后10~20 min测量净身高、体质量,计算体质量指数(BMI), BMI=体质量(kg)/身高(m)2。
1.2.2 实验室检查: 抽取患者透析当日上机前静脉血,送检验科检测血清白蛋白(Alb)、血红蛋白(Hb)、血尿素氮(BUN)、血肌酐(Scr)、血钙、血磷、甲状旁腺激素(iPTH)、超敏C反应蛋白(hs-CRP)等指标水平,并计算尿素清除指数(Kt/V)。
1.2.3 骨骼肌质量测量: 以骨骼肌质量指数(SMI)表示骨骼肌质量,于患者透析结束后使用人体成分分析仪进行分析,采用生物电阻抗法测量骨骼肌肌肉质量[7]。
SMI=骨骼肌肌肉质量(kg)/身高(m)2。
1.2.4 肌肉力量评估: 通过手握力评估肌肉力量,握力测量使用香山家用电子握力器(型号EH101)。嘱患者取坐姿,手肘弯曲90 °, 用非造瘘手使劲握住握力器,重复测量3次,每次测量间隔60 s以上,取最大值。
1.2.5 肌肉功能评估: 通过日常步速评估肌肉功能,可使用辅助工具协助完成。患者以日常步速在6 m直线上行走,每人走2次,以用时较少的一次计算步速。
1.2.6 肌少症诊断: 采用亚洲肌少症工作组(AWGS)的肌少症诊断标准,满足下列第l项和后2项中的1项即诊断为肌少症[8]。① 生物电阻抗分析显示SMI<7.0 kg/m2(男性)或<5.7 kg/m2(女性); ② 手握力<26 kg (男性)或<18 kg (女性); ③ 日常步速<0.8 m/s。
1.2.7 生存质量评估: 采用SF-36量表评估患者的生存质量。SF-36量表涵盖生理健康、心理健康2个领域共8个维度,生理健康领域包括生理机能、生理职能、躯体疼痛和一般健康状况这4种维度,心理健康领域包括精神健康、情感职能、社会功能和精力这4种维度。计算各维度得分和总分,最高100分,评分越高表示生存质量越好[9]。
1.2.8 营养干预: 在常规基础医学治疗的基础上,对患者进行个体化营养干预。首先评估患者的营养状况,再结合患者的饮食习惯、劳动强度、血生化指标结果等制订个体化食谱,食谱中包含食物的种类、数量、交换份额等[10]。干预期间每半个月随访1次,落实患者执行情况。遵循原则: ① 蛋白质摄入量以1.2~1.5 g/(kg·d)为宜,建议50%以上为优质蛋白(鱼肉、瘦肉、虾、鸡蛋等),若患者不能接受高蛋白饮食,可予等量蛋白粉替代; ② 摄入热量一般为30 kcal/(kg·d), 老年人和体力劳动明显减少者则以25 kcal/(kg·d)为宜,热量主要来源为主食和脂肪; ③ 电解质摄入量根据有无水肿及高血压调整,盐摄入量以3~5 g/d 为宜,限制含钾、含磷食物摄入; ④ 水分摄入量以透析间期体质量增加<5%为宜; ⑤ 膳食纤维摄入量以20 g/d为宜。
1.3 统计学分析
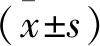
2 结 果
2.1 临床资料比较
本研究共纳入102例MHD患者,肌少症发生率为27.45%(28/102)。根据有无肌少症,将患者分为肌少症组28例和无肌少症组74例。2组患者年龄、性别、BMI、Alb、hs-CRP、BUN、Scr比较,差异有统计学意义(P<0.05); 2组患者透析龄、原发病、Hb、血钙、血磷、iPTH、Kt/V比较,差异无统计学意义(P>0.05), 见表1。

表1 2组患者临床资料比较
2.2 生存质量比较
治疗前,肌少症组患者的生理机能、躯体疼痛、一般健康状况维度评分和生理健康领域总分、SF-36量表总分均低于无肌少症组,差异有统计学意义(P<0.05), 见表2。

表2 2组患者治疗前生存质量评分比较 分
2.3 肌少症相关指标比较
治疗过程中患者因住院或依从性差等脱失11例(肌少症组6例、无肌少症组5例),最终共91例患者按要求完成3个月营养干预治疗,其中肌少症组22例,无肌少症组69例。治疗后, 2组患者骨骼肌质量指数、握力均大于治疗前,且肌少症组骨骼肌质量指数、握力的治疗前后差值大于非肌少症组,差异有统计学意义(P<0.05); 2组患者治疗前后日常步速差异无统计学意义(P>0.05), 见表3。

表3 2组患者治疗前后肌少症相关指标比较
2.4 治疗前后生存质量比较
接受个体化营养干预治疗后, MHD患者的生理职能、一般健康状况、精力维度评分和生理健康领域总分、SF-36量表总分均高于治疗前,差异有统计学意义(P<0.05), 见表4。

表4 91例MHD患者治疗前后生存质量评分比较 分
3 讨 论
“肌肉减少症”概念最初由ROSENBERG I H[11]提出,是一种随年龄增长出现的以骨骼肌质量减少、肌力下降、功能减退为特征的退行性病变。慢性肾脏病(CKD)患者的肌少症发病率高于普通人群,且随着CKD的进展而增高,尤其值得注意的是,肌少症可极大增加ESRD患者的死亡风险和医疗费用[12-13]。目前,人们对于MHD患者肌少症的认识尚不全面,早期识别并干预对改善患者生存质量和延长生存期具有重要意义。
本研究中, MHD患者肌少症发病率为27.45%(28/102), 且女性发病率(18.87%)低于男性(36.73%), 与既往研究[14]结论相似。本研究发现, 2组患者在年龄、性别、BMI、Alb、hs-CRP、BUN、Scr方面比较,差异有统计学意义(P<0.05)。BMI、蛋白质、透析前尿素、透析前肌酐水平均能反映MHD患者的营养状况,其中蛋白质合成与降解平衡是维持骨骼肌质量的主要因素[15], 肌肉蛋白丢失将直接导致肌肉质量下降及营养缺失,更容易引发肌少症。MHD患者肌少症发病的性别差异考虑与性激素有关,女性MHD患者常存在雌二醇下降及月经稀少,雌激素可通过核受体及G蛋白偶联雌激素受体提高肌力,但并无证据显示其可对骨骼肌量产生影响。相对而言,男性MHD患者普遍伴有睾酮减少,睾酮参与肌肉蛋白质的合成,其缺乏可促进男性骨骼肌质量下降。此外,男性患者可能比女性患者更易发生炎症性肠功能障碍,引起食欲减退,从而导致肌少症发病率增加[16]。动物实验[17]亦显示,肾切除的雄性大鼠会出现贫血和营养不良,但配对的雌性大鼠没有明显变化。微炎症状态在MHD患者中较为常见,既往研究[18]显示高水平肿瘤坏死因子、C反应蛋白可使肌肉蛋白质降解增加和合成减少,从而显著增加肌肉量和肌肉强度丢失的风险。
本研究显示,治疗前,肌少症组患者的生理机能、躯体疼痛、一般健康状况维度评分和生理健康领域总分、SF-36量表总分均显著低于无肌少症组,提示肌少症严重影响MHD患者的生活质量,尤其是身体健康和生理功能方面。分析原因,肌少症可造成患者乏力、易疲劳、肌肉力量下降,甚至出现身体平衡障碍、容易跌倒、骨折、身体残疾等[19-20]。
流行病学研究[21]表明,相当多的因素可能导致MHD患者肌少症发病率增加,包括蛋白质摄入不足、能量缺乏、衰老、运动不足、慢性炎症、激素失衡、尿毒症毒素积聚等。蛋白质摄入和能量水平在CKD患者的饮食治疗中起着关键作用。近期研究[22]发现,对于尿毒症肌少症的治疗,患者更倾向于采取饮食干预措施。目前, MHD患者肌少症的饮食疗法尚未完善,严格遵守任何共性的营养指导均不恰当,临床医师应结合患者个体的疾病活动性、营养风险和依从性等因素综合考虑干预方案。
本研究中,个体化营养干预治疗3个月后, 2组患者SMI、握力均改善,且肌少症组治疗前后差值大于非肌少症组,差异有统计学意义(P<0.05), 表明营养支持不仅能增加MHD患者的肌肉质量,还能改善患者的肌力,且肌少症组改善更明显,与JU S H等[23]研究结论类似。2组患者治疗前后日常步速差异无统计学意义(P>0.05), 考虑与MHD患者普遍存在活动能力和活动意愿下降有关,联合运动干预或可改善患者的肌肉功能。本研究还发现,治疗后, MHD患者的生理职能、一般健康状况、精力维度评分和生理健康领域总分、SF-36量表总分均高于治疗前,差异有统计学意义(P<0.05), 表明营养干预可显著提升MHD患者的生存质量。
综上所述, MHD患者的肌少症发病率较高,与年龄、性别、营养状态、微炎症有关,严重影响患者的生存质量。个体化营养干预治疗可减轻MHD患者的肌少症症状,并提高患者的生存质量,建议在临床推广应用。本研究尚存在不足之处,例如入组患者有限,干预时间较短,未同时设立非干预对照组,未来应开展大样本量研究进行长期营养介入和随访进一步验证。
