微小RNA-203b-3p调控多发性骨髓瘤细胞增殖、迁移和侵袭的分子机制研究
2023-09-21薛静,郭博,胡玲,付杏
薛 静, 郭 博, 胡 玲, 付 杏
(海南省妇女儿童医学中心, 1. 检验科, 2. 血液肿瘤科, 海南 海口, 570000)
多发性骨髓瘤(MM)是一种克隆性B细胞恶性肿瘤,其特征是分化的单克隆浆细胞在骨髓中堆积[1-2]。MM被认为是世界上最难治愈的浆细胞恶性肿瘤之一,占所有血液学癌症的13%以上[3]。由于耐药性的产生,近年来MM的复发率呈逐渐升高趋势[4]。微小RNA(miRNA)是一种高度保守的小型非编码RNA分子,在基因的调控中起着关键作用。此外, miRNA可以通过转录或转录后调控相应的靶基因而影响癌细胞的增殖和转移[5-7]。研究[8-10]表明, miRNA的异常表达与MM的发生和进展有关,这可能促使对人类MM机制发生新的认识。ZHAO Y等[11]研究表明,微小RNA-144-3p(miR-144-3p)通过靶向细胞间质上皮转换因子(c-Met)抑制细胞增殖并诱导MM的凋亡。微小RNA-203(miR-203)在MM中通过靶向Bmi-1可以抑制细胞生长并调节G1/S转换[12]。研究[13]显示, miR-203b-3p在紫杉醇耐药的肿瘤进程调控中同样发挥作用。尽管如此, miR-203b-3p在MM细胞中的作用和功能仍然未知。
肿瘤坏死因子超家族成员13b(TNFSF13B)是一种B细胞激活因子(BAFF),主要由骨髓系细胞产生[14]。BAFF在B细胞的生存、增殖和分化中起着至关重要的作用,可以导致部分恶性肿瘤的发生和发展[15-16]。最近的研究[17]表明, BAFF/受体蛋白或TNFSF13BmRNA在系统性红斑狼疮和淋巴瘤中表现出异常的表达。本研究观察MM细胞中miR-203b-3p与TNFSF13B的关系,探讨miR-203b-3p影响MM细胞增殖、迁移和侵袭的分子机制,现将结果报告如下。
1 材料与方法
1.1 组织标本和细胞系
选取2020年2月—2022年7月在海南省妇女儿童医学中心接受手术的30例MM患者的骨髓瘤组织和癌旁组织,其中男14例,女16例; 年龄35~67岁,中位年龄47岁。所有组织样本放在-80 ℃的液氮中冷冻,以备日后实验使用。本研究得到了本院伦理学委员会的批准,并获得了所有受试者的书面知情同意书。MM细胞系(U266、RPMI-8226、LP-1和H929)和正常人骨髓基质细胞系(HS-27A)购自BeNa生物(中国北京)。
1.2 基因芯片分析
本研究从30对组织中随机抽取了3对骨髓瘤组织和癌旁组织,然后进行RNA提取,并对RNA进行了鉴定分析。利用Affymetrix HUGene 2.0ST基因芯片(Affymetrix, Santa Clara, CA, USA)筛选出表达异常的mRNA。差异倍数>4或<-4和P<0.05被设定为筛选标准。基因芯片数据通过DNAstar软件(Lasergene, Madison, WI)进行分析。
1.3 细胞培养、转染和分组
细胞在RPMI 1640培养基(Sigma-Aldrich,美国)中加10% FBS和0.1%青霉素-链霉素培养,然后在37 ℃的培养箱中保存。miR-203b-3p模拟物和TNFSF13B过表达载体(TNFSF13 cDNA)由苏州基因制药有限公司(中国苏州)合成,其中miR-203b-3p模拟物的序列为5′-ATCGCATCGACTACCATCACT-3′。使用Lipofectamine 2000试剂(Life Technologies, 美国)将LP-1细胞系分别转染miR-203b-3p模拟物和TNFSF13B过表达的质粒。转染后24 h检测转染效率。实验分以下5组进行: 空白组(非转染), NC组(转染pcDNA3.1空白质粒), miR-203b-3p组(转染miR-203b-3p模拟物), TNFSF13B组(转染pcDNA3.1-TNFSF13B过表达质粒),以及miR-203b-3p+TNFSF13B组(共同转染miR-203b-3p模拟物和TNFSF13B过表达质粒)。
1.4 实时荧光定量聚合酶链式反应(qRT-PCR)检测miR-203b-3p的表达水平
按照说明书使用TRIzol试剂(Beyotime,中国)和PureLink RNA Mini Kit(Invitrogen)提取总RNA。使用TIANScript Ⅱ RT试剂盒(TIANGEN)进行RNA的反转录。PCR在MiniOpticon实时PCR系统(Bio-Rad)上进行,并使用SYBR-Green RealMastcrMix(Bio-Rad)进行扩增检测。U6是miR-203b-3p的内参基因。miR-203b-3p或U6的相对表达量采用2-△△Ct方法测量。PCR引物是由Sangon Biotech(中国上海)制作的。miR-203b-3p的引物设计为加Poly A法: 正向5′-GTGCAGGGTCCGAGGT-3′, 反向5′-GCCGCGTGAAATGTTTAGG-3′;U6的引物是正向5′-CTCGCTTCGGCAGCACA-3′, 反向5′-ACGCTTCACGAATTTGCGT-3′。
1.5 蛋白质印迹分析(Western blot)检测TNFSF13B的表达水平
本研究收获处于对数期的细胞。使用RIPA缓冲液(Sigma-Aldrich)进行总蛋白的提取,直到细胞生长达到80%汇合。采用BCA蛋白测定试剂盒(Pierce, Rock ford, IL)鉴定蛋白浓度。蛋白质通过10%的SDS-PAGE(Bio-Rad)分离,然后按照指南放入聚偏氟乙烯(PVDF)膜(Invitrogen)中。5%的脱脂牛奶涂抹在膜的密封处1 h, 然后在4 ℃下加入一级抗体抗TNFSF13B(ab8396, 1∶1 000, Abcam, 英国)和抗GAPDH(ab22555, 1∶1 000, Abcam, 英国)并孵育过夜,然后采用TBST冲洗膜3次,每次10 min。随后将二抗HRP标记的山羊抗兔IgG H&L抗体(1∶2 000)加入到膜上,再孵育1 h, 之后采用TBST冲洗膜2次。通过增强型化学发光(ECL)检测系统(Thermo Scientific)观察免疫活性蛋白,并在显微镜下拍照(Bio-Rad)。β-actin作为内参蛋白用于检测。
1.6 双荧光素酶报告试验检测miR-203-3p与TNFSF13B的靶向关系
质粒pmirGLO和pGEM-T载体均购自Promega公司。PmirGlo-TNFSF13B 3′非翻译区-野生型(3′UTR-wt)和PmirGlo-TNFSF13B 3′UTR-突变(3′UTR-mut)是由XL定点突变试剂盒(Qiagen)构建。将LP-1细胞放入带有48孔的平板中。细胞在达到80%汇合度之前不进行转染。使用Invitrogen公司的Lipofectamine 2000试剂将miRNA(miR-203b-3p mimic或对照组)和载体(野生型或突变型)共同转染到细胞中,然后在室温下进行培养。转染后24 h使用荧光素酶报告测定试剂盒(Promega)评估荧光素酶活性。
1.7 集落形成试验和划痕试验
将细胞接种到60 mm的培养皿中,在37 ℃的潮湿环境下培养2周; 除去完整的培养基,采用磷酸盐缓冲液(PBS)清洗细胞2次; 采用0.1%的水晶紫染色20 min, 然后除去水晶紫溶液,采用甲醇固定集落,并对集落进行计数。上述实验至少进行了3次。
收集细胞并置于48孔板中(每孔1×106细胞)。当细胞生长到75%汇合时,用无菌的200 mL微量吸头来刮取单层细胞,随后采用PBS洗2次脱落的细胞,然后培养24 h。在显微镜下观察0、24 h的细胞划痕愈合区。
1.8 Transwell侵袭试验
为了检查LP-1细胞的侵袭能力,将细胞置于转孔板中,与无血清培养基(100 μL)混合后,在上腔加入Matrigel(BD Biosciences, 美国),然后在37 ℃下保存过夜; 采用胰蛋白酶裂解细胞,采用无血清培养基稀释,将细胞(1×105)转移到上腔。下室含有600 μL DMEM(Sigma-Aldrich)和10% FBS(Invitrogen)。培养24 h后,采用棉签刮除非入侵细胞,采用甲醇和0.1%的水晶紫固定和染色迁移或入侵的细胞。采用光学显微镜(日本尼康)检测侵入的细胞。
1.9 统计学分析
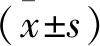
2 结 果
2.1 miR-203b-3p在MM组织和细胞中的表达情况
为了检查骨髓瘤组织和癌旁组织的表达情况,本研究通过基因芯片分析筛选出肿瘤组织和癌旁组织中异常表达的miRNA(图1A)。选择MM组织和细胞中低表达的miR-203b-3p mRNA作为研究靶基因,通过qRT-PCR检测组织样本中miR-203b-3p的表达。与癌旁组织相比, miR-203b-3p在肿瘤组织中的表达水平降低,差异有统计学意义(P<0.05)(图1B); 同时, miR-203b-3p在MM细胞系(U266、RPMI-8266、LP-1和H929)中的表达与正常骨髓基质细胞系(HS-27A)相比降低,差异有统计学意义(P<0.05)(图1C)。选择miR-203b-3p表达水平最低的LP-1细胞系进行后期实验。
2.2 TNFSF13B是MM细胞中miR-203b-3p的靶基因
TargetScan数据库预测,在TNFSF13B的3′UTR-wt区有1个miR-203b-3p的直接结合点(图2A)。与miR-203b-3p模拟物和TNFSF13B 3′UTR-wt共转染组相比,细胞的荧光素酶活性降低,差异有统计学意义(P<0.05), 而miR-203b-3p模拟物和TNFSF13B 3′UTR-mut共转染组与对照组的差异无统计学意义(P>0.05)(图2B)。本研究证实miR-203b-3p直接针对TNFSF13B。Western blot检测结果表明,与正常细胞相比,肿瘤组织和MM细胞中TNFSF13B蛋白水平的表达升高,差异有统计学意义(P<0.05)(图2C、2D)。

A: TargetScan预测在TNFSF13B的3′UTR中存在miR-203b-3p的直接结合位点; B: 与对照组相比, miR-203b-3p模拟物和TNFSF13B 3′UTR-wt的共转染显著降低了荧光素酶活性,而miR-203f-3p模拟品和TNFSF1 3B 3′UTR-mut的共转染组与对照组无显著差异; C: Wesfern blot检测显示肿瘤组织中TNFSF13B蛋白的表达显著高于正常邻近组织; D: Wesfern blot检测显示TNFSF13B蛋白在MM细胞系(U266、RPMI-8226、LP-1和H929)中的表达显著高于正常人骨髓基质细胞系(HS-27A)。与对照组比较, *P<0.05; 与正常组织比较, #P<0.05; 与HS-27A比较, △P<0.05。
2.3 miR-203b-3p对MM细胞的增殖和转移的影响
miR-203b-3p和miR-203b-3p+TNFSF13B均能促进miR-203b-3p的表达,差异有统计学意义(P<0.05), 而TNFSF13B对miR-203b-3p的表达无影响,差异无统计学意义(P>0.05)(图3A)。miR-203b-3p能够抑制TNFSF13B的表达,而TNFSF13B组表现为促进了TNFSF13B的表达(P<0.05)(图3B)。此外,集落形成实验结果表明, miR-203b-3p抑制了MM细胞的增殖,而TNFSF13B促进了MM细胞的增殖,差异有统计学意义(P<0.05)(图3C)。划痕试验结果显示, MM细胞的迁移受到miR-203b-3p的抑制,而TNFSF13B则促进其迁移,差异有统计学意义(P<0.05)(图4A); 侵袭试验结果表明, miR-203b-3p抑制了MM细胞的侵袭,而TNFSF13B增强了MM细胞的侵袭,差异有统计学意义(P<0.05)(图4 B)。
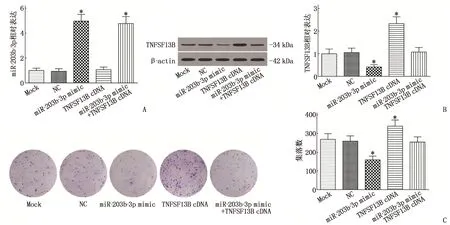
A、B: miR-203b-3p组和miR-203b3p+TNFSF13B组的miR-203b-3p的表达水平高于对照组, qRT-PCR和Wesfern blot检测显示,与对照组比较, miR-203b-3p组的TNFSF13B表达较低, TNFSF13B组的TNFSF13B表达较高, miR-203b-3p+TNFSF113B组的miR-203b-3p和TNFSF13B组的miR203b-3p表达与对照组无显著差异; C: 集落形成试验采用结晶紫染色,放大倍数40倍,miR-203b-3p组MM细胞的集落数量低于对照组,而TNFSF13B组MM细胞集落数量高于对照组, miR-203-b-3p+TNFSFF13B组的集落数与对照组无显著差异。与空白组(Mock)或对照组比较, *P<0.05。

A: 伤口愈合试验表明(比例尺为100 μm), miR-203b-3p组的迁移率低于对照组,而TNFSF13B组的迁移速率高于对照组,miR-203b-3p+TNFSF13B组与对照组、NC组无显著差异; B: Transwell分析表明(结晶紫染色,放大倍数40倍,比例尺为50 μm), miR-203b-3p组的侵袭细胞数低于对照组,而TNFSF13B组的侵袭细胞数高于对照组,miR-203b-3p+TNFSF113B组与对照组、NC组无显著差异。与对照组比较, *P<0.05。
3 讨 论
本研究结果显示, miR-203b-3p的表达在MM组织及细胞中显著下调,并验证了miR-203b-3p在MM细胞中能够靶向调控TNFSF13B的表达,同时还证明了miR-203b-3p通过抑制TNFSF13B对MM细胞的生物学功能产生了抑制作用。
miRNA已经被证实可以调节各种生物过程。研究[18-19]显示, miRNA在肿瘤中失调,包括MM。miR-21能够调控MM细胞的增殖能力。YANG Y J等[20]验证了miR-137/197调节MM细胞的活力、克隆形成和迁移。miR-203b-3p在包括肝细胞癌和结肠癌等多种肿瘤中的作用也相继被证实[21]。ZHANG C Y等[22]研究结果显示, miR-203在三阴性乳腺癌(TNBC)中被下调,从而抑制了TNBC细胞的增殖和迁移。与既往研究结果类似,本研究结果显示, miR-203b-3p在MM细胞中下调,并抑制MM细胞的增殖和转移。这是通过特异性结合TNFSF13B而实现的。miR-203b-3p已被发现通过靶向各种基因来抑制各种肿瘤的侵袭性。AN N等[23]发现, miR-203b-3p靶向CASK导致胃癌细胞的增殖和侵袭性降低。WU S Q等[12]发现,通过靶向Bmi-1恢复miR-203b-3p能明显抑制MM细胞的生长和G1/S转换。YANG P S等[24]发现, miR-203b-3p通过靶向CREB1 mRNA抑制了MM的细胞增殖。复杂的miRNA网络参与了癌症的发展。miR-203b-3p被认为通过靶向各种基因影响MM以及其他癌症的发展。本研究验证了MM细胞中miR-203b-3p和TNFSF13B之间的新型分子调控网络。
TNFSF13B属于TNF超家族,该家族已被证明是细胞活动的重要调节器。TNF家族的2个成员APRIL和BAFF, 已被发现在许多癌症中高表达,包括MM[25]。BRUNETTI G等[26]证明, TNFSF14在MM中促进破骨细胞生成而抑制成骨细胞生成。ZHU X J等[27]研究表明, TNFSF13B在免疫性血小板减少症患者中表达升高。在MM晚期患者血清中发现TNFSF13B升高与骨髓瘤细胞的生长有关[28]。然而, TNFSF13B在MM细胞中的作用尚不明确。本研究证实了TNFSF13B对MM细胞活性的调节机制。本研究结果显示, TNFSF13B在MM组织和细胞中明显上调。此外,本研究通过克隆形成实验、划痕实验和侵袭实验证实了TNFSF13B促进了MM细胞的增殖和转移。
综上所述, miR-203b-3p可能通过靶向调控TNFSF13的表达来抑制MM细胞的增殖、迁移及侵袭。这些发现不仅为深入研究miR-203b-3p在MM细胞中的作用机制提供了科学依据,而且为MM的临床治疗提供了一种新的潜在治疗策略。
