多功能解磷真菌的筛选与解磷活性评价
2023-09-20杨腊英郭立佳周游汪军梁昌聪徐云龙黄俊生
杨腊英 郭立佳 周游 汪军 梁昌聪 徐云龙 黄俊生

关键词:解磷真菌;产紫篮状菌;磷酸三钙;植酸钙;拮抗作用
磷是作物生长发育所必需的三大营养元素之一,在植物的细胞分裂、能量转移、信号传导、核酸合成以及光合作用等过程中发挥着重要作用,也是农业生产中最重要的养分限制因子。磷以磷肥的形式添加到土壤中,据统计,在我国,磷肥在土壤中的当季利用率一般只有10%~25%[1],植物未利用的部分均转化成不溶的固定形式。在酸性土壤中,土壤中难溶性无机磷多被固定为磷酸铁、磷酸铝类化合物,在中性及石灰性土壤中则多被固定为磷酸三钙类化合物。因此,如何开发和利用被土壤固定的磷素,提高土壤中磷的有效利用率,减少化学磷肥的施用是我国可持续农业中必需解决的问题之一。调节土壤酸碱度、施用有机肥、土壤淹水处理、合理施用磷肥和利用解磷微生物活化土壤难溶性磷均为提高土壤磷素有效性的途径[2],其中,利用解磷微生物来提高土壤磷素有效性不仅符合当下“化肥使用量零增长”的需求,而且可以减少因磷肥的过量施用所造成的农业环境污染。
微生物对磷矿粉等难溶性磷肥的增溶作用及其在农业中的应用正成为国内外研究人员广泛关注的研究热点。很多土壤微生物包括细菌、真菌和放线菌均可参与土壤难溶性磷的溶解、转化和迁移过程,通过酸化、螯合和交换反应,将土壤中被固定的不溶性磷酸盐变成可溶形式[3-5],以利于植物的吸收,进而增加作物产量[6-7]。目前对解磷细菌的溶磷特性和机制已开展了大量研究,但解磷真菌的相关研究仍然较少,已报道的主要为曲霉属(Aspergillus)、青霉属(Penicillium)[6-18]、木霉属(Trichoderma)[19-20]、篮状菌属(Talaromyces)[19,21]、枝孢属(Cladosporium)[22]、拟青霉属(Paecilomyces)[23-24]等,其他类群较少报道。解磷真菌与细菌相比,其产生有机酸的能力更强,部分种属的溶磷效率明显高于细菌[8],且在传代培养过程中溶磷活性的稳定性也显著优于细菌[10]。因此,寻找更多有溶磷功能的真菌类群,可为增强土壤或肥料中磷的可利用性提供更多的菌种资源。
笔者团队通过近10a的研究,已研发出一系列用于防控香蕉枯萎病、根结线虫等土传病害的生物菌肥产品,为扩宽生物菌肥菌株的功效,将拮抗生防菌与提高肥效利用率的菌株相结合研发不同系列的微生物菌肥,既可提高作物抵御病虫害入侵的能力,又能提高磷的利用率,进而改善农产品品质。本研究采用无机磷筛选培养基,从农田黑土中筛选出高效解磷菌株,定性分析该菌株的解磷能力与芽孢杆菌的相互作用,为后续利用该菌株进行新菌肥的研发与田间应用奠定基础。
1材料与方法
1.1材料
1.1.1供试土壤土壤样品采自西藏藏族自治区墨脱县背崩乡(29°1436N,95°109E),土壤类型为黑土,采样点为玉米根周土壤。
1.1.2供试菌株解磷对照菌株LGJPJ、拮抗芽孢杆菌菌株X5、香蕉枯萎病病原菌菌株B2均由中国热带农业科学院环境与植物保护研究所微生物资源研究与利用研究组分离鉴定并保存。
1.1.3供试培养基
(1)简化版无机磷固体培养基:葡萄糖10.0g,硫酸铵2.0g,磷酸三钙5.0g,琼脂20.0g,水1000mL,pH7.00~7.50。
(2)简化版蒙金娜固体培养基:葡萄糖10.0g,硫酸铵2.0g,植酸钙2.0g,琼脂20.0g,水1000mL,pH7.00~7.50。
(3)简化版无机磷(有机磷)液体培养基:葡萄糖10.0g,硫酸铵2.0g,磷酸三钙5.0g(植酸鈣2.0g),胰蛋白胨0.5g,去离子水1000mL,pH7.00~7.50。
(4)保存用PDA培养基:马铃薯200g,葡萄糖20g,琼脂18g,蒸馏水1000mL,自然pH。
(5)LB培养基(g/L):胰蛋白胨10.0g,氯化钠10.0g,酵母提取物5.0g。
所有培养基均在121℃条件下高压灭菌20min。
1.1.4供试溶液(1)钼酸盐溶液:13.00g钼酸铵[(NH4)6Mo7O24·4H2O]溶于100mL蒸馏水,0.35g酒石酸锑钾(KSbC4H4O7·H2O)溶于100mL蒸馏水。在不断搅拌的情况下把钼酸铵溶液徐徐加入到300mL50%硫酸溶液中,然后加入酒石酸锑钾溶液混匀,于棕色瓶4℃保存。
(2)10%抗坏血酸溶液:10g抗坏血酸溶于100mL的蒸馏水中,于棕色瓶4℃保存。
(3)150mmol/L对硝基苯磷酸二钠(pNPP)溶液:称取2.784gpNPP溶于50mL蒸馏水中。
1.2方法
1.2.1孢子接种液制备挑取菌株的菌丝,放于PDA平板中,28℃恒温培养至长出孢子,用无菌水冲洗孢子并经无菌3层擦镜纸过滤后,即制备成真菌的孢子悬液,经镜检孢子数约为7×106个/mL。
1.2.2有效磷含量测定吸取各处理的培养液2mL于10000r/min离心10min,参考陈玮[25]的钼锑抗比色法,测定上清液中的有效磷含量(使用光程10mm的比色皿,波长采用700nm),以不接菌作为空白对照。以波长700nm处吸光度值(OD700)为纵坐标(y),溶磷量(x)为横坐标绘制磷标准曲线,得到钼锑抗磷标准曲线线性回归方程为:y=0.5031x+0.0112,相关系数R2=0.9976,通过磷标准曲线回归方程计算溶液中的有效磷含量,以确定菌株的解磷能力。溶磷率计算公式为:溶磷率=(接菌有效磷含量?对照有效磷含量)/加入无机磷源的量×100%。
1.2.3解磷菌的筛选(1)解磷菌的初筛。称取10g土壤样品置于90mL无菌水中,28℃摇床震荡30min制成土壤悬液,土壤悬液梯度稀释至10–1、10–2后分别用玻璃棒涂布于无机磷固体培养基上,吹干后用封口膜封口并倒置于生化培养箱中28℃培养。通过观察平板上所长真菌菌落周围是否产生透明圈来初步筛选解磷菌,挑取具有较明显透明圈的真菌菌落转接至PDA平板上进行纯化培养,并作为解磷真菌复筛的初筛菌株。
(2)解磷菌的复筛。150mL三角瓶中装入无机磷液体培养基50mL,接入制备的孢子悬液200μL,于28℃180r/min震荡培养5d。解磷对照菌株LGJPJ、芽孢杆菌X5从LB平板接种单菌落于LB液体培养基中,摇培16h后,分别接种200μL菌液至无机磷液体培养基中,于37℃、180r/min摇床上培养5d,吸取各摇培液2mL离心后取上清液,根据有效磷含量测定方法,对比各菌株培养液中有效磷浓度的大小,筛选出高效解磷菌。
(3)解磷菌对有机磷的矿化能力。挑取解磷菌株菌饼置于简化版蒙金娜固体培养基上,通过观察平板上所长真菌菌落周围是否产生透明圈,分别测定解磷菌菌落直径(d)和溶磷圈直径(D),计算可溶性指数(D/d),分析菌株对有机磷的矿化能力。同时向培养基平板上滴加2mL150mmol/LpNPP,覆盖溶磷圈,4h后观察显色结果,如有黄色产生则说明解磷菌分泌磷酸酶。
1.2.4解磷菌的鉴定(1)真菌DNA的提取。将经单孢纯化菌株在PDA培养基中活化,再按照SDS法[26]提取真菌DNA,于–20℃保存。
(2)ITS基因序列扩增。用真菌通用引物ITS1(5-TCCGTAGGTGAACCTGCGC-3)、ITS4(5-TCCTCCGCTTATTGATATGC-3)进行PCR扩增。PCR扩增反应体系:模板1μL,10mmol/L引物各1μL,TakaraMix12.5μL,用ddH2O补至25μL。PCR反应条件:94℃预变性2min,然后94℃变性30s、55℃退火50s、72℃延伸1min,共35个循环,最后72℃再延伸7min。PCR扩增产物置于4℃保存。
(3)β-tubulin基因序列扩增。用真菌通用引物Bt2a(5-GGTAACCAAATCGGTGCTGCTTTC-3)、Bt2b(5-ACCCTCAGTGTAGTGACCCTTGGC-3)进行PCR扩增。PCR扩增反应体系:模板1μL,10mmol/L引物各1μL,TakaraMix12.5μL,用ddH2O补至25μL。PCR反应条件:94℃预变性2min,然后94℃变性30s、58℃退火50s、72℃延伸1min,共35个循环,最后72℃再延伸7min。PCR扩增产物置于4℃保存。
用1%琼脂糖凝胶电泳对产物进行检测,PCR产物经纯化后送生工生物工程(上海)股份有限公司测序,获得的序列经GenBank中的Blast程序与数据库中的所有序列进行比较分析,利用DNAStar软件构建系统发育树。
1.2.5解磷真菌的解磷能力分析(1)解磷菌株对不同浓度磷酸三钙的解磷能力。50mL不含磷酸三钙的无机磷液体培养基置于150mL三角瓶中,分别加入0.125、0.250、0.400、0.500、0.600、0.750、1.000g磷酸三钙,制成终浓度分别为2.5、5.0、8.0、10.0、12.0、15.0、20.0g/L的无机磷液体培养基,分别加入200μL制备的孢子悬液,180r/min、28℃摇床培养11d后,室温静置培养,分别在第1、3、5、7、9、11、13、17、25天吸取培养液2mL,测定有效磷含量及培养液pH,每处理3次重复。菌株解磷能力为接菌培养液有效磷浓度减去不接菌培养液有效磷浓度,取3次重复的平均值(mg/L)。
(2)解磷菌株不同孢子浓度悬液的解磷能力。50mL无机磷液体培养基置于150mL三角瓶中,将制备的孢子悬液分别按照0.2、2、20、200μL,2mL接入无机磷液体培养基中,使孢子终浓度分别为28、280、2.8×103、2.8×104、2.8×105个/mL。28℃摇床180r/min培养11d后,室温静置培养,分别在第1、3、5、7、9、11、13、17、25天吸取培养液2mL,测定有效磷含量,每处理3次重复。
(3)解磷菌株对不同浓度植酸钙的矿化能力。在含50mL(植酸钙终浓度分别为2.0、5.0g/L)的简化版蒙金娜液体培养基的150mL三角瓶中,分别加入孢子悬液200μL,孢子终浓度均为2.8×104个/mL,180r/min28℃摇床培养11d后,室温静置培养,分别在第1、3、5、7、9、11、13、15、17、25、35天吸取培养液2mL,测定有效磷含量,每处理3次重复。
1.2.6解磷真菌与芽孢杆菌、香蕉枯萎病菌之间的相互拮抗作用采用平板对峙法测定解磷真菌XZY3PSF与芽孢杆菌X5、香蕉枯萎病菌B2之间的相互拮抗作用。香蕉枯萎病菌B2用PDA平板按照孢子悬浮液制备法获得病原真菌的孢子悬液,参考汪军等[27]的拮抗活性检测方法,按照等边三角形状分别接种直径为0.5cm的香蕉枯萎病菌B2、解磷真菌XZY3PSF菌饼及芽孢杆菌X5菌液10μL,28℃培养3~4d,观察相互之间的拮抗情况。
1.3数据处理
采用Excel2010和SPSS19.0软件对数据进行分析处理,数值进行对数转换后采用LSD法进行多重比较,采用Pearsons法进行相关性分析,利用Excel2010软件制作图表。
2结果与分析
2.1解磷菌的筛选
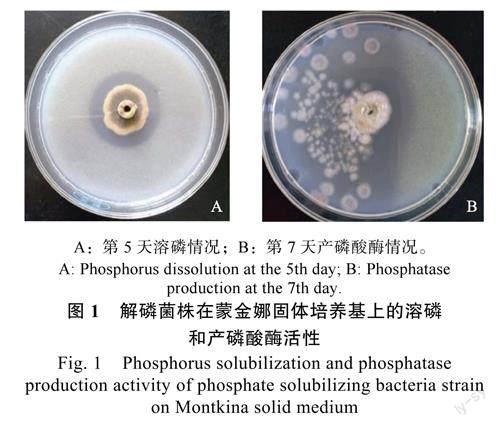
在无机磷固体培养基平板上,解磷菌株周围能形成一圈透明圈(图1A),根据透明圈直径大小可以初步判断解磷菌株解磷能力的强弱。通过对初筛的解磷菌株进行解磷能力测定,结果表明,5d后该菌株的解磷能力达到502.1mg/L,分别高于对照菌株LGJPJ(68.9mg/L)、拮抗芽孢杆菌菌株X5(53.3mg/L)7.3倍、9.4倍。解磷菌株培養第5天在蒙金娜固体培养基平板上的可溶性指数达1.6,滴加pNPP后观察到有黄色产生(图1B),说明解磷菌株可分泌磷酸酶。将该菌株命名为XZY3PSF,并进一步对其进行分子鉴定和解磷特性研究。
2.2菌株XZY3PSF的鉴定
菌株XZY3PSF在PDA培养基上的初生菌丝为白色透明,3d后开始产生绿色孢子,聚集在中央,周围菌丝为白色,平板背面显示为橘红色,培养至15d后菌丝几乎长满整个平板,孢子灰绿色(图2A),平板背面深红色(图2B)。产孢结构3分支且轮生(图2C),孢子椭圆形,3.16~3.69μm,孢子呈长链状(图2D)。
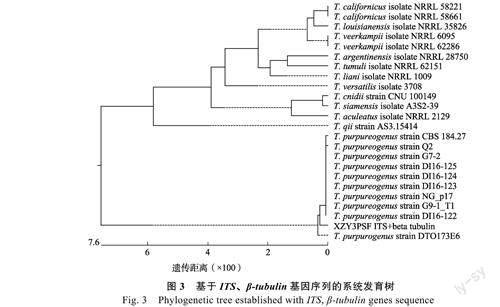
选择均有ITS与β-tubulin基因序列的同一菌株,并将其序列进行拼接,采用邻位法构建系统发育树,发现菌株XZY3PSF的ITS与β-tubulin基因拼接序列与归属于T.purpureogenus的CBS184.27等9株菌株在同一分支,且相似度达到99.8%(图3)。根据形态观察和ITS与β-tubulin基因序列对比结果,鉴定XZY3PSF为篮状菌属(Talaromyces)产紫篮状菌(T.purpureogenus)。
2.3菌株XZY3PSF对磷酸三钙、植酸钙的解磷能力
2.3.1菌株XZY3PSF对不同浓度磷酸三钙的解磷能力从图4可知,随着磷酸三钙浓度的升高,培养液中的最高有效磷含量无显著变化,5g/L磷酸三钙的培养液中的有效磷含量相对较高,而2.5g/L磷酸三钙的溶磷率最高,溶磷率随磷酸三钙浓度的增加而降低。随着培养时间的延长,从第9天开始,有效磷含量开始下降,在第13天后有效磷含量随磷酸三钙浓度的增大而增大,且在第25天时,浓度为15、20g/L磷酸三钙的有效磷含量极显著高于其他浓度(表1)。
2.3.2菌株XZY3PSF不同孢子浓度对磷酸三钙的解磷能力从图5可知,随着解磷菌株孢子浓度的增加,有效磷含量最高值出现的时间逐渐缩短,分别出现在第11、9、9、7、7天;随着培养时间的延长,孢子浓度为28个/mL的有效磷含量下降趋势较缓,而其余浓度在第25天与最高峰值呈极显著差异,尤以浓度为2.8×104个/mL的有效磷含量下降趋势最为陡峭,在第17天有效磷含量仅为93.9mg/L,在第25天有效磷含量仅为10.3mg/L,与第7天分别相差5.6倍、50.8倍。
2.3.3菌株XZY3PSF对不同浓度植酸钙的解磷能力从图6可知,在测试时间段内,2种植酸钙浓度的有效磷含量均随培养时间的延长而增加,其中浓度为5.0g/L的有效磷含量在第25天达到最高峰;同时随着植酸钙浓度的升高,有效磷含量亦增加,在不同时间均呈极显著差异。
2.4菌株XZY3PSF与芽孢杆菌X5、香蕉枯萎病菌B2之间的相互作用
采用对峙培养法综合评价解磷菌株XZY3PSF与已用于研发生物菌肥产品的芽孢杆菌X5对香蕉枯萎病菌B2的生长抑制情况,及解磷菌株XZY3PSF与芽孢杆菌X5之间的相互作用,研究发现解磷菌XZY3PSF可抑制香蕉枯萎病菌B2的生长,同时与芽孢杆菌X5之间存在一定的相互拮抗作用(图7)。
3讨论
本研究中筛选的解磷菌株XZY3PSF与对照菌株LGJPJ、芽孢杆菌X5相比,其溶磷效率在7倍以上,这与WHITELAW等[8]的研究结果相似,且解磷菌株XZY3PSF经传10代后,其仍具有较好的溶磷活性。经鉴定,菌株XZY3PSF鉴定为产紫篮状菌(T.purpureogenus),篮状菌属(Talaromyces)是一种正被开发利用的生防菌类群,已报道从开裂的人参种皮中分离得到黄色篮状菌(T.flavus),该菌能产生几丁质酶,从而抑制核盘菌、黄萎病菌、立枯病菌的细胞壁形成,还能抑制稻瘟病菌、链格孢菌、尖镰孢菌的孢子萌发和菌丝伸长[28]。田叶韩等[29]发现产紫篮状菌Q2菌株对多种土传病害有明显的防治作用,赵洋等[30]发现Q2菌株可通过产生细胞壁降解酶破坏尖镰孢菌菌丝形态,起到抑制病原菌生长的作用。据笔者所查文献,目前尚无产紫篮状菌在解磷方面的研究报道。通过“三三”拮抗实验发现菌株XZY3PSF亦对香蕉枯萎病菌具有较好的抑菌作用,该菌株既有高效解磷效果又具较好拮抗作用,为后续生物菌肥的研发提供优良微生物菌种。
通过研究0~25d解磷菌株XZY3PSF对磷酸三钙的解磷情况,发现随着培养时间的延长,不同孢子浓度或同一孢子浓度不同磷酸三钙浓度的有效磷含量均下降,尤其到13d静置培养后下降速度更快,这可能是由于菌株生长消耗所致。NARSIAN等[9]研究发现,较高浓度的磷对溶磷活性无影响,但是由于菌株的持续生长,使菌株生长过程中会以利用培养基中有效磷的形式导致有效磷浓度下降。李豆豆等[18]等发现草酸青霉菌PSF1在1~6d对磷酸三钙的解磷量呈上升趋势,在第6天解磷量达到最高后略有下降,可能是由于此时培养液中菌体较多对磷的消耗较大导致。这一发现与NARSIAN等[9]、李豆豆等[18]的报道一致,且本研究结果基于更长时限,结论更客观、可靠。
本研究发现解磷菌株XZY3PSF对有机磷类的植酸钙具有持续的矿化作用,随着培养时间的延长,0~25d有效磷含量呈逐渐上升趋势,在第35天时略有下降或趋于平缓,且该菌株对有机磷类磷源的矿化或分解效率强于已报道的巨大芽孢杆菌等细菌。杨晓燕等[31]研究发现巨大芽孢杆菌能够有效降解有机磷和无机磷,对卵磷脂中的磷分解后有效磷含量达到最高值为1.67mg/L,本研究中菌株XZY3PSF对植酸钙矿化后有效磷含量高达368.6mg/L,对大豆卵磷脂中的磷降解率最高达94.5mg/L(数据另行分析处理)。
利用解磷菌来制备土壤改良剂、生物肥料等,不仅能提高土壤有效磷的利用率、增加农作物的产量,还能有效减少磷素的流失[32]。目前,部分从土壤中分离的解磷菌已投入实际应用,且效果显著。如洋葱伯克霍尔德菌(Burkholderiacepacia)作为生物肥料可以显著提高番茄、马铃薯、洋葱等作物的产量[33];巴西青霉菌(Penicilliumbilaii)对小麦等谷物类作物的促生作用明显,能有效减少化学磷肥的施用[7];以固氮菌株和溶磷真菌產紫篮状菌混合发酵所制复合型菌肥对辣椒苗的促生效果最佳[34]。分离的解磷菌株XZY3PSF对有机磷和无机磷的降解具有高活性,且对香蕉枯萎病菌具有较好的拮抗活性,研究结果为研发具拮抗功能又可提高土壤中磷利用率的复合生物菌肥奠定基础。
