具核梭杆菌感染对食管癌KYSE150细胞紫杉醇化疗抵抗的影响
2023-09-19张哲源刘怡文杨海军代宁涛李军扩郭艺博孔金玉周福有
张哲源,刘怡文,付 臻,杨海军,代宁涛,李军扩,孙 蔚,郭艺博,孔金玉,周福有
1)安阳市肿瘤医院;河南科技大学附属安阳市肿瘤医院;河南省食管癌精准防治医学重点实验室 河南安阳 455000 2)河南科技大学临床医学院;河南科技大学第一附属医院;河南省微生态与食管癌防治重点实验室;河南省肿瘤表观遗传重点实验室 河南洛阳 471003 3)安阳市肿瘤医院影像科 河南安阳 455000 4)安阳市肿瘤医院病理科 河南安阳 455000 5)安阳市肿瘤医院胸外科 河南安阳 455000
食管癌发病率与死亡率极高,早期临床症状不明显,确诊时多发展至中晚期[1]。中晚期食管癌患者最主要的治疗方式之一为化疗,其中紫杉醇(pachitaxel,PTX)为最常用的化疗药物,但易产生耐药[2]。因此,探明PTX的耐药机制,对于改进食管癌治疗方案、改善食管癌患者预后至关重要。本团队前期研究[3-4]已证实具核梭杆菌(Fusobacteriumnucleatum,Fn)的长期定植,不仅可重塑肿瘤微环境,削弱机体抗肿瘤免疫反应,还可促进肿瘤细胞葡萄糖代谢,为其恶性增殖提供能量。虽然Fn在食管癌中的致病机制有待进一步探讨,但本团队已证实Fn感染可导致食管癌患者预后不良[1,5]。研究[6]表明,固有免疫系统在机体抵抗病原微生物入侵时发挥重要作用,而炎症复合体为机体固有免疫系统的重要组成部分;其中,核苷酸结合寡聚化结构域样受体蛋白3(NOD-like receptor protein 3,NLRP3)是炎症复合体中最具特征性的多聚体蛋白复合体[7]。多种病原微生物均可通过活化NLRP3,诱导促炎因子成熟并分泌到胞外,调控免疫应答,引发炎症反应,为自身长期定植提供有利条件[8],且NLRP3的活化可使肿瘤干细胞(cancer stem cells,CSCs)干性增强[9]。有研究[10]显示,CSCs为肿瘤耐药、复发和转移的根源,对各种治疗均具有抗性;且乙醛脱氢酶1(acetaldehyde dehydrogenase 1,ALDH1)已被证实可作为食管癌优选的干细胞标记物。本研究首先建立NLRP3敲降的食管癌细胞系,用Fn分别感染亲本与敲降细胞系,探讨Fn对食管癌细胞中NLRP3的调控机制;然后通过PTX干预裸鼠皮下荷瘤实验,研究Fn感染导致PTX化疗抵抗的系统机制,为食管癌的临床治疗提供新思路。
1 材料与方法
1.1 细胞、主要试剂与仪器人食管癌KYSE150细胞系(上海博谷生物科技有限公司),293T细胞系(中国医学科学院),Fn标准菌株(ATCC 25586,美国路易斯维尔大学捐赠);脑心浸液培养基(法国梅里埃公司)、体积分数5%无菌脱纤维绵羊血、体积分数1%氯化血红素和 1 g/L维生素K1(中国索莱宝科技有限公司),胎牛血清(美国Gibco公司),RPMI 1640与DMEM 培养基(美国HyClone公司),NLRP3敲降质粒及慢病毒包装试剂盒(美国GeneCopeia公司),ALDEFLUORTM试剂盒(加拿大Stemcell technologies公司),SPF级BALB/C雄性裸鼠[中国常州卡文斯实验动物有限公司,动物许可证号:SCXK(苏)2016-0010],荧光素酶检测试剂盒(德国Berthold Technologies公司),CCK-8试剂盒(日本同仁化学研究所),PTX(美国Selleck Chemicals公司),NLRP3与ALDH1兔抗人单克隆抗体(美国Abcam公司),GAPDH兔抗人单克隆抗体、山羊抗兔IgG、BCA蛋白定量试剂盒及ECL发光显影液(中国康为世纪生物科技有限公司)。凝胶成像系统(美国BIO-RAD公司),厌氧工作站(美国COY公司),流式细胞仪(美国贝克曼公司),酶标仪及PE小动物活体光学成像系统(美国珀金埃尔默公司)。
1.2 NLRP3敲降食管癌细胞系的构建于37 ℃、体积分数5%CO2的培养箱常规培养293T 细胞,待密度为70%时,开始转染。采用慢病毒包装试剂盒,将NLRP3敲降质粒(NLRP3-DNA)配制为NLRP3-DNA-EndoFectin混合物,具体步骤参照说明书进行。将混合物加入293T细胞中,48 h后收取病毒上清,0.45 μm滤器过滤,去除细胞碎片。待KYSE150细胞密度至70%时,加入病毒上清进行转染,嘌呤霉素筛选2周。提取细胞蛋白质,通过Western blot检测NLRP3敲降效率。将NLRP3敲降后的细胞命名为KYSE150-N。
1.3 食管癌细胞的Fn感染于厌氧工作站(37 ℃,体积分数85% N2、10% H2和5% CO2)中常规培养Fn,培养基为含体积分数5%无菌脱纤维绵羊血、体积分数1%氯化血红素和1 g/L维生素K1的脑心浸液培养基。Fn具体培养方法及纯度鉴定方法参照本课题组前期研究[5]。待KYSE150及KYSE150-N细胞密度为70%时,将对数生长期Fn菌液加入细胞培养基(感染复数MOI=10),感染不同时间(12、24、48和72 h)。将Fn感染72 h后的两种细胞命名为KYSE150+Fn及KYSE150-N+Fn。
1.4 各组细胞和瘤体组织中NLRP3及ALDH1蛋白表达的检测提取Fn未感染组和Fn感染组(12、24、48与72 h)KYSE150细胞蛋白以及KYSE150、KYSE150-N、KYSE150+Fn和KYSE150-N+Fn组细胞及裸鼠瘤体组织蛋白。用BCA蛋白定量试剂盒检测蛋白浓度。样本(30 μg总蛋白/泳道)于100 g/L SDS-聚丙烯酰胺凝胶电泳分离,并转移至PVDF膜。含50 g/L脱脂牛奶液的TBST室温封闭1 h,NLRP3、ALDH1(按1∶1 000 TBST稀释)和GAPDH(按1∶2 000 TBST稀释)抗体4 ℃孵育过夜,山羊抗兔IgG(按1∶2 000 TBST稀释)孵育2 h,用ECL发光显影液于凝胶成像系统中检测目的蛋白条带,Image Lab软件测定蛋白条带灰度值,以目的蛋白与内参蛋白灰度值比值为最终蛋白相对表达量[11]。实验重复3次。
1.5 各组细胞PTXIC50的CCK-8检测采用CCK-8试剂盒检测:①Fn未感染组及Fn感染组(12、24、48和72 h)KYSE150细胞的PTX 24 h药物IC50。②KYSE150组、KYSE150-N组、KYSE150+Fn组及KYSE150-N+Fn组细胞的PTX 24 h药物IC50。每组细胞均于96孔板中配制100 μL细胞悬液(每孔1 000个细胞),至培养箱预培养24 h(37 ℃、体积分数5%CO2)。每组均设置1个对照孔及不同质量浓度的实验孔(0.5、1.0、1.5、2.0、2.5……30.0 mg/L),按质量浓度分别加入PTX,培养24 h。每孔加入CCK-8试剂10 μL,1 h后更换为新鲜培养基。酶标仪测定OD450 nm,计算IC50[12]。实验重复3次。
1.6 各组细胞体外增殖能力的平板克隆检测将KYSE150、KYSE150-N、KYSE150+Fn和KYSE150-N+Fn组细胞分别接种于6孔板,每孔1 000个细胞,常规培养1周。当出现肉眼可见的克隆时终止培养,弃去培养基。经PBS冲洗、体积分数4%甲醛固定、结晶紫染色后,拍照并计数克隆数[13]。实验重复3次。
1.7 各组细胞克隆成球能力的成球实验检测将KYSE150、KYSE150-N、KYSE150+Fn和KYSE150-N+Fn组细胞配制成单细胞悬液,每组取1×105个细胞,于低吸附皿中悬浮培养1周,当出现肉眼可见的克隆球时终止培养,对直径 40 μm的克隆球进行拍照,计数[14]。实验重复3次。
1.8 各组细胞中的CSCs百分比检测将KYSE150、KYSE150-N、KYSE150+Fn和KYSE150-N+Fn组细胞用ALDEFLUORTM检测缓冲液调整至1×106个/mL。每组抽取1 mL细胞悬液放入检测管(DEAB-),并于对照管(DEAB+)加入5 μL二乙氨基苯甲醛(diethylaminobenzaldehyde,DEAB)。于检测管的细胞悬液中加入5 μL ALDEFLUORTM试剂混匀,并抽取0.5 mL混合物加入对照管。37 ℃孵育30 min后离心弃上清,留取细胞沉淀。用0.5 mL ALDEFLUORTM检测缓冲液重悬细胞沉淀,并于流式细胞仪上检测。以检测管与对照管中CSCs百分比的差值为最终CSCs百分比[14]。实验重复3次。
1.9 各组细胞成瘤能力的裸鼠皮下荷瘤实验选择24只4~6周龄健康SPF级雄性BALB/C裸鼠(约20 g)为实验对象。于温度为 (25±2) ℃且湿度为 40%~60%的SPF级鼠笼饲养。自然昼夜照明。裸鼠自由进食、饮水(饲料、饮水均为SPF级)。适应性饲养 1周后,随机分为4组,每组6只。用荧光素酶标记KYSE150、KYSE150-N、KYSE150+Fn和KYSE150-N+Fn细胞,然后按分组于每只裸鼠右侧腋下接种标记后的细胞(5×106个)。接种2周后,待各组裸鼠肿瘤长至直径约5~10 mm,按10 mg/kg的剂量尾静脉注射PTX,3 d 1次,共给药6次[12]。末次给药3 d后,由PE小动物活体成像仪拍摄并检测肿瘤大小,然后采用深麻醉下颈椎脱臼法处死小鼠,并将瘤体剥离称重。称重后将瘤体研磨,一部分提取新鲜组织蛋白,检测各组裸鼠瘤体内NLRP3及ALDH1蛋白的表达情况;另一部分配制成单细胞悬液,检测各组裸鼠瘤体内CSCs百分比,方法同前。
1.10 统计学处理采用SPSS 26.0进行数据处理。应用两独立样本t检验比较KYSE150组细胞与KYSE150-N组细胞中NLRP3蛋白表达量的差异。应用单因素方差分析和LSD-t检验比较①Fn未感染组及Fn感染组(12、24、48与72 h)KYSE150细胞的PTX药物IC50及NLRP3蛋白表达量的差异;②KYSE150组、KYSE150-N组、KYSE150+Fn组及KYSE150-N+Fn组细胞中NLRP3及ALDH1蛋白表达量、CSCs百分比、体外增殖能力、克隆成球能力、PTX 24 h药物IC50及裸鼠成瘤能力的差异。检验水准α=0.05。
2 结果
2.1 NLRP3敲降的KYSE150细胞系的建立见图1。结果显示,与KYSE150细胞(0.39±0.07)相比,KYSE150-N细胞中NLRP3蛋白表达量(0.14±0.03)降低(t=5.568,P=0.005),提示成功建立NLRP3敲降的KYSE150-N细胞系。
2.2 Fn感染对KYSE150细胞的PTX应答效力及NLRP3蛋白表达的影响见图2、表1。由图2、表1可知,各Fn感染组细胞的PTXIC50及NLRP3蛋白表达量均高于Fn未感染组,且两指标随Fn感染时间的延长而逐渐增高(P均<0.05)。

表1 各组细胞的PTX 24 h IC50及NLRP3蛋白表达的比较(n=3)

1:Fn未感染组;2:Fn感染12 h 组;3:Fn感染24 h组;4:Fn感染48 h组;5:Fn感染72 h组
2.3 Fn感染及NLRP3敲降对KYSE150细胞中NLRP3、ALDH1蛋白表达及CSCs百分比的影响见图3和表2。与KYSE150组相比,KYSE150+Fn组细胞的NLRP3、ALDH1蛋白表达量及CSCs百分比均增高(P均<0.05);而KYSE150-N组细胞上述指标均降低(P均<0.05)。与KYSE150+Fn组细胞相比,KYSE150-N+Fn组细胞上述指标均降低(P均<0.05)。

表2 各组细胞中NLRP3、ALDH1蛋白和CSCs百分比比较(n=3)

1:KYSE150组;2:KYSE150-N组;3:KYSE150+Fn组;4:KYSE150-N+Fn组
2.4 Fn感染及NLRP3敲降对KYSE150细胞体外增殖能力、克隆成球能力和PTX应答效力的影响见图4、图5和表3。与KYSE150组相比,KYSE150+Fn组细胞的体外增殖能力、克隆成球能力及PTXIC50均增高(P均<0.05);而KYSE150-N组细胞上述指标均降低(P均<0.05)。与KYSE150+Fn组细胞相比,KYSE150-N+Fn组细胞上述指标均降低(P均<0.05)。
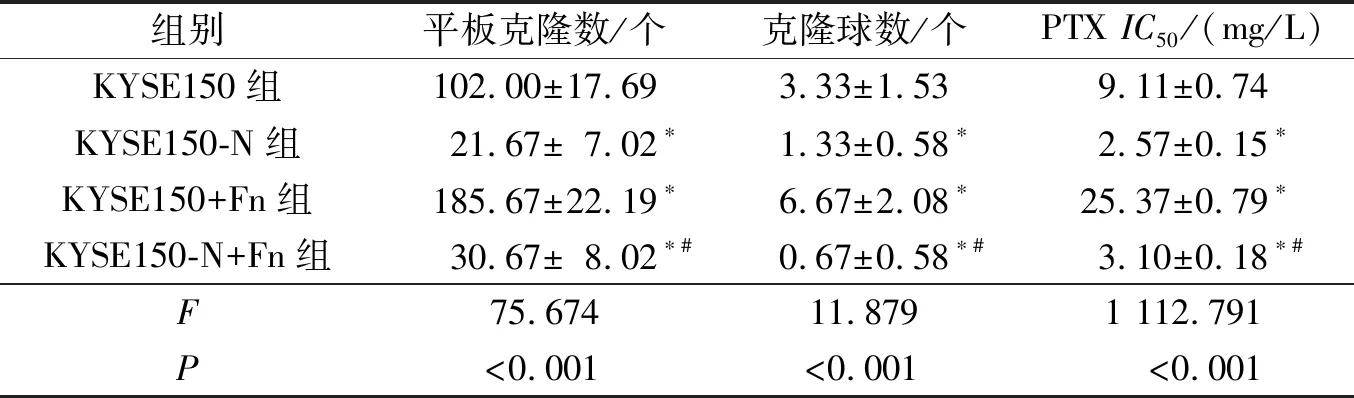
表3 各组细胞体外增殖能力、克隆成球能力和PTX IC50的比较 (n=3)
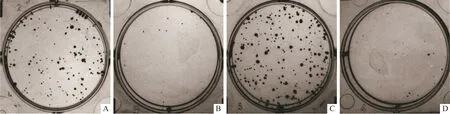
A:KYSE150组;B:KYSE150-N组;C:KYSE150+Fn组;D:KYSE150-N+Fn组

A:KYSE150组;B:KYSE150-N组;C:KYSE150+Fn组;D:KYSE150-N+Fn组
2.5 Fn感染及NLRP3敲降对裸鼠PTX化疗敏感性的影响见表4。由表4可知,与KYSE150组相比,KYSE150+Fn组裸鼠成瘤能力增强(P<0.05),而KYSE150-N组裸鼠成瘤能力减弱(P<0.05),提示此组裸鼠瘤体对PTX化疗敏感性增强。与KYSE150+Fn组相比,KYSE150-N+Fn组裸鼠成瘤能力减弱(P<0.05),提示Fn感染并不能增强KYSE150-N+Fn组裸鼠对PTX化疗的抗性。

表4 各组裸鼠肿瘤荧光强度和肿瘤质量比较(n=6)
2.6 各组裸鼠瘤体内NLRP3、ALDH1蛋白表达及CSCs百分比的比较结果见图6、表5。与KYSE150组相比,KYSE150+Fn组裸鼠瘤体中NLRP3、ALDH1蛋白及CSCs百分比均增加(P均<0.05),而KYSE150-N组裸鼠瘤体中NLRP3、ALDH1蛋白及CSCs百分比减少(P均<0.05);与KYSE150+Fn组相比,KYSE150-N+Fn组裸鼠瘤体中NLRP3、ALDH1蛋白及CSCs百分比减少(P均<0.05)。

表5 各组裸鼠瘤体内NLRP3、ALDH1蛋白表达及CSCs百分比的比较(n=6)
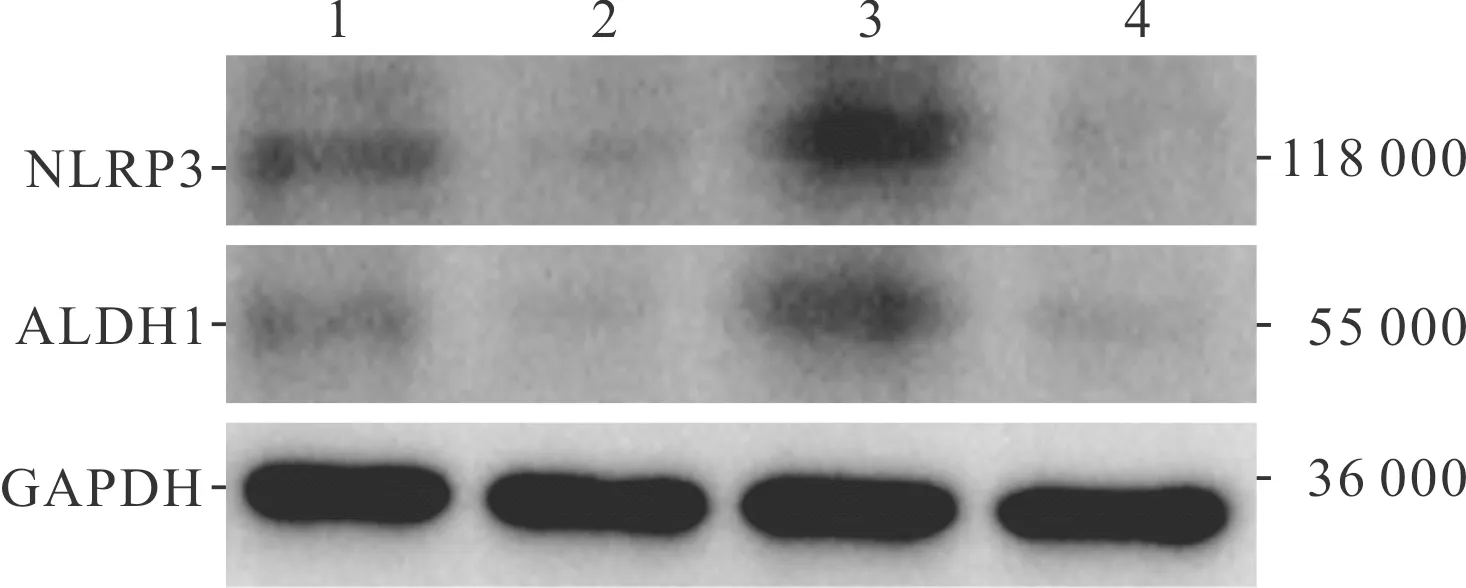
1:KYSE150组;2:KYSE150-N组;3:KYSE150+Fn组;4:KYSE150-N+Fn组
3 讨论
化疗为中晚期食管癌患者最主要的治疗方式之一,其中PTX为最常用的一线化疗药物。PTX可促进微管蛋白聚合,使癌细胞生长停滞于有丝分裂期,从而有效抑制其恶性增殖;但多数患者治疗后,均会产生不同程度耐药,导致后续治疗效果不理想[15]。因此,探明食管癌PTX 耐药的分子机制对改进食管癌治疗方案、提高临床疗效具有极其重要的意义。
研究表明,口腔条件致病菌Fn可通过多种途径诱导肿瘤细胞化疗抵抗,并促进其恶性增殖:Fn可通过激活结肠癌细胞中ANO1,导致结肠癌奥沙利铂及5-氟尿嘧啶化疗抵抗[16];Fn可通过上调Wnt5a介导的NFATc3促进口腔鳞癌细胞顺铂耐药[17];Fn还可通过引发ESCC细胞自噬潮降低其对5-氟尿嘧啶、顺铂及紫杉醇的敏感性[18]。本团队前期研究[1]已证实,Fn感染阳性的食管癌患者术后生存时间显著缩短,且Fn感染可降低食管癌细胞对PTX的应答效力。本研究发现,随Fn感染时间的延长,PTXIC50升高,食管癌细胞KYSE150对PTX的应答效力逐渐减弱,提示Fn可诱导食管癌细胞PTX耐药,但耐药的具体分子机制尚不完全明确。
宿主抵抗病原微生物入侵的第一道保护屏障为机体的固有免疫系统,其主要成分为炎症复合体。NLRP3炎症小体是炎症复合体中最具特征性的多聚体蛋白复合体,可识别多种病原微生物,活化Caspase-1以介导IL-1β和IL-18等促炎因子释放到胞外,从而调节免疫应答并引起炎症反应[19]。病原微生物的持续感染可激活NLRP3炎症小体,参与多种肿瘤的恶性演进:牙龈卟啉单胞菌可通过活化造血NLRP3炎症小体,招募骨髓细胞,重塑促炎性肿瘤微环境,诱导结直肠癌的发生发展[20];EB病毒可介导宿主细胞中NLRP3蛋白与高迁移率族蛋白B1结合,维持自身裂解信号,促进伯基特淋巴瘤的恶性进展[21]。本研究发现,随Fn感染时间的延长,食管癌细胞KYSE150中NLRP3蛋白表达量逐渐增高,提示Fn可诱导食管癌细胞中NLRP3高表达,且具有时间依赖性。
资料显示,抑制NLRP3炎症小体的过度激活可增强多种恶性肿瘤对化疗药物的应答效力:抑制非小细胞肺癌中NLRP3活性,可重新激活顺铂诱导的细胞焦亡,增强癌细胞对顺铂的敏感性[22];阻断口腔鳞癌中NLRP3信号通路,可减弱5-氟尿嘧啶诱导的干性富集,增强其治疗效果[23]。由于CSCs可无限增殖、多向分化,且可抵抗常规放化疗,因此被认为是肿瘤耐药、复发和转移的根源[24]。CSCs的分选已成为肿瘤治疗的关键。研究[10]已证实,ALDH1是食管癌优选的CSCs标志物,参与基因表达、组织分化和维持内环境稳定等功能。本研究发现,Fn感染可引起KYSE150+Fn组细胞中ALDH1蛋白及CSCs百分比均显著增高,提示Fn可诱导食管癌细胞中ALDH1蛋白高表达,引起CSCs大量富集。为探索NLRP3在Fn致病机制中发挥的作用,本研究建立NLRP3敲降的KYSE150-N细胞系,发现NLRP3敲降时,KYSE150-N组细胞中ALDH1蛋白及CSCs百分比均随之减少。而Fn感染NLRP3敲降的KYSE150-N+Fn组细胞时,并不能引起ALDH1蛋白及CSCs百分比增高,提示NLRP3为食管癌细胞中Fn诱导CSCs富集过程中的关键调控因子。本研究还发现,Fn感染时,KYSE150+Fn组细胞的体外增殖能力、克隆成球能力及PTXIC50均显著增高,提示Fn可增强食管癌细胞的干细胞样特性,并降低其对PTX的敏感性。NLRP3敲降后,KYSE150-N组上述指标均随之降低,提示食管癌细胞中NLRP3的激活与干细胞样特性的维持密切相关。而Fn感染NLRP3敲降的KYSE150-N+Fn组细胞时,并不能引起其上述指标增高,提示NLRP3在Fn诱导的食管癌细胞干细胞样特性增强及PTX化疗抵抗过程中发挥重要作用。
本研究的裸鼠皮下荷瘤实验结果显示,与KYSE150组相比,KYSE150+Fn组裸鼠成瘤能力及瘤体内NLRP3、ALDH1蛋白与CSCs百分比均增高,提示Fn可通过激活NLRP3诱导食管癌细胞ALDH1高表达,引起CSCs大量富集,导致PTX治疗抵抗;而KYSE150-N组裸鼠上述指标均降低,提示NLRP3的敲降可抑制食管癌细胞ALDH1表达,导致CSCs减少,对PTX治疗的敏感性增强。与KYSE150+Fn组相比,KYSE150-N+Fn组裸鼠成瘤能力及瘤体内NLRP3、ALDH1蛋白与CSCs百分比均减少,提示NLRP3的敲降阻断了Fn引起的PTX化疗抵抗,表明NLRP3为食管癌细胞中Fn感染引起的PTX化疗抵抗中的关键调控因子。
综上所述,Fn可通过激活NLRP3诱导食管癌细胞ALDH1高表达,引起CSCs大量富集,导致PTX化疗抵抗,最终促进食管癌细胞恶性增殖。有效清除Fn并抑制NLRP3的活性可能为食管癌治疗提供新策略和治疗手段。
