一株黄颡鱼源迟缓爱德华氏菌弱毒株的分离鉴定及特性分析
2023-09-19靳洪振王玲玲吴亚鑫彭康尧袁汉文雷连成张付贤
靳洪振,王玲玲,2,3,吴亚鑫,彭康尧,袁汉文,2,3,雷连成,4,张付贤,2,3
(1.长江大学动物科学学院,湖北荆州 434023;2.湿地生态与农业利用教育部工程研究中心,湖北荆州 434023;3.涝渍灾害与湿地农业湖北省重点实验室,湖北荆州 434023;4.吉林大学动物医学学院,长春 130062)
黄颡鱼(Pelteobagrusfulvidraco)俗称“黄辣丁”、“黄姑子”,为鲿科(Bagridae)黄颡鱼属(Pelteobagrus),是中国特色淡水鱼类。2020年黄颡鱼养殖总产量为5.655×105t,在特色鱼类中产量排名第二。黄颡鱼肉质滑嫩、刺少味美、营养价值高、深受广大消费者喜爱,是人们餐桌上的不可或缺的佳肴。但随着黄颡鱼养殖业的快速发展,特别是养殖规模及密度不断增加,导致水产病害频发;再加上抗生素的不规范使用,黄颡鱼的病害问题越发严重,其中以细菌病最为突出。比较常见的黄颡鱼致病菌有迟缓爱德华氏菌(Edwardsiellatarda,Et)、类志贺邻单胞菌(Plesiomonasshigelloides)、嗜水气单胞菌(Aeromonashydrophila)等[1,2]。
迟缓爱德华氏菌属于肠杆菌科,无荚膜、无芽孢、有运动力的革兰氏阴性菌,其在动物体内、海洋、湖泊、河流、泥土中广泛存在,是一种人-鱼共患的条件致病菌[3,4]。迟缓爱德华氏菌宿主范围广,可引起鸟类、爬行类、鱼类、两栖类感染和人类胃肠道症状。随着水产养殖规模的不断扩大,迟缓爱德华氏菌已经成为引起水产养殖动物发病的重要病原菌。研究发现,该菌可感染多种水产养殖动物,如大口黑鲈(Micropterussalmoides)、罗非鱼(Oreochromismossambicus)、龟(Mauremysreevesii)、牛蛙(Lithobatescatesbeiana)、鳜(Sinipercachuatsi)、黄鳝(Monopterusalbus)等[5]。鱼类感染迟缓爱德华氏菌的主要症状表现为:腹部肿胀,并有腹水;肝脏、肾脏肿大,体表、鳍基和头部皮肤有出血、溃烂现象。近年来,黄颡鱼感染迟缓爱德华氏菌多次发生,传染性强,死亡率高,给黄颡鱼养殖造成了严重的经济损失[6]。
为查明2021年8月湖北荆州一养殖基地黄颡鱼出现烂身、腹水等症状的病原,本研究从患病黄颡鱼的肝脏、肾脏、脾脏等组织中分离纯化出致病菌,经革兰氏染色镜检、生理生化特性、16S rRNA基因序列分析鉴定分离菌株为迟缓爱德华氏菌,通过致病性分析和筛选对致病菌有抑制效果的抗菌药物和中药,为迟缓爱德华氏菌致病机理的研究和黄颡鱼病害的防控提供科学依据和数据参考。
1 材料与方法
1.1 实验材料
2021年8月采集湖北荆州某养殖基地出现鱼体溃烂、腹腔肿大等临床症状的发病黄颡鱼,体质量在100 g左右。人工感染实验材料为湖北省荆门市某黄颡鱼养殖场健康黄颡鱼,体质量100~110 g,经7 d暂养观察,特定病原检测为阴性的黄颡鱼用于实验。
主要试剂:革兰氏染色剂、琼脂均购自北京索莱宝生物科技有限公司;Labselect纯医用级聚苯乙烯96孔细胞培养板,购自北京兰杰柯科技有限公司;Mueller-Hinton(MH)肉汤培养基购自青岛海博生物技术有限公司;药敏纸片、空白药敏纸片、细菌微量生化管购自杭州微生物试剂有限公司;2×PCR Mix酶、DL2000 DNA Marker购自北京聚合美生物科技有限公司;细菌基因组提取试剂盒购自北京天根生化科技有限公司;反转录试剂盒购自南京诺唯赞生物科技股份有限公司;引物合成及测序委托生工生物工程(上海)股份有限公司。
1.2 病原菌的分离与培养
检查记录患病黄颡鱼的外观症状,用75%的酒精擦拭病鱼体表进行消毒;在无菌条件下解剖病鱼,观察其内部组织器官病变情况;取病变组织肝、肾、脾、肠和腹水至无菌1.5 mL EP管内,充分研磨后,添加适量PBS溶液充分混匀。使用组织研磨液划线接种于LB琼脂培养基上,28 ℃培养24 h。随机挑取单个优势菌落纯化培养,革兰氏染色后使用光学显微镜镜检。
1.3 病原检测
使用无菌剪刀和镊子取患病黄颡鱼病变组织(约200 mg)放入无酶的1.5 mL的EP管中进行研磨,使用病毒DNA和RNA基因组提取试剂盒提取基因组作为病毒检测的模板;以恒温培养24 h后长出的单菌落为检测细菌的模板。以嗜水气单胞菌OmpA基因(登录号:NZ.CP050851.1)设计特异性引物,参考文献[7-14]合成迟缓爱德华氏菌、温和气单胞菌和草鱼呼肠孤病毒等病原的引物序列(表1),反应体系(20 μL):模板1 μL、2×PCR mix 10 μL、上下游引物(10 μmol/L)各1 μL、dd H2O 7 μL;PCR扩增条件:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,31个循环;72 ℃延伸10 min。反应后用5 μL产物使用1.0%琼脂糖凝胶进行电泳,恒压120 V电泳25 min。

表1 患病黄颡鱼病原检测引物信息Tab.1 Primer information for pathogen detection of diseased P.fulvidraco
以分离和提取病鱼脏器的基因组DNA作为模板,使用特异性引物体系,通过PCR检测迟缓爱德华氏菌在黄颡鱼的肝脏、肾脏、脾脏、肠道和腹水中的分布情况。
1.4 生理生化鉴定
挑取分离菌株的单菌落接入5 mL的LB液体培养基中,在28 ℃、180 r/min的摇床过夜培养16 h;取10 μL菌液加入细菌微量生化管中,28 ℃培养24 h或48 h后进行生理生化分析;将氧化酶试纸用蒸馏水浸湿,用接种环挑取单菌落,涂在试纸上,在30 s之内变为蓝色或蓝紫色为强阳性,2 min内不变色为阴性。
1.5 测序分析和系统发育树
1.5.1 16S rRNA鉴定
取分离菌株的纯培养物提取基因组作为模板,以通用引物27-F:AGAGTTTGATCMTGGCTCAG和1492-R:GGTTACCTTGTTACGACTT进行PCR扩增。25 μL反应体系如下:模板1 μL、2×PCR mix 12.5 μL、上下游引物(10 μmol/L)各1 μL、dd H2O 9.5 μL。PCR扩增条件:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,33个循环;72 ℃延伸10 min。反应后用25 μL产物使用1.5%琼脂糖凝胶进行电泳。PCR产物委托上海生工生物工程有限公司武汉测序部进行测序;测序结果在GeneBank数据库上进行序列同源性比对分析。
1.5.2 系统发育树建立
将测序得到的菌株的16S rRNA序列在NCBI上进行BLAST比对,选取肠杆菌科同源性较高以及其他的爱德华氏菌属的水产病原菌,如杀鱼爱德华氏菌EIB202、鳗鱼爱德华氏菌和人源迟缓爱德华氏菌作为内群;再选取克雷伯氏菌属、埃希氏菌属和沙门氏菌属作为外群,利用MEGA11.0软件进行多序列比对,Neighbor-joining法构建分子系统树,并且取1 000次Bootstrap检验置信度。
1.6 毒力基因检测
参考SRINIVASA等[15]迟缓爱德华氏菌的毒力基因报道,合成迟缓爱德华氏菌的4个主要毒力基因(esaV、katB、fimA和gadB)的引物(表2),PCR分析迟缓爱德华氏菌分离株携带毒力基因情况。使用细菌基因组提取试剂盒提取分离菌株Et-4的基因组作为模板,PCR反应体系25 μL:模板1 μL、2×PCR mix 12.5 μL、上下游引物(10 μmol/L)各0.5 μL、dd H2O 10.5 μL。PCR扩增条件:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,33个循环;72 ℃延伸10 min。反应后用5 μL产物使用1.5%琼脂糖凝胶进行电泳。

表2 迟缓爱德华氏菌毒力基因引物序列Tab.2 Primers sequences of virulence gene associated with E.tarda
1.7 人工回归感染实验
分离菌株Et-4经活化后,挑取单菌落接种到LB液体培养基中,28 ℃、180 r/min摇床培养6 h,4 000 r/min离心5 min收集菌体,无菌PBS洗涤三次,PBS重悬菌体,采用平板法进行计数并测定菌液浓度[16,17]。
健康黄颡鱼于实验室内暂养一周,选取健康且不携带嗜水气单胞菌、类志贺邻单胞菌、草鱼呼肠孤病毒、迟缓爱德华氏菌等特定病原体的黄颡鱼用于人工感染实验。人工腹腔注射感染实验共设立4个实验组和1个对照组,每组12尾,注射0.3 mL,实验组每尾鱼攻毒剂量分别为1.248×108、3.12×107、7.8×106、1.95×106CFU/g,对照组每尾鱼接种0.3 mL无菌PBS。实验鱼均隔离养殖在玻璃缸内,加热棒控制水温为23 ℃,pH值6.8~7.5,溶氧大于5 mg/L,氨氮小于0.06 mg/L。每天进行观察,按鱼体质量0.5%的量每日投喂一次;连续观察7 d,记录感染后黄颡鱼的发病症状与死亡情况,根据寇氏法[18]计算其半数致死剂量;比对人工感染死亡黄颡鱼与自然感染死亡黄颡鱼的临床症状和病理变化,并对发病死亡的实验黄颡鱼进行病原菌的再次分离和鉴定。
1.8 生物被膜形成能力测定
活化后的分离菌株接种于LB液体培养基中,在28 ℃,180 r/min摇床培养12 h;在96 孔细胞培养板中加入 100 μL的LB培养基和1 μL的菌液,未接种菌液的空白培养基孔作为对照;28 ℃孵育 8~10 h后,吸弃 96 孔板内液体,;加入甲醇固定25 min,并洗净晾干;0.1%的结晶紫染色10 min,洗净晾干后加入冰醋酸溶解结晶紫,10 min后在550 nm处测定OD值;实验重复三次,判定分离菌株生物被膜形成能力[19,20]。
1.9 药物敏感性实验
1.9.1 抗菌药物药敏实验
将分离菌株Et-4用无菌生理盐水稀释到0.5麦氏浓度,用无菌棉签蘸取菌液均匀涂布在MH固体培养基(Mueller-Hinton agar,MHA)上,采用Kirb-Bauer(K-B)纸片扩散法,将30种抗菌药物纸片贴在培养基上,28 ℃恒温培养24 h,测量药敏片的抑菌圈直径,结果判断参照美国临床实验室标准化委员会(CLSI)标准[21]。
1.9.2 耐药基因检测
取分离菌株Et-4的纯培养物提取基因组作为模板,合成耐药基因的特异性引物[22,23](表3),PCR检测分离菌株Et-4携带耐药基因情况。PCR反应体系25 μL:模板1 μL、2×PCR mix 12.5 μL、上下游引物(10 μmol/L)各1 μL、dd H2O 9.5 μL。PCR扩增条件:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,33个循环;72 ℃延伸10 min。反应后用5 μL反应产物使用1.5%琼脂糖凝胶进行电泳,恒压120 V电泳25 min。

表3 耐药基因引物信息以及目标产物大小Tab.3 Primer information and target product size of drug resistance genes
1.10 中药药敏实验
选取42种中药:黄芩、紫苏子、独活、麻黄、款冬花、桑皮、川贝母、天竹黄、大黄(熟)、白术、荆芥、半夏、黄连、僵蚕(炒)、白附子(炙)、茯苓、羌活、桔梗、明雄黄、朱砂、枳壳、连翘、板蓝根、鱼腥草、全蝎、野菊花、薄荷、五味子,金银花,胖大海。五倍子、秦皮、石榴皮、首乌藤、肉桂、丁香、蒲公英、板蓝根、地榆、槟榔、大青叶、乌梅[24-26],体外实验分析其对分离菌株Et-4的抑制情况。
中药药液和药敏片的制备:取中药材2 g,加入40 mL水浸泡1 h后煎煮,沸腾后转文火继续煎煮2 h,用三层纱布过滤并收集滤液;过滤后的药渣继续加入40 mL水,按上述方法进行煎煮过滤;两次过滤的药液浓缩为2 mL,最终浓度为1 g/mL;高压灭菌后,放于4 ℃保存。取空白药敏片,将滤纸片放入制备好中药药液中浸泡1 min,经高压灭菌后放入55~65 ℃烘箱内烘干备用。
取200 μL菌悬液均匀涂布于LB固体培养基,均匀贴上制备的中药药敏纸片,37 ℃恒温培养24 h;测量抑菌圈大小,实验重复3次,计算抑菌圈平均直径,参照徐晓津[27]提供的抑菌标准判断不同中药的抑菌能力。
2 结果
2.1 病原鉴定
发病黄颡鱼出现打圈、浮头、烂身和腹部肿大等症状,剖检可见腹腔内积有大量腹水,肝脏、肾脏肿大,肝脏和肠道有出血。采集病变组织进行PCR鉴定特定病原。PCR结果如图1所示,嗜水气单胞菌、维氏气单胞菌、温和气单胞菌、无乳链球菌、蛙属虹彩病毒、草鱼呼肠孤病毒、病毒性出血败血症病毒的引物均未扩增出特异性条带,结果为阴性;迟缓爱德华氏菌的引物扩增出阳性条带,表明黄颡鱼疑似迟缓爱德华氏菌感染。
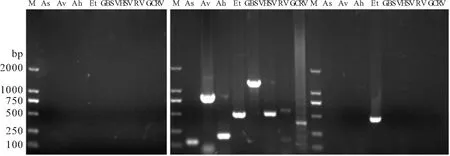
图1 病原的PCR鉴定Fig.1 Identification of the pathogens by PCRM.DL 2000 DNA Marker;泳道2~9为阴性对照,11~18为阳性对照,20~27为检测样品;As.温和气单胞菌;Av.维氏气单胞菌;Ah.嗜水气单胞菌;Et.迟缓爱德华氏菌;GBS.无乳链球菌;VHSV.病毒性出血败血症病毒;RV.蛙属虹彩病毒;GCRV.草鱼呼肠孤病毒。
分别采集患病黄颡鱼不同的病变组织并提取基因组,以迟缓爱德华氏菌特异性引物进行扩增,结果如图2所示,在患病黄颡鱼的肝脏、肾脏和腹水中均能扩增出迟缓爱德华氏菌特异的条带,表明在黄颡鱼的肝、肾和腹水中均存在迟缓爱德华氏菌。
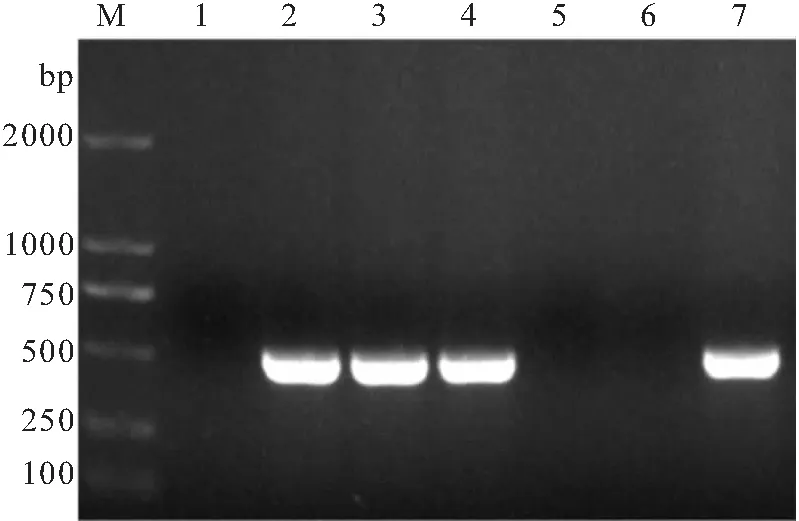
图2 分离菌株在组织中分布Fig.2 Detection of isolated strain in tissuesM.2000bp DNA Marker;1.阴性对照;2.阳性对照;3.肝;4.肾;5.脾;6.肠;7.腹水。
2.2 细菌分离与菌落形态
用患病黄颡鱼的肝脏和腹水划线接种LB固体平板,28 ℃培养24 h生成灰白色、湿润有光泽、表面光滑的菌落;在光学显微镜下可见红色、两端钝圆的短杆菌,为革兰氏阴性杆菌(图3),与迟缓爱德华氏菌的形态特征一致。

图3 分离菌株的形态学观察Fig.3 Morphological observation of the isolated straina.培养基生长形态;b.革兰氏染色镜检(100×)。
2.3 分离菌的生理生化鉴定
分离菌株的氧化酶实验呈阴性,可使葡萄糖产气,MR、赖氨酸脱羧酶、硫化氢、麦芽糖、鸟氨酸脱羧酶、葡萄糖和靛基蓝呈阳性,其余精氨酸双水解酶等呈阴性(表4)。分离菌株的生理生化特性与伯杰氏细菌分类手册中迟缓爱德华氏菌的生理生化特性一致。

表4 Et-4的生理生化鉴定结果Tab.4 Physiological and biochemical identification results of Et-4
2.4 16S rRNA序列分析
对分离菌株的16S rRNA基因进行扩增,扩增出的基因片段大小为1 443 bp;基因片段测序发现,分离菌株与迟缓爱德华氏菌ATCC23685(GenBank:GG739637.1)的同源性为99.79%;利用MEGA 11.0软件进行多序列比对,Neighbor-joining法构建分子系统树,结果如图4所示,分离菌株与爱德华氏菌属菌株聚为一支,与克雷伯氏菌属、埃希氏菌属和沙门氏菌属较远。结合以上实验结果可判定分离菌株为迟缓爱德华氏菌,命名为Et-4。
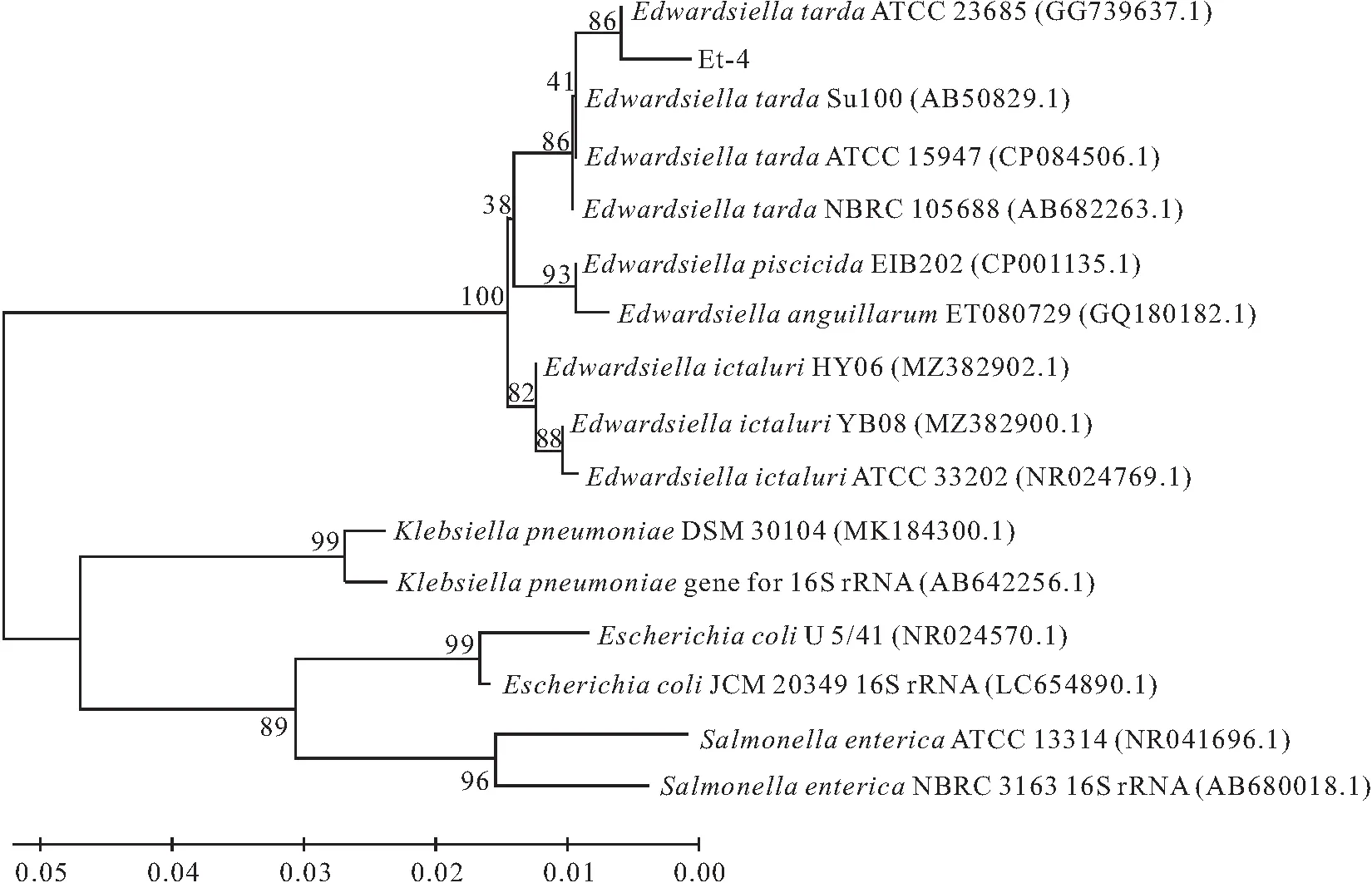
图4 基于分离菌株Et-4的16S rRNA的基因序列构建的系统进化树Fig.4 Phylogenetic tree constructed based on 16S rRNA gene sequences of isolated strain Et-4
2.5 分离菌株毒力基因分析
采用4种毒力基因的特异性引物对迟缓爱德华氏菌Et-4进行PCR扩增,结果表明,在4种毒力基因目的条带处均未出现清晰条带(图5),表明迟缓爱德华氏菌分离株Et-4缺失上述4种毒力基因,其毒力基因型为esaV-fimA-gadB-katB-,初步判定其为弱毒株。

图5 毒力基因检测Fig.5 Detection of virulence genes of isolated strain Et-4M.DL 2000 DNA Marker;泳道2-5为阴性对照;泳道7-10为菌株Et-4。
2.6 人工感染实验
将分离菌株Et-4通过腹腔注射的方式感染健康黄颡鱼,攻毒后患病鱼出现明显的食欲下降,游动无力,反应迟钝;病鱼体表粘液脱落,皮肤组织出现红肿、出血和溃疡;鳃盖、鳍条基部充血,腹部肿大等临床症状(图6),以1.248×108CFU/g组和3.12×107CFU/g组黄颡鱼的临床症状最为显著。在攻毒后6 d,1.248×108CFU/g组和3.12×107CFU/g组黄颡鱼全部死亡,7.8×106CFU/g组死亡8尾,1.95×106CFU/g组死亡4尾,PBS组死亡2尾(图7)。剖检病鱼可见严重的腹水、肝脏和肾脏病变,PCR鉴定为迟缓爱德华氏菌感染,从肝脏、肾脏和腹水中分离出的优势菌群经16S rRNA测序分析与攻毒菌株一致;PBS组病死鱼未见明显病变,也未检出攻毒菌株。统计分离菌株Et-4对黄颡鱼的半致死剂量为3.9×106CFU/g,结合毒力基因检测结果进一步确定分离株Et-4为esaV-fimA-gadB-katB-的弱毒株。
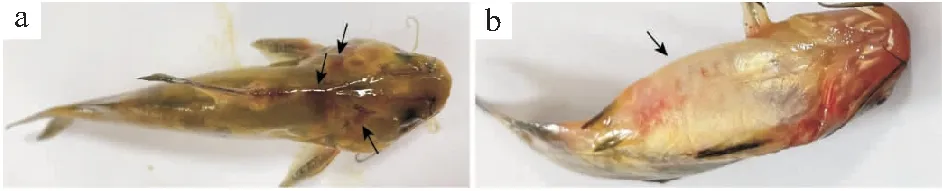
图6 人工感染后黄颡鱼患病症状Fig.6 Symptoms of P.fulvidraco after artificial infection1.头部点状出血;2.腹部肿大。
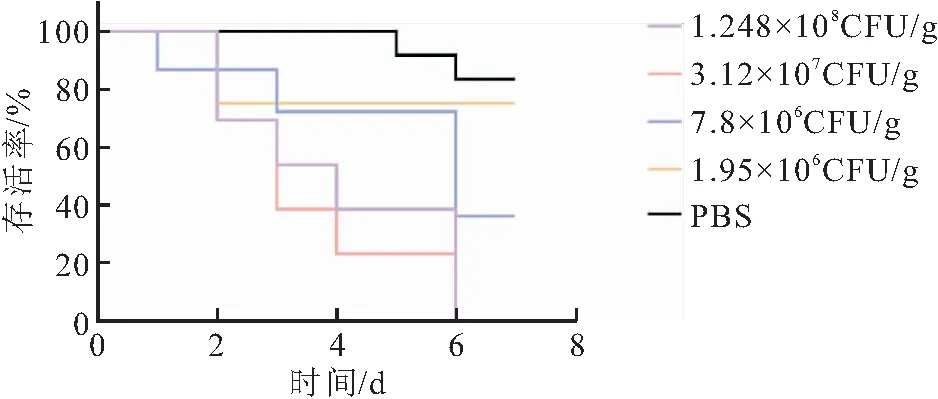
图7 不同实验组黄颡鱼的存活曲线Fig.7 Survival curve of P.fulvidraco in different experimental groups
2.7 生物被膜形成能力测定结果
分离菌株Et-4的生物被膜形成能力测定的OD550 nm值为0.409 7,而空白组OD550 nm值仅为0.075 0,表明迟缓爱德华氏菌分离菌株Et-4具有较强的生物被膜形成能力。
2.8 药物敏感性实验
2.8.1 抗菌药物药敏实验结果
采用药敏纸片琼脂平板扩散法对菌株Et-4进行药敏实验,结果如表5所示,分离菌株Et-4对头孢类药物、庆大霉素、新霉素、卡那霉素、丁胺卡那、呋喃唑酮和多粘菌素B敏感;对米诺环素、氯霉素、头孢哌酮中度敏感,对四环素类、青霉素类、万古菌素、复方新诺明等13种药物耐药。药敏结果表明,迟缓爱德华氏菌分离菌株Et-4为多重耐药菌株。

表5 抗菌药物药敏实验结果Tab.5 Drug susceptibility test of isolated strain Et-4
2.8.2 Et-4耐药基因结果
耐药基因检测结果发现,分离菌株Et-4携带耐药基因tetA、sul1和aadA1(图8),表明分离菌株Et-4对四环素类、磺胺类和氨基糖苷类抗菌药物有一定的耐药性。
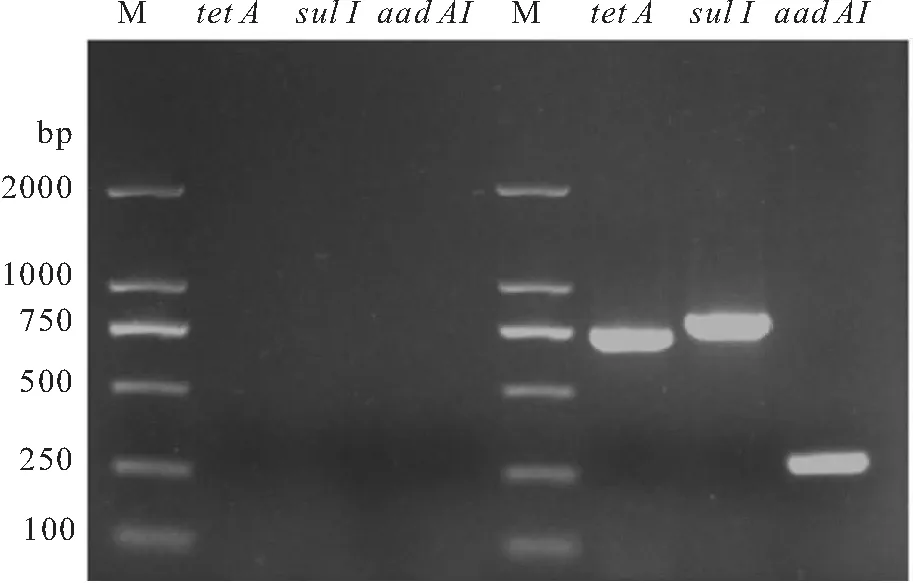
图8 耐药基因检测Fig.8 Detection results of drug resistance gene of isolated strain Et-4M:2000 bp DNA Marker;2~4泳道:阴性对照;6~8泳道:Et-4。
2.9 中药药敏实验结果
采用药敏纸片琼脂平板扩散法对菌株Et-4进行药敏实验,结果如表6所示,Et-4对乌梅和丁香较为敏感,其次五倍子、生地榆、秦皮、蒲公英等中药对菌株Et-4也有一定的抑菌效果。
3 讨论
近年来,黄颡鱼养殖中出现体表溃烂症状的临床病例较多,主要由迟缓爱德华氏菌、拟态弧菌(V.miminus)、温和气单胞菌(A.sobria)和维氏气单胞菌(A.veronii)等细菌感染引起[28,29]。本研究从患病黄颡鱼组织中分离到的优势菌株经16S rRNA基因序列鉴定为迟缓爱德华氏菌,其主要存在于病鱼肝脏、肾脏和腹水中,具有一定的组织嗜性;自然发病黄颡鱼和人工感染黄颡鱼观察到的临床症状与PANDEY等[30]、MURWANTOKO等[31]、YANG等[32]学者所报道的一致,并且均能从肝脏、肾脏和腹水中分离到攻毒菌,证实迟缓爱德华氏菌为湖北荆州某养殖基地黄颡鱼身体溃烂、严重腹水的致病菌。胡兵等[33]分离的迟钝爱德华氏菌导致黄颡鱼头部出现“头穿孔”的典型临床症状,与本研究分离毒株感染出现的临床症状存在显著差异,可能与分离毒株的分布区域以及致病性有关。因此,临床上开展黄颡鱼烂身病诊治时,应综合考虑临床症状、分子生物学检测以及致病菌的毒力、耐药性进行针对性的治疗。
经鉴定迟缓爱德华氏菌分离菌株Et-4不携带四种主要的毒力基因:esaV、fimA、gadA1和katB,这与罗非鱼源迟缓爱德华氏菌天然弱毒株的毒力基因谱型相似[34]。程俊茗等[35]分离的鲫源迟缓爱德华氏菌携带fimA、citC、gadB、mukF、katB、esrB和sodB等7个毒力基因,与本研究分离菌株的毒力基因携带情况显著不同。人工感染实验发现,迟缓爱德华氏菌分离菌株Et-4在低剂量感染时对黄颡鱼没有明显的致病性;当攻毒剂量增加至1.95×106CFU/g时,黄颡鱼出现烂身、腹水等症状;统计分离株Et-4对黄颡鱼的半致死剂量为3.9×106CFU/g,综合其毒力基因型确定迟缓爱德华氏菌分离株Et-4为弱毒株。
本研究通过药敏试验发现迟缓爱德华氏菌分离菌株Et-4对四环素类、青霉素类、万古菌素、磺胺类的复方新诺明等13种药物耐药,是一株多重耐药菌;筛查耐药基因发现,分离菌株Et-4携带耐药基因tetA、sul1和aadA1,其对四环素类药物的耐药性可能与tetA基因有关,对磺胺类药物的耐药性可能与sul1基因有关,对氨基糖苷类抗菌药物的耐药性可能与其携带的aadA1耐药基因有关。在生物被膜形成能力方面,分离株Et-4具有较强的生物被膜形成能力,属于易产生生物被膜的细菌,这与其在药敏试验中呈现的多重耐药结果相符。综合分离菌株的生物被膜能力、耐药基因、药物敏感性和致病性,表明分离株Et-4为多重耐药的弱毒株,这也在一定程度上解释了生产上抗生素使用时效果不佳的原因。
本研究发现,中药乌梅和丁香对分离株Et-4具有较好的抑菌效果。因此,在开展迟缓爱德华氏菌防治时,可考虑使用中药乌梅、丁香、地榆和蒲公英的复方药剂或单味中药的有效成分。针对近年来黄颡鱼的迟缓爱德华氏菌病多发的问题,养殖户在生产上应提升水质,改善养殖环境;合理调配饲料,提高黄颡鱼的基础免疫力;充分考虑条件致病菌的耐药性和致病性,结合敏感抗菌药物和中药进行联合用药和精准施治。本实验黄颡鱼源的迟缓爱德华氏菌致病性和耐药性研究结果,可为黄颡鱼迟缓爱德华氏菌感染的防控提供理论依据。
