eomesa功能缺失对斑马鱼雌鱼生殖的影响
2023-09-19张婷婷佟广香孙志鹏唐国盘周慧杰匡友谊
张婷婷,佟广香,孙志鹏,闫 婷,唐国盘,周慧杰,6,匡友谊
(1.上海海洋大学 水产与生命学院,上海 201306;2.中国水产科学研究院黑龙江水产研究所,哈尔滨 150070;3.农业农村部淡水水产生物技术与遗传育种重点实验室,哈尔滨 150070;4.淡水鱼类育种国家地方联合工程实验室,哈尔滨 150070;5.河南牧业经济学院,郑州 450046;6.天津农学院,天津 300000)
金鱼(Carassiusauratus)是我国主要养殖的观赏鱼种类之一,蛋种金鱼因其背鳍缺失而深受人们喜爱[1、2]。在研究背鳍缺失的分子机制中发现,eomesa(eomesodermina)是调控背鳍发育的关键基因。如DU等[3]通过TILLING(Targeting induced local lesions in genomes)技术构建斑马鱼(Daniorerio)eomesafh105突变体,该突变将第100位酪氨酸转变为终止密码子使eomesa功能异常,并使eomesafh105纯合突变体缺失背鳍[4];宋诗颖[5]利用CRISPR/Cas9(Clustered regularly interspaced short palindromic repeat)技术获得了瓯江彩鲤(Cyprinuscarpiovar.color)背鳍缺失突变系。以上研究说明可利用CRISPR/Cas9基因编辑技术敲除eomesa进行背鳍缺失型金鱼、锦鲤等观赏鱼的培育,但也有一些研究同时发现eomesa的突变可致使雌鱼生殖障碍,阻碍了利用此基因开展背鳍缺失观赏鱼新品种的培育[6-8]。
eomesa基因属于重要的转录因子T-box基因家族成员,广泛存在于各种生物中[9]。eomesa是目前斑马鱼中发现的唯一一个母源T-box因子,主要在中内胚层的前体细胞中表达[8]。eomesa在斑马鱼胚胎发育的多个过程中起关键作用,尤其是在中内胚层的形成中起着决定性作用,并影响斑马鱼胚胎的外包运动[6];eomesa在早期囊胚中抑制外胚层基因表达,在胚盾期eomesa过表达诱导中胚层标记基因gsc(goosecoid)、chd(coronaryheartdisease)和flh(floatinghead)的异位表达[8],与mixer(mixfamily)、foxh1(forkheadboxh1)一起介导Nodal信号,进而影响中内胚层的发育[10]。但关于eomesa在生殖中的作用鲜有报道,霍锦倩等[11]通过qPCR(Quantitative real-time PCR)分析表明eomesa基因在斑马鱼的卵巢中高表达,说明eomesa也可能在性腺发育中起到调控作用。
母源因子eomesa在斑马鱼早期发育中起着关键的调控作用,其功能缺失导致雌鱼生殖障碍,并使斑马鱼背鳍缺失,但其机制仍未知。本研究利用CRISPR/Cas9技术构建eomesa功能缺失突变系,进一步通过表型测定、繁殖行为观察、卵巢组织学比较分析,以及性腺发育相关基因的qRT-PCR分析,以期探讨eomesa对斑马鱼雌鱼生殖的影响。
1 材料与方法
1.1 实验用鱼
本研究所用的AB品系斑马鱼购买自国家斑马鱼资源中心,饲养于中国水产科学研究院黑龙江水产研究所斑马鱼养殖中心,饲养条件为28.5 ℃,每天投喂2次丰年虫。斑马鱼受精卵于28.5 ℃恒温培养箱中培养,受精后4~5 d可平游后转移至10 L养殖缸中养殖,投喂草履虫,15 dpf(days post fertilization,dpf)转入循环水养殖系统中养殖,投喂丰年虫。
1.2 eomesa-/-纯合系构建
根据曹顶臣等[12]和唐国盘等[13]描述的方法构建eomesa敲除纯合系(eomesa-/-),简要描述如下:利用CHOPCHOP(http://chopchop.cbu.uib.no)在1号外显子处设计基因敲除靶位点(GGTTCGGTTCTTCCACCCGCCGG),采用HiScribeTMT7 Quick High Yield RNA Synthesis Kit(NEB E2050s,MA,USA)试剂盒体外合成sgRNA,将sgRNA与Cas9蛋白(NEB M0646M,MA,USA)按终浓度为5 pmol/μL混合后,显微注射至单细胞斑马鱼胚胎中。利用唐国盘等[13]描述的PCR产物聚丙烯酰胺凝胶电泳方法检测突变体,检测引物为eomesa-F:ATCTGGGCACTGATCGATACTT,eomesa-R:AACTGATAACCACCCCCAAAC。对突变体的PCR产物进行测序,确定突变体基因型。因eomesa-/-突变体无法自然繁殖,采用人工授精方式构建eomesa-/-纯合系。
1.3 突变体表型观察
随机选择60 dpf野生型和eomesa-/-突变体斑马鱼进行表型观察和骨骼染色。参照杨建等[14]的方法对骨骼进行茜素红染色。随机选取健康成鱼,经麻醉剂安乐死后,在解剖镜下分离并观察卵巢、输卵管,用Zessis SteREO Discovery V8体视显微镜进行观察、拍照。
1.4 卵巢组织学分析
随机选择60、90 dpf野生型和无背鳍eomesa-/-突变体斑马鱼各3尾,在解剖镜下分离卵巢组织,采用波恩试液固定24~48 h,经酒精梯度脱水和二甲苯透明后,进行石蜡包埋。利用MICROM HM200石蜡切片机以厚度为6 μm进行切片。切片经苏木精-伊红染色后在OLYMPUS BX53生物显微镜下观察、拍照。
1.5 繁殖行为观察及繁殖性能测定
随机选择养殖3个月后达到性成熟的野生型和无背鳍表型eomesa-/-突变体斑马鱼,取野生型、eomesa-/-的雄鱼分别与野生型、eomesa-/-雌鱼按雌雄比为1∶1的比例放入产卵盒,在产卵盒中用透明隔板隔开雌雄鱼。次日光照后,去除挡板,观察其繁殖行为,交配后记录产卵量。
采用人工授精方法按雌雄比为1∶1的比例构建无背鳍表型突变体自交和野生型自交家系,人工授精参照胥鹏飞[6]描述的方法进行。受精卵置于28.5 ℃培养箱中孵化,孵化过程中统计并计算产卵量、受精卵数、孵化率和仔鱼畸形率。实验家系每周繁殖一次,分4周完成试验,其中初产家系和孵化过程中因水霉等原因受精卵死亡超过10%的家系不计入统计结果。按照KIMMEL等[15]的标准确定统计斑马鱼胚胎发育时期,实验家系饲喂至成鱼,统计雌雄比例。
1.6 eomesa-/-突变体卵巢基因表达分析
随机选择45、60、90 dpf 3个生长阶段的野生型和无背鳍表型突变体斑马鱼各5尾采集卵巢组织,以及采集5组12 hpf(hours past fertilization)胚胎期(体节期,PGCs在此时期迁移至生殖嵴[16])的胚胎,每组10枚受精卵,用于性腺发育相关基因的qRT-PCR分析。采用Trizol(Life Teachnologies,USA)提取总RNA,使用PrimeScriptTM RT reagent Kit with gRNA Eraser(Takara,USA)合成cDNA。用SYBR Green法检测cyp17a1、amh、dnd1、vasa、nanos3和dmrt1这6个性腺发育相关基因的表达水平,扩增引物采用Primer3 plus设计(表1),以actb1为内参。采用10 μL反应体系进行qRT-PCR实验,包括:5 μL 2×Luna Universal qPCR Master Mix(NEB,MA,USA),0.5 μL 10 ρmol/μL的正向、反向引物,2 μL 50 ng/μL cDNA,2 μL nuclease-free水。qRT-PCR于QuantStudio 6 Flex Real-Time PCR(Thermo Fisher,CA,USA)系统中进行扩增,程序为:95 ℃预变性20 s;之后,95 ℃变性10 s,60 ℃延伸20 s,循环40次。

表1 性腺发育相关基因qRT-PCR引物序列Tab.1 Primer sequences of gonadal development-related genes for qRT-PCR
1.7 数据分析
采用2-ΔΔCt法[17]评估野生型和突变体样本在胚胎发育和胚后发育各时期中性腺发育相关基因的表达量,使用SPSS软件进行T检验(Student′s T-test)分析基因表达量、繁殖性能相关指标在野生型和突变体中的显著差异,采用卡方检验分析雌雄性比在野生型和突变体中的差异,当P<0.05表示差异显著。使用GraphPad Prism 8软件绘制斑马鱼繁殖性能相关指标以及基因表达量分布图。
2 结果与分析
2.1 eomesa-/-纯合系构建
采用CRISPR/Cas9对eomesa的第1外显子进行敲除(图1a),构建了eomesa-/-纯合系,通过Sanger测序的序列分析发现eomesa-/-突变体在靶位点处缺失5 bp,并颠换2 bp(图1b)。根据DNA序列推断的氨基酸序列分析发现,eomesa-/-突变体在第157位氨基酸处发生移码,并在第203位氨基酸处出现终止密码子(图1c,红色框所示)。
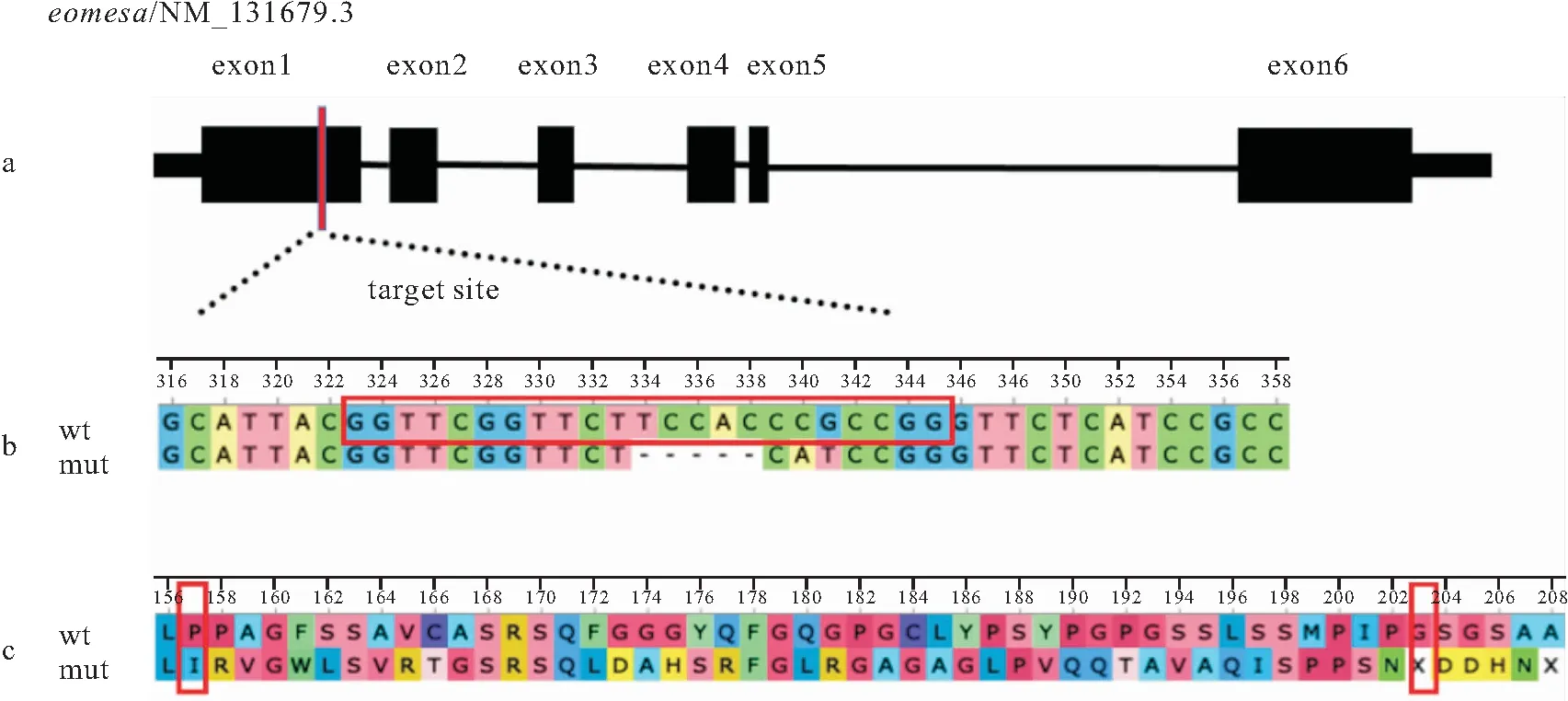
图1 eomesa敲除示意图Fig.1 Schematic diagram of eomesa knockoutwt:野生型;mut:eomesa-/-突变体。a:eomesa结构示意图;b:eomesa-/-突变体碱基序列比对,红色框为sgRNA靶位点,PAM序列为CGG(343~345处);c:eomesa-/-突变体氨基酸序列比对,红色框中X为终止密码子。
2.2 eomesa-/-突变体骨骼表型观察
外形和骨骼染色观察发现,相对于野生型(图2 a~c),eomesa-/-突变体骨骼具有两种表型,即背鳍缺失表型(mut1,图2d~f),以及背鳍和臀鳍同时缺失表型(mut2,图2g~i)。茜素红染色发现,mut1除缺失背鳍鳍条外,其支鳍骨也严重缺失(图2e~f);mut2的背鳍鳍条和支鳍骨全部缺失(图2h),但保留了少部分臀鳍支鳍骨(图2i)。以上说明,敲除eomesa后导致了背鳍和臀鳍支鳍骨和鳍条的发育异常。

图2 60 dpf eomesa-/-突变体和野生型斑马鱼外形及骨骼染色观察Fig.2 Observation of body shape and skeleton staining of 60 dpf eomesa-/- mutants and wild-type D.rerio(a~c):野生型斑马鱼;(d~f):突变体1,无背鳍;(g~i):突变体2,无背鳍及无臀鳍;黑色箭头:支鳍骨。
2.3 eomesa-/-突变体繁殖能力分析
野生型与eomesa-/-突变体自然交配的繁殖情况分析发现,eomesa-/-雄鱼能正常繁殖,与野生型雌鱼自然交配的受精卵数量为(152±50)枚,与野生型雌、雄自然交配的受精卵数量无显著性差异。但eomesa-/-雌鱼不能与eomesa-/-雄鱼和野生型雄鱼自然繁殖(表2)。繁殖行为学观察表明,虽然eomesa-/-雌鱼有正常的求偶行为,但不能自然排卵,说明eomesa的敲除未影响雄鱼的生殖能力,但可能通过影响卵巢的发育或排卵,从而影响雌鱼的生殖。
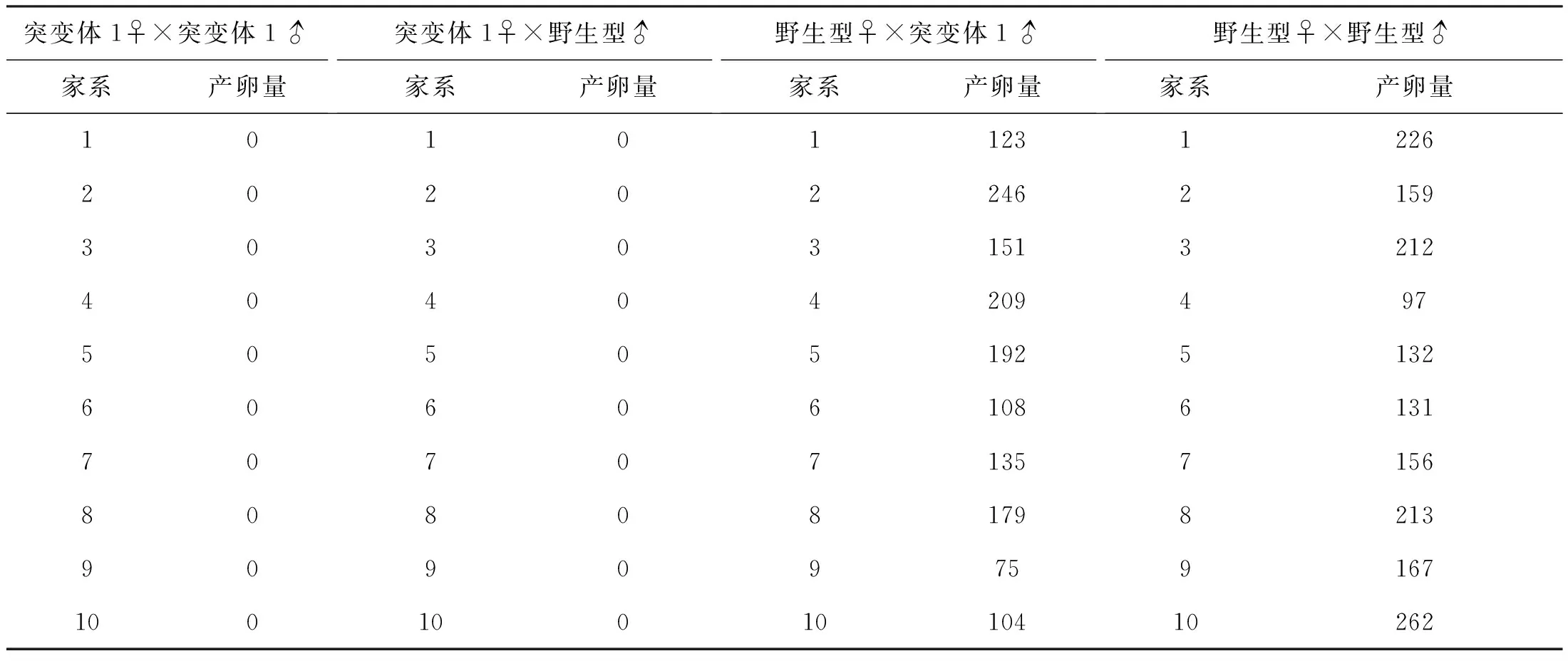
表2 突变体1与野生型斑马鱼自然交配繁殖数据统计Tab.2 Summary of the natural spawn of eomesa-/- mutants 1 and wild-type D.rerio
为分析eomesa功能异常是否影响卵子的发育,对eomesa-/-突变体进行了人工繁殖实验。研究表明,eomesa-/-雌鱼可通过人工授精方式进行繁殖,其子代发育正常。对通过人工授精构建的eomesa-/-家系(n=10)和野生型家系(n=12)的繁殖性能分析发现,野生型家系的受精率、孵化率及畸形率分别为73.5%、78.6%和9.9%,突变体家系的受精率、孵化率及畸形率分别为70.8%、70.3%和47.9%;与野生型家系相比,突变体家系中受精率和孵化率无明显差异,但突变体家系中胚胎的畸形率显著高于野生型家系(表3,图3)。胚胎发育观察发现,8 hpf野生型胚胎发育至70%外包期(图4a),而突变体胚胎发育至胚盾期(图4e),由此可得eomesa-/-突变体的胚胎从原肠胚盾期开始发育延迟;eomesa-/-突变体胚胎在22 hpf时出现畸形表型,胚胎卵黄异常膨大(图4b~c,f~g);孵化后,突变体幼鱼出现明显卵黄囊膨大、脊柱弯曲、心囊水肿的现象(图4d,图4h)。以上说明,敲除eomesa基因后,虽然可通过人工授精方式进行繁殖,但其导致了胚胎发育异常,从而使畸形率显著升高。
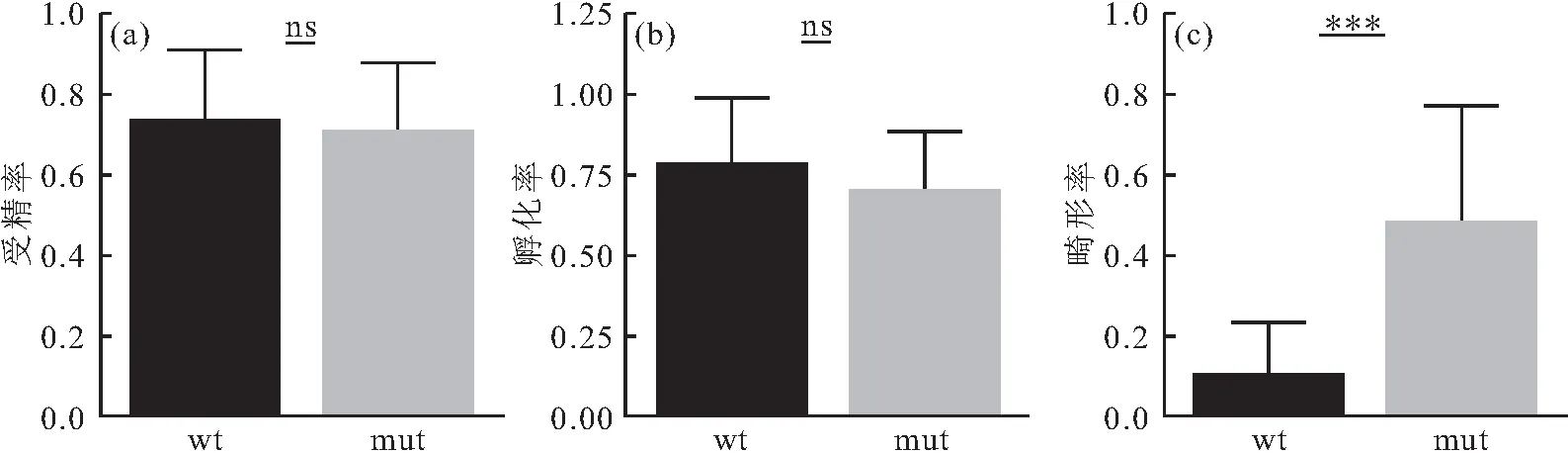
图3 野生型与eomesa-/-突变体1斑马鱼受精率、孵化率、畸形率的比较Fig.3 Comparison of fertilization rate,hatching rate and deformity rate between wild-type and eomesa-/- mutants 1 D.rerio采用平均数±标准差表示野生型和eomesa-/-突变体1斑马鱼的受精率、孵化率和仔鱼畸形率。***:(P<0.001);ns:无显著差异。
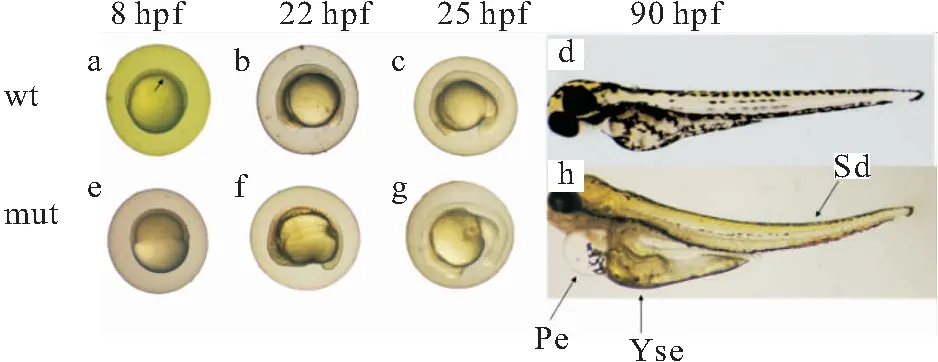
图4 野生型与eomesa-/-突变体1斑马鱼胚胎及幼鱼发育观察Fig.4 Developmental observation of embryos and larvae of wild-type and eomesa-/- mutants 1 D.rerio embryos and larvae(a~c):野生型胚胎;d:野生型幼鱼;(e~g):eomesa-/-突变体1胚胎;h:eomesa-/-突变体1幼鱼;Pe:心囊水肿;Yse:卵黄囊水肿;Sd:脊柱弯曲。
对人工授精的eomesa-/-突变体与野生型家系雌雄个体统计发现,野生型雌雄比约为1∶1,与野生型相比突变体1中雌雄比约为1∶3,雌鱼比例明显更低,eomesa-/-突变体斑马鱼的雄鱼数量显著增加(表4,图5),说明eomesa功能异常除影响雌鱼的生殖外,也影响了雌雄的性别分化。

表4 野生型和eomesa-/-突变体1斑马鱼家系雌雄数据统计Tab.4 Summary of male and female in wild-type and eomesa-/- mutants 1 families
2.4 斑马鱼卵巢组织学分析
虽然可通过人工授精方式使eomesa-/-突变体进行繁殖,但其eomesa敲除是否影响卵子的发育仍未知。斑马鱼卵巢组织切片观察发现,60 dpf野生型的卵母细胞处于卵黄发生中期向成熟卵母细胞过渡的阶段(图6a~b),而eomesa-/-的卵巢发育处于初级生长期向卵黄发生中期过渡的阶段(图6c~d),与野生型相比eomesa-/-突变体的卵母细胞发育在卵黄发生中期明显滞后。90 dpf野生型斑马鱼已经性成熟,此时卵母细胞已经进入成熟期,卵黄颗粒充满卵母细胞(图6e~f),而eomesa-/-突变体的卵母细胞发育略有滞后,其内部的卵黄颗粒数目明显少于野生型斑马鱼卵母细胞中的卵黄颗粒数目(图6g~h)。
进一步的解剖观察发现eomesa-/-突变体输卵管与野生型相比无明显差异,并未发现输卵管堵塞缺失现象(图7),结合上述的人工授精实验表明eomesa功能异常可能通过影响斑马鱼的排卵机制,使其不能自然排卵。
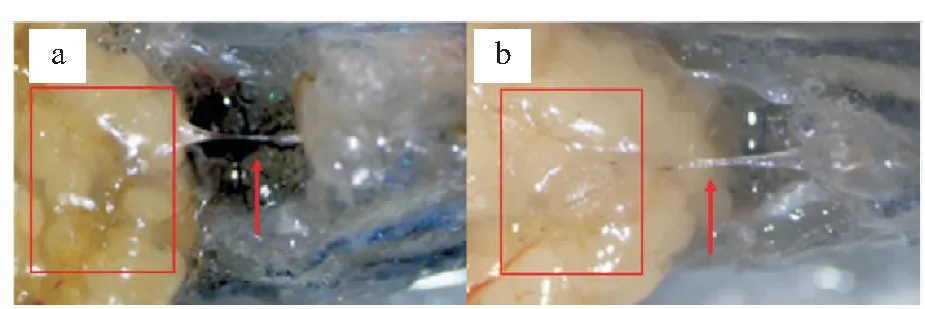
图7 eomesa-/-突变体1与野生型斑马鱼输卵管的观察Fig.7 Observation of oviducts in eomesa-/- mutants 1 and wild-type D.rerioa:野生型;b:突变体;红色框:卵巢;红箭头:输卵管。
2.5 性腺发育相关基因在胚胎发育阶段和卵巢组织中的表达
3个原始生殖细胞发育标志基因(dnd1、vasa、nanos3)在斑马鱼胚胎发育体节期(12 hpf)及3个卵巢发育阶段(45、60、90 dpf)的表达量如图8所示。结果表明:12 hpf时,dnd1和nanos3在突变体胚胎中的表达量显著低于其在野生型胚胎中的表达量,而突变体胚胎中vasa基因的表达量则显著高于其在野生型胚胎中的表达量。在45 dpf时期,dnd1、vasa和nanos3在突变体卵巢中的表达量显著高于其在野生型卵巢中的表达量;在60 dpf和90 dpf阶段,dnd1和vasa在突变体卵巢中的表达量与其在野生型卵巢中的表达量无显著性差异;nanos3在60 dpf突变体与野生型卵巢中的表达量无显著性差异,但90 dpf时其在突变体卵巢中的表达量显著高于其在野生型卵巢中的表达量。
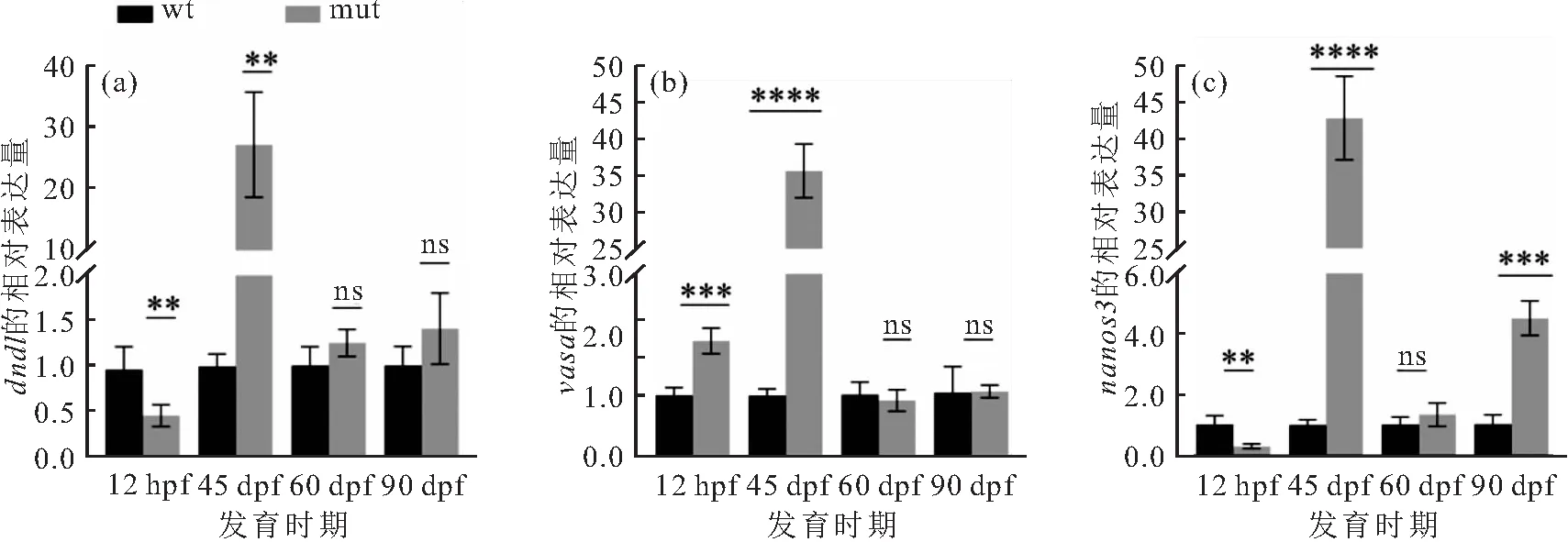
图8 3个原始生殖细胞标志基因在eomesa-/-突变体1和野生型斑马鱼胚胎及4个发育阶段的表达量Fig.8 Expressed levels of three marker genes of PGCs in eomesa-/- mutants 1 and wild-type D.rerio embryos and four developmental stages′ ovaries采用均数±标准差表示基因的表达水平。**:P<0.01;***:P<0.001;****:P<0.000 1;ns:无显著差异。
3个性腺发育基因(cyp17a1、amh、dmrt1)在斑马鱼胚胎发育体节期(12 hpf)及三个卵巢发育阶段(45、60、90 dpf)的表达量如图9所示。结果表明:在体节期中,cyp17a1在突变体中的表达量显著低于其野生型中的表达量,而amh和dmrt1的表达量则相反,其在突变体中的表达量显著高于其在野生型中的表达量。在45 dpf和60 dpf时,突变体卵巢中cyp17a1基因的表达量显著高于其在野生型卵巢中的表达量,而amh在45 dpf突变体中的表达量显著低于野生型中的表达量,在60 dpf突变体的表达量显著高于野生型中的表达量。在90 dpf时,突变体卵巢中dmrt1的表达量显著高于其在野生型卵巢中的表达量,而cyp17a1、amh的表达量则相反。根据以上结果得知,cyp17a1和amh在不同发育时期野生型和突变体中的表达量均体现出显著性差异。

图9 3个性腺发育基因在eomesa-/-突变体1和野生型斑马鱼4个发育阶段的表达Fig.9 Expression of three gonadal developmental genes in eomesa-/- mutant 1 and wild-type D.rerio at four developmental stages采用均数±标准差表示野生型和突变体斑马鱼3个性腺发育特异性基因表达水平。*:P<0.05;**:P<0.01;***:P<0.001;****:P<0.000 1;ns:无显著差异。
3 讨论
对斑马鱼[3-6]、金鱼(Carassiusauratus)[18]和瓯江彩鲤[5]等鱼类的研究发现,T-box家族的eomesa基因在奇鳍发育中扮演着重要角色。前期研究[7]和本研究均发现eomesa的功能缺失导致了斑马鱼背鳍和臀鳍的缺失,但纯合突变体雌鱼无法繁殖,阻碍了利用eomesa基因在无背鳍金鱼育种中的应用。目前,eomesa基因调控斑马鱼繁殖的机制未知,本研究在构建eomesa-/-纯合系的基础上,通过繁殖行为观察、繁殖性能测定、卵巢形态结构分析和基因表达等方面探讨了eomesa功能缺失对斑马鱼雌鱼生殖的影响。研究表明,eomesa-/-雄鱼可自然繁殖,但雌鱼不能自然繁殖;繁殖行为观察表明雌鱼虽然可进行求偶配对行为,但不能排卵。进一步研究表明eomesa-/-雌鱼可通过人工授精方式获得正常发育的后代,并且后代可以达到性成熟,这与以前的研究一致[6-8]。解剖观察发现eomesa-/-雌鱼的卵巢和输卵管形态正常,组织切片的分析表明eomesa基因的敲除不影响卵子的成熟,但使卵母细胞的发育滞后。由此推断,eomesa应在卵母细胞发育和排卵机制两方面影响斑马鱼的繁殖,但主要通过影响排卵机制导致雌鱼无法自然排卵。
鱼类的生殖排卵是多因素影响的复杂过程,包括性腺发育以及生殖系统与神经系统的协调[19]。性腺由生殖细胞和周围的体细胞组成,生殖细胞主要负责产生配子将遗传信息传递给子代,而性腺体细胞主要负责维持生殖细胞生长发育以及第二性征[20]。生殖细胞在胚胎早期由原始生殖细胞(PGC)发育而来,PGC进行不对称分裂形成体细胞和PGCs[21]。在早期胚胎发育过程中,PGCs向生殖脊定向迁移,并与周围的体细胞衍生细胞一起发育成性腺[22、23]。那么eomesa的功能缺失是否可通过扰乱内胚层的分化影响PGCs的发育和迁移,进而影响雌鱼的性腺发育呢?
为深入研究eomesa基因功能缺失对雌鱼生殖的影响,本研究分析了6个性腺发育相关基因的表达量,包括3个PGC标志基因和3个性腺发育相关基因。研究表明,eomesa功能缺失显著性影响了dnd1、vasa和nanos3的表达。dnd1[24]、vasa[25]、nanos3[26]这些母源mRNA定位于生殖脊中,并且随着胚胎发育被整合进入体细胞和PGCs。在斑马鱼中,nanos3基因并不是原始生殖细胞形成所必需的,但缺少该基因,PGCs就不能够正常迁移至生殖脊中,而过早地分化、凋亡[26]。dnd1是PGC细胞迁移的关键基因,缺失dnd1会导致原始生殖细胞的迁移受阻,并使PGC过早地分化、凋亡,但体细胞发育不受影响[27]。在斑马鱼中vasa基因是公认的PGCs和生殖细胞的理想标记,可以追踪PGCs在胚胎发育过程中的迁移,揭示成熟卵母细胞的生殖脊位置和胚胎发育过程中PGCs的分布[25]。以上说明dnd1、nanos3对原始生殖细胞的生存和迁移具有重要的调节作用,本研究表明,eomesa基因功能缺失导致了dnd1和nanos3在体节期(12 hpf)的mRNA水平降低(P<0.01),可能阻碍PGCs迁移至生殖脊,进而使卵母细胞的发育受到影响,造成卵巢发育迟缓。
性腺发育相关基因是动物卵巢产生及生长、发育的重要原因,例如cyp17a1、amh和dmrt1等基因共同调节卵巢的正常形成和功能。细胞色素cyp17或p450c17作为性腺类固醇激素、孕激素及糖皮质激素生物合成的关键限速酶,其在调控性腺发育、生殖细胞分化及维持第二性征等方面起到重要的作用[28]。ZHAI等[29]敲除斑马鱼cyp17a1基因后,导致雌性向雄性逆转,雄性的交配行为和第二性征缺失。amh,又称缪勒氏管抑制物,是转化生长因子β(TGF-β)家族成员[30],在雄性和雌性生殖细胞增殖和分化中起到重要作用[31]。在硬骨鱼类中,dmrt1在性腺中的表达量要高于其他组织,并且在很多物种的性腺中发现dmrt1的表达呈性别二态性,表现为雄性特异性或显著的雄性偏向性[32]。林桥洪[33]研究表明,在斑马鱼中dmrt1缺失会导致雄性到雌性的部分性逆转。以上研究表明amh和dmrt1对于斑马鱼正常的性别分化是必不可少的;并协同调控雄性生殖细胞的自我更新、增殖和分化,保证正常的精巢发育及精子形成[33]。此外,斑马鱼的性腺发育及分化比较特殊,在早期阶段全部发育成“类卵巢”结构,可称为雌雄同体时期;在受精后的第40 ~ 50天性腺开始分化;当发育至60天时分化结束,卵巢和精巢形成[34]。本研究表明eomesa功能缺失显著干扰了cyp17a1、amh和dmrt1的表达量,在性腺分化时期,amh基因表达量升高,而cyp17a1表达量降低,这可能是导致本研究中eomesa-/-突变体中雄鱼显著增加的原因。性成熟期eomesa-/-突变体中amh和cyp17a1的表达量都显著低于野生型的表达量,而dmrt1的表达量显著高于野生型的表达量,说明eomesa功能缺失可能通过干扰这些基因的表达,导致卵母细胞的发育受到影响,使性腺发育滞后,并可能使卵子的质量受到影响,致使畸形率偏高。此外,有研究表明cyp17a1对青鳉卵母细胞分化过程中雌二醇的形成具有重要的作用[35],因此eomesa的功能缺失也可能通过影响cyp17a1的表达量,从而影响eomesa-/-雌鱼的交配行为,如排卵,但其仍需进一步研究。
综上所述,本研究通过构建eomesa-/-突变系,从繁殖行为、繁殖性能测定、卵巢组织切片及性腺发育相关基因的表达等方面分析了eomesa功能缺失对雌性斑马鱼生殖的影响,为深入分析eomesa调控斑马鱼雌鱼生殖的分子机制提供了基础。
