葛根及其复方配伍对自身免疫性重症肌无力大鼠骨骼肌Mitofilin、OPA1 蛋白表达的影响
2023-09-19文颖娟杨俊超彭高强王河江仝武宁
陈 茉,文颖娟,杨俊超,彭高强,王河江,仝武宁
(1.陕西中医药大学,陕西 咸阳 712046;2.陕西中医药大学附属渭南市中心医院,陕西 渭南 714000)
重症肌无力(myasthenia gravis,MG) 是一种受自身抗体介导的获得性神经-肌肉接头免疫性疾病[1]。以眼睑下垂、骨骼肌无力、易疲劳为主要临床表现,多采用糖皮质激素、胆碱酯酶抑制剂、免疫球蛋白等药物治疗[2],虽在一定程度上可缓解患者临床症状,但长期用药易发生肝肾功能损害、内分泌系统失衡等一系列不良反应,严重危及患者生命。故选取有效靶点,深层次探析MG 发病与治疗机制,已迫在眉睫。
经研究证实,线粒体与MG 骨骼肌异常密切相关[3]。一方面,当骨骼肌线粒体发生异常,机体自由基产生增加、兴奋性氨基酸释放增多、钙离子超载等,使得异常线粒体过度堆积于体内,出现胞睑下垂、运动障碍等症状;另一方面,若肌肉组织中正常线粒体数目过少,则无法产生足够的能量以维持肌肉的收缩活动,亦会出现四肢无力等临床表现[4]。因此,本研究以骨骼肌线粒体为出发点,研究归脾胃经药物葛根及其复方对骨骼肌线粒体内膜蛋白Mitofilin、视神经萎缩蛋白(optic atrophy 1,OPA1) 的影响,深入探讨自身免疫性重症肌无力 (experimental autoimmune myasthenia gravis,EAMG) 发病与治疗机制,以期为从“脾-肌肉-线粒体” 角度治疗重症肌无力提供科学依据。
1 材料
1.1 动物 SPF 级雌性大鼠80 只,体质量160~180 g,购于四川成都达硕实验动物有限公司[实验动物生产许可证号SCXK (川) 2020-030]。
1.2 药物 葛根组由葛根20 g 组成;葛芪组由葛根20 g、黄芪15 g 组成;葛参组由葛根20 g、丹参15 g 组成;葛妙组由葛根20 g、苍术15 g、黄柏15 g、牛膝15 g、薏苡仁15 g 组成;葛根复方组由葛根20 g、黄芪15 g、丹参15 g、苍术15 g、牛膝15 g、黄柏15 g、薏苡仁15 g 组成。中药饮片均购于陕西中医药大学校医院,按常规煎法分别浓缩成50 mL 药液,大鼠用药量为成人用药的6.25 倍。强的松组采用强的松混悬液,由0.2%羧甲基纤维素钠配制。
1.3 试剂 鼠源性R97~R116 肽段、完全弗氏试剂(complete freund’ s adjuvant,CFA)、不完全弗氏试剂(incomplete freund’ s adjuvant,IFA)、PBS 磷酸缓冲液、2.5% 戊二醛 (货号C8385FE270-1、F5881、F5506、ZLI-9062、P1126,陕西博达生物科技有限公司);ECL 超敏发光试剂盒、Mitofilin 兔抗大鼠多克隆抗体、OPA1 兔抗大鼠多克隆抗体、乙酰胆碱受体抗体 (acetylcholine receptor antibody,AchR-ab) ELISA 试剂盒、电泳液、转膜液、一抗稀释液、二抗稀释液、封闭液 (货号WB0164、BS-1824R、PB0773、ml003131、WB0132、WB0154、WB0158、WB0159、WB0161,西安阿尔宝生物科技有限公司)。
1.4 仪器 超净工作台、165-8001 型垂直电泳槽、170-3930 型Trans-Blot 转印槽(美国Bio-Rad 公司);Multiskan FC550 型酶标仪 (美国Thermo Fisher Scientific 公司);JY88-Ⅱ型超声波细胞破碎仪(宁波新芝生物科技股份有限公司)、SH01D 型高速台式离心机(上海知信实验仪器技术有限公司)。
2 方法
2.1 模型建立 将80 只大鼠按照随机数字表法分为空白组、模型组、葛根组、葛芪组、葛参组、葛妙组、葛根复方组、强的松组,每组10 只,除空白组外,其余7 组均参考文献[5] 报道方法复制EAMG 模型。将鼠源性R97~R116 肽段、CFA、PBS 按照1 ∶1.5 ∶1.5 比例充分混匀制成免疫乳剂,取乳剂200 μL 于大鼠足垫、腹部、背部多点皮下注射;首次免疫后30、45 d,将三者再次按照1 ∶3 ∶3比例充分混匀制成免疫乳剂后,取乳剂200 μL 强化接种。空白组则在同一时间段注射等量PBS。观察大鼠进食量、饮水量、毛色以及体质量(每周称量3 次) 变化。
2.2 分组及给药 最后1 次造模2 d 后进行灌胃给药,各组给药剂量分别为葛根组2.08 g/kg、葛芪组3.65 g/kg、葛参组3.65 g/kg、葛妙组8.33 g/kg、葛根复方组11.46 g/kg,强的松组5.4 mg/kg;空白组和模型组灌胃给予等量生理盐水,每天1 次,连续给药4 周。
2.3 血清IFN-γ、IL-4 水平检测 分别于造模后2 周和给药结束24 h 后,大鼠体外静脉取血,检测血清中干扰素γ(interferon γ,IFN-γ) 和白细胞介素4 (interleukin 4,IL-4) 水平。
2.4 大鼠腓肠肌肌电平均振幅变化 仰卧位固定大鼠,通过针电极将地线固定于大鼠尾部,沿肌纤维走行于记录电极旁开3~5 mm 处缓慢插入另一单极针作为参考电极,给予0.5~1 Hz 电流刺激强度,分别于造模后2 周和灌胃给药结束24 h 后,采用MPA2000 软件进行肌电振幅变化分析。
2.5 血清AchR-ab 水平检测 给药结束24 h 后麻醉大鼠,腹主动脉取血,3 000 r/min 离心15 min,分离得血清,于-20 ℃保存,严格按照AchR-ab ELISA 试剂盒说明书检测血清AchR-ab 水平。
2.6 骨骼肌线粒体超微结构观察 处死大鼠后迅速分离坐骨神经,取胫骨前肌分支,利用锋利刀片修成2 mm×2 mm×2 mm 大小块,浸泡于2.5%戊二醛磷酸盐缓冲液中4 ℃固定2 h,再浸于1%四氧化锇液中固定1 h,脱水包埋后,切成约50 nm 厚度,以铅、铀染色,于透射电镜下观察。
2.7 Western blot 法检测Mitofilin、OPA1 蛋白表达 处死大鼠后迅速分离大鼠胫骨前肌,剪切成细小碎片,匀浆、裂解,离心后取上清液,检测蛋白浓度。经制胶、上样、电泳、转膜、脱脂奶粉封闭,加入稀释后的一抗 (1 ∶1 000) 4 ℃孵育过夜,洗涤条带,加入二抗(1 ∶500) 室温孵育显影,采用Image-Pro Plus 软件分析灰度值,以βactin 条带灰度值为参照,计算目的蛋白Mitofilin、OPA1 相对表达。
2.8 统计学分析 通过SPSS 25.0 软件进行处理,数据以(±s) 表示,符合正态分布数据采用t检验和方差分析;非正态分布数据则采用秩和检验。P<0.05 表示差异有统计学意义。
3 结果
3.1 葛根及其复方配伍对EAMG 大鼠体质量的影响 如表1 所示,首次免疫前各组体质量均无显著差异 (P>0.05)。免疫后第4 周(给药前),模型组和各给药组大鼠体质量低于空白组(P<0.01);免疫后第6 周(给药第2周),模型组和各给药组大鼠体质量低于空白组 (P<0.01),且各给药组大鼠体质量与模型组比较无显著差异(P>0.05);免疫后第8 周(给药第4 周),模型组大鼠体质量低于空白组(P<0.01),各给药组大鼠体质量高于模型组(P<0.01)。
表1 葛根及其复方配伍对EAMG 大鼠体质量的影响(g,±s,n=10)
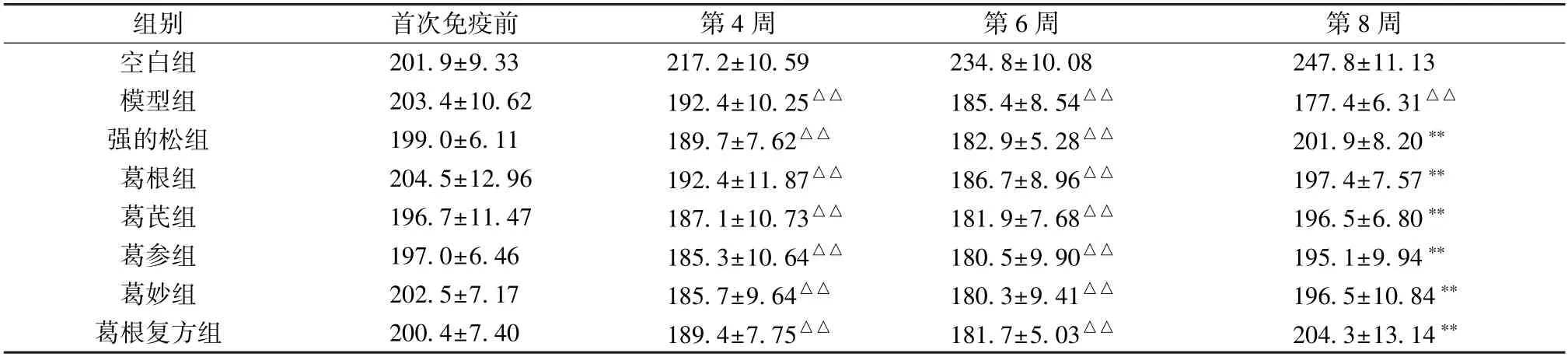
表1 葛根及其复方配伍对EAMG 大鼠体质量的影响(g,±s,n=10)
注:与空白组比较,△△P<0.01;与模型组比较,**P<0.01。
组别首次免疫前第4 周第6 周第8 周空白组201.9±9.33217.2±10.59234.8±10.08247.8±11.13模型组203.4±10.62192.4±10.25△△185.4±8.54△△177.4±6.31△△强的松组199.0±6.11189.7±7.62△△182.9±5.28△△201.9±8.20**葛根组204.5±12.96192.4±11.87△△186.7±8.96△△197.4±7.57**葛芪组196.7±11.47187.1±10.73△△181.9±7.68△△196.5±6.80**葛参组197.0±6.46185.3±10.64△△180.5±9.90△△195.1±9.94**葛妙组202.5±7.17185.7±9.64△△180.3±9.41△△196.5±10.84**葛根复方组200.4±7.40189.4±7.75△△181.7±5.03△△204.3±13.14**
3.2 葛根及其复方配伍对EAMG 大鼠血清IFN-γ、IL-4 水平的影响 如表2 所示,给药前,与空白组比较,模型组和各给药组大鼠血清IFN-γ、IL-4 水平均升高(P<0.01);给药后,与模型组比较,各给药组大鼠血清IFN-γ、IL-4 水平均降低(P<0.01)。
表2 EAMG 大鼠各组IFN-γ、IL-4 变化测定(pg/mL,±s,n=10)
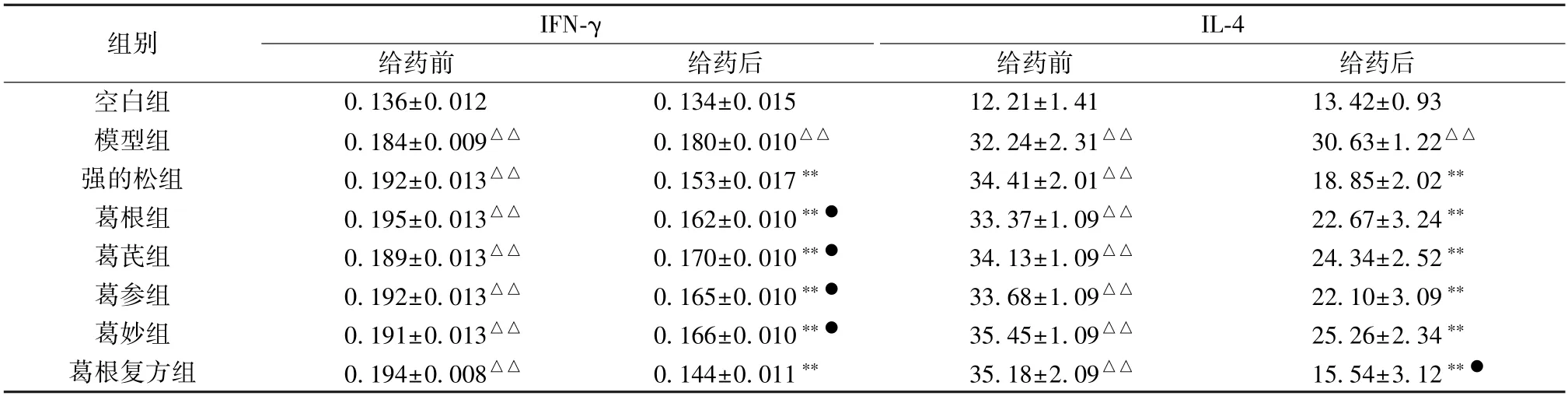
表2 EAMG 大鼠各组IFN-γ、IL-4 变化测定(pg/mL,±s,n=10)
注:与空白组比较,△△P<0.01;与模型组比较,**P<0.01;与强的松组比较,●P<0.05。
组别IL-4给药前给药后给药前给药后IFN-γ空白组0.136±0.0120.134±0.01512.21±1.4113.42±0.93模型组0.184±0.009△△0.180±0.010△△32.24±2.31△△30.63±1.22△△强的松组0.192±0.013△△0.153±0.017**34.41±2.01△△18.85±2.02**葛根组0.195±0.013△△0.162±0.010**●33.37±1.09△△22.67±3.24**葛芪组0.189±0.013△△0.170±0.010**●34.13±1.09△△24.34±2.52**葛参组0.192±0.013△△0.165±0.010**●33.68±1.09△△22.10±3.09**葛妙组0.191±0.013△△0.166±0.010**●35.45±1.09△△25.26±2.34**葛根复方组0.194±0.008△△0.144±0.011**35.18±2.09△△15.54±3.12**●
3.3 葛根及其复方配伍对EAMG 大鼠腓肠肌肌电平均振幅的影响 如表3 所示,给药前,与空白组比较,EAMG 大鼠腓肠肌肌电平均振幅降低(P<0.01);给药4 周后,与模型组比较,各给药组大鼠腓肠肌肌电平均振幅升高(P<0.01),其中以强的松组和葛根复方组升高最为显著。
表3 葛根及其复方配伍对EAMG 大鼠腓肠肌肌电平均振幅的影响(μV,±s,n=10)

表3 葛根及其复方配伍对EAMG 大鼠腓肠肌肌电平均振幅的影响(μV,±s,n=10)
注:与空白组比较,△△P<0.01;与模型组比较,**P<0.01;与强的松组比较,●P<0.05。
组别给药前给药后空白组19.7±1.319.3±1.0模型组6.2±0.9△△6.5±0.4△△强的松组4.7±0.8△△16.9±0.3**葛根组5.4±0.3△△14.1±0.5**葛芪组5.9±0.2△△13.5±0.7**葛参组6.2±0.5△△14.9±0.4**葛妙组6.0±0.3△△13.1±0.6**葛根复方组5.5±0.5△△17.7±0.7**●
3.4 葛根及其复方配伍对EAMG 大鼠血清AchR-ab 水平的影响 如表4 所示,与空白组比较,模型组大鼠血清AchRab 水平升高(P<0.01);与模型组比较,各给药组大鼠血清AchR-ab 水平降低(P<0.01),其中以葛妙组、强的松组、葛根复方组最为显著。
表4 葛根及其复方配伍对EAMG 大鼠血清AchR-ab 水平的影响(±s,n=10)
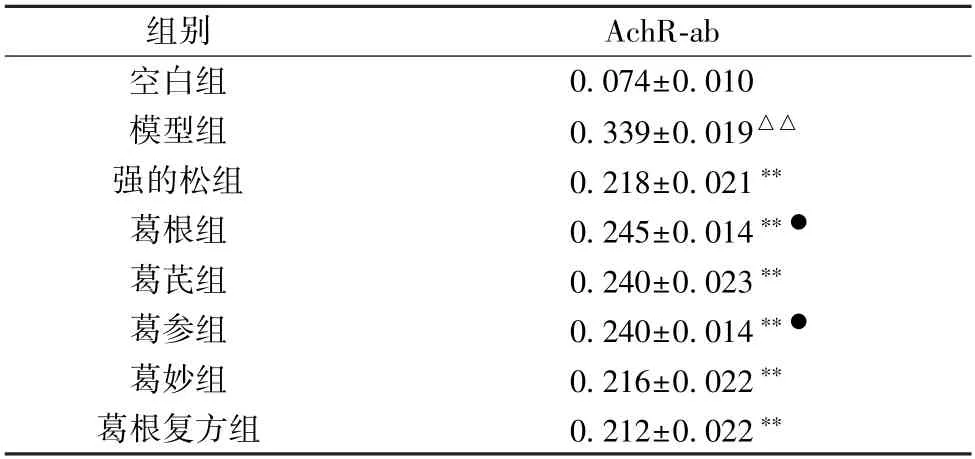
表4 葛根及其复方配伍对EAMG 大鼠血清AchR-ab 水平的影响(±s,n=10)
注:与空白组比较,△△P<0.01;与模型组比较,**P<0.01;与强的松组比较,●P<0.05。
组别AchR-ab空白组0.074±0.010模型组0.339±0.019△△强的松组0.218±0.021**葛根组0.245±0.014**●葛芪组0.240±0.023**葛参组0.240±0.014**●葛妙组0.216±0.022**葛根复方组0.212±0.022**
3.5 葛根及其复方配伍对EAMG 大鼠骨骼肌线粒体超微结构的影响 如图1 所示,正常情况下,骨骼肌线粒体呈线状或杆状,均匀分布于Z 线两侧,双层核膜清晰完整,内嵴膜结构清晰,排列规则,基质分布均匀,线粒体无肿胀或空泡变性形态。与空白组比较,模型组可见线粒体肿胀明显,甚至出现线粒体空泡变性,内嵴排列紊乱、断裂,部分可见内嵴溶解消失;与模型组比较,各给药组线粒体肿胀程度减弱,线粒体数目增多,内嵴排列较为整齐,未见明显空泡化。

图1 各组大鼠线粒体超微结构示意图(×30 000)
3.6 葛根及其复方配伍对EAMG 大鼠骨骼肌线粒体塑性蛋白表达的影响 与空白组比较,模型组大鼠骨骼肌线粒体Mitofiln、OPA1 蛋白表达降低(P<0.05);与模型组比较,各给药组大鼠骨骼肌Mitofilin、OPA1 蛋白表达升高(P<0.05),其中以葛根复方组和强的松组的变化情况最为显著,见图2、表5。
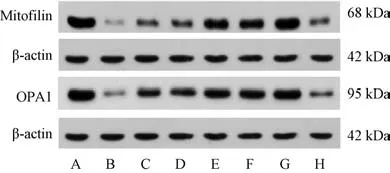
图2 各组大鼠骨骼肌Mitofilin、OPA1 蛋白电泳图
表5 葛根及其复方配伍对EAMG 大鼠骨骼肌Mitofilin、OPA1 蛋白表达的影响(±s,n=5)
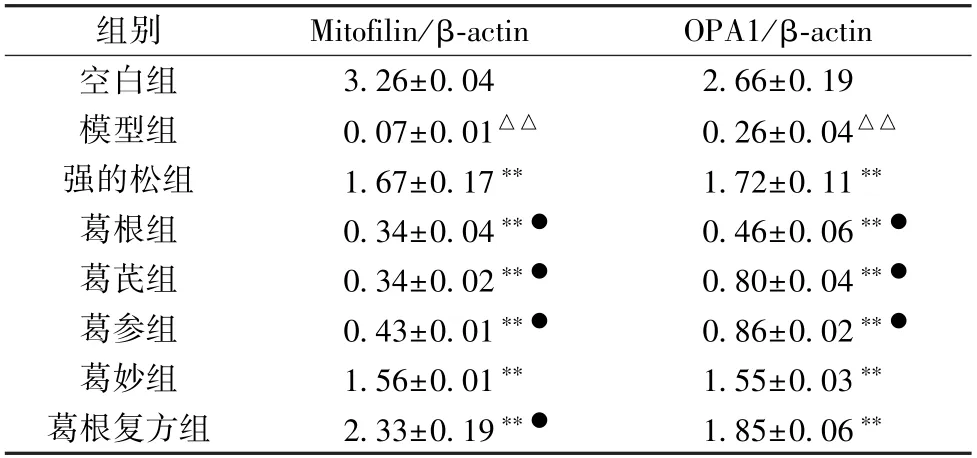
表5 葛根及其复方配伍对EAMG 大鼠骨骼肌Mitofilin、OPA1 蛋白表达的影响(±s,n=5)
注:与空白组比较,△△P<0.01;与模型组比较,**P<0.01;与强的松组比较,●P<0.05。
组别Mitofilin/β-actinOPA1/β-actin空白组3.26±0.042.66±0.19模型组0.07±0.01△△0.26±0.04△△强的松组1.67±0.17**1.72±0.11**葛根组0.34±0.04**●0.46±0.06**●葛芪组0.34±0.02**●0.80±0.04**●葛参组0.43±0.01**●0.86±0.02**●葛妙组1.56±0.01**1.55±0.03**葛根复方组2.33±0.19**●1.85±0.06**
4 讨论
重症肌无力属中医“痿证” 范畴。《素问·痿论》言:“脾主肌肉”,《脾胃论》 中亦提到:“脾胃俱旺,则能食而肥;脾胃俱虚,则不能食而瘦……脾虚则肌肉削”。强调脾胃作为气血生化之源,滋养全身。全身健壮的体现首先来自气血充盛,其次来自肌肉强健。肌肉为气血所养,气血为脾胃所化,脾胃强盛则肌肉强健。葛根为根,根主上升,甘味入脾,能补脾胃之气,脾胃气盛则肌肉力强,辛则散表,升举阳气,解其肌腠。国家级名老中医裘昌林[6]、周仲瑛[7]、李声岳[8]、刘友章[9]等均以葛根配伍治疗重症肌无力,临床疗效确切。前期实验研究亦证实,葛根及其复方配伍通过调节氮自由基(RNS) 衰减水平以及ATP 酶活性等恢复EAMG 大鼠心肌、平滑肌、胸腺组织线粒体正常功能,有效降低AchR-ab 表达[10-14]。因此,本实验仍以葛根为主药,以期能够明确葛根及其复方配伍对EAMG 大鼠骨骼肌线粒体的调控机制。
线粒体嵴是保障线粒体正常功能的重要结构之一[15],嵴连接点 (crista junctions,CJs) 可能通过Mitofilin 和OPA1 之间的相互作用[16]参与线粒体氧化磷酸化,完成线粒体塑性,实现线粒体生物合成[17-18]。研究发现,重症肌无力患者体内OPA1 蛋白失活,线粒体管状网络结构裂解,出现线粒体过度分裂[19],而通过上调神经肌肉病变小鼠线粒体内Mitofilin 蛋白表达,能够有效提升OPA1 蛋白表达,恢复线粒体形态功能[20]。此外,细胞因子IFN-γ 和IL-4 能够通过调节B 细胞,干预AchR-ab 表达[21]。在EAMG 模型中,若IL-4 过度表达,将刺激Th1 细胞大量分泌IFN-γ,导致骨骼肌运动终板发生超敏反应,诱发或加重MG 临床症状[22-23]。通过降低IFN-γ 和IL-4 水平,可有效减弱乙酰胆碱受体抗体浓度,起到积极的治疗作用[24-25]。
本研究证实,葛根及其复方配伍可通过上调线粒体塑性蛋白Mitofilin、OPA1 表达,干预线粒体内嵴形态,有效调节AchR-ab、IFN-γ、IL-4 水平,提高腓肠肌肌力水平,一定程度上恢复EAMG 大鼠骨骼肌线粒体正常功能。而葛根及其复方配伍能否通过影响线粒体塑性蛋白表达,调控EAMG 大鼠线粒体动力学相关蛋白表达,影响线粒体生物合成,仍有待进一步证实。
