雷公藤多苷片对类风湿关节炎合并间质性肺病患者的临床疗效
2023-09-19黄传兵朱子衡马熙檬李方泽胡赛赛陈莹莹
李 舒,万 磊,刘 健,黄传兵,朱子衡,马熙檬,程 静,李方泽,胡赛赛,陈莹莹
(安徽中医药大学第一附属医院,安徽 合肥 230031)
类风湿关节炎是一种以慢性关节病变为主的自身免疫系统性疾病[1],除关节表现外,常累及皮肤、肺、肾、眼等关节外器官,其中肺因含有丰富的结缔组织和血管而更容易波及,肺间质性病变是类风湿关节炎累及肺部的最常见病变[2],患者死亡风险是无间质性肺病累及的3 倍[3]。间质性肺病常出现在类风湿关节炎早期,发病初期除关节症状外无明显其他不适,并且肺部病变可先于关节表现,当发现时往往已进展至较重阶段,故本病早期诊断与治疗非常重要。目前,肺功能测试(PFT)适合疾病进展期的病情评估[4],而肺部高分辨率薄层平扫CT (HRCT) 对间质性肺病的早期诊断敏感[5]。
临床上,大多以糖皮质激素联合免疫抑制剂来治疗类风湿关节炎合并间质性肺病[6],但激素不良反应多,治疗类风湿关节炎的常规药物甲氨蝶呤可致间质性肺病[7],并且随着病情进展免疫抑制剂剂量增加,导致肺部有严重感染风险[8]。雷公藤多苷源于具有祛风解毒、消肿通络功效的雷公藤,不良反应少,本研究考察雷公藤多苷片对类风湿关节炎合并间质性肺病患者的临床疗效及对HRCT 定量评分、关节和肺部证候、免疫炎症、肺功能、生活质量的影响,现报道如下。
1 资料与方法
1.1 一般资料 2019 年12 月至2021 年12 月收治于安徽中医药大学第一附属医院风湿病科的90 例类风湿关节炎合并间质性肺病患者,随机数字表法分为对照组和观察组,每组45 例,2 组一般资料见表1,可知差异无统计学意义(P>0.05),具有可比性。研究经医院伦理委员会批准 (批号2019AH-12)。
表1 2 组一般资料比较(±s,n=45)Tab.1 Comparison of general data between the two groups (±s,n=45)
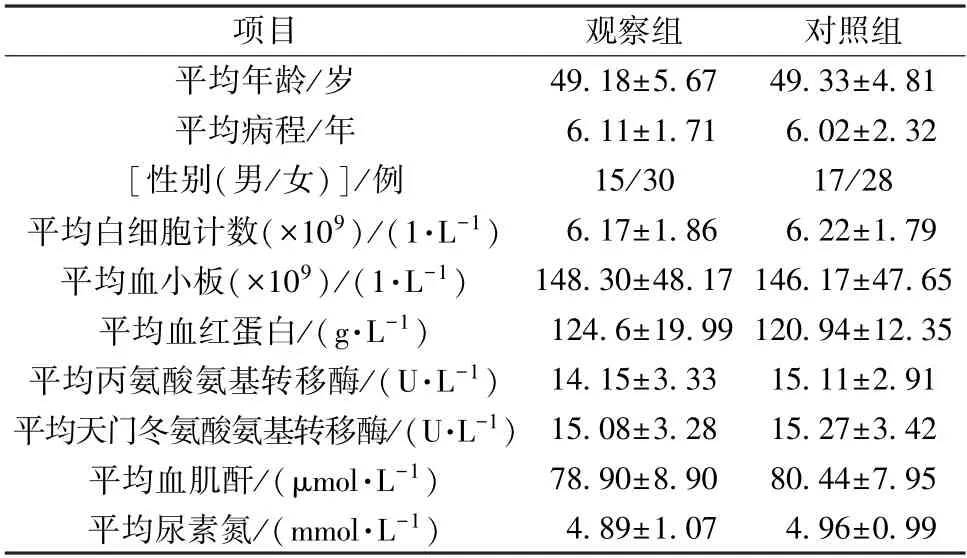
表1 2 组一般资料比较(±s,n=45)Tab.1 Comparison of general data between the two groups (±s,n=45)
项目观察组对照组平均年龄/岁49.18±5.6749.33±4.81平均病程/年6.11±1.716.02±2.32[性别(男/女)]/例15/3017/28平均白细胞计数(×109)/(1·L-1)6.17±1.866.22±1.79平均血小板(×109)/(1·L-1)148.30±48.17 146.17±47.65平均血红蛋白/(g·L-1)124.6±19.99 120.94±12.35平均丙氨酸氨基转移酶/(U·L-1)14.15±3.3315.11±2.91平均天门冬氨酸氨基转移酶/(U·L-1) 15.08±3.2815.27±3.42平均血肌酐/(μmol·L-1)78.90±8.9080.44±7.95平均尿素氮/(mmol·L-1)4.89±1.074.96±0.99
1.2 诊断标准 类风湿关节炎参考2010 年美国风湿病学会(ACR) 提出的最新分类标准、评分系统[9],间质性肺病参考2015 年美国胸科协会(AST)/欧洲呼吸协会(ERS) 标准[10]。
1.3 纳入标准 (1) 符合“1.2” 项下诊断标准;(2) 年龄18~75 岁;(3) 遵医嘱坚持服药,依从性好;(4) 患者了解本研究,签署知情同意书。
1.4 排除标准 (1) 合并心血管、肝脏、肾脏、造血系统等严重疾病,以及除间质性肺病以外的其他严重肺部疾病;(2) 有精神疾病;(3) 孕妇或哺乳期妇女。
1.5 治疗手段
1.5.1 对照组 采用来氟米特(福建汇天生物药业有限公司,国药准字H20050175,10 mg/片) 口服,每天1 次,每次1 片,疗程12 周。
1.5.2 观察组 在对照组基础上采用雷公藤多苷片(湖南千金协力药业有限公司,国药准字Z43020138,10 mg/片) 口服,每天3 次,每次2片,疗程12 周。
1.6 疗效评价 根据美国风湿病学会(ACR)[11]标准,包括临床症状改善20% (ACR20)、临床症状改善50% (ACR50)、临床症状改善70%(ACR70),以<ACR20 为无效。
1.7 指标检测
1.7.1 HRCT 定量评分 双肺分区以右下肺静脉、主动脉弓为界线,分为6 个区[12],根据弥漫性结节影、磨玻璃样变、肺泡实变、小叶间隔增厚、胸膜下线、网格影伴囊腔形成或蜂窝状改变程度分为0、1、2、3、4、5 分,总分即为HRCT 定量评分,满分30 分[13]。
1.7.2 中医证候评分 参照《中药新药临床研究指导原则(试行) 》[14],记录治疗前后关节、肺部证候变化并评分,其中关节证候包括关节疼痛、关节肿胀、关节压痛、关节晨僵持续时间,分为4级;肺部证候评包括干咳、咳痰、胸闷、气短,也分为4 级,均分别计为0、3、6、9 分。
1.7.3 实验室指标 (1) 治疗前后以血沉管(黑管) 采集患者空腹前臂静脉血各3 mL,采用Vital Monitor-20 全自动血沉分析仪检测血沉(ESR);(2) 治疗前后以生化管(黄管) 采集患者空腹前臂静脉血各5 mL,在3~5 ℃下低温凝固,4 000 r/min 离心15 min,分离血清,置于-80 ℃冰箱中保存,采用HITACHI7600-020 全自动生化分析仪检测超敏C 反应蛋白(hs-CRP)、类风湿因子(RF)、免疫球蛋白 (IgA、IgG、IgM)、补体(C3、C4) 水平;(3) 治疗前后以生化管(黄管)采集患者空腹前臂静脉血各5 mL,在3~5 ℃下低温凝固,4 000 r/min 离心15 min,分离血清,置于-80 ℃冰箱中保存,采用酶联免疫吸附(ELISA) 法检测肿瘤坏死因子-α (TNF-α)、白介素-10 (IL-10) 水平,相关试剂盒均购自武汉基因美生物科技有限公司(批号GR202212ab)。
1.7.4 肺功能指标 采用CHEST 8800D 肺功能仪(日本CHEST 公司) 检测,包括肺活量 (VC)、肺总量(TLC)、第1 秒用力呼吸容积(FEV1)、用力肺活量 (FVC)、用力呼气1 s 率 (FEV1/FVC)、一氧化碳弥散量(DLco),均以实测值占预计值的比例表示,大于80%为正常。
1.7.5 生活质量 采用国际普适生活质量量表(SF-36) 进行评价,分为8 个维度,包括生理机能(PF)、生理职能(RP)、躯体疼痛(BP)、一般健康状况(GH)、精力(VT)、社会功能(SF)、情感职能(RE)、精神健康 (MH),分值越高,生活质量越高,调查问卷由患者独立完成,并要求根据其实际情况、真实感受填写,对于填写困难者则口述答案,由调查者代为填写。
1.7.6 不良反应发生率 每周检测血常规、肝肾功能、二便常规、心电图,记录治疗期间是否出现肝肾功能损害、恶心呕吐、皮疹、脱发等不良反应,计算其发生率。
1.8 统计学分析 通过SPSS 23.0 软件进行处理(双侧检验),计量资料以(±s) 表示,满足正态性者组间比较采用t检验,不符合正态性者组间比较采用秩和检验;计数资料以百分率表示,组间比较采用卡方检验或非参数检验。以P<0.05 为差异具有统计学意义。
2 结果
2.1 脱落情况 本研究无病例脱落,均完成随访。
2.2 临床疗效 表2 显示,观察组ACR50 高于对照组(P<0.05)。
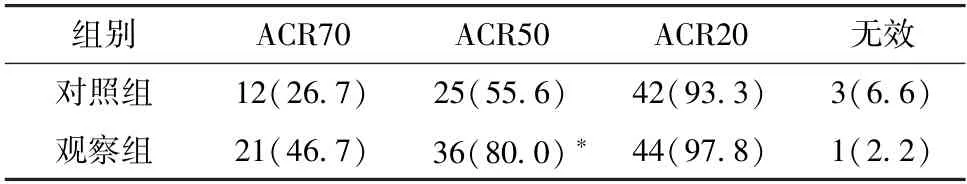
表2 2 组ACR20/50/70 比较[例(%),n=45]Tab.2 Comparison of ACR20/50/70 between the two groups [case (%),n=45]
2.3 HRCT 定量评分 治疗前,对照组、观察组HRCT 定量评分分别为(10.04±2.96)、(9.24±3.09) 分,差异无统计学意义(P>0.05),具有可比性。治疗后,2 组HRCT 定量评分降低(P<0.05),分别为(7.80±1.04)、(5.67±1.64) 分(P<0.05),以观察组更明显(P<0.05)。
2.4 中医证候评分 表3 显示,治疗后,对照组关节疼痛、关节肿胀、咳痰评分降低(P<0.05),观察组关节疼痛、关节肿胀、关节压痛、关节晨僵、咳痰、胸闷、气短评分降低(P<0.05),并且观察组关节疼痛、关节肿胀、关节压痛、关节晨僵、胸闷、气短评分低于对照组(P<0.05)。
表3 2 组中医证候评分比较(分,±s,n=45)Tab.3 Comparison of TCM syndrome scores between the two groups (score,±s,n=45)
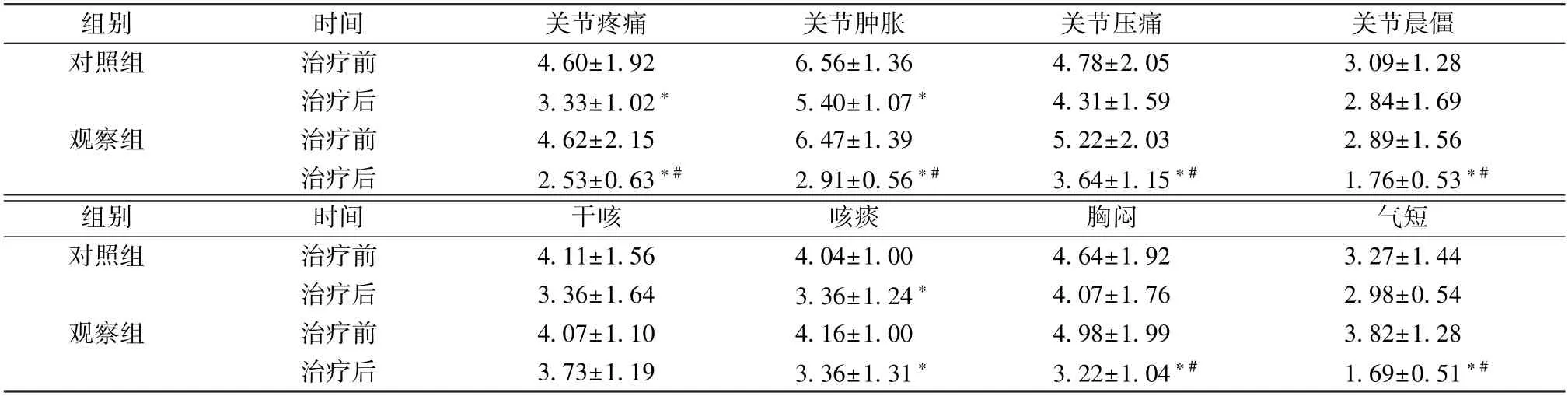
表3 2 组中医证候评分比较(分,±s,n=45)Tab.3 Comparison of TCM syndrome scores between the two groups (score,±s,n=45)
注:与同组治疗前比较,*P<0.05;与对照组治疗后比较,#P<0.05。
组别时间关节疼痛关节肿胀关节压痛关节晨僵对照组治疗前4.60±1.926.56±1.364.78±2.053.09±1.28治疗后3.33±1.02*5.40±1.07*4.31±1.592.84±1.69观察组治疗前4.62±2.156.47±1.395.22±2.032.89±1.56治疗后2.53±0.63*#2.91±0.56*#3.64±1.15*#1.76±0.53*#组别时间干咳咳痰胸闷气短对照组治疗前4.11±1.564.04±1.004.64±1.923.27±1.44治疗后3.36±1.643.36±1.24*4.07±1.762.98±0.54观察组治疗前4.07±1.104.16±1.004.98±1.993.82±1.28治疗后3.73±1.193.36±1.31*3.22±1.04*#1.69±0.51*#
2.5 实验室指标比较 表4 显示,治疗后,对照组ESR 及hs-CRP、RF、TNF-α 水平降低 (P<0.05);观察组ESR 及hs-CRP、RF、IgM、TNF-α水平降低(P<0.05),IL-10 水平升高(P<0.05),并且观察组ESR 及hs-CRP、RF、IgM、TNF-α 水平低于对照组,IL-10 水平更高(P<0.05)。
表4 2 组实验室指标比较(±s,n=45)Tab.4 Comparison of laboratory indices between the two groups (±s,n=45)
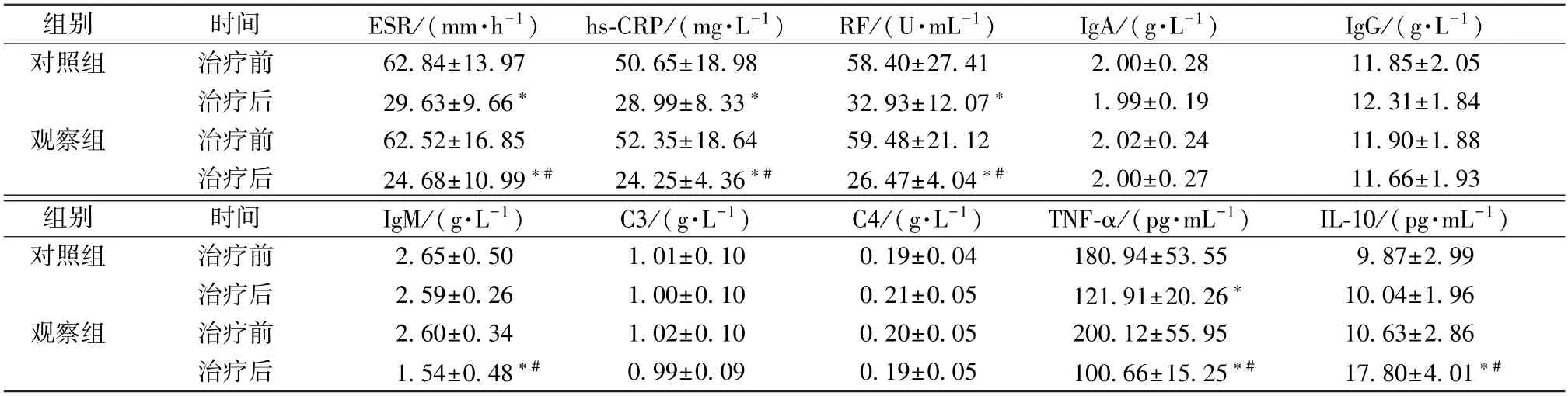
表4 2 组实验室指标比较(±s,n=45)Tab.4 Comparison of laboratory indices between the two groups (±s,n=45)
注:与同组治疗前比较,*P<0.05;与对照组治疗后比较,#P<0.05。
组别时间ESR/(mm·h-1)hs-CRP/(mg·L-1)RF/(U·mL-1)IgA/(g·L-1)IgG/(g·L-1)对照组治疗前62.84±13.9750.65±18.9858.40±27.412.00±0.2811.85±2.05治疗后29.63±9.66*28.99±8.33*32.93±12.07*1.99±0.1912.31±1.84观察组治疗前62.52±16.8552.35±18.6459.48±21.122.02±0.2411.90±1.88治疗后24.68±10.99*#24.25±4.36*#26.47±4.04*#2.00±0.2711.66±1.93组别时间IgM/(g·L-1)C3/(g·L-1)C4/(g·L-1)TNF-α/(pg·mL-1)IL-10/(pg·mL-1)对照组治疗前2.65±0.501.01±0.100.19±0.04180.94±53.559.87±2.99治疗后2.59±0.261.00±0.100.21±0.05121.91±20.26*10.04±1.96观察组治疗前2.60±0.341.02±0.100.20±0.05200.12±55.9510.63±2.86治疗后1.54±0.48*#0.99±0.090.19±0.05100.66±15.25*#17.80±4.01*#
2.6 肺功能指标 表5 显示,治疗后,观察组VC、TLC、FVC、DLco 升高 (P<0.05),并且DLco 高于对照组(P<0.05)。
表5 2 组肺功能指标比较(±s,n=45)Tab.5 Comparison of pulmonary function indices between the two groups (±s,n=45)
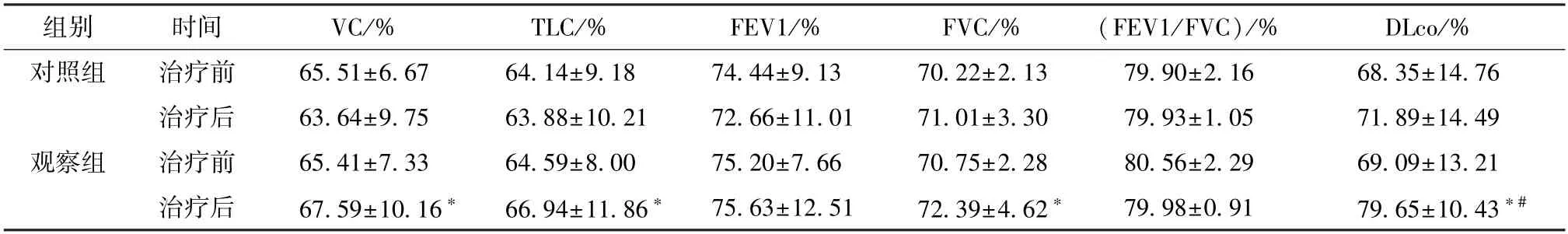
表5 2 组肺功能指标比较(±s,n=45)Tab.5 Comparison of pulmonary function indices between the two groups (±s,n=45)
注:与同组治疗前比较,*P<0.05;与对照组治疗后比较,#P<0.05。
组别时间VC/%TLC/%FEV1/%FVC/%(FEV1/FVC)/%DLco/%对照组治疗前65.51±6.6764.14±9.1874.44±9.1370.22±2.1379.90±2.1668.35±14.76治疗后63.64±9.7563.88±10.2172.66±11.0171.01±3.3079.93±1.0571.89±14.49观察组治疗前65.41±7.3364.59±8.0075.20±7.6670.75±2.2880.56±2.2969.09±13.21治疗后67.59±10.16*66.94±11.86*75.63±12.5172.39±4.62*79.98±0.9179.65±10.43*#
2.7 生活质量 表6 显示,治疗后,对照组PF、BP 评分升高(P<0.05),观察组PF、SF、BP、VT 评分升高(P<0.05),并且观察组SF、VT 评分高于对照组(P<0.05)。
表6 2 组生活质量比较(分,±s,n=45)Tab.6 Comparison of life qualities between the two groups (score,±s,n=45)
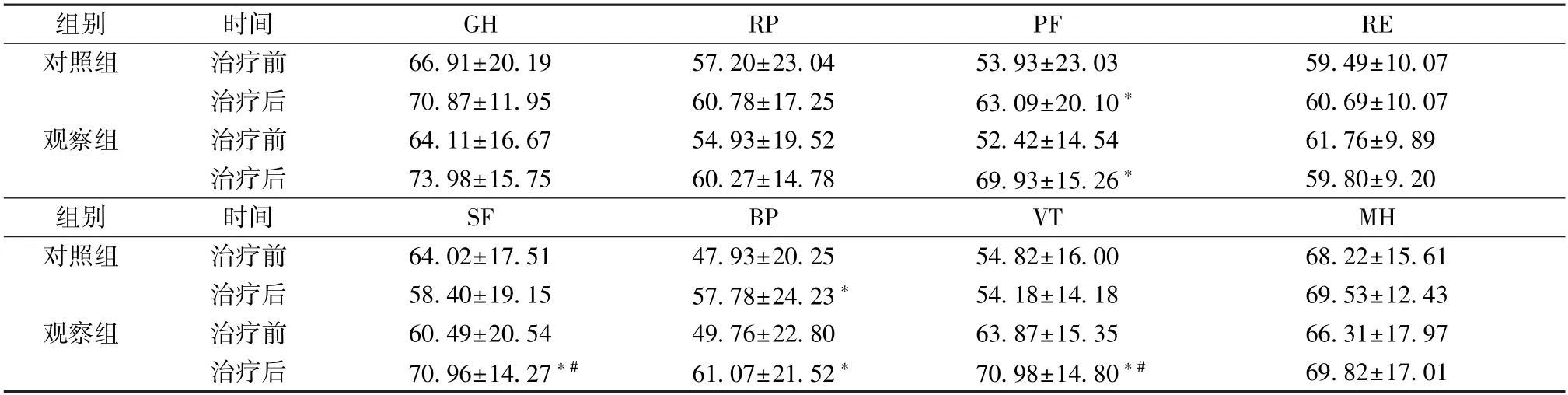
表6 2 组生活质量比较(分,±s,n=45)Tab.6 Comparison of life qualities between the two groups (score,±s,n=45)
注:与同组治疗前比较,*P<0.05;与对照组治疗后比较,#P<0.05。
组别时间GHRPPFRE对照组治疗前66.91±20.1957.20±23.0453.93±23.0359.49±10.07治疗后70.87±11.9560.78±17.2563.09±20.10*60.69±10.07观察组治疗前64.11±16.6754.93±19.5252.42±14.5461.76±9.89治疗后73.98±15.7560.27±14.7869.93±15.26*59.80±9.20组别时间SFBPVTMH对照组治疗前64.02±17.5147.93±20.2554.82±16.0068.22±15.61治疗后58.40±19.1557.78±24.23*54.18±14.1869.53±12.43观察组治疗前60.49±20.5449.76±22.8063.87±15.3566.31±17.97治疗后70.96±14.27*#61.07±21.52*70.98±14.80*#69.82±17.01
2.8 不良反应发生率 治疗期间,对照组出现2例肝功能异常,1 例白细胞减低;观察组出现2 例白细胞降低,1 例肝功能异常,1 例口腔溃疡,2组不良反应发生率(6.67%、8.89%) 比较,差异无统计学意义(P>0.05)。
3 讨论
肺部受累为类风湿关节炎常见的并发症之一,可表现为弥漫性肺间质纤维化、胸膜病变、肺血管炎等,导致肺功能发生变化[15]。类风湿关节炎合并间质性肺病可归属于中医“肺痹” 范畴,晚期可发展为“肺痿”。雷公藤多苷是从雷公藤植物根中提取精制的成分,具有祛风解毒、除湿消肿、舒筋通络功效,雷公藤多苷片既保留了原药材的免疫抑制作用,又去除了许多毒性成分,方中有效成分雷公藤甲素具有抑制炎症反应、免疫抑制、诱导淋巴细胞凋亡、抑制血管增生和保护软骨等作用[16-17]。本研究发现,观察组ACR50 改善有效率明显高于对照组,关节疼痛、关节肿胀、关节压痛、关节晨僵、胸闷、气短评分降低程度更明显,ESR、hs-CRP、RF 水平改善程度更优。
抗炎细胞因子IL-10 水平升高时,可抑制Thl细胞因子增殖、合成及B 淋巴细胞分化,导致免疫球蛋白、免疫复合物的形成减少,补体系统激活状态受抑制,从而减少炎性细胞对关节滑膜、骨及肺组织的刺激[18],还可抑制早期肺间质纤维化的炎症反应,减少肺泡炎程度,缓解对肺组织的损伤[19]。TNF-α 在肺纤维化发展中起着重要作用[20-21]。本研究发现,观察组在降低IgM、促炎因子TNF-α 水平,升高抗炎因子IL-10 水平方面优于对照组,HRCT 定量评分更低,肺功能参数VC、TLC、FVC、DLco 改善程度更明显;治疗后,观察组PF、SF、BP、VT 评分升高明显,其中SF、VT评分高于对照组。
综上所述,雷公藤多苷片可调节类风湿关节炎合并间质性肺病患者免疫炎症,改善关节和肺部炎症、肺通气功能、弥散功能,从而提高临床疗效、生活质量,安全性较高。但本研究存在样本量少、随访时间短等局限,并且对患者是否可长期耐受及相应药物不良反应仍需作进一步观察。今后,课题组将进行多中心、大样本量、双盲随机对照研究,明确雷公藤多苷片优势环节,以期为中医药治疗类风湿关节炎合并间质性肺病提供更有力的证据。
