扩大标准供者和标准供者供肾异体肾移植术后早期疗效及安全性对比*
2023-09-19雷中杰吴凯军梁思敏
雷中杰,李 茂,吴凯军,梁思敏
(重庆医科大学附属第一医院泌尿外科,重庆 400016)
终末期肾病(end stage renal disease,ESRD)是全球面临的一种重大慢性疾病,是各种肾脏疾病引起的肾脏功能不可逆衰退的终末阶段,严重威胁人类身心健康,患者只能依赖肾脏替代治疗(renal replacement therapy,RRT),包括异体肾移植、血液透析和腹膜透析来维持生命。其中,异体肾移植是ESRD患者的首选治疗方法。然而,可移植的肾脏供应量逐渐趋于稳定,相当大一部分患者在长期透析等待肾源的过程中死亡[1]。研究报道,美国只有约1/4的候补患者能在5年内接受心脑死亡供者肾移植,器官丢弃率达20.1%[2]。同时,由于人口逐渐老龄化,高龄供者与受者的占比逐渐升高,加之人群罹患高血压、糖尿病等慢性疾病的基数增加,导致公民逝世后器官捐献(donation after citizen’s death,DCD)中扩大标准供者(expanded criteria donor,ECD)占比逐渐升高。因此,在DCD中如何纳入更多的符合临床标准的供肾是一个重要的研究内容,ECD供肾的纳入使用,无疑可挽救大量患者的生命。
ECD存在不利于移植物存活的各种因素,包括供者高龄、长期高血压病史、长期糖尿病史、冷缺血时间>36 h等。按照美国器官共享网络(United Network on Organ Sharing,UNOS),ECD的纳入标准为年龄≥60岁,或年龄50~59岁且符合以下3项中的2项或以上:(1)死因为脑血管意外;(2)既往有高血压病史;(3)捐献前血肌酐>132.6 μmol/L。美国目前ECD供肾在尸体供肾移植的占比不到20%[3]。根据既往研究,ECD较标准供者(standard criteria donor,SCD)供肾移植增加了70%的失败风险(RR=1.70)[4]。另有研究表明,40岁以上、等待时间长或长期透析治疗但存活率低的ESRD患者,在接受ECD供肾移植后获得了明显的存活优势,且随着等待时间的持续增加,ECD供肾移植产生的生存益处更多[5]。为了在使用ECD缓解肾脏供需压力的同时,给肾移植受者及移植肾更好的预后,本研究通过回顾性分析本院泌尿外科110例器官捐献供肾移植对象相关临床资料,分析ECD和SCD供肾移植后受者早期移植肾功能恢复及术后并发症发生率之间的差异,为临床ECD供肾移植提供参考。
1 资料与方法
1.1 一般资料
选取本院泌尿外科2015年1月至2020年12月接受异体肾移植的受者匹配者110例,其中接受ECD供肾的受者为ECD组(n=30,占27.3%),接受SCD供肾的受者为SCD组(n=80,占72.7%)。供者临床资料主要包括:年龄、身高、体重、原发病、末次血肌酐等。受者临床资料主要包括:年龄、身高、体重、动态监测血肌酐变化、估算肾小球滤过率(estimated glomerular filtration rate,eGFR)等。
1.2 方法
1.2.1纳入及排除标准
纳入标准:本研究纳入DCD供肾,均经人体器官获取组织(Organ Procurement Organizations,OPO)评估可用于器官移植,通过医学伦理审查,捐献人或有法定决策权的家属知情同意后,使用器官分配系统进行自动分配,用于ABO血型相容[6]的成人单肾同种异体肾移植手术。根据Nyberg评分系统[7]评估供肾质量,分为4级:A级0~9分,供肾质量最佳;B级10~19分,供肾质量良好;C级20~29分,供肾质量中等;D级30~39分,供肾质量较差。根据该评分系统,ECD供肾定义为评分>20分的供肾。供者排除标准:(1)原因不明的昏迷;(2)侵袭性或血液系统恶性肿瘤;(3)恶性传染病;(4)严重的未经治疗或未控制的败血症;(5)特殊类型的感染。所有供者器官捐献均符合《尸体器官捐献供者及器官评估和维护规范(2019版)》中规定的捐献条件[8]。
1.2.2免疫抑制剂应用方案
受者围手术期免疫诱导方案为:兔抗人胸腺细胞免疫球蛋白(术中开始给予50 mg/d,连续给药3~6 d,若体重<50 kg,给予25 mg/d)或巴利昔单抗(术前2 h及术后第4天分别给予20 mg/d)。术后采用环孢素A/他克莫司+麦考酚钠/吗替麦考酚酯+泼尼松的三联免疫抑制方案,并根据血清药物浓度调整剂量。
1.2.3观察指标
记录受者身高、体重、年龄、术前血肌酐等基线数据,监测受者术后住院期间每日血肌酐水平及术后1、3、6个月血肌酐水平,收集资料计算受者术后移植肾功能延迟恢复(delayed graft function,DGF)发生率、急性排斥反应(acute rejection,AR)发生率、移植肾失功率、受者移植肾带功死亡率,并根据计算公式:eGFR=175×血清肌酐-1.154×年龄-0.203(女性×0.742)[9],得到相应的eGFR。移植肾DGF定义为满足以下任意一条:(1)术后1周内恢复透析;(2)术后10 d血肌酐水平>400 μmol/L;(3)术后2周血肌酐水平>300 μmol/L[10-13]。血肌酐下降幅度=(术后第1天血肌酐水平-术后第7天血肌酐水平)/术后第1天血肌酐水平×100%,比值越大说明肾脏恢复速度越快[14]。术后1周以上,血肌酐水平>140 μmol/L时为移植肾功能异常[15],统计两组各时间段移植肾功能异常者占比。
1.3 统计学处理
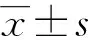
2 结 果
2.1 ECD组和SCD组的基线资料比较
本研究最终筛选纳入供者58例,其中大部分供者捐献双肾,提供相应供肾110个;所有受者均接受单肾移植,匹配受者110例。经再次筛选与匹配,根据Nyberg评分,分为ECD组30例、SCD组80例,为减少混杂因素,本研究对初次肾移植者(102例)和再次肾移植者(8例)分别进行分析。初次肾移植者与再次肾移植者接受ECD和SCD供肾构成比比较,差异有统计学意义(χ2=5.398,P=0.034),见表1。

表1 初次肾移植和再次肾移植者接受ECD和SCD供肾构成比比较[n(%)]
为控制所得数据的统一性,随访时间控制在手术至术后6个月。根据统计结果,两组供者性别、身高、体重、围手术期低血压[收缩压(SBP)<80 mmHg或舒张压(DBP)<50 mmHg大于30min]、围手术期心肺复苏史、供肾左右侧、人类白细胞抗原(HLA)错配数、热缺血时间比较,差异均无统计学意义(P>0.05);两组受者性别、年龄、身高、体重、体重指数(BMI)、主刀医生、透析方式、透析时间、术前血肌酐水平等比较,差异均无统计学意义(P>0.05)。以供者、受者的身高比值作为判断移植肾大小适配性的初步指标,两组供受者身高比无明显差异(P>0.05)。两组供者Nyberg评分、年龄、末次血肌酐水平、BMI、原发病(是否死于脑血管意外)、高血压既往史及冷缺血时间比较,差异均有统计学意义(P<0.05)。匹配后供、受者一般资料见表2、3。

表2 两组供肾对应供者(初次肾移植)一般资料比较

表3 两组供肾对应受者(初次肾移植)一般资料比较
2.2 两组受者术后早期并发症及肾功能恢复情况比较
ECD组与SCD组受者术后AR(12.0%vs.7.8%)和DGF(28.0%vs.19.7%)发生率比较,差异均无统计学意义(P>0.05);SCD组中2例受者为原发性移植肾无功能(PNF);ECD组与SCD组受者术后6个月移植肾失功发生率分别为4.0%和6.5%,失功原因均考虑为AR;ECD组与SCD组均有1例受者发生移植肾带功死亡,死亡原因为肺部感染所致呼吸衰竭(1例)和感染性休克(1例),见表4。

表4 两组供肾对应受者(初次肾移植)术后早期并发症、血肌酐、eGFR及移植肾功能异常者占比比较
观察受者术后第1~12天(住院期间)及术后第1、3、6个月肾功能恢复情况,结果显示:术后第1天,ECD组受者血肌酐水平略低于SCD组;术后第2~12天、术后第1个月ECD组受者血肌酐水平均高于SCD组,但差异无统计学意义(P>0.05);术后第3、6个月,ECD组受者血肌酐水平均高于SCD组,差异有统计学意义(P<0.05),见图1、表4;两组术后第7天肌酐下降幅度比较,差异无统计学意义(P>0.05),见表4。

图1 两组供肾对应受者(初次肾移植)术后第1~12天血肌酐水平
以受者eGFR表示移植肾功能。术后第7天及术后第1、3、6个月,ECD组受者eGFR均低于SCD组,其中两组术后第3、6个月eGFR有明显差异(P<0.05)。术后第7天及术后第1、3个月,两组移植肾功能异常者占比均无明显差异(P>0.05);术后第6个月,ECD组移植肾功能异常者占比高于SCD组,差异有统计学意义(52.0%vs.10.4%,P<0.001),见表4。
2.3 初次肾移植受者术后第6个月出现移植肾功能异常影响因素的logistic回归分析
将可能影响初次肾移植受者术后第6个月出现移植肾功能异常相关变量纳入单因素logistic回归模型,术后第6个月移植肾功能异常赋值为1,移植肾功能恢复正常赋值为0。结果显示:Nyberg评分(OR=1.193,95%CI:1.089~1.307,P<0.001)、供者年龄(OR=1.075,95%CI=1.026~1.125,P=0.002)、供者末次血肌酐(OR=1.007,95%CI:>1.000~1.013,P=0.049)、受者年龄(OR=1.044,95%CI:0.996~1.094,P=0.073)、受者术前血肌酐(OR=0.998,95%CI:0.996~1.000,P=0.076)与术后第6个月出现移植肾功能异常相关,见表5。进一步将单因素分析中P<0.1的相关因素纳入多因素回归方程后发现,Nyberg评分是术后第6个月出现移植肾功能异常的独立危险因素(OR=1.250,95%CI:1.012~1.544,P=0.039),见表6。

表5 受者(初次肾移植)术后第6个月出现移植肾功能异常的单因素分析

表6 受者(初次肾移植)术后第6个月出现移植肾功能异常的多因素分析
2.4 再次肾移植者中两组供受者的资料
再次肾移植者包括ECD组受者5例,SCD组3例,术前的基线资料均与初次移植者相似。术后并发症中,ECD组有2例发生DGF,SCD组未发生DGF;SCD组1例发生AR,ECD组未发生AR;两组均未发生PNF;术后早期人/肾均存活。血肌酐下降幅度及术后第1个月血肌酐水平均与初次移植者相似,术后第3、6个月移植肾功能均正常。
3 讨 论
肾移植手术是目前治疗ESRD的首选治疗方式,而ECD供肾的应用是肾移植领域缓解肾源不足问题的重要途径。对ECD供肾的研究,有助于指导合理选择ECD供肾,减少不必要的器官丢弃,避免更多术后并发症的发生。
3.1 ECD和SCD供肾
本研究结果显示,两组受者在肾移植术后AR、移植肾DGF的发生率无明显差异(P>0.05),与既往报道一致[2];PNF发生率较低,这可能与本研究样本量较小有关。一项多中心回顾性研究提示,DGF是ECD受者发生移植肾功能丧失的独立危险因素[16],早期干预可减少DGF的发生及缩短持续时间,对ECD供肾长期存活有治疗意义;ECD组与SCD组受者在术后第6个月时的移植肾失功发生率分别为4.0%和6.5%,受者移植肾带功死亡率分别为4.0%和1.3%。以上早期术后并发症发生率未见明显差异(P>0.05),移植肾和受者的安全性、恢复情况均较好。MERION等[5]研究表明,在移植后早期,由于手术过程本身和术后并发症相关风险,ECD受者的死亡率会高于候选受者,且死亡风险升高需要7个月以上才能恢复到SCD组的水平。而本研究中两组受者的存活率均较高,这可能与肾移植医师技术、免疫排斥药物等的进步有关,ECD供肾移植后早期受者能获得较好的生存获益。
3.2 冷缺血时间
本研究中,ECD供肾在总体供肾中占比为27.3%,在初次肾移植者中占24.5%。这与MERION等[5]的研究结果相符合。两组供者年龄、末次血肌酐水平、原发病、高血压既往史、Nyberg评分均有明显差异(P<0.05)。同时,ECD组冷缺血时间明显长于SCD组(P<0.05)。BRENNAN等[17]研究表明,冷缺血时间大于24 h及30 h时,会相应增加肾移植失败风险。本研究中两组供肾冷缺血时间均小于24 h,其中ECD组供肾的冷缺血时间更长,考虑与ECD组供者血液循环更不稳定,供者入院至器官获取前准备时间相对更短,未能更早联系受者入院行术前准备,导致器官获取至肾移植手术前时间延长有关。影响因素分析结果提示,冷缺血时间并非术后第6个月出现移植肾功能异常的独立影响因素,这与KAYLER等[18]研究结果一致。
3.3 Nyberg评分
两组受者术后第1个月血肌酐水平及eGFR无明显差异(P>0.05),术后第7天肌酐下降幅度也未见明显差异,提示术后住院期间ECD组受者移植肾功能恢复情况与SCD组一致;至术后第3、6个月两组出现明显差异,ECD组受者血肌酐水平更高,eGFR更低,提示SCD组在术后第3、6个月时移植肾功能恢复得更好,肾功能更稳定。此外,为了进一步采用血肌酐水平反映受者的移植肾功能,本研究以“术后1周以上,血肌酐水平>140 μmol/L”为移植肾功能异常;术后第3个月时,两组受者移植肾功能异常者占比未见明显差异,尚可认为ECD组在术后第3个月时肾功能恢复情况与SCD组一致;而术后第6个月时,ECD组移植肾功能异常者占比明显高于SCD组。经多因素分析显示,Nyberg评分增加是术后第6个月出现移植肾功能异常的独立危险因素。Nyberg评分是基于供者年龄、高血压病史、末次血肌酐、死亡原因、供受者HLA错配数等5个因素所计算出的供肾质量得分。在本研究中,Nyberg评分更高的ECD组在术后早期各时间段移植肾功能异常者占比均高于SCD组,但到术后第6个月时才出现明显差异(P<0.05),这可能与肾移植手术和免疫抑制治疗等因素对早期移植肾功能的影响有关。随着时间的推移,肾移植手术本身导致的移植肾缺血再灌注损伤、应激反应的影响逐渐减弱,同时维持性免疫抑制治疗的程度逐渐降低,药物毒性的影响逐渐减少,Nyberg评分对移植肾功能的影响程度也就随之增大。术后第6个月受者往往已从肾移植手术后恢复,免疫维持治疗的药物剂量经过不断调整,基本达到长期维持剂量,对肾功能的影响减弱,Nyberg评分增加所致的供肾功能异常情况也表现出来。
3.4 ECD-再次肾移植
本研究中,ECD供肾较SCD供肾更多用于再次肾移植,初次肾移植及再次肾移植组中ECD占比有明显差异(24.5%vs.62.5%,P<0.05),这表明肾移植医师更倾向于使用“ECD-再次肾移植”的搭配,以期受者取得更大的生存获益。这与PANCHAL等[19]的研究符合:再次移植使用ECD供肾提高了患者生活质量,降低了医疗成本,并且由于SCD供肾的等待时间更长,对于需要再次移植的患者,接受ECD供肾是有益的。再次肾移植者中DGF和AR的发生情况与初次肾移植者相似,人/肾均存活,均未发生PNF,且早期肌酐下降幅度也较好。ECD供肾用于再次肾移植的疗效与安全性目前值得肯定,但因为本中心开展尸体供肾移植以来再次肾移植数量仍较少,本研究纳入的样本量小,后续需要扩大样本量或利用前瞻性研究行进一步分析。
综上所述,ECD与SCD供肾在异体肾移植术后早期受者并发症及人/肾存活率方面无明显差异,ECD供肾在运用于异体肾移植时有较好的疗效和安全性,ECD供肾可作为移植肾的有效来源。ECD因存在更多不利于供肾存活的因素,维护时间更短,导致冷缺血时间延长,可通过加强对等待肾移植受者的随访,缩短术前准备时间,从而缩短冷缺血时间。Nyberg评分有助于预测受者肾移植的效果,对于Nyberg评分较高的供者应尽早干预,有望降低移植肾功能异常的发生率并改善患者预后。再次肾移植更倾向于使用ECD供肾,受者术后早期移植肾功能恢复情况良好,术后并发症并没有相应增加,“ECD-再次肾移植”的搭配可以让更多移植失败的患者获得肾源。但本研究为回顾性研究,未来仍需要更大样本量、更长期的随访观察,获取更多的临床资料,对ECD供肾的质量评估、取舍及供受者的匹配标准做进一步研究,让ECD供肾能更安全、有效、广泛地运用在异体肾移植中,缓解移植肾的供需压力。
