PET显像新技术在子宫恶性肿瘤中的进展
2023-09-18高钟秀顾莹莹唐立钧
高钟秀,顾莹莹,唐立钧
南京医科大学大学第一附属医院核医学科,江苏 南京 210029
近年来,中国女性宫颈癌(cervical cancer,CC)与子宫内膜癌(endometrial cancer,EC)的发病率与死亡率逐年递增,发病人群也趋于年轻化[1]。CC与EC患者常伴有阴道流血、排液等病史,可通过诊刮、阴道镜、宫腔镜等有创检查确诊。常规影像学检查包括阴道超声、CT 和磁共振(magnetic resonance,MR),但它们对全身多发转移的检出率不高,且其参数变化无法及时反映治疗效果。正电子发射断层扫描(positron emission tomography,PET)显像可以在一次检查中整合代谢、解剖信息,是一种全身无创性的检查手段,其中以18F-脱氧葡萄糖(18F-fluoro-2-deoxyglucose,18F-FDG)应用最为成熟。但18F-FDG显像剂具有许多局限,如子宫炎性及生理性摄取导致的假阳性改变,或是由于肿瘤糖代谢不显著而致的假阴性表现[2-4],因此众多新型PET显像剂及新设备正在研发。本文将针对新型PET 显像剂及新设备在CC 及EC 诊疗中的应用作一综述。
1 CC新型显像剂
CC与高危人乳头瘤病毒持续感染密切相关,早期患者可无明显症状,随着病情进展会出现接触性阴道出血、异常排液等。CC的病理分型包括宫颈鳞癌、腺癌、腺鳞癌及神经内分泌肿瘤等。新型核素显像通过整合肿瘤的表型特征和解剖学细节,实现对CC的高质量评估,目前已成为诊疗研究中的热点。
1.1 新型广谱肿瘤显像剂
成纤维细胞活化蛋白(fibroblast activation protein,FAP)是肿瘤相关成纤维细胞特异性表达的一种表面抗原[5],选择性表达于90%以上的上皮类肿瘤细胞[6]。成纤维细胞激活蛋白抑制剂(FAP inhibitor,FAPI)是FAP的特异性酶抑制剂,可被放射性核素68Ga标记用于肿瘤显像。Dendl等[7]对CC患者行68Ga-FAPI PET检查发现,原发和继发性病灶均具有较好的吸收率和对比度;并且患者脑实质背景对68Ga-FAPI 的摄取显著低于18F-FDG,这有利于精确勾画转移灶及后续制定放疗计划。Zhang等[8]研究发现,68Ga-FAPI PET较18F-FDG PET可检出更多CC患者的淋巴结转移灶,这可能与68Ga-FAPI成像的靶本比更高有关。此外,FAPI还可被治疗性核素177Lu、90Y等标记用于治疗,从而实现诊疗一体化[9-10]。然而在子宫体部恶性肿瘤中,由于月经周期、子宫术后瘢痕或子宫肌瘤都有可能造成子宫局部68Ga-FAPI 高摄取,因此仍需更大规模的前瞻性研究来证实68Ga-FAPI在子宫疾病,尤其是EC中的临床价值[11-12]。
1.2 细胞乏氧显像剂
放射治疗是恶性肿瘤的主要治疗方式之一,研究表明,肿瘤灶微环境的乏氧状态影响肿瘤侵袭性和放化疗耐药性[13],放疗前通过量化病灶的乏氧程度能提供更精准的肿瘤覆盖靶点,予以更高放疗剂量照射乏氧区域的同时也减少放射性直肠炎、膀胱炎的发生[14]。现有的乏氧显像剂分两类:氟标硝基咪唑类和铜标N4-甲基硫代半脲类。
氟标硝基咪唑类乏氧显像剂包括18F-FMISO、18F-FETNIM 及18F-FAZA 等。18F-FMISO 是缺氧成像最广泛的硝基咪唑化合物,但在乏氧组织中摄取及常氧组织中清除均较缓慢,在注射后2~4 h才可采集图像,因此检查耗时长且病灶背景对比差[15]。新一代硝基咪唑化合物18F-FETNIM可突破18F-FMISO的部分局限性[16],但由于在18F-FETNIM PET 图像中CC病灶较难与相邻正常软组织区分开来,限制了它在测量肿瘤缺氧体积中的使用[14]。18F-FAZA 较18F-FMISO具有更好的血液和非靶组织清除率,且在肠道摄取偏低,因此腹部图像质量优于18F-FMISO[17],但它经泌尿系统排泄,容易干扰邻近病变的检出。
铜标的N4-甲基硫代半脲类显像剂以60Cu-ATSM表现最佳,60Cu-ATSM具有更快的药代动力学,注射后30 min即可成像,并且ATSM具有亲脂性,泌尿系统排泄不明显,图像质量更好,是评估盆腔病变的理想显像剂[18]。Dehdashti 等[19]研究证实,治疗前60Cu-ATSM 乏氧显像可预测疗效,肿瘤-肌肉摄取(T/M)比值>3.5 可区分缺氧肿瘤、常氧肿瘤以及有复发可能的肿瘤,同时60Cu-ATSM 摄取与无进展生存期和总生存期呈负相关。有学者认为,CC的60Cu-ATSM显像与肿瘤进展及血管生成相关分子标志物——血管内皮生长因子(vascular endothelial growth factor,VEGF)、表皮生长因子(epidermal growth factor receptor,EGFR)、环氧化酶-2(cyclooxygenase-2,COX-2)、糖类抗原-9(carbohydrate antigen-9,CA-9)的过度表达和预后不良相关[20]。然而,CC放射治疗引起的靶区血管损伤可能会使血流减少,从而干扰60Cu-ATSM的摄取;同时,放射治疗直接引起的肿瘤细胞坏死也会减少60Cu-ATSM的摄取[21]。
1.3 细胞增殖显像剂
研究表明,同步放化疗在有效抑制CC 细胞增殖的同时可导致病灶区域的炎性反应,因此治疗后病灶区持续存在轻到中度18F-FDG 摄取,这无法反映真实的肿瘤活性残留[19]。18F-氟代胸苷(18F-flurothymidine,18F-FLT)是18F标记的胸腺嘧啶核苷,在胸腺激酶的作用下被磷酸化进而局限在细胞内,是应用最广泛的细胞增殖显像剂[22]。18F-FLT 不被放化疗后的宫颈炎性灶所摄取,因此较18F-FDG 更适用于治疗反应的监测及化疗耐药的早期识别[23]。Paulina 等[24]通过联合分析39 例CC 患者的18FFDG 及18F-FLT PET图像发现,原发肿瘤的糖酵解总量/增殖总量和18F-FDG 代谢体积越高,患者预后越差;且不同分化程度的CC摄取18F-FLT的SUVmax差异有统计学意义。另外,放疗会导致骨髓严重损伤,增加患者贫血及感染风险,因此减少对造血功能活跃的红骨髓区照射是减轻并发症的有效方法[25-26]。相比18F-FDG PET,18F-FLT PET有助于鉴别黄骨髓与红骨髓,从而使18F-FLT 增殖显像更适合CC 患者调强放疗方案的规划[27]。
1.4 生长抑素受体(somatostatin receptor,SSTR)显像剂
宫颈神经内分泌癌(neuroendocrine cervix carcinoma,NECC)是一种以SSTR 过度表达为特征的罕见肿瘤,最主要的病理类型是小细胞癌[28-29]。NECC有极高的淋巴转移和血行播散倾向,甚至早期确诊的患者病死率也较高,大部分患者因确诊时已存在远处转移而失去接受根治性手术的机会,因此在疾病局限期确诊至关重要[30]。SSTR 配体可被68Ga 标记用于成像,常见的神经内分泌肿瘤显像剂包括:68Ga-DOTA-TOC、68Ga-DOTA-TATE 和68Ga-DOTANOC。2017 年Andres 等[31]报告了1 例小细胞型NECC患者,该患者先前行全身增强CT检查未发现转移灶,然而行68Ga-DOTA-TATE PET显示出高摄取的原发灶和孤立性骨盆骨转移灶,且均被活检证实。众多研究认为,68Ga-DOTA-TATE PET检测初发或复发的神经内分泌肿瘤非常准确[32],68Ga-DOTATATE PET 对SSTR 阳性表达的NECC 的敏感性为96%,特异性为100%[33]。但原发于宫颈的NECC 比较罕见,因此,现阶段关于SSTR PET 在NECC 中的研究较少。
2 EC 新型显像剂——雌激素受体(estrogen receptor,ER)显像剂
EC是发生在子宫内膜的上皮性恶性肿瘤,多发生于围绝经期及绝经后妇女。根据EC 发病机制和生物学行为将其分为雌激素依赖型和非雌激素依赖型。大部分EC 属于雌激素依赖型,它的发生与无孕激素拮抗的雌激素持续刺激直接相关。当雌激素与ER 结合后,可促进癌细胞的存活和增殖,因此ER 可作为EC 成像的靶点。ER 有两种异构体:ERα和ERβ,针对这两种靶点的代表性显像剂分别为16α-18F-17β-雌二醇(16α-18F-fluoroestradiol,18F-FES)、2-18F-氟-6-(6-羟基-2-基)吡啶-3-醇[2-18F-fluro-6-(6-hydroxynaphthalen-2-yl)pyridin-3-ol,18F-FHNP]。
研究认为,ERα阳性患者行内分泌治疗后的临床缓解率较ERα阴性的患者更高且生存时间更长,治疗前及治疗中监测ERα受体变化可优化患者治疗方案,因此ERα有望作为EC患者预后的潜在分子标志物[34-35]。18F-FES是一种雌激素类似物,已成功用于乳腺癌和其他妇科癌症患者的ER成像[36-37]。一项包含67 例患者的研究表明[38],EC 原发灶的18F-FES SUVmean 是影响患者无进展生存期的独立预后因素,并与肿瘤分期、组织学、淋巴血管间隙受累和淋巴结转移显著相关。另一项研究认为,高级别EC会通过加速葡萄糖代谢而降低雌激素依赖性,因此18F-FDG 与18F-FES 的SUVmean 比值(18F-FDG/18F-FES)与EC 的国际妇产科联盟(Federation of International of Gynecologists and Obstericians,FIGO)分期和和侵袭性相关;18F-FDG/18F-FES=2.0 鉴别良恶性病灶的准确度为86%,优于18F-FDG(68%)及MR(77%)[39]。因此18F-FES PET 在EC 精准诊断及辅助制定治疗决策上具有优势。
ERβ和ERα具有相反的生物学功能,有发挥抗增殖和促肿瘤细胞凋亡的作用,其表达水平随肿瘤进展而下调[40]。基于此,研究人员开发出一种ERβ受体选择性显像剂——18F-FHNP,其标记产率和比活度高,对ERβ具有优先亲和力。Antunes等[41-42]研究发现,18F-FHNP 代谢率Ki(18F-FHNP 的血浆时间-活性曲线斜率值)及SUV值可评估ERβ的表达。另有研究表明,ERβ阳性但ERα阴性的乳腺癌患者可因行他莫昔芬内分泌治疗而获益[43],因此评估肿瘤ERβ的表达状态是必要的。这些临床前结果表明18F-FHNP具有很好的前景,但18F-FHNP PET目前仅应用于乳腺癌,仍需大量临床前和临床研究探索EC患者行18F-FHNP PET成像的临床价值。
3 PET/MR技术
近年来,PET/MR 迅速兴起,目前的PET/MR 一体机成像是将PET成像的分子信息和MR高软组织分辨率的解剖信息结合的多模态成像新技术,在某些方面优于PET/CT,有望成为妇科癌症患者成像评估的支柱[44]。一项纳入46 例CC 患者的研究也指出:PET对淋巴结转移和FIGO分期的诊断价值高于单独的MR成像,而MR成像对病理分化程度的诊断价值高于PET。因此,PET/MR联合成像的临床价值更大[45]。Schwartz等[46]认为18F-FDG PET/CT 和PET/MR 均能明确CC 及EC 的诊断,它们对区域淋巴结和腹部转移灶的检出率相似,然而PET/MR 能更清晰地显示病灶及其肿瘤对宫旁组织和膀胱的侵犯,从而优化疾病分期或治疗方法。对于妊娠早期CC患者,须避免使用对比增强成像以免伤害胎儿,研究发现给予18F-FDG 后,胎儿受辐射剂量低于有确定性影响的阈值[47],且18F-FDG PET/MR对恶性肿瘤的敏感性高于常规的增强成像[48],因此更鼓励在妊娠期间使用18F-FDG PET/MR 检查[49]。也有研究认为虽然全身18F-FDG PET/MR 并不能获得比18F-FDG PET/CT更高的分期准确性,然而在复发的妇科肿瘤患者中,18F-FDG PET/MR 显著提升了肿瘤复发灶的检出率以及复发灶分期的准确性[50-51]。虽然PET/MR成本相对较高,其有关临床研究相对较少,但相信MR技术和新型显像剂的不断发展势必赋予PET/MR更加光明的未来。
4 总结与展望
现阶段,针对CC及EC的新型核素显像剂层出不穷,各类相关临床试验也陆续开展(表1)。与传统检查手段相比,新型核素显像剂及新设备能更加细致地探索肿瘤微环境,不仅对肿瘤转移灶具有独特的诊断价值,且能够测量体内肿瘤行为、表征整体肿瘤负荷并捕获肿瘤表型异质性,因此在优化疾病诊断、治疗方面都有着巨大的潜能。相信随着核医学和分子生物学等学科的融合发展,肿瘤核素显像在核医学分子影像领域的应用也愈发广阔,也期待核素放药及检查设备能够不断探索精进、推陈出新,早日在临床诊疗中发挥更显著的优势。
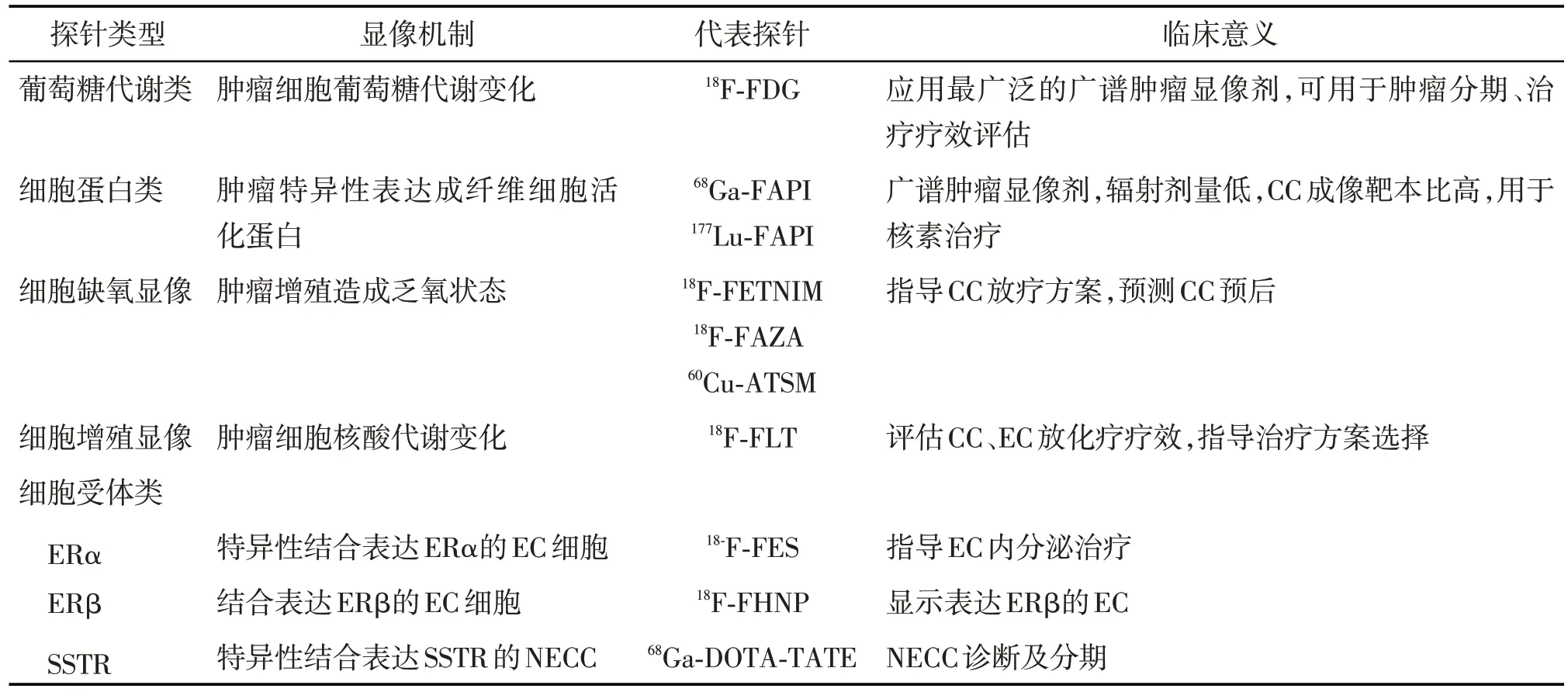
表1 核医学显像剂在子宫恶性肿瘤应用中的基本情况Table 1 Basic information of nuclear medicine imaging agents in uterine malignant tumors
