高分辨率压缩感知TOF-MRA技术对豆纹动脉成像的研究
2023-09-18武鹏飞鲁珊珊胡永志吴飞云
武鹏飞,鲁珊珊,李 青,胡永志,吴飞云
南京医科大学第一附属医院影像科,江苏 南京 210029
豆纹动脉(lenticulostriate arteries,LSA)主要由大脑中动脉发出,为基底神经节及其附近区域提供血液,其病变与脑卒中和小血管病相关[1-2]。LSA的可视化对于理解小血管病的病理机制及指导治疗至关重要。长期以来,数字减影血管造影(digital subtraction angiograph,DSA)一直是评估LSA的金标准,但它是一种有创、有辐射的检查方法[3]。计算机断层血管成像(computed tomographic angiography,CTA)和基于3.0T 磁共振(magnetic resonance,MR)的传统时间飞跃法磁共振血管造影(time-of-flight magnetic resonance angiography,TOF-MRA)都无法很好地显示LSA[4]。虽然7.0T TOF-MRA 在显示LSA 方面更具有优势,然而目前超高场尚无法临床普及。
近年来,压缩感知(compressed sensing,CS)技术在MR 成像应用中得到快速发展,其原理是利用非线性迭代正则化重建中成像结构的固有稀疏性,从欠采样k空间数据中近似获得全采样测量的图像质量,从而减少MR 数据重建所需的样本数量来实现快速成像[5]。既往研究表明,CS技术有助于在合理的扫描时间内获得高分辨率TOF-MRA 图像,同时可以明显提高血管边缘锐利度,有利于显示细小血管[3]。本研究旨在探讨基于3.0T MR 的高分辨率CS TOF-MRA(0.4 mm× 0.4 mm × 0.4 mm)对LSA 评估的应用价值。
1 对象和方法
1.1 对象
本研究获得了南京医科大学第一附属医院伦理委员会的批准(批准文号:2022-SRFA-216),所有受试者均签署了知情同意书。收集2022年5—7月在医院接受头颅MR体检的23例健康志愿者,其中男7 例,女16 例,年龄18~39 岁,中位年龄22 岁。纳入标准:既往无脑血管病变史,年龄>18 岁,图像质量好,无运动伪影。排除标准:有脑血管病变史及幽闭恐惧症或金属植入物等MR禁忌证。
1.2 方法
1.2.1 扫描方法
采用3.0T MR 扫描仪(Siemens Skyra,西门子,德国)、20 通道头颈联合线圈进行扫描。扫描体位采用仰卧位,头先进,定位中心在眉弓处,扫描范围从颈内动脉C6 段至大脑中动脉的M4 段。扫描参数:视野(field of view,FOV)220 mm×220 mm,重复时间(repetition time,TR)21 ms,回波时间(echo time,TE)3.49 ms,翻转角(flip angle)18°,层厚0.6 mm,矩阵368×334,重建体素大小为0.4 mm×0.4 mm×0.4 mm。CS 加速因子分别设置为7(CS7)、5(CS5)、3(CS3)、2(CS2),相应的采集时间分别为2 min 3 s、2 min 35 s、4 min 8 s、6 min 3 s。数据重建采用改进的快速迭代收缩阈值算法进行10次迭代重构,重建时间分别为1 min 5 s、1 min 1 s、1 min 20 s、1 min 16 s。
1.2.2 图像分析
将所有CS TOF-MRA原始图像传输至后处理工作站,由两名有经验的神经影像医师分别在不知道加速因子的情况下对CS TOF-MRA的原始图像及最大密度投影(maximum intensity projection,MIP)重建图像进行独立评估。两者对图像分析意见不一致时由另一位高年资神经影像医生协助达成共识,评估内容如下。
LSA显示质量:进行0~3级的主观评分。0级为LSA 几乎不可见,无法诊断;1 级为LSA 边缘显著模糊,管腔不连续,远端分支不可见;2 级LSA 边缘稍模糊,远端分支部分可见;3 级为LSA 边缘清晰,管腔连续,远端分支可见[6]。
LSA 显示数目及长度:将扫描图像的原始数据采用MIP后处理,分别计算CS2、CS3、CS5、CS7图像显示的两侧LSA 的总条数(number,N)和其中最长LSA的长度(length,L)。
血管边缘锐利度:使用Matlab 下基于局部边缘梯度分析的感知锐度指数(perceptual sharpness index,PSI)来计算不同加速倍数下所获得TOF-MRA 图像的血管边缘锐利度[7]。
1.3 统计学方法
采用SPSS 24.0 软件进行统计学分析。采用Shapiro-Wilk检验计量资料是否符合正态分布,符合即用均数±标准差()表示,不符合用中位数(四分位数)[M(P25,P75)]表示;计数资料用频数及百分比[n(%)]表示。两位阅片者对分类资料评价的一致性采用Kappa 检验,对连续变量资料评价的一致性采用组内一致性ICC 检验,<0.40 为一致性较差;0.40~0.75 为一致性中等;>0.75 为一致性较好。采用Friedman 检验,对LSA 显示质量和数目进行总体分析,并采用成对比较法进行组间两两比较。采用单因素方差分析,对LSA 显示长度和血管边缘锐利度PSI 进行总体分析,组间两两比较采用最小显著差异法(least significant difference,LSD)。P<0.05为差异有统计学意义。
2 结果
23 例健康志愿者均顺利完成检查,无不良反应。CS TOF-MRA图像显示健康志愿者头颅血管均无明显病变。图1 为1 例20 岁男性健康志愿者CS TOF-MRA检查结果。

图1 1例20岁男性健康志愿者CS TOF-MRA检查结果
2.1 图像质量的定性评价
两位神经影像医师对不同加速倍数CS TOFMRA图像质量的主观评分具有较好的一致性(Kappa值:CS2 0.82;CS3 0.71;CS5 0.75;CS7 0.69)。结果显示:基于CS2、CS3图像,LSA图像质量评分在2级以上的分别为23 例(100.0%)、21 例(91.3%),明显优于CS5(11 例,47.8%)和CS7(3 例,13.0%)(表1)。两两比较结果显示:CS2 和CS3 之间、CS5 和CS7 之间图像质量比较差异无统计学意义,其余两组之间差异均具有统计学意义(P<0.05,表2)。

表1 23例健康志愿者图像质量主观评分[n(%)]
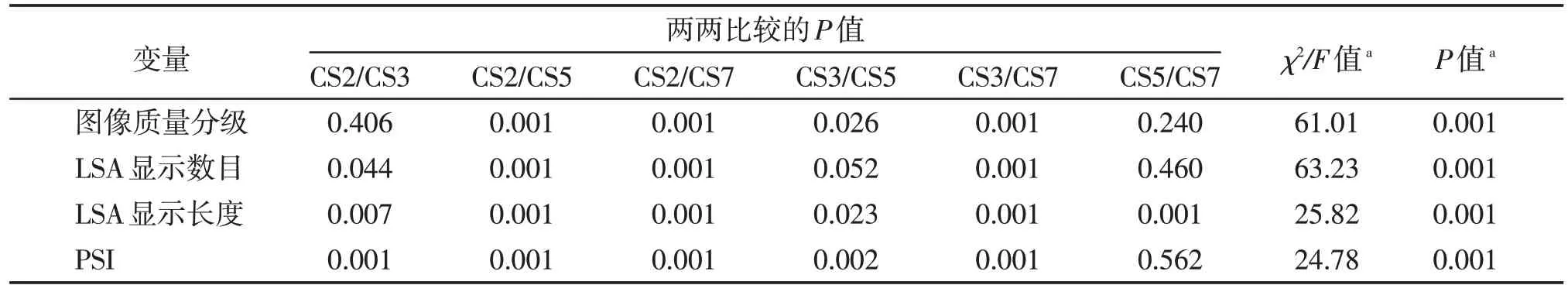
表2 不同加速因子图像对LSA显示的两两比较结果
2.2 LSA显示数目及长度
两名神经影像医师对LSA 显示数目的一致性评价较好(Kappa 值:CS2 0.82;CS3 0.71;CS5 0.75;CS7 0.69)。基于CS2 图像,16 例(69.6%)被检者LSA 显示数目在5 条以上,显著优于CS3(2 例,8.7%)、CS5(0 例,0%)和CS7(0 例,0%)(表3)。两两比较结果显示,CS3 和CS5 之间、CS5 和CS7 之间LSA 显示数目差异无统计学意义,其余各组之间差异均有统计学意义(P<0.05,表2)。

表3 不同加速倍数下LSA显示长度、数目及血管边缘锐利度
两名神经影像医师对LSA 显示长度的一致性评价较好(ICC 值:CS2 0.86;CS3 0.70;CS5 0.69;CS7 0.75)。方差分析结果显示,不同加速倍数下的CS TOF-MRA 显示的LSA 长度显著不同(F=25.82,P=0.001)。LSD多重比较结果显示,对LSA长度的显示能力:CS2[(3.47±0.29)cm]>CS3[(3.22±0.29)cm]>CS5[(3.00±0.33)cm]>CS7[(2.69±0.32)cm],两两比较差异均有统计学意义(P<0.05,表3)。
2.3 血管边缘锐利度评价结果
不同加速倍数下CS TOF-MRA图像的血管边缘锐利度PSI显著不同(F=24.78,P=0.001)。基于CS2图像的血管边缘锐利度PSI 明显优于CS3、CS5 及CS7(P均<0.05,表3),基于CS3 图像的血管边缘锐利度PSI优于CS5及CS7(P均<0.05),而CS5和CS7之间差异无统计学意义(P>0.05,表2)。
3 讨论
LSA疾病最初由Caplan等[8]在1989年提出。他们认为在病理情况下,这些微小动脉容易发生脂质玻璃样变和纤维蛋白变性,或被动脉粥样硬化斑块阻塞开口,从而导致远端脑灌注不足,引起各种神经病理疾病[9]。非侵入性的LSA成像可以为研究脑小血管疾病的病理生理学机制及临床诊治提供帮助。
尽管目前的神经影像技术如DSA、CTA及TOFMRA等已被用于研究血管病理生理机制,但受到其侵入性或分辨率有限的影响,它们在小血管疾病的临床应用中受到限制[10]。随着超高场7.0T MR技术的迅猛发展,7.0T TOF-MRA目前成为观察颅内LSA的最佳无创手段。然而,7.0T 系统在临床环境中的可用性非常有限。传统3.0T TOF-MRA 主要用于大动脉成像,其评估微血管结构的分辨率不足、信噪比差,很难显示LSA。CS技术是通过利用图像的可压缩性或稀疏性,从减少的k 空间样本中重建图像。由于颅脑血管在像素域上是稀疏的,因此TOF-MRA是CS技术非常好的应用对象[11]。本课题组既往研究表明,CS 技术与TOF-MRA 序列相结合,可以在临床合理时间范围内完成高分辨率(0.4 mm×0.4 mm×0.4 mm)图像采集,提高颅内小血管的显示能力及血管边缘锐利度[12]。
本研究采集了4 种不同加速因子的CS TOFMRA 图像,结果显示,CS2 图像在主客观评价中均优于其他3组,随着加速因子的增大,图像质量的主客观评价均呈下降趋势。既往Yamamoto 等[13]比较了CS TOF-MRA 不同加速因子(CS3 和CS5)对烟雾病血管的显示能力,他们认为低倍加速因子CS3 对小血管的显示优于CS5,本研究结果与其一致,基于CS2 所获得的LSA 显示数目、长度及血管边缘锐利度均优于其他加速因子。此外,低加速因子的CS TOF-MRA 还能有效降低源图像中心部位的斑点噪声[14]。本研究在CS TOF-MRA图像重建环节使用了图像处理单元(graphic processing unit,GPU),使扫描后的总重建时间为1 min 10 s,如果采集同样高分辨率的图像,传统TOF-MRA扫描时间为5 min 23 s,重建时间为2 min。高分辨CS TOF-MRA 序列可以同时兼顾扫描速度和分辨率,有利于将该序列纳入到临床扫描协议中,各向同性高分辨率的原始数据(0.4 mm×0.4 mm×0.4 mm)亦方便进行多角度的MIP图像重建,有利于对LSA疾病的显示和诊断。
本研究有几个局限。第一,由于LSA 的轨迹是三维的,而且它们的角度是不同的,因此在冠状位部分MIP 图像上的测量可能存在一定误差[15]。第二,DSA被认为是评估LSA的金标准,但其有创性阻碍了它在健康志愿者中的应用,因此无法将CS TOF-MRA 显示的LSA 与DSA 结果进行头对头的比较。此外,考虑到传统的TOF-MRA 对LSA 显示极其困难,且获得各向同性0.4 mm 的高分辨率图像需要13 min,过长的扫描时间使被试者很难配合,本研究中未设置传统的TOF-MRA对照组。第三,本研究采用的迭代重建次数为10次,LSA的显示可能通过更多的迭代次数进一步提升。然而Lin等[3]研究表明:当迭代次数为20时,重建时间将大大延长,势必会影响临床扫描流程。第四,本研究是一项初步研究,且样本量较少。但尽管如此,研究结果初步肯定了CS TOF-MRA对LSA的显示能力。该技术对LSA病变的显示及诊断能力有待进一步在患者中进行评估。
基于2倍加速因子的高分辨率CS TOF-MRA 在临床合理的扫描时间内,可以提供较好的LSA 图像,且在LSA 显示数目、长度和血管边缘锐利度方面,优于其他加速因子的CS-TOF MRA。该技术可为临床采用3.0T MR显示及研究LSA相关性疾病提供了潜在的新方法。
