卵巢上皮性癌患者生存预测模型的构建及验证
2023-09-15孔艺燕李小钊应小燕
孔艺燕 李小钊 应小燕

[摘要] 目的 分析卵巢上皮性癌(epithelial ovarian cancer,EOC)流行病學特征及影响预后的相关因素,并绘制列线图个体化预测患者的总体生存率。方法 收集公共数据库2010–2017年诊断的12 675例EOC术后患者,按7:3比例随机分为建模组(n=8875)和内部验证组(n=3800)。采用Cox回归分析筛选影响术后患者总体生存时间的独立预后因素,并建立模型,从南京医科大学第二附属医院病案系统收集82例患者作为外部验证组,预测EOC患者的生存率。用校准曲线和一致性指数(C指数)、受试者操作特征(receiver operating characteristic,ROC)曲线估计预测和实际总体生存率之间列线图的准确性和一致性。结果 根据Cox多因素筛选影响术后EOC患者总体生存时间的独立预后因素(P<0.05)构建预测模型。校准曲线显示基于预测模型预测患者的生存与实际生存具有较好的一致性。建模组、外部验证组、内部验证组在预后模型显示出中等判别能力,1、3、5年生存率的ROC曲线下面积(area under the curve,AUC)分别为0.772、0.782、0.799;0.742、0.778、0.795;0.653、0.807、0.827。预测模型的C指数为0.763(95%CI:0.755~0.771)。结论 预测模型有较好的预后准确性,能可靠预测EOC患者的1、3、5年生存率,有助于EOC患者进行个性化的预后评估和指导临床决策。
[关键词] 卵巢癌;预后模型;列线图;生存分析
[中图分类号] R737 [文献标识码] A [DOI] 10.3969/j.issn.1673-9701.2023.24.013
Construction and validation of postoperative survival prediction model for patients with epithelial ovarian cancer
KONG Yiyan, LI Xiaozhao, YING Xiaoyan
Department of Obstetrics and Gynecology, the Second Affiliated Hospital of Nanjing Medical University, Nanjing 210000, Jiangsu, China
[Abstract] Objective To analyze the epidemiological characteristics and prognostic factors of epithelial ovarian cancer (EOC), and to draw a line graph to predict overall survival. Methods A total of 12 675 EOC patients diagnosed in a public database from 2010 to 2017 were randomly divided into a modeling group (n=8875) and an internal validation group (n=3800) in a 7:3 ratio. cox regression analysis was used to screen independent prognostic factors affecting the overall survival time of patients after surgery to establish a model. Totally 82 patients were collected from our hospitals medical record system as an external validation group to predict the survival rate of patients with EOC. Calibration curve and consistency index (C index) and receiver operating characteristic (ROC) curve were used to estimate the accuracy and consistency of the graph between prediction and actual overall survival. Results A prediction model was established based on cox multivariate screening of independent prognostic factors (P<0.05) that affected the overall survival time of postoperative EOC patients. The calibration curve showed that the patients' survival predicted by the prediction model was in good agreement with the actual survival. Modeling group, external validation group, internal validation group showed moderate discriminant ability in the prognostic model, and the AUC values of the area under the curve (AUC) for 1 year, 3 and 5 years survival were 0.772, 0.782, 0.799; 0.742, 0.778, 0.795; 0.653, 0.807, 0.827. The C index of the prediction model was 0.763(95%CI: 0.755-0.771). Conclusion The prediction model has good prognostic accuracy and can reliably predict the 1 year, 3 and 5 years overall survival of patients with EOC. This predictive model could prove to be a good predictive tool for gynecological clinical practice and help patients with EOC to personalize prognosis assessment and guide clinical decision making.
[Key words] Ovarian cancer; Prognostic model; Column chart; Survival analysis
![]() 卵巢癌(ovarian cancer,OC)是全球第三大常见妇科恶性肿瘤,其初始发病时常无明显症状,肿瘤隐匿生长且无合适早期监测手段,诊断时多为晚期,5年生存率为25%[1]。卵巢上皮性癌(epithelial ovarian cancer,EOC)约占所有OC组织学类型的85%,预后较差[2-3]。目前EOC患者的预后主要由高年资医生依据个人经验进行判断,无法依据患者病情做出具体客观的预后预测分析。美国癌症研究所的监测、流行病学和最终结果(surveillance,epidemiology,and end results,SEER)数据库由美国国家癌症研究所赞助的收集癌症发病率和生存的数据库,包括人口统计、原发肿瘤、生命状态和生存率[4]。列线图是临床常用的一种对危险因素进行评分,进而预测肿瘤预后的统计学方法[5]。本文旨在探讨影响EOC患者预后的独立因素,建立预后预测模型并进行内、外部验证以预测EOC患者的总体生存率,协助临床医生正确评价EOC患者的预后,从而为EOC患者的个性化治疗提供参考。
卵巢癌(ovarian cancer,OC)是全球第三大常见妇科恶性肿瘤,其初始发病时常无明显症状,肿瘤隐匿生长且无合适早期监测手段,诊断时多为晚期,5年生存率为25%[1]。卵巢上皮性癌(epithelial ovarian cancer,EOC)约占所有OC组织学类型的85%,预后较差[2-3]。目前EOC患者的预后主要由高年资医生依据个人经验进行判断,无法依据患者病情做出具体客观的预后预测分析。美国癌症研究所的监测、流行病学和最终结果(surveillance,epidemiology,and end results,SEER)数据库由美国国家癌症研究所赞助的收集癌症发病率和生存的数据库,包括人口统计、原发肿瘤、生命状态和生存率[4]。列线图是临床常用的一种对危险因素进行评分,进而预测肿瘤预后的统计学方法[5]。本文旨在探讨影响EOC患者预后的独立因素,建立预后预测模型并进行内、外部验证以预测EOC患者的总体生存率,协助临床医生正确评价EOC患者的预后,从而为EOC患者的个性化治疗提供参考。
1 资料与方法
1.1 资料来源
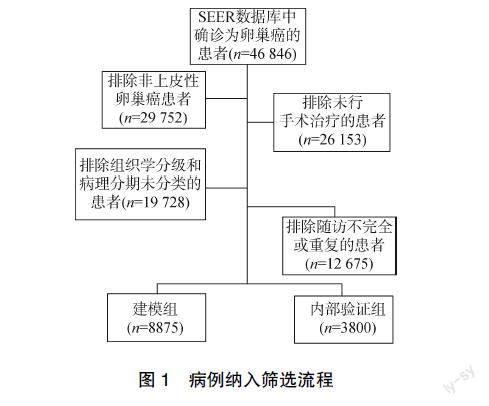
从SEER数据库获取完整的2010–2017年数据集,包含美国18个登记处的基本肿瘤信息:年龄、婚姻状况、组织学类型、组织学分级、肿瘤单双侧、手术方式、化疗、脏器转移、肿瘤分期、淋巴结转移、总生存期及生存状态。根据纳入排除标准剔除缺失及随访信息不完整的数据,最终得到12 675条有效数据,病例纳入筛选流程见图1。
1.1.1 纳入标准 ①病理诊断为EOC,根据《国际疾病分类肿瘤学专辑》[6]第三版编码。浆液性癌:8441、8442、8460、8461、8462、8463;黏液性癌:8440、8450、8470、8471、8472、8480、8481、8482;子宫内膜癌:8380、8381、8382、8383;透明細胞癌:8310、8313;移行细胞癌:8120、8130。②EOC为第一原发肿瘤。
1.1.2 排除标准 基本肿瘤及随访信息缺失。
1.2 数据库访问及分组方法
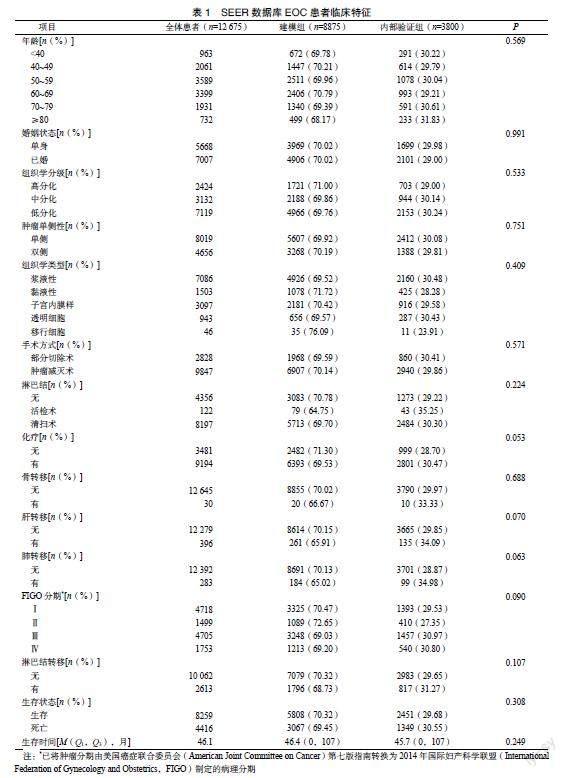
向SEER官方申请数据库权限,批准后分配账号及密码,用SEER*Stat软件获取SEER队列数据。中国队列数据以门诊或电话随访来获取患者的生存情况,总体生存期从确诊时间到死亡或随访的最后期限。为更好地统计分析和报告数据,将观察指标自定义为二分类或多分类变量,见表1。
1.3 统计学方法
本研究用单、多变量Cox比例风险模型求出风险比(hazard ratio,HR)和95%CI,P<0.05为差异有统计学意义,并探讨上述因素对EOC患者总体生存率的影响。用R软件构建所有数据的列线图和统计分析。
1.4 列线图的构建及验证
列线图是一个可视化的回归模型,根据每个影响因素的回归系数设定评分标准并将每个变量在积分量表上给出一个分数[5]。通过将底部量表显示的总分相加得出每个患者总分后计算并预测个体患者的总体生存率。将上述可能影响EOC患者预后的因素纳入研究,患者以7∶3 比例随机分为建模组(n=8875)和内部验证组(n=3800)。建模组用Cox多因素回归筛选独立预后因素并构建生存预测模型即列线图。此预测模型的正确性采用C指数、校准曲线、受试者操作特征(receiver operating characteristic,ROC)曲线进行内、外部验证,其中C指数曲线和ROC曲线的区域较大、校准曲线与预测的危险程度相近,表明模型的正确性较高。
2 结果
2.1 SEER数据库EOC患者临床特征
根据纳入排除标准,自SEER数据库筛选12 675例EOC患者,其临床特征差异无统计学意义(P>0.05),以此保证后续建模稳定,见表1。
2.2 建模队列预后因素的筛选
单因素Cox回归示13个预后因素与总体生存率有相关性,差异有统计学意义(P<0.05)。进行多因素Cox回归确定这些因素的独立预后价值,显示骨、肝转移对总体生存率可能无生存预测价值(P≥0.05)。其中年龄<40岁患者总体生存率优于另外5个年龄层(P<0.05);已婚患者总体生存率优于单身患者(P<0.05);低分化与高分化患者相比总体生存率明显较差(P<0.05);与双侧EOC相比,单侧受累患者中位总体生存率明显更长(P<0.05);非浆液性癌总体生存率优于浆液性癌患者(P<0.05);进行部分手术切除患者的总体生存率优于肿瘤减灭术(P<0.05);行淋巴结活检或清扫术的总体生存率优于未行淋巴结处理的患者(P<0.05);进行化疗患者的总体生存率优于未行化疗的患者(P<0.05);有肺、淋巴结转移与无肺、淋巴结转移的患者相比总体生存率明显较差(P<0.05);FIGO分期越晚患者总体生存率相比早期患者明显更差(P<0.05)。
2.3 列线图的构建
用R软件将多因素Cox回归筛选影响EOC患者预后的11个独立因素纳入分析得出预测EOC患者的1、3、5年总生存率的列线图,见图2。举例:一例70岁已婚EOC患者行肿瘤减灭术和淋巴结清扫术,为肿瘤双侧受累的低分化浆液性癌伴淋巴结、肺转移,病理分期为国际妇产科学联盟(International Federation of Gynecology and Obstetrics,FIGO)Ⅳ期,术后进行化疗。根据Nomogram模型计算分值为265分,对应的1、3、5年生存率为60%~70%、10%~20%,<10%。其中对预测模型产生较大影响的预后因素依次为FIGO分期、年龄、病理类型、组织学分级。
2.4 外部验证队列的临床特征
为检测该模型的准确性,基于预测模型所纳入的变量,将南京医科大学第二附属医院82例术后EOC患者作为外部验证组,详细的临床特征见表3。
2.5 评价列线图
列线图的C指数在0.65~0.75是可接受的[7]。本研究的C指数为0.763(95% CI:0.755~0.771),表明本研究的列线图的预测能力有较高准确性。为提高预测模型的可信度,排除建模样本的人种或地域差异,用内、外部数据对预测模型的校准度进行验证。用校准曲线判定模型的预测误差或过度拟合,当模型与45°线的拟合结果良好时,该模型的校准能力良好[8]。结果显示列线图对EOC患者1、3、5年生存率预测结果与实际相符合。其生存率与标准曲线非常接近,见图3。预测模型在建模组、外部、内部验证组显示中等或以上判别能力,1、3、5年生存率的ROC曲线的AUC分别为0.772、0.782、0.799(图4A~C)和0.653、0.807、0.827(图4D~F)和0.742、0.778、0.795(图4G~I)。提示该预测模型在各组中有良好准确性。
3 讨论
癌症的临床研究离不开生存分析,治疗选择和预后评估至关重要。在临床工作中,EOC患者复发危险度高,术中情况差,在随访及治疗过程中会给予更多关注,但对术中情况好、术野肉眼无残留病灶的患者的预后更容易放松警惕。Nomogram是一种用多个指标诊断疾病、预测疾病预后或复发的模型,其核心是多因素分析的结果,对不同预测指标整合并分配相应评分,合计评分并以线段图的形式将各变量与结局预测的关系可视化呈现并诊断或预测。近年来列线图构建癌症预测模型获得广泛接受,其将大量复杂的因素简化成数字预测模型预测事件发生概率并较好预测不同个体间的生存差异,协助医生筛选高危患者并确定适当的治疗措施,为患者争取更多的获益。本研究着眼于具体临床特征筛选有意义的预后因素建立预测模型以预测EOC患者的生存预后。ROC的AUC及校准曲线均显示预测模型良好的区分度和校准度。
既往研究认为EOC独立预后因素是年龄、病理类型、组织学分级、FIGO分期等。Zhang等[9]研究显示高龄患者存活率较短,原因是老年患者合并较多基础性疾病,对手术耐受度、化疗敏感性及副作用耐受力均差于年轻患者,使老年患者治疗效果无法达到预期。本研究与Gardner等[10]认为已婚患者较单身的总体生存率高、预后好。原因可能是婚姻可带来财务资源协助治疗癌症,延长生存期[11]。本研究中病理类型是影响患者远期预后的重要因素,与Kossa?等[3]和Morice等[12]研究結果认为非浆液性癌较浆液性癌预后好。因此确定病理类型可预判EOC患者预后状况,为临床医生制定治疗方案提供理论支持。本研究与既往研究示FIGO分期对EOC患者治疗结局、预后有最为重要的预测意义[13-17]。Petru等[15]指出Ⅰ期患者的5年生存率高于Ⅲ期(分别为75%和26%)。Ditto等[16]指出FIGO Ⅲa期以后,分期越晚,死亡风险越高,预后越差。本研究示早期患者淋巴结转移率低于晚期,预后较好。肿瘤侵犯周边淋巴结,提示其有更强的侵袭力,同时有较高的临床分期。本研究及Zhang等[9]指出组织分化越低恶性程度越高,肿瘤的侵袭能力越强,预后也越差。本研究报告肝、骨、肺转移的发生率和总体生存期,与Gardner等[18]研究一致,肝转移发生率最高,其次是肺、骨转移。EOC合并肝转移发生率占所有EOC的6.9%[2],尽管发生率很高,但患者的总体生存期相对较长。目前针对远处转移主要治疗是控制原发疾病。
综上所述,列线图可有效评估EOC患者预后并为随访治疗提供个体参考。本研究属于回顾性研究,受限于SEER数据库,缺少诸如化疗方案、化疗敏感性、复发情况、基因突变等临床关键信息,因此列线图不含这些潜在的预后因素。所以本文结论并不完全代表EOC预后特点,还需开展多中心、大规模、前瞻性的临床研究,制定符合我国实际情况的诊疗策略。尽管存在局限,但本研究率先用列线图分析EOC患者术后在大型人群的长期生存且较便捷地通过这些临床信息对生存率进行简易判断, 该列线图可能被证明是妇科临床实践的良好预测工具并协助EOC患者进行个性化预后评估和指导临床决策。
[参考文献]
[1] KUROKI L, GUNTUPALLI S R. Treatment of epithelial ovarian cancer[J]. BMJ, 2020, 371: m3773.
[2] 崔粮驿, 孙天水, 毕芳芳, 等. 626例上皮性卵巢癌的预后分析[J]. 中国妇产科临床杂志, 2019, 20(6): 487–490.
[3] KOSSA? M, LEARY A, SCOAZEC J Y, et al. Ovarian cancer: A heterogeneous disease[J]. Pathobiology, 2018, 85(1-2): 41–49.
[4] PERES L C, CUSHING-HAUGEN K L, K?BEL M, et al. Invasive epithelial ovarian cancer survival by histotype and disease stage[J]. J Natl Cancer Inst, 2019, 111(1): 60–68.
[5] YOU D, ZHANG Z, CAO M. Development and validation of a prognostic prediction model for postoperative ovarian sex cord-stromal tumor patients[J]. Med Sci Monit, 2020, 26: e925844.
[6] 張思维. 《国际疾病分类肿瘤学专辑》第三版修订简介[J]. 中国肿瘤, 2004(7): 4–7.
[7] JIANG S J, ZHAO R J, LI Y R, et al. Prognosis and nomogram for predicting postoperative survival of duodenal adenocarcinoma: Aretrospective study in China and the SEER database[J]. Sci Rep, 2018, 8(1): 7940.
[8] VAN CALSTER B, NIEBOER D, VERGOUWE Y, et al. A calibration hierarchy for risk models was defined: From utopia to empirical data[J]. J Clin Epidemiol, 2016, 74: 167–176.
[9] ZHANG W, ZHANG W, LIN Z, et al. Survival outcomes of patients with primary breast cancer following primary ovarian cancer[J]. Med Sci Monit, 2019, 25: 3869–3879.
[10] GARDNER A B, SANDERS B E, MANN A K, et al. Relationship status and other demographic influences on survival in patients with ovarian cancer[J]. Int J Gynecol Cancer, 2020, 30(12): 1922–1927.
[11] LUTGENDORF S K, DE GEEST K, BENDER D, et al. Social influences on clinical outcomes of patients with ovarian cancer[J]. J Clin Oncol, 2012, 30(23): 2885–2890.
[12] MORICE P, GOUY S, LEARY A. Mucinous ovarian carcinoma[J]. N Engl J Med, 2019, 380(13): 1256–1266.
[13] FOURCADIER E, TR?TARRE B, GRAS-AYGON C, et al. Under-treatment of elderly patients with ovarian cancer: A population based study[J]. BMC Cancer, 2015, 15: 937.
[14] WEI W, LI N, SUN Y, et al. Clinical outcome and prognostic factors of patients with early-stage epithelial ovarian cancer[J]. Oncotarget, 2017, 8(14): 23862–23870.
[15] PETRU E, HUBER C, SAMPL E, et al. Comparison of primary tumor size in stage Ⅰ and Ⅲ epithelial ovarian cancer[J]. Anticancer Res, 2018, 38(11): 6507–6511.
[16] DITTO A, LEONE ROBERTI MAGGIORE U, BOGANI G, et al. Predictive factors of recurrence in patients with early-stage epithelial ovarian cancer[J]. Int J Gynaecol Obstet, 2019, 145(1): 28–33.
[17] GE L, LI N, YUAN G W, et al. Nedaplatin and paclitaxel compared with carboplatin and paclitaxel for patients with platinum-sensitive recurrent ovarian cancer[J]. Am J Cancer Res, 2018, 8(6): 1074–1082.
[18] GARDNER A B, CHARO L M, MANN A K, et al. Ovarian, uterine, and cervical cancer patients with distant metastases at diagnosis: Most common locations and outcomes[J]. Clin Exp Metastasis, 2020, 37(1): 107–113.
(收稿日期:2022–10–10)
(修回日期:2023–08–18)
