1株间座壳属真菌抗松材线虫的活性
2023-09-14于金英吕耀平
于金英,汪 冶,吕耀平,于 威
(1.浙江理工大学 生命科学与医药学院,杭州 310018; 2.丽水学院 生态学院,浙江丽水 323000)
松材线虫(Bursaphelenchusxylophilus)是一种寄生在松树上并导致松材线虫病发生的病原性植物线虫,对松树具有高度的破坏性,借助媒介昆虫松墨天牛可以从受侵染的树木迅速传播,引起病害流行[1-2]。通过注干施用(半)合成农药被认为是最有效的直接控制松材线虫的策略之一,并在亚洲国家得到了广泛应用[3]。然而,大多数杀线剂可能对非目标生物体有害,引起严重的环境和人类健康等问题已被停用。因此,很多研究者以期从植物或微生物代谢产物中发现对环境友好且具有更高效杀虫性能的天然化合物来代替合成杀虫剂,在防治松材线虫的同时,保护环境并节约成本。
在松材线虫病的生物防治研究方面,大量研究表明,微生物可以产生对松材线虫具有毒杀作用的酶和次级代谢物,如担子菌毛头鬼伞(Coprinuscomatus)产生的含氧杂环化合物[4],链霉菌(Streptomycessp.)产生的杀鱼菌素[5],以及应用最为成功的微生物杀虫剂苏云金芽孢杆菌(Bacillusthuringiensis)产生的杀虫晶体蛋白等[6],但是由于众多生物因素以及非生物因素的干扰,相关的研究多停留在高效菌株的筛选和室内研究,生物菌剂的应用并没有获得很好的实践效果[7]。
植物内生真菌是一种寄生在植物活体组织中而不引起任何有害症状的微生物。内生真菌与寄主互惠共生,寄主提供内生菌所需要的生境和营养,真菌分泌植物生长和生存所需的功能性代谢产物,这些代谢物在结构与功能上与寄主植物的次生代谢产物相似[8]。苦楝(Meliaazedarach)为楝科落叶乔木植物,其次生代谢产物如苦楝素具有广泛的杀虫活性[9-10]。迄今,有关苦楝内生真菌杀线虫活性的研究鲜有报道,因此,本研究选取苦楝作为研究对象,筛选具有杀线活性的内生真菌,为进一步开发生防菌剂防治松材线虫病提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 供试植物 供试植物苦楝于2021 年10 月采自浙江省丽水市,随机选取苦楝茎、叶、果实的健康组织。
1.1.2 供试松材线虫 松材线虫分离于丽水市莲都区大港头森林防疫站提供的马尾松(Pinusmassoniana)疫木,经浙江省农科院鉴定为松材线虫,置于长有灰葡萄孢(Botrytiscinerea)的培养皿中,28 ℃避光饲养。
1.1.3 供试培养基 马铃薯葡萄糖琼脂(PDA)培养基:去皮马铃薯200 g切块加适量蒸馏水,加热至马铃薯熟烂,经纱布过滤,滤液加入20 g葡萄糖、20 g琼脂粉,加蒸馏水定容至1 000 mL,置于高压灭菌锅内121 ℃灭菌20 min。
马铃薯葡萄糖液体(PDB)培养基:去皮马铃薯200 g、葡萄糖20 g,操作步骤与PDA培养基制作一致。
1.1.4 主要仪器 体视显微镜(Leica EZ4W,德国徕卡,德国),离心机(凯达TG16G,湖南凯达科学仪器有限公司,中国),紫外-可见分光光度计(日本岛津 UV-1780,岛津公司,日本),旋转薄膜蒸发仪(BUCHI-R210, 瑞士步琦有限公司,瑞士),恒温振荡培养箱(KS 4000i control,IKA,德国),超净工作台(博迅SW-CJ-1CU,上海博迅医疗生物仪器股份有限公司,中国),超声波清洗器(SG250H,上海冠特超声仪器有限公司,中国),旋涡混合器(GL-88B,海门市其林贝尔仪器制造有限公司,中国),生化培养箱(SHP-150,上海森信实验仪器有限公司,中国),电子天平[SQP,赛多利斯科学仪器(北京)有限公司,中国]。
1.1.5 其他材料 酶试剂盒(南京建成生物工程研究所),DNA抽提试剂盒(擎科生物科技有限公司),PCR通用引物(擎科生物科技有限公司设计合成),1.5%琼脂糖凝胶电泳(1.5 g琼脂糖,100 mL 1×TAE缓冲液);乙酸乙酯、二甲基亚砜等试剂(国药集团化学试剂有限公司)。
1.2 试验方法
1.2.1 苦楝内生真菌的分离与纯化 将采集的苦楝组织样品用无菌水清洗干净,依次经75%(V/V)的酒精溶液浸洗4~5 min,2%(V/V)的次氯酸钠浸洗4~5 min,75%酒精浸洗0.5 min,无菌水漂洗2~3次,用灭菌滤纸吸干多余水分后,用灭菌解剖刀将苦楝的茎、叶、果实切成小段/小片,放置于PDA固体培养基上,每皿3块组织,于 28 ℃恒温倒置培养,将各组织的最后一次无菌水冲洗液涂布于PDA培养基上平行培养,以检测苦楝组织消毒是否彻底[11-13]。待组织块长出菌丝后,用灭菌接种针挑取菌丝尖端转接于PDA固体培养基上,在PDA固体培养基上纯化后,PDA斜面培养基4 ℃保存。
1.2.2 摇瓶发酵 将4 ℃保藏的菌种接种于PDA固体培养基中活化,生化培养箱28 ℃静置培养7 d活化。将活化好的菌株切块接入装有150 mL PDB液体培养基的锥形瓶中,接种后, 28 ℃、180 r·min-1振荡培养3 d[14]。
1.2.3 活性菌株初筛 将发酵液于6 000 r·min-1离心10 min去除菌丝,使用微孔过滤器(0.22 μm)过滤得到滤液,待生长于灰葡萄孢培养基上的大多数线虫处于妊娠期(J4/成虫)时,将线虫同龄(生长期)化,使所有线虫处于同一生长水平,使用贝尔曼漏斗法,线虫静置12 h后收集至离心管中,于4 000 r·min-1离心5 min,用0.9%生理盐水冲洗3次,配置成100条·mL-1的线虫悬浮液,在24孔板中,每孔加入0.5 mL的线虫悬浮液,再加入等量发酵液,以背景溶液作为空白对照,设置3个平行试验,分别于处理后12、24、36和48 h在体视显微镜下观察线虫的存活状况。虫体运动且为螺旋形判定为活虫;虫体不运动且身体僵直判定为死虫。按以下公式计算死亡率和校正死亡率[15]。
死亡率=死虫数/供试虫数×100%
校正死亡率=(处理组死亡率-对照组死亡率)/(1-对照组死亡率)×100%
1.2.4 胞内、胞外代谢产物制备 活性菌株摇瓶发酵3 d后,对发酵液进行离心,将菌丝与真菌发酵液分离,滤液中加入等体积的乙酸乙酯,萃取3次后合并萃取液,减压回收溶剂得到胞外代谢产物,称量后用2%(V/V) 二甲亚砜(DMSO)溶解配置成20 mg·mL-1溶液,置于4 ℃保存,备用。菌丝加入100 mL乙酸乙酯,超声萃取30 min后静置,减压回收溶剂得到胞内代谢产物,称量后用2% DMSO溶解配置成20 mg·mL-1溶液,置于 4 ℃保存,备用[16-17]。将得到的胞内、胞外代谢产物用2% DMSO连续稀释制备2、1、0.6和0.4 mg·mL-1的系列测试溶液。
1.2.5 室内毒力测定 参照“1.2.3”的方法,以2% DMSO作为空白对照,每个浓度设置3个平行试验,分别于12、24、36和48 h在体视显微镜下观察线虫的存活情况,根据公式计算死亡率和校正死亡率。
1.2.6 对松材线虫卵孵化的影响 用贝尔曼漏斗收集处于妊娠期的松材线虫,用无菌水清洗3次后置于空白培养皿中培养12 h,待线虫产卵并黏底后,用无菌水收集松材线虫卵,配制为卵悬浮液(约200个·mL-1)。将约0.5 mL卵悬浮液和0.5 mL测试溶液混合在24孔板中,混合溶液的终质量浓度为2、1、0.6和0.4 mg·mL-1。在25 ℃黑暗环境下孵育24和48 h后,在体视显微镜下统计孵化的卵数[18]。
线虫孵化率=孵化线虫数/处理线虫卵数×100%
线虫孵化抑制率=(对照线虫孵化率-处理线虫孵化率)/对照线虫孵化率×100%
1.2.7 对松材线虫酶活力的影响 取4 mL松材线虫(约10万条),分别加入1 mL配置好的菌株J352-03胞内、胞外代谢产物,溶液的终质量浓度为0.5 mg·mL-1,充分混匀,以背景溶液作为对照,每处理设3次重复。将各管置于28 ℃培养箱中避光培养,分别于12、24、36和48 h 充分摇匀后取出1 mL,4 000 r·min-1离心5 min,去上清,以蒸馏水清洗3次。加入适量生理盐水冰浴匀浆,2 500 r·min-1离心10 min后取上清,用生理盐水定容至1 mL。使用考马斯亮蓝G250染色法测定线虫匀浆液的蛋白含量,并根据酶试剂盒说明测定酶的活性[19]。
1.2.8 活性内生真菌的鉴定 形态学鉴定:灭菌接种针挑取菌丝接种于PDA固体培养基上,于28 ℃真菌培养箱中培养3~5 d,观察菌落的形态特征。挑取纯化后的菌丝通过插片法制作真菌显微玻片,观察菌丝和分生孢子形态等特征,根据菌株的形态特征,查阅相关文献,比对观察结果,初步确定菌株的分类地位。
分子生物学鉴定:采用硅基质吸附柱法从真菌中抽提DNA。采用通用引物[20]ITS1 (5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)扩增ITS区序列,PCR 扩增条件:95 °C预变性5 min,扩增40个循环(95 °C变性15 s,50 °C 退火20 s,72 °C延伸40 s)。采用1.5%琼脂糖凝胶电泳检测PCR产物。
PCR产物送至上海元莘生物医药科技有限公司测序。利用NCBI-BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)对所测内生真菌ITS区序列进行同源性比对,得到真菌序列同源性最相似种属,借助软件MEGA11(Mega Limited;新西兰)采用邻接法(Neighbor-joining)构建系统进化树,确定各分离菌株的种类。
1.2.9 数据分析 利用Excel 2010进行数据、图表处理。采用Graphpad Prism 8.0(GraphPad Software;美国)软件计算半数致死浓度(LC50)以及方差分析(Analysis of Variance,简称ANOVA),并使用Tukey检验(P=0.05)比较数据之间的差异显著性。
2 结果与分析
2.1 杀松材线虫活性菌株的筛选
2.1.1 活性菌株初筛 按照“1.2.3”的方法对31株苦楝内生真菌发酵滤液的杀线活性进行测定,发现菌株J352-03对松材线虫的毒性较强。由表1可知,该菌株发酵液处理48 h时线虫的校正死亡率可达到100%。
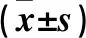
表1 菌株J352-03对松材线虫的杀线活性
2.1.2 J352-03胞内和胞外代谢产物对松材线虫的杀虫活性 按照“1.2.4”方法制备菌株J352-03胞内和胞外代谢产物,将松材线虫置于不同梯度质量浓度(2、1、0.6和0.4 mg·mL-1)的J352-03胞内和胞外代谢产物中,分别在浸渍处理12、24、36和48 h后观察松材线虫的存活状况并计算校正死亡率(图1),图1表明菌株J352-03对松材线虫的毒杀活性呈现出随着样品浓度的提高而增加的趋势,在2 mg·mL-1质量浓度下浸渍处理松材线虫48 h后,菌株J352-03胞内、胞外的次生代谢产物对松材线虫的校正死亡率可高达100%。
同组不同小字母表示 0.05 水平上差异显著
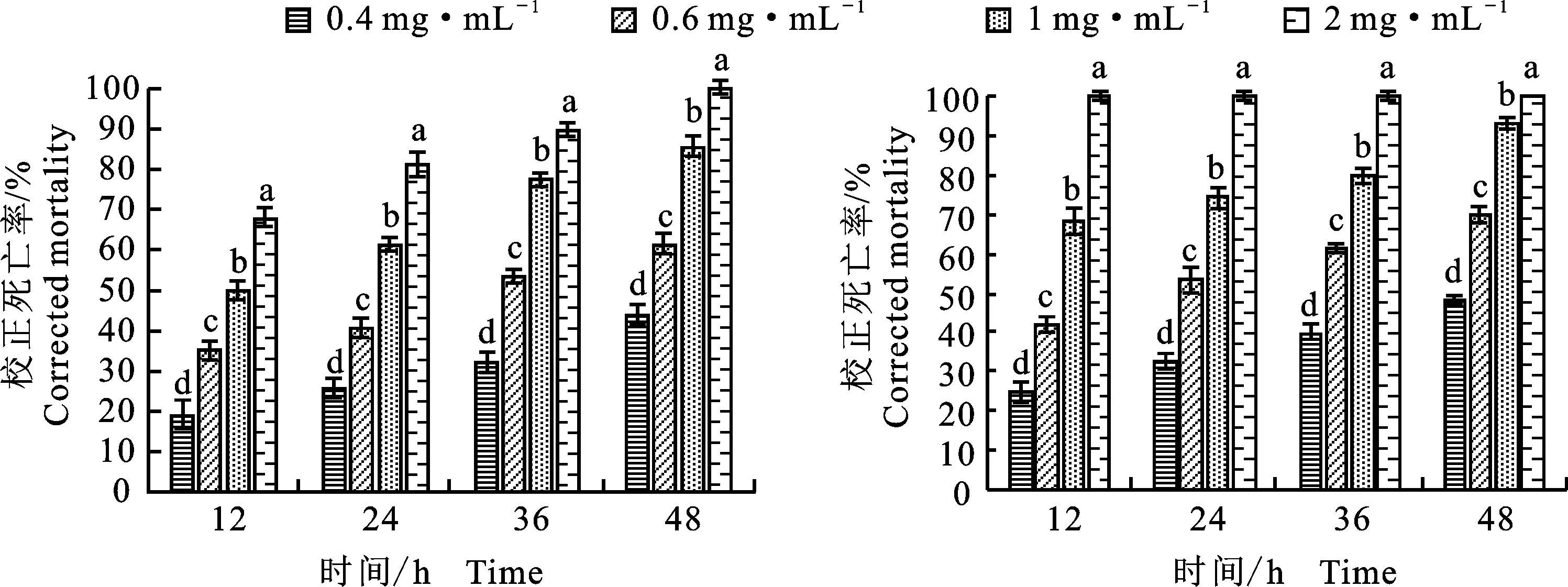
2.1.3 半致死浓度LC50运用Graphpad Prism 8.0对松材线虫暴露于菌株J352-03次生代谢产物的校正死亡率数据进行拟合得到LC50值以及毒力回归方程(表2),结果显示菌株J352-03的次生代谢产物对不同处理时间的松材线虫均表现出显著的杀虫活性,在48 h时松材线虫死亡率达到最高值,胞内、胞外代谢产物的LC50值分别为 0.46、0.42 mg·mL-1。
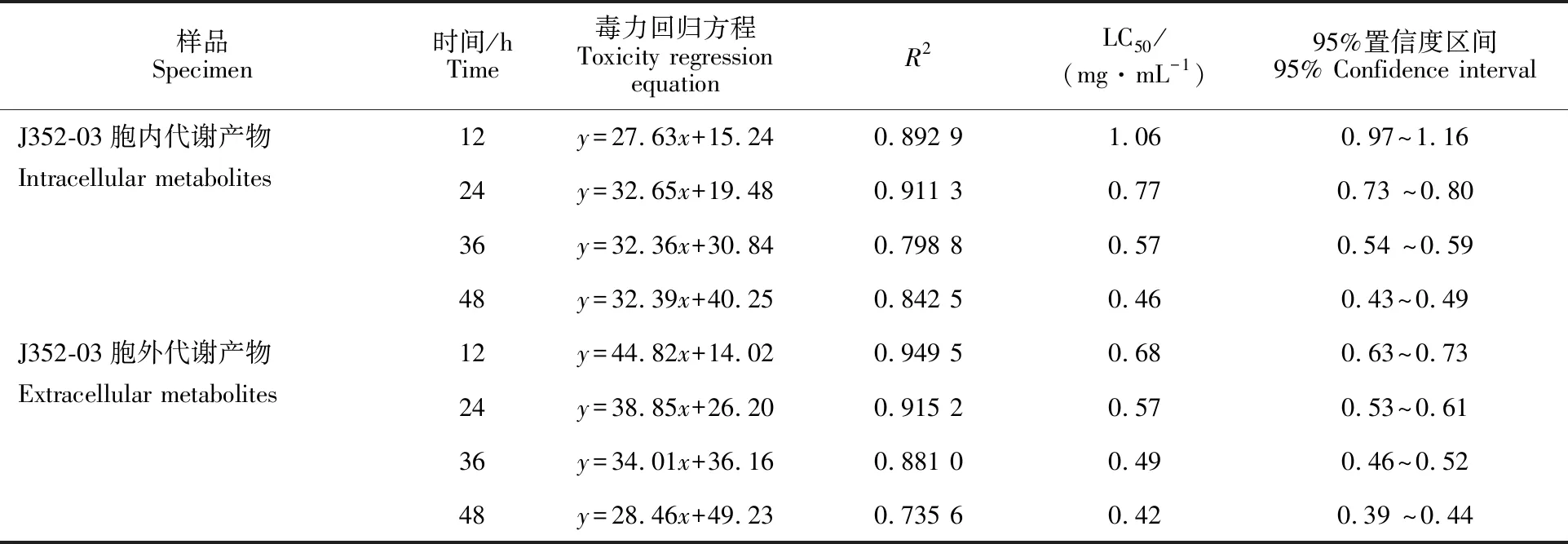
表2 菌株J352-03胞内和胞外代谢产物毒杀松材线虫作用的LC50值
2.2 对松材线虫卵孵化的影响
菌株J352-03的胞内代谢产物处理24 h时,在2、1、0.6、0.4 mg·mL-1质量浓度下的孵化率分别为20.02%、24.84%、42.81%、57.69%,显著低于对照组(79.16%;P<0.05);在处理48 h时累积孵化率分别为28.75%、35.42%、 51.67%、62.33%,显著低于对照组(85.42%;P<0.05)。菌株J352-03胞外代谢产物处理 24 h时,2、1、0.6、0.4 mg·mL-1质量浓度下的孵化率分别为10.51%、20.11%、34.76%、 47.58%,显著低于对照组(79.16%;P<0.05);在处理48 h时累积孵化率分别为20.42%、 29.17%、44.17%、55.42%,显著低于对照组 (85.42%;P<0.05)。随浓度的增加,其对线虫的孵化抑制活性逐渐增强,在2 mg·mL-1质量浓度下浸渍24 h时,胞内、外代谢产物对线虫的孵化抑制率为74.74%, 86.74%,浸渍48 h时抑制率为66.54%、76.05%(图2)。
图2 菌株J352-03代谢产物处理24 h和48 h后松材线虫的累积孵化率(A)和孵化抑制率(B)
2.3 对松材线虫酶活力的影响
2.3.1 对松材线虫乙酰胆碱酯酶活力的影响 松材线虫乙酰胆碱酯(AChE)对J352-03胞内、外代谢产物非常敏感,对照组与给药组AChE活力在不同时间段的变化趋势相对一致,给药处理组AChE活力始终低于对照组(图3;P<0.05), 24~48 h,胞内、胞外代谢产物处理后的两组松材线虫AChE活力接近,无显著性差异(P>0.05)。

图3 菌株J352-03代谢产物处理下松材线虫体内乙酰胆碱酯酶酶活力的变化
2.3.2 对松材线虫三磷酸腺苷酶活力的影响 由图4可知,给药处理组的三磷酸腺苷酶(ATP酶)活力在不同时间点均低于对照组的ATP酶活力,并且存在显著性差异(P<0.05),胞内、胞外代谢产物处理48 h时,两组松材线虫ATP酶活力相近,分别为1.92、1.5 U·mgprot-1,无显著性差异(P>0.05)。表明菌株J352-03的胞内、外代谢产物可以有效地抑制松材线虫ATP 酶的活性。
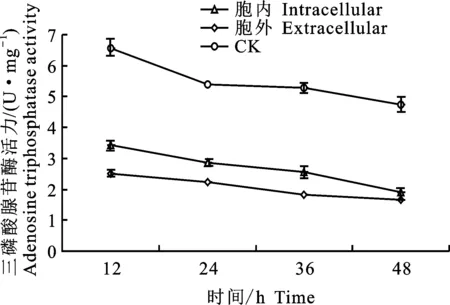
图4 菌株J352-03代谢产物处理下松材线虫体内三磷酸腺苷酶活力的变化
2.3.3 对松材线虫超氧化物歧化酶活力的影响 图5显示,在处理12 h时,对照组松材线虫的超氧化物歧化酶(SOD)活力为160.43 U·mgprot-1,此时浸渍于胞内、胞外代谢产物中的松材线虫的SOD活力为109.5、81.11 U·mgprot-1,显著低于对照组(P<0.05)。12~36 h,给药处理组与对照组变化趋势相对一致。在36 h后,给药处理组松材线虫的SOD活力依旧呈下降趋势,但此时对照组SOD活力小幅度提升。整个变化过程中给药处理组SOD活力显著低于对照组 (P<0.05),表明菌株J352-03的胞内、外代谢产物可以抑制松材线虫的SOD活力。
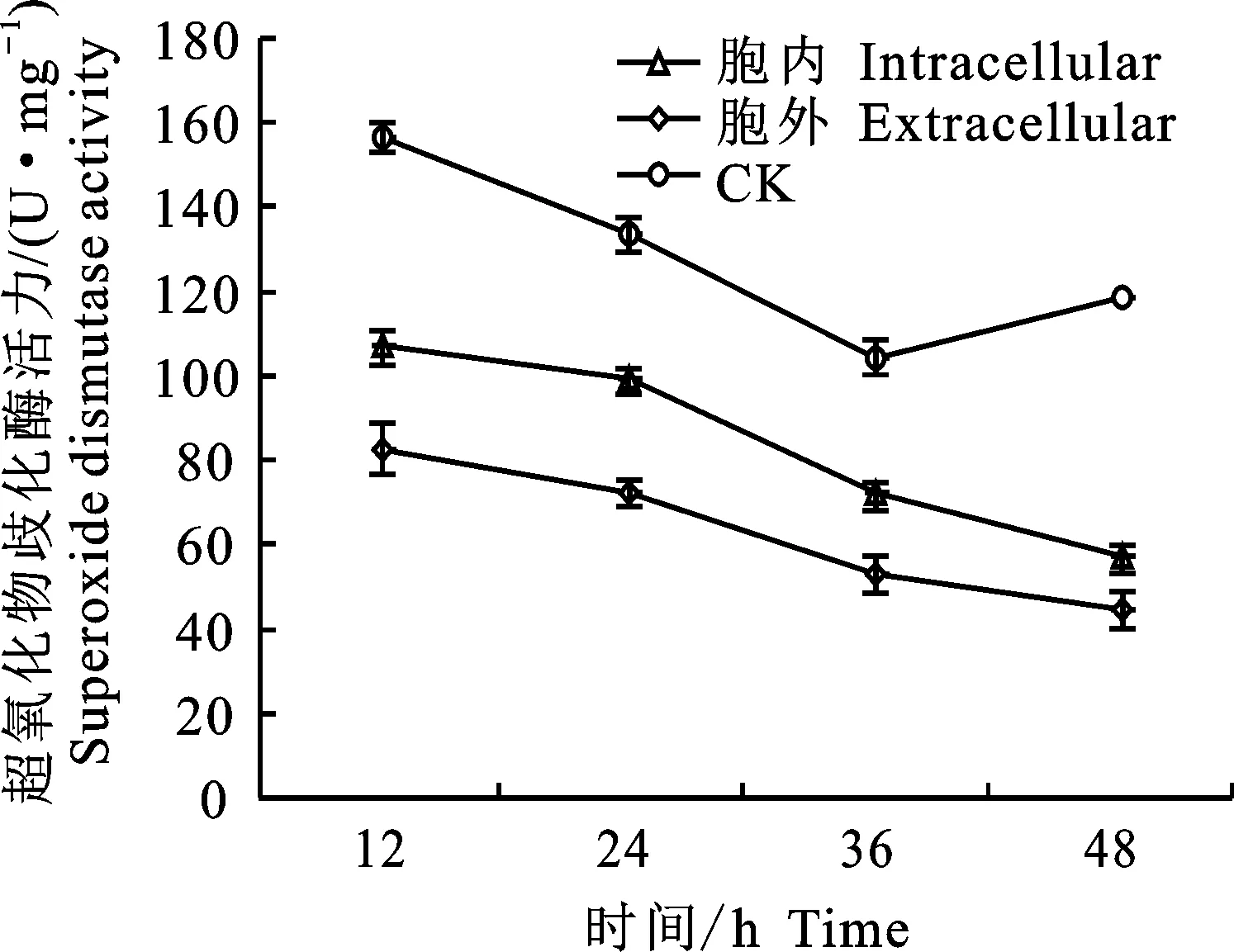
图5 菌株J352-03代谢产物处理下松材线虫体内超氧化物歧化酶活力的变化
2.3.2 对松材线虫过氧化氢酶活力的影响 图6显示,在松材线虫暴露24 h前,给药处理组松材线虫的过氧化氢酶(CAT)活力显著高于对照组(P<0.05),在24 h时,3 组松材线虫的CAT活力无显著性差异(P>0.05),但是随着中毒时间的延长,给药处理组CAT活力逐渐被抑制,对照组CAT活力显著高于给药处理组(P<0.05)。
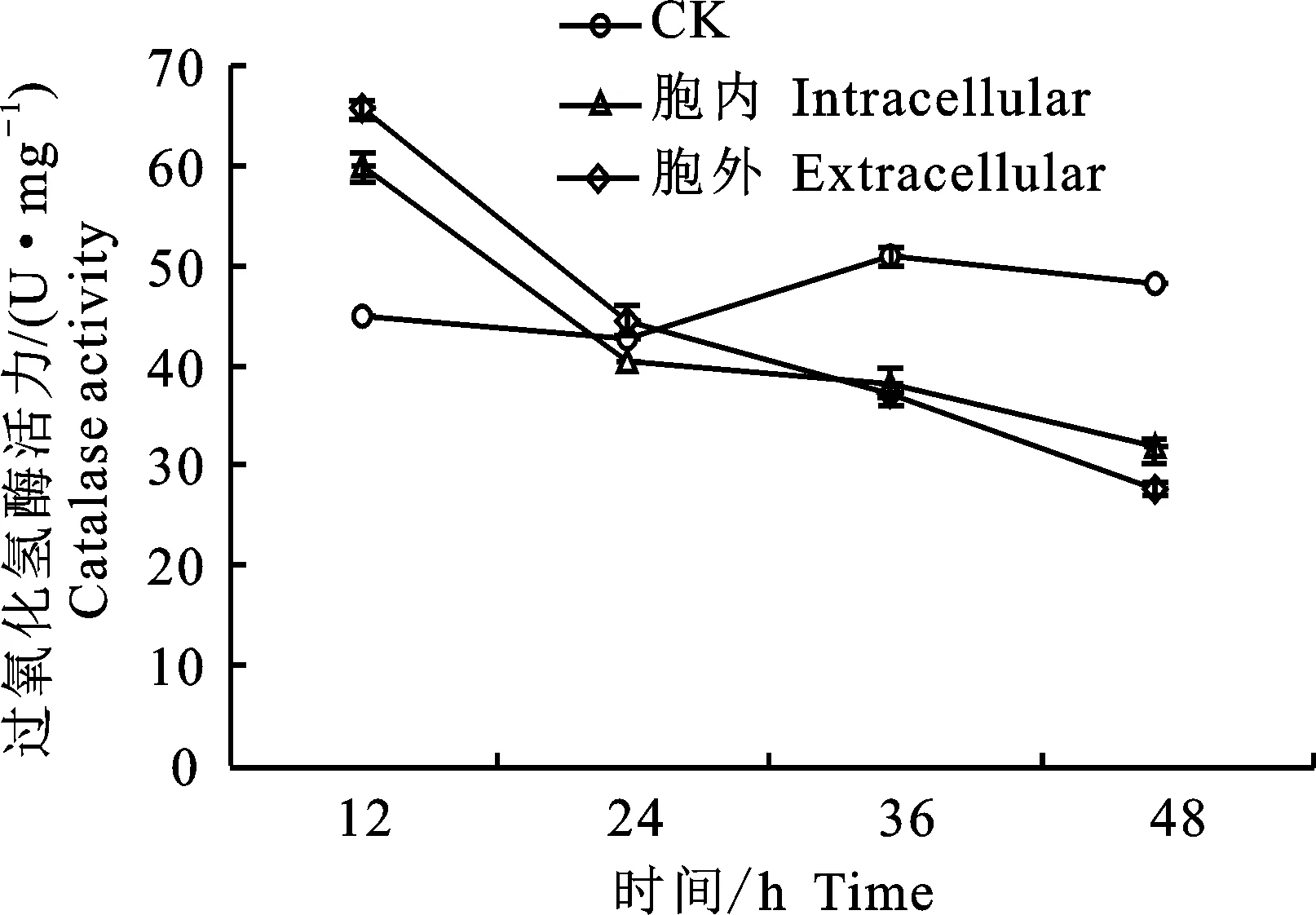
图6 菌株J352-03代谢产物处理下松材线虫体内过氧化氢酶酶活力的变化
2.4 有杀线虫活性菌株的鉴定
2.4.1 表型特征 如图7所示,菌株J352-03在PDA培养基上的菌落外观呈白色,边缘规则,菌落干燥不透明,28 ℃避光培养时生长迅速,培养3 d菌落直径可达5 cm,培养后期会出现黑色的分生孢子器。油镜下观察,菌丝发达呈细长分枝状,分生孢子呈椭圆形,与文献[21]一致,初步鉴定J352-03为间座壳属真菌。
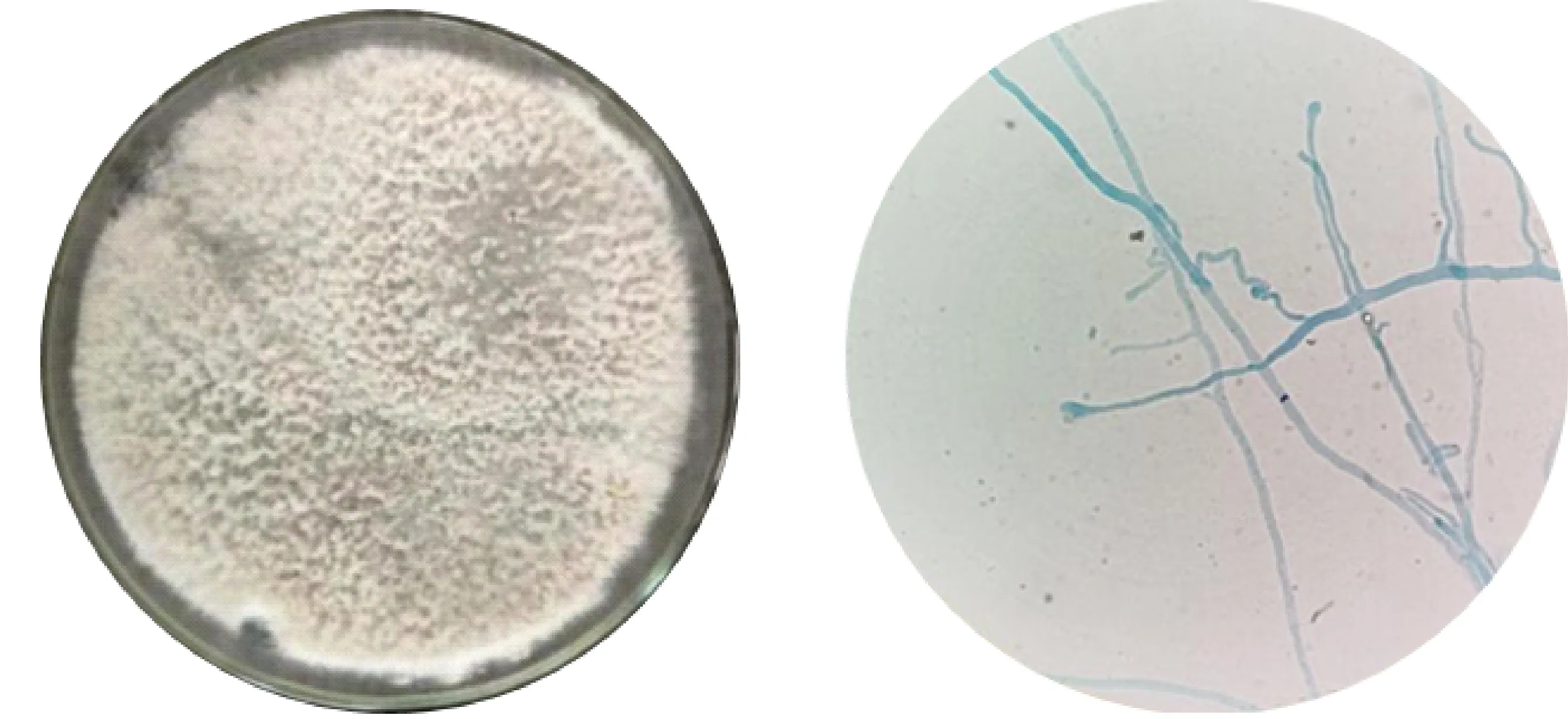
图7 菌株J352-03的菌落及其菌丝形态(100x)
2.4.2 ITS区序列分析以及系统发育树构建 将提取到经琼脂糖凝胶电泳检测质量良好的DNA,通过PCR扩增得到ITS序列,PCR产物经凝胶电泳检测(图8)。将测序得到的ITS区序列通过NCBI-BLAST进行同源性比对,取同源性最相近的10个种属的序列借助软件MEGA11构建系统进化树,构建的系统进化树(图9)表明,菌株J352-03与Diaporthesp.(登录号:KU375703.1)聚类在同一分支,两者序列相似性为99.46%。根据同源性比较结合菌株的形态学观察,将菌株J352-03鉴定为间座壳属中的一个未知种Diaporthesp.。
图8 菌株J352-03 rDNA-ITS序列PCR鉴定
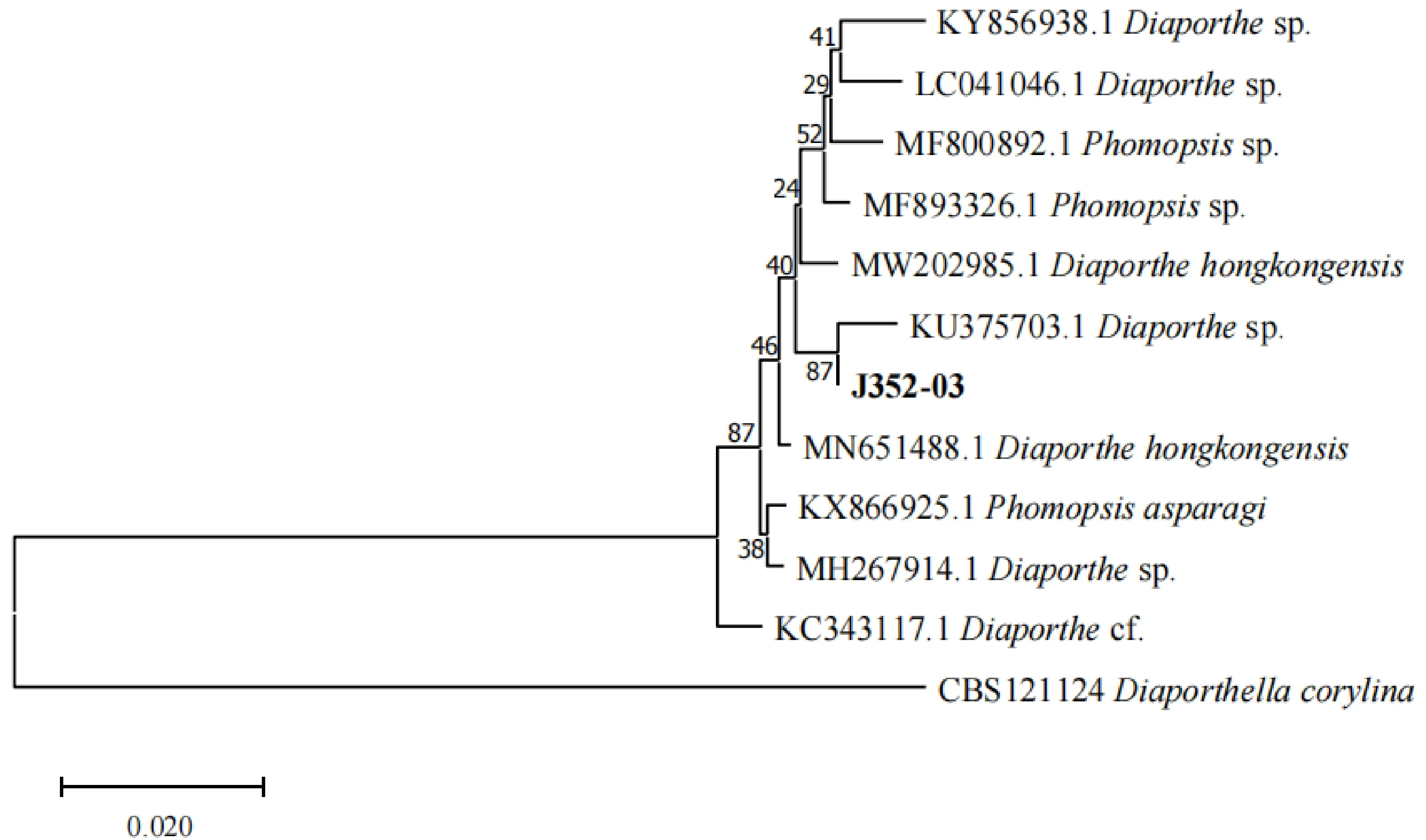
图9 基于ITS序列建立的菌株J352-03及其近似种的系统发育树
3 讨论与结论
Diaporthesp.属于间座壳属真菌,该属真菌通常从植物中分离得到,广泛存在于自然界,近年来国内外研究者对其次生代谢产物进行了研究,发现其次生代谢产物具有结构多样性以及丰富的生物活性,主要包括生物碱类、萜类、吡喃酮类、蒽醌类、酸衍生物、醇类和酰胺类等。Diaporthesp.中的生物活性化合物丁香酚可以用来抑制细菌以及抗氧化剂[22-23];Li等[24]分离到一种羊毛甾醇衍生物对革兰氏阳性菌和阴性菌,特别是对临床分离的化脓性链球菌(Streptococcuspyogenes)和铜绿假单胞菌(Pseudomonasaeruginosa),以及对人致病的金黄色葡萄球菌(Staphylococcusaureus)均有明显的抗菌作用。此外,还具有细胞毒性、抗菌、抗高胆固醇、抗结核、抗糖尿病、抗氧化和抗炎特性[25]。因此,Diaporthesp.在农药医药方面有潜在的应用价值,但是,目前对于Diaporthesp.的杀虫活性鲜有报道,Zhang等[25]从Diaporthesp.中分离到两种高度取代的二苯甲酮抑制剂,可显著抑制寄生虫环磷酸鸟苷(cyclic guanosine monophosphate,简称cGMP)依赖性蛋白激酶活性,这说明Diaporthesp.可潜在成为杀线生防菌。
线虫在受到外源性伤害时,其体内与代谢相关的酶活性会发生改变[26-27],乙酰胆碱酯酶(AChE)是一种参与神经传递的重要蛋白质,是有机磷酸盐和氨基甲酸盐类杀虫剂的重要靶标,位于突触后膜上的AChE将神经递质乙酰胆碱水解为胆碱和醋酸酯来终止信号,在线虫体内起着终止神经冲动的重要作用。给药处理组可以显著抑制AChE酶活力,推测给药后的松材线虫通过抑制AChE导致乙酰胆碱不能被水解,在突触间隙积累,最终引起虫体肌肉剧烈收缩,产生痉挛性麻痹,导致线虫死亡。三磷酸腺苷酶(ATP酶)是一种与物质运送、能量转换以及信息传递相关的蛋白酶,与机体代谢密切相关,也是菊酯类杀虫剂的主要作用靶标之一。由于ATP酶是能量转换的关键酶,推测当ATP酶活性被抑制时,线虫生命活动所需要的能量不能被满足,最终导致线虫死亡;超氧化物歧化酶(SOD)、过氧化氢酶(CAT)等抗氧化酶有助于抵消活性氧(ROS)在细胞和分子水平上引起氧化损伤的毒性。SOD是松材线虫体内的一种富含金属离子的抗氧化酶,当SOD含量充足时,自由基被俘获,细胞处于健康状态,但是当SOD含量缺失或不足时,细胞受自由基侵害,发生变异、衰老或死亡。当松材线虫的SOD活性受到抑制时,将会影响线虫体内清除氧自由基的效率,从而造成线虫体内毒素堆积,使细胞膜产生过氧化,导致细胞膜破坏和损伤,最终导致线虫死亡,线虫细胞正常的生理代谢遭到干扰,从而破坏线虫的抗氧化保护酶系;CAT是一种四亚基血红素酶,是松材线虫体内的解毒相关酶,松材线虫体内的过氧化氢对细胞高度有害,其积累将导致DNA、蛋白质和脂质的氧化,从而导致细胞凋亡,CAT通过将过氧化氢分解为水和分子氧来阻止细胞产生活性氧(ROS),使细胞免受过氧化氢的伤害。给药处理组线虫前期CAT酶活力明显高于对照组以满足松材线虫中毒后的解毒需求,但是随着中毒时间的延长,给药组CAT酶活力逐渐被抑制,松材线虫在菌体代谢产物的作用下体内的过氧化氢得不到分解,在线虫体内积累,从而使松材线虫体内产生毒性很大的氢氧自由基,细胞功能受到极大的影响并逐渐凋亡,最终导致线虫死亡。Diaporthesp.的代谢产物对4 种酶活性均有抑制作用,表明其毒性作用机制可能是综合作用产生。
本研究从苦楝中分离得到1株具有高效杀线虫活性的菌株Diaporthesp.,研究表明,Diaporthesp.代谢产物对松材线虫具有较强的致死作用,对松材线虫卵的孵化以及体内代谢活动相关酶(AchE、SOD、ATP、CAT)活性均有不同程度的抑制作用。对Diaporthesp.杀线虫的主要成分及其机制有待深入研究。
