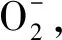信号在冬小麦根系细胞中的产生及传导机理
2023-09-14祁伟亮孟建军刘自成施万喜杨财容乔义林李金玲陈思伟姚来来赖守孝刘文辉袁兰兰
祁伟亮,孟建军,张 成,刘自成,施万喜,杨 虓,乔 岩,杨财容,乔义林,李金玲,陈思伟,姚来来,赖守孝,张 鹏,刘文辉,王 婧,袁兰兰
(1.陇东学院 农林科技学院,甘肃庆阳 745000;2.陇东旱地作物种质改良及产业化协同创新中心,甘肃庆阳 745000;3.甘肃省旱地冬小麦种质创新与应用工程研究中心,甘肃庆阳 745000; 4.成都师范学院 化学与生命科学学院,特色园艺生物资源开发与利用四川省高校重点实验室,成都 611130)
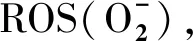
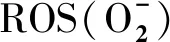
1 材料与方法
1.1 试验材料
材料有品种‘陇育5号’‘陇育8号’‘陇育10号’及品系‘陇育5-2’,源于陇东学院小麦研究所。
1.2 试验方法
1.2.1 冬小麦遗传背景分析 为进一步明确冬小麦品种‘陇育5号’‘陇育8号’‘陇育10号’及品系‘陇育5-2’的遗传背景,染色体制片按照Qi等[14]的方法进行。首先将制备好的片子进行荧光原位杂交(Fluorescence in situ hybridization,FISH)分析,选用探针pSc119.2(绿色)和pTa535(红色)检测冬小麦品种‘陇育5号’‘陇育8号’‘陇育10号’及品系‘陇育5-2’的A、B、D染色体组。探针pSc119.2主要区分小麦B基因组,探针pTa535主要识别小麦A、B、D基因组[15]。探针pSc119.2和pTa535由上海英骏生物技术有限公司合成,杂交程序参照Fu等[16]和Qi等[14]的方法配置10 μL杂交液体系:pSc119.2(0.3 μL)+pTa535(0.3 μL)+9.4 μL(2 × SSC和 1×TE)缓冲液瞬时离心混合。每张载玻片上滴加10 μL探针工作液,置于37 ℃恒温水浴锅中杂交2 h,杂交完后用2×SSC溶液清洗,晾干后向每张载玻片上滴加10 μL DAPI复染液,黑暗环境下放置10 min后,然后用荧光显微镜(Olympus BX-51)采集照片。
1.2.2 ROS信号组织检测 挑选籽粒饱满的冬小麦种子,清洗干净、吸干、低温(4 ℃)春化12 h,以打破种子休眠。将冬小麦品种‘陇育5号’‘陇育8号’‘陇育10号’及品系‘陇育5-2’分别进行正常处理(25 ℃)、DPI+正常处理(25 ℃)、冷胁迫 (4 ℃)和DPI+冷胁迫(4 ℃)抑制处理。
正常处理(25 ℃)和DPI+正常处理(25 ℃):将冬小麦品种‘陇育5号’‘陇育8号’‘陇育10号’及品系‘陇育5-2’在正常处理(25 ℃)和 DPI+正常处理(25 ℃)条件下培养2 d,培养条件为昼夜温度(25 ℃),光/暗周期(14 h/10 h),光照度(6 000 lx)。因DPI+正常处理(25 ℃)后种子未发芽,对正常处理(25 ℃)1 d和2 d的材料进行ROS组织染色,染色方法参照 Kumar等[17]的方法,首先将氯化硝基四氮唑蓝(NBT)1%溶液倒入培养瓶,淹没种子并避光侵染8 h。其后将材料浸泡在无水乙醇中。最后用甘油浸制并固定试验材料并在正置荧光显微镜(BA410E)下拍照。DPI(317.92 μmol/L)称取10 mg二苯基氯化碘盐,以少许二甲亚砜溶解,用50 mmol/L磷酸缓冲液(pH 7.8)定容至100 mL。
冷胁迫(4 ℃)处理和DPI+冷胁迫(4 ℃)抑制处理:为了明确冷胁迫处理后,冬小麦品种‘陇育5号’‘陇育8号’‘陇育10号’及品系‘陇育5-2’在冷胁迫(4 ℃)环境下的发芽率、根系和芽的生长情况及ROS信号在冬小麦组织细胞中的产生规律。首先将冬小麦品种‘陇育5号’‘陇育8号’‘陇育10号’及品系‘陇育5-2’在冷胁迫 (4 ℃)条件下培养7 d,培养条件为昼夜温度 (4 ℃),光/暗周期(14 h/10 h),光照度(6 000 lx)。然后分别对培养7 d的材料进行发芽率、根长和芽长测定,发芽率=种子发芽数/供试种子数×100%。

2 结果与分析
2.1 冬小麦遗传背景及种子发芽情况分析
为进一步明确冬小麦品种‘陇育5号’‘陇育8号’‘陇育10号’及品系‘陇育5-2’的遗传背景,以pSc119.2和pTa535为探针进行遗传背景分析,结果表明:‘陇育5号’(图1-a)、‘陇育5-2’(图1-b)、‘陇育8号’(图1-c)和‘陇育10号’(图1-d)等材料均属于六倍体材料(2n=42),染色体组成为AABBDD基因组。

以pSc119.2(绿色)和pTa535(红色)为探针对‘陇育5号’(a)、‘陇育5-2’(b)、‘陇育8号’(c)和‘陇育10号’(d)进行鉴定
在正常(25 ℃)环境下‘陇育5号’‘陇育5-2’‘陇育8号’和‘陇育10号’的发芽率无显著差异(P>0.05)且发芽率均在95%以上,这说明供试材料的种子生长活力较好。在4 ℃冷胁迫环境下培养7 d后,‘陇育5号’‘陇育5-2’‘陇育8号’和‘陇育10号’种子的发芽率分别为91.71%、 90.63%、72.45%和62.78%(表1),且冷胁迫 (4 ℃)环境下品系‘陇育5-2’和‘陇育5号’的长势显著好于‘陇育8号’和‘陇育10号’(图2),其中‘陇育5号’的芽长为2.15 cm,显著长于品系‘陇育5-2’,但品系‘陇育5-2’的根长为3.81 cm,显著长于‘陇育5号’(表1),这说明‘陇育5-2’和‘陇育5号’在冷胁迫环境下的适应能力存在差异性。
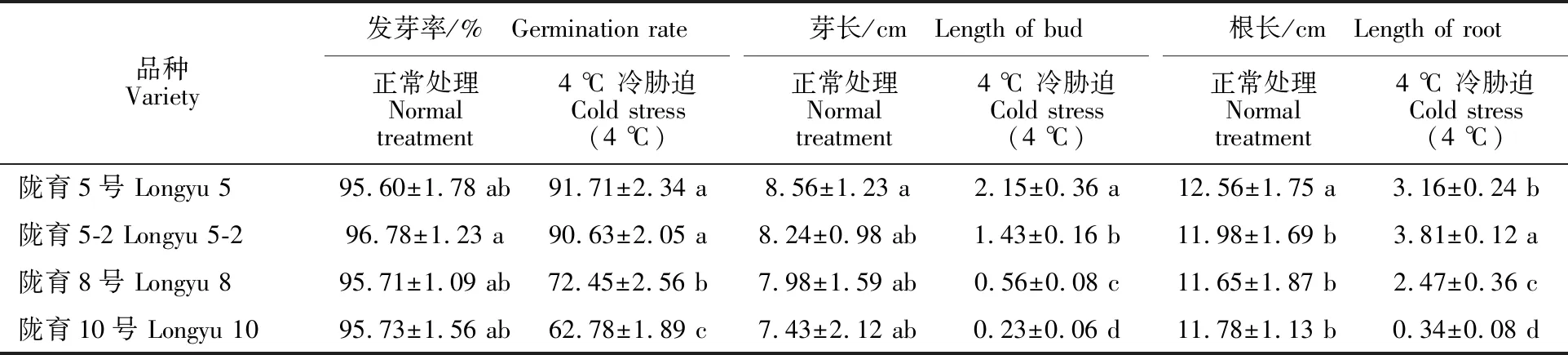
表1 冷(4 ℃)胁迫处理后冬小麦发芽率及生长情况

冬小麦‘陇育5号’(a)、‘陇育5-2’(b)、‘陇育8号’(c)和‘陇育10号’(d)
2.2 正常环境下在冬小麦组织细胞中的分布规律
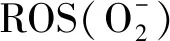

冬小麦‘陇育5号’(a, b, c)、‘陇育5-2’(d, e, f)、‘陇育8号’(g, h, i)和‘陇育10号’(j, k, l)在正常环境下(25 ℃)培养1 d(a, d, g, j)和2 d(b, e, h, k)时,并采用NBT对冬小麦进行染色,蓝色聚合物沉淀代表在植株体内的富集程度。在正常环境下 (25 ℃)DPI处理冬小麦‘陇育5号’(c)、品系‘陇育5-2’(f)、‘陇育8号’(i)和‘陇育10号’(l)2 d
2.2 冷胁迫环境下,在冬小麦组织细胞中的分布规律


对冷(4 ℃)胁迫处理(a, b, c, g, h, i)和冷(4 ℃)胁迫+DPI处理 (d, e, f, j, k, l)后的冬小麦幼苗进行NBT染色,‘陇育5号’(a, d, g, j)、‘陇育5-2’(b, e, h, k)、‘陇育8号’(c, f, i, l)
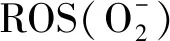
3 讨 论
冬小麦是甘肃主要粮食作物,面积和产量均居全省口粮作物之首,其中旱地小麦约占 75%。而陇东作为甘肃冬小麦的主产区,因冬季严寒干旱、春季降水少,春旱和小麦生育后期高温等环境因素影响,导致冬小麦的越冬率、产量及品质等造成严重影响。因此选育强抗寒抗旱冬小麦品种,是促进甘肃冬小麦增产的有效的技术途径。目前在甘肃陇东等北部晚熟冬麦区生产推广的‘陇育5号’[19]、‘陇育10号’[20]和‘陇育8号’[21]等品种具有较强的抗寒、抗旱性和丰产性,其中‘陇育5号’成为北部冬麦区旱地甘肃陇东和宁夏固原的第一大品种,2017年被全国农技中心确定为“华北、西北地区耐旱节水品种”。本研究通过FISH技术分析,结果表明‘陇育5号’‘陇育8号’‘陇育10号’和品系‘陇育5-2’等材料均属于六倍体材料(2n=42)。在4 ℃冷胁迫环境下培养7 d后,‘陇育5-2’和‘陇育5号’的发芽率和长势显著好于‘陇育10号’‘陇育8号’,这说明‘陇育5-2’和‘陇育5号’在冷胁迫环境下具有较好的适应性。

3.2 NADPH酶介导产生的ROS在冬小麦细胞内及细胞间的信号传导机制