灵芝三萜类物质液态发酵研究进展
2023-09-14刘艳芳苏晓薇唐传红李娥贤李树红张劲松
冯 杰,刘艳芳,苏晓薇,唐传红,李娥贤,李树红,周 帅,张劲松*
(1 上海市农业科学院食用菌研究所,国家食用菌工程技术研究中心,农业农村部南方食用菌资源利用重点实验室,上海市农业遗传育种重点实验室,上海 201403;2 云南省农业科学院生物技术与种质资源研究所,昆明 650223)
灵芝为多孔菌目灵芝科灵芝属真菌,日常生活中所说的灵芝都是指灵芝子实体,其是我国最受重视的传统中药之一,可药食两用[1]。 研究表明:由于灵芝的化学成分复杂,使其含有多样的活性成分[2]。 灵芝已被证明具有治疗癌症、糖尿病和人类免疫缺陷病毒(HIV)病的作用[3],从灵芝中分离出来的主要活性成分有三萜类、多糖类、生物碱类、氨基酸类、油脂类及微量元素等。 灵芝三萜类物质因具有抗肿瘤、保肝、免疫调节、调血脂和降血糖、抗真菌、抗炎和延缓衰老等作用而日益受到国内外研究人员的重视[4-5]。
根据异戊二烯定则,多数三萜被认为是由6 个异戊二烯缩合而成的。 灵芝三萜是羊毛甾烷类衍生物[6],羊毛甾醇是其前体物,羊毛甾烷型灵芝三萜按结构可分为四环三萜和五环三萜,按碳原子数可分为C24、C27 和C30[7]。 根据官能团和侧链的不同,可将其分为灵芝酸、灵芝醇、灵芝醛和灵芝内酯等,以灵芝酸和灵芝醇类为主[8]。
灵芝三萜类物质主要存在于野生采摘和人工栽培的子实体或孢子粉以及液态深层发酵的菌丝体中。人工栽培主要分为原木栽培和代料栽培[9],原木栽培主要是椴木栽培,选择以阔叶树木为主的木头栽培[10];代料栽培中代料指将树木的下脚料和其他辅料如木屑、棉籽壳、麸皮等物质混合制成的培养基,可分为瓶栽和袋栽,目前袋栽应用较为广泛[11]。 液态发酵是在富含必需营养成分的液态培养基中培养灵芝菌丝体,所获得的菌丝体具有较高的生物活性,目前主要利用摇瓶和发酵罐培养,前者主要进行菌种的选育和培养工艺的优化,后者则应用于工业化生产[12]。
目前,野生灵芝较为稀少而较难获取,人工栽培技术不稳定且生长周期较长、成本较高、存在连作障碍,而液态发酵技术有发酵周期短、培养条件易控、不受环境影响、生产效益高、可应用于工业化等优点[13-15],通过液态发酵可获得高得率的菌丝体及高活性的灵芝三萜。
本文从灵芝三萜生物合成途径、液态发酵高产灵芝三萜的培养条件调控、外源物对液态发酵高产灵芝三萜的影响等方面重点阐述灵芝三萜类物质液态发酵的进展,并通过总结代谢通量方法在微生物发酵领域的研究进展,讨论代谢通量在灵芝三萜类物质液态发酵合成方面的应用前景。
1 灵芝三萜类物质生物合成途径
1.1 萜类物质生物合成途径
植物萜类合成主要为质体中的2-C-甲基-D-赤藓糖醇-4-磷酸(MEP)途径和细胞质中的甲羟戊酸(MVA)途径。 有研究表明,MEP 途径合成单萜、二萜和类胡萝卜素,而MVA 途径主要合成倍半萜和三萜[16]。 MEP 途径和MVA 途径都可以生成前体物质异戊烯焦磷酸(IPP)和二甲基烯丙基焦磷酸酯(DMAPP),且IPP 可以在细胞质和质体之间穿梭[17],说明MEP 途径和MVA 途径并非独立存在。 不同数量的IPP 与DMAPP 结合生成香叶基二磷酸(GPP)、法呢基二磷酸(FPP)、香叶基香叶基二磷酸(GGPP)。GPP、FPP 和GGPP 在萜烯合酶(TPS)的作用下生成不同类型的萜烯[18]。 各类烯丙基焦磷酸酯经特异性萜类合酶作用可产生各种萜类的碳骨架,如植烯、鲨烯等[19]。
MEP 途径主要是以丙酮酸和3-磷酸甘油醛(GAP)通过1-脱氧-5-磷酸-D-木酮糖合成酶(DXS)转化成1-脱氧-木酮糖-5-磷酸(DXP),经过多步反应,最后生成IPP 和DMAPP[18,20](图1)。 DXS 及DXR 是MEP途径的两个关键酶,其活性直接影响下游萜类化合物的合成[16]。

图1 植物萜类物质合成的MEP 途径Fig.1 MEP pathway for the synthesis of plant terpenoids
MVA 途径是由乙酰辅酶A(Ac-CoA)经过乙酰辅酶A 硫解酶(AACT)和β-羟基-β甲基戊二酰-CoA 合成酶(HMGS)催化、缩合生成羟甲基戊二酰CoA(HMG-CoA),再由3-羟基-3-甲基戊二酸单酰辅酶A 还原酶(HMGR)催化生成MVA,MVA 经过多步反应后在甲羟戊酸-5-焦磷酸脱羧酶(MDD)的作用下生成IPP[21](图2)。 HMGR 是MVA 途径的第一个关键限速酶,其活性直接影响下游产物的合成[17]。
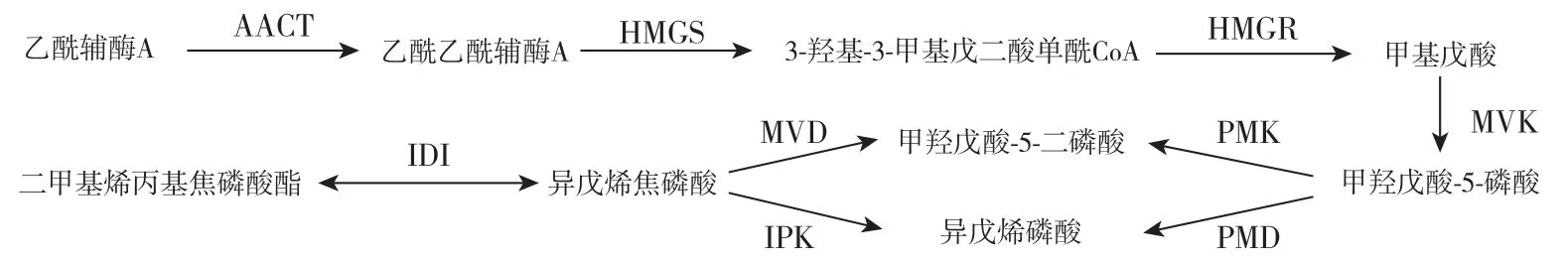
图2 植物萜类物质合成的MVA 途径Fig.2 MVA pathway for the synthesis of plant terpenoids
1.2 灵芝三萜生物合成途径
灵芝三萜类化合物主要是一类高度氧化的羊毛甾烷衍生物,灵芝酸是灵芝三萜中的一类,主要是通过甲羟戊酸途径进行生物合成。 甲羟戊酸途径经过多步反应生成三萜的前体物质:IPP 和DMAPP,在萜类合酶的作用下生成法呢基焦磷酸(FPP),后在鲨烯合酶(SQS)的作用下产生鲨烯(SQ),经多步反应合成羊毛甾醇(LS)。 合成途径的下游部分是羊毛甾醇,羊毛甾醇在合成灵芝酸的同时还会产生麦角甾醇和酵母甾醇[22](图3)。 目前羊毛甾醇合成灵芝酸的途径仍然未知,有研究表明[23],细胞色素P450(CYP450)单加氧酶参与了合成途径,并且发现CYP450 对应的基因在修饰羊毛甾醇骨架、催化羊毛甾醇合成灵芝酸具有重要作用。 Zhang 等[24]经过多次筛选不同培养条件下与类固醇结合的P450 基因,在灵芝中过表达后发现CYP512v2 表达与灵芝酸T 的积累显著相关。 Yang 等[25]研究发现,CYP450 基因中的CYP512U6 可以促进灵芝酸DM 和灵芝酸TR 生成灵芝酸Jc,利用酿酒酵母的甾醇还原酶还能够羟基化改性灵芝酸DM,而CYP505D13 配合生成环状灵芝三萜[26]。 从羊毛甾醇到灵芝三萜中的CYP450 基因方面的研究较复杂,且羊毛甾醇合成的灵芝三萜化合物种类较多,而CYP450 基因的相关研究成果只是“冰山一角”,所以羊毛甾醇合成灵芝酸这一未知途径仍需继续深入研究[27]。
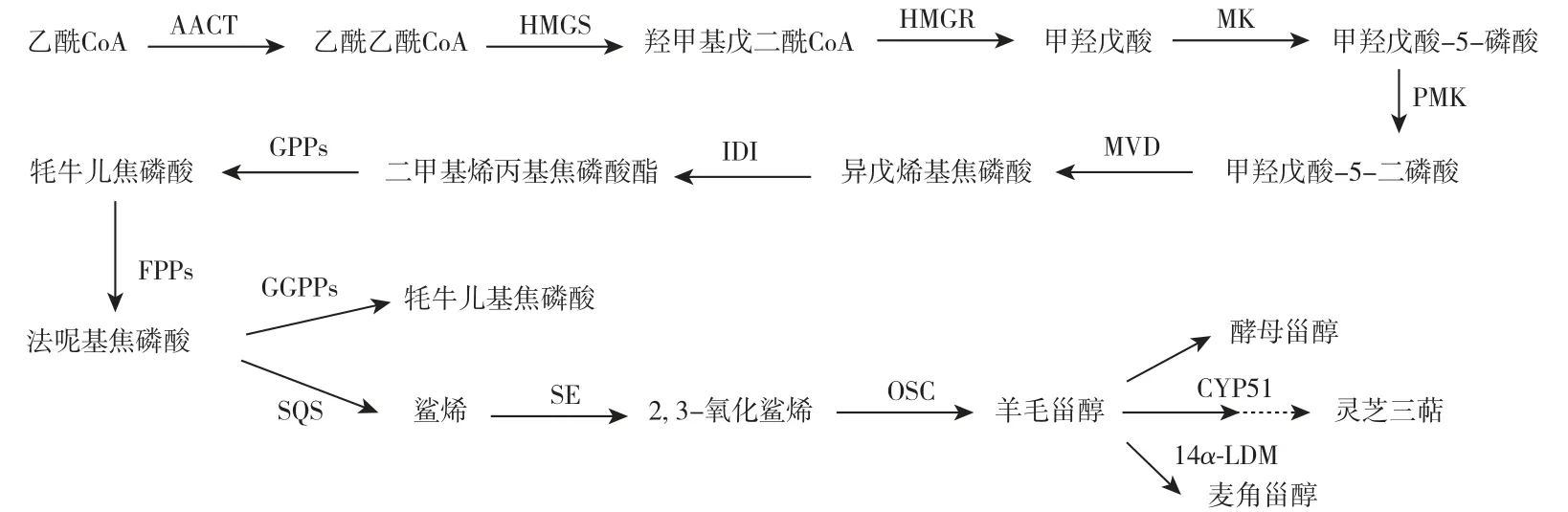
图3 灵芝三萜合成途径Fig.3 Synthesis pathway of Ganoderma triterpenes
2 液态发酵高产灵芝三萜的培养条件调控
2.1 培养基因素调控
灵芝液态深层发酵的主要发酵过程与抗生素发酵过程较为类似,其培养基主要由碳源、氮源、无机盐和微量元素、生长因子等组成。 通过对培养基的优化,可以直接影响灵芝三萜的产生。 王谦等[28]研究发现,玉米粉和葡萄糖较适合灵芝生长,发酵获得的湿菌丝体产量达到35 g∕(100 mL);杨德等[29]研究表明,玉米粉可以提高灵芝菌丝体生物量至2.05 g∕(100 mL)。 金德宽[30]通过使用不同的碳源、氮源、无机盐研究培养基组成对灵芝酸的影响,得到最佳发酵工艺条件为蔗糖40 g∕L、豆饼粉1.5 g∕L、KH2PO41.5 g∕L、MgSO41.5 g∕L,生物量和灵芝三萜产量分别为9.15 g∕L 和0.441 g∕L。 冯杰等[31]研究发现,在‘沪农灵芝1 号’培养过程中添加N-10 酵母自溶粉比对照的灵芝三萜产量提高了6.22%。 翟双星等[32]在基础培养基中使用不同酵母粉进行有机氮源复配试验,发现将酵母粉N-1 与N-2 复配添加时,灵芝三萜产量可达0.478 g∕L,比单一添加酵母粉N-1 和N-2 分别提高了21%和139%。 当酵母粉N-1、N-2、N-3 混合添加时,灵芝三萜产量可达0.514 g∕L,比3 种氮源的对照组分别提高了30%、157%和74%。 Wei 等[33]通过葡萄糖蔗糖混合分批补料方式对灵芝进行液态发酵,灵芝三萜产量比对照提高了40%。
2.2 培养环境因素调控
除了培养基因素调控,发酵温度、发酵时间、溶氧、搅拌转速、pH 等培养条件对灵芝三萜产量的影响也有相关研究。 温度对灵芝消耗葡萄糖的速率有一定影响,促使胞内发生各种生化反应,进而影响菌丝体的生长以及代谢物质的生成。 汪金萍等[34]研究发现,28 ℃为灵芝菌丝体最适生长温度。 Wang 等[35]在灵芝液态发酵过程中对发酵温度和初始pH 进行调控,发现温度为28.6 ℃、初始pH 为5.9 时,胞内三萜产量可达到308.1 mg∕L。 Feng 等[36]研究了不同发酵时间段的温度对灵芝液态发酵的影响,发现在0—61 h 时,32 ℃的发酵温度促进菌丝体生长;在62—127 h 时,温度从31 ℃降到30 ℃,保持菌丝体生长的同时促进灵芝三萜的合成;在128 h 后,温度维持在29 ℃,稳定灵芝三萜的合成,使得产量达到0.269 g∕L。 发酵时间的长短会影响菌丝体的生长及灵芝三萜的生成。 Liu 等[37]研究发现,当培养基中的葡萄糖为44.4 g∕L、蛋白胨为5.0 g∕L、发酵时间为437.1 h 时,可得到菌丝体干重11.3 g∕L,灵芝酸Me 产量4.8 mg∕L。
灵芝液态深层发酵的过程需要氧气促进菌丝体生长以及在发酵中后期促进灵芝三萜的合成。 有研究表明,较高的氧浓度可以促进菌丝体生长,而较低的氧浓度可以促使灵芝三萜的产生。 通气量与培养环境下的溶氧直接相关。 Zhang 等[38]研究发现,当溶氧量达到80%时,灵芝三萜产量可达到1.43 g∕L。冯杰等[39]采用5 L 发酵罐研究通气量对灵芝液态发酵的影响,发现当通气量为8 L∕min 时,灵芝三萜得率为0.204 g∕L,最大菌丝体得率达到8.77 g∕L。 搅拌转速也会通过影响溶氧量和剪切力的变化而影响灵芝液态发酵。 冯杰等[40]发现,在发酵40 h 前,将转速调整为150 r∕min,40 h 后调整至100 r∕min,可得到三萜含量0.720 mg∕(100 mg)。
pH 会影响灵芝细胞膜通透性,进而影响营养物质吸收、产物分泌以及三萜酸合成相关酶的活性[41]。Wang 等[42]在灵芝的液态发酵研究中发现,pH 6.0 是产生灵芝酸的关键培养条件之一。 潘江安等[43]在灵芝的液态发酵中提出了四阶段pH 控制策略,在0—26 h 时pH 自然,26—36 h 时pH 为4.0,36—81 h 时pH 为4.5,81—168 h 时pH 为5.0,得到菌丝体干重为14.18 g∕L,三萜产量为279.59 mg∕L。 Tang 等[44]运用多阶段调节pH 结合溶氧量控制的方法对灵芝液态发酵进行研究,发现初始自然pH、在4 d 时pH 控制在3.0、在6 d 时pH 调为4.5,溶氧量在0—6 d 为25%、6 d 后为10%,灵芝三萜产量可达到754.6 mg∕L。
3 外源物对液态发酵高产灵芝三萜的影响
近年来,灵芝液态发酵过程中添加外源物质促进目的产物的增加已成为一种新的调控手段。 外源添加物可以提高菌丝体生物量和灵芝三萜产量,降低培养基原材料的成本、控制环境条件的耗能。 外源物通过调节代谢产物生物合成途径中的关键酶活性、诱导特定酶的基因表达、改变细胞通透性来最大限度地积累目的产物[45]。
3.1 细胞色素P450 诱导剂和抑制剂
在灵芝三萜生物合成的下游途径中,细胞色素P450 是从羊毛甾醇到灵芝三萜生成途径中一个关键的影响因素。 Wang 等[46]通过转录组动力学分析发现,cyp5150L8 是调节羊毛甾醇的关键基因。 Xu 等[47]通过透明颤菌血红蛋白表达提高灵芝酸的研究发现,cyp512a2、cyp512v2 和cyp512a13 转录水平上调,推测这些P450 基因与灵芝酸生成有关。
Liang 等[48]研究表明,灵芝液态发酵中在静置培养的第5 天添加100 μmol∕L 的细胞色素P450 诱导剂苯巴比妥,总灵芝酸含量、灵芝酸Mk、S、T 和Me 含量都增加,HMGR、SQS 和LS 的转录水平均有提高,说明苯巴比妥对灵芝酸合成的诱导作用可能归因于其对代谢流的促进。 梁翠霞[49]研究发现,在第7 天添加10 μmol∕L 的麦角固醇合成抑制剂咪康唑抑制了麦角固醇合成,促进了羊毛甾醇积累,提高了灵芝酸产量,推测咪康唑对灵芝酸合成的促进作用机制可能是通过基因以外的方式实现的。 Nojokiden 等[50]在灵芝液态发酵的第9 天添加100 μmol∕L 细胞色素P450 诱导剂利福平,灵芝酸产量达到18.6 mg∕g,并发现利福平虽然能够提高灵芝酸产量,但同时也抑制了菌丝体的生成。
灵芝酸的生成也可能建立在细胞凋亡的基础上,You 等[51]使用阿司匹林诱发ROS 增加,促使细胞凋亡、灵芝酸生成,角鲨烯合酶和羊毛甾醇的表达合酶编码基因也有所下调。
3.2 植物激素
植物激素是指植物生长过程中产生的微量但能响应环境胁迫调节自身生理过程的有机化合物,在植物的生长过程中可以调节植物生长、影响次级代谢、激发免疫防御系统等[52-53]。 植物激素作为信号分子可通过激活特定代谢途径来提高目的代谢产物。 近年来,关于植物激素诱导灵芝酸生成的研究以茉莉酸甲酯(MeJA)和水杨酸(SA)为主。
辛燕花等[54]在研究MeJA 对灵芝液态深层发酵的影响时发现,在发酵的第4 天添加100 μmol∕L MeJA,灵芝菌丝体中灵芝酸含量积累到最大50.02 mg∕g。 任昂[55]以吐温-20 为助剂,研究MeJA 对灵芝液态深层发酵的影响,发现在第6 天加入254 μmol∕L MeJA,灵芝三萜含量可达到4.52 mg∕(100 mg)干菌丝体,比对照提高了45.3%。 考察MeJA 对关键酶基因转录水平的影响时发现,不同浓度MeJA 在不同时间的诱导下,每个基因响应MeJA 诱导的变化情况各不相同,但灵芝三萜生物合成途径中的羟甲基戊二酰CoA 还原酶(HMGR)、法呢基焦磷酸合酶(FPPS)和羊毛甾醇合成酶(OSC)基因被MeJA 上调最为显著。Cao 等[56]研究发现,SA 能够诱导灵芝三萜合成,HMGR、SQS 基因的转录水平也显著提高。 Liu 等[57]研究发现,SA 信号可以通过抑制线粒体复合物Ⅲ调节胞内ROS 水平,参与调控灵芝的次级代谢合成。 Ye等[58]研究发现,单独添加150 μmol∕L SA 诱导灵芝液态发酵时可以提高37.19%的三萜含量,上调法呢基焦磷酸合酶(FPPS)、鲨烯合酶(SQS)和羊毛甾醇合酶(LS)基因的表达,将钙离子和SA 结合添加可以提高46.9%的三萜含量,上调6 种基因表达,推测SQS 是该途径的关键酶。 褪黑素是一种植物生长促进剂,鲍锐等[59]研究表明,褪黑素可以提高灵芝生物量和促进灵芝酸产生,并推测作用机理可能与SA 诱导灵芝酸生物合成相关酶的基因表达、促进灵芝酸的生物合成相似。 Zhang 等[60]研究表明,灵芝液态发酵中添加乙烯可以提高灵芝酸产量,达到33 mg∕g 干菌丝体,比对照提高了90%,同时羊毛甾醇和鲨烯含量增加。
3.3 油脂物质
油脂物质通过改变真菌细胞膜结构和通透性或直接影响代谢途径中某些重要的酶活性以促进真菌的次生代谢产物合成。 朱会霞[61]研究发现,当添加油酸、α-萘乙酸、L-谷氨酸时,油酸是影响灵芝酸生成的最显著因素。 姚强等[62]使用不同的脂肪酸作为外源添加物进行灵芝液态发酵,发现硬脂酸、亚油酸和棕榈酸对生物量有促进生长,仅亚油酸对胞内三萜表现出较强的促进作用,其他两者均呈现抑制作用,说明不同脂肪酸对灵芝三萜的产生表现出不同的效果,可能与其链的长短以及饱和度的差异有关。
Feng 等[63]考察了6 种外源添加剂油酸、大豆油、正己烷、正十二烷、乙酸乙酯和吐温-80 对灵芝液态发酵的影响,发现当油酸为主要外源添加剂时,得到最大菌丝干重为12.15 g∕L、三萜产量为0.776 g∕L,说明培养基中加入油酸是最有效的。 孙冰沁等[64]考察油酸对灵芝三萜生物合成途径中关键酶编码基因的影响时发现,油酸可以上调SQS 和CYP51 基因表达,抑制14α-LDM 酶基因表达,但达到最高灵芝三萜产量时,SQS、CYP51 基因表达上调并不是最高,14α-LDM 基因表达也没有下调到最低,推测油酸诱导产生灵芝三萜的机理可能是改变细胞膜的通透性或灵芝的基础代谢、转录调控和信号转导的相关基因转录。
薏苡仁油是主要成分含9.26%油酸、17.83%棕榈酸、31.94%亚油酸的油脂类物质[65]。 黎李平[65]研究发现,当初始pH 为6.9,发酵第2 天添加3%的薏苡仁油时,菌丝体内的灵芝三萜得率为44.01 mg∕g。Yang 等[66]研究发现,与玉米油、红花油、橄榄油相比,薏苡仁油可以更好地促进菌丝体和灵芝三萜的生长,在第0 天添加薏苡仁油后,菌丝体生物量是对照的3.34 倍,灵芝三萜产量是对照的2.76 倍。 毕澎洋[67]在灵芝液态发酵的第48 小时添加2%薏苡仁油,菌丝体生物量可达到11.44 g∕L,是对照的3.58 倍;在发酵过程的第24 小时添加,灵芝酸产量可达到130.4 mg∕L,是对照的4.04 倍。 Liu 等[68]研究表明,薏苡仁油诱发NO、H2O2的增加,NO 和H2O2参与了薏苡仁油诱导灵芝三萜合成的信号转导过程,从而促进灵芝三萜含量的提高。 张容容[69]研究发现,在第0 天添加1.5 g∕L 薏苡仁油不仅可以显著提高灵芝液态发酵的生物量和三萜产量,而且菌丝体细胞在指数生长末期到稳定期间对诱导作用表现最为敏感,说明薏苡仁油可在较长时间内诱导灵芝菌丝体产生次级代谢产物,进一步发现NO 和H2O2作为信号分子在薏苡仁油的诱导过程中具有协同作用。 Zhou 等[70]研究发现,添加0.2%薏苡仁酯可以促进灵芝液态发酵的菌丝体生长,推测薏苡仁酯可作为促进因子影响灵芝液态发酵。
4 代谢通量方法在微生物发酵领域的研究进展
通过灵芝三萜合成途径可以看出,从羊毛甾醇到灵芝三萜生成的中间反应是未知的,无法通过信号通路和基因表达解释,但也无法规避该反应,所以寻找一种新方法研究灵芝三萜合成途径的机理是有必要的。 代谢通量方法是代谢途径中一种常用的研究菌种调控生成代谢产物机理的方法,可以围绕次生代谢产物合成途径中的关键中间前体进行定量分析,发现是否有同一前体的非目标产物的通量生成,从而进一步深入研究。 代谢通量方法可以直接应用于菌种的初级代谢产物,也可以控制初级代谢产物的通量[71]。
4.1 代谢通量方法在细菌代谢合成目的产物方面的应用
朱文泽等[72]建立了谷氨酸棒杆菌合成L-组氨酸的代谢网络模型,发现在发酵初期添加柠檬酸钠能够改变L-组氨酸生物合成途径的关键节点6-磷酸葡萄糖、丙酮酸及乙酰辅酶A 的代谢流分布,维持糖酵解途径、磷酸戊糖途径与三羧酸循环之间的代谢流量平衡,有利于提高L-组氨酸生物合成途径的代谢流量,最终使L-组氨酸的代谢流增加了7.86%。 张克旭等[73]应用黄色短杆菌发酵合成L-缬氨酸,通过物料衡算和MATLAB 线性规划方法,发现发酵中后期L-缬氨酸合成过程中的代谢流量分步主要通过糖酵解途径和磷酸戊糖途径,再进入三羧酸循环途径,找到关键节点6-磷酸葡萄糖、磷酸烯醇丙酮酸以及丙酮酸节点,得出降低三羧酸循环的代谢流量,增大糖酵解途径的流量可以使L-缬氨酸产量增加。
黄金等[74]建立了不同溶氧条件下大肠杆菌合成L-苏氨酸的代谢网络模型,对关键节点6-磷酸葡萄糖、磷酸烯醇丙酮酸以及α-酮戊二酸进行代谢通量分析发现,增加磷酸戊糖途径代谢流量,减少糖酵解途径和三羧酸循环代谢流量,可以大幅降低碳物质的流失;确定溶氧是发酵中后期的关键因素,增加溶氧有利于L-苏氨酸的生成,抑制副产物生成。 Niu 等[75]建立了大肠杆菌发酵促使甘油生成L-蛋氨酸的代谢网络模型,发现L-蛋氨酸主要来源于磷酸烯醇丙酮酸转化为草酰乙酸的途径,增强磷酸戊糖途径可提供大量NADPH,增加溶氧水平促使目的产物合成。 Yao 等[76]建立了大肠杆菌产乙醇的代谢模型,对菌株HJ06PN 的产醇通量分布分析发现,磷酸二羟丙酮节点的碳分配将更多的碳从较低的糖酵解途径逐渐引导到乙醇的生物合成途径,三羧酸循环减少了乙酸的生成,NADH 转化为NADPH 的转氢化通量不断增大。 Hong 等[77]建立了两种大肠杆菌菌株高产白藜芦醇模型,第一株菌株以酪氨酸为前体,通过磷酸戊糖途径合成对香豆酸,第二株菌株结合第一株菌株产生的对香豆酸和糖酵解途径合成的乙酰辅酶A 合成丙二酰辅酶A 生成白藜芦醇,以20 g∕L 葡萄糖为底物可获得55.7 mg∕L 的白藜芦醇。 通过代谢通量分析表明,柠檬酸循环和丙二酰辅酶A 供应节点之间的平衡是白藜芦醇产生的关键点。
王泽建等[78]建立了粪产碱杆菌发酵合成凝胶多糖的代谢网络模型,通过分析葡萄糖和麦芽糖作为底物对凝胶多糖代谢通量的影响,发现麦芽糖比葡萄糖的凝胶多糖得率高出45.8%,原因是以麦芽糖为碳源时磷酸戊糖途径的绝对代谢通量提升了40%以上。 磷酸二羟丙酮途径通量的增加提升了NADPH 还原力供给速率,加快了碳源作为底物向产物的摩尔转化速率。
林美君[79]使用代谢通量方法构建了4 种乳酸菌中央碳代谢网络模型,找出关键节点为6-磷酸葡萄糖、6-磷酸果糖、磷酸烯醇丙酮酸、丙酮酸、草酰乙酸和α-酮戊二酸,并对乳酸产量和乳酸菌OD 值的相关性进行了研究。
4.2 代谢通量方法在真菌代谢合成目的产物方面的应用
Zhang 等[80]通过代谢通量方法探讨了不同氮源对糖多孢红霉菌8 号产红霉素的影响,发现在氮源优化条件下,磷酸戊糖途径为红霉素合成提供了更多的NADPH。 较高的正丙醇比消耗率促进红霉素合成,正丙醇通过甲基丙二酰辅酶A 节点流入中枢碳代谢。
Li 等[81]建立了热带念珠菌CICC1779 利用葡萄糖和木糖产乙醇的代谢模型,发现溶氧量是高产乙醇的关键节点,诱变菌株产生的乙醇为24.85 g∕L,是野生菌株的1.41 倍,溶氧量增加后可以达到26.56 g∕L,且突变株的木糖还原酶和木糖脱氢酶活性均高于原株,表明诱变株可以有效利用木糖促进目的产物代谢。
Tomàs-Gamisans 等[82]研究发现,以甘油为碳源可以促进毕赤酵母产氨基酸。 Hayakawa 等[83]建立了添加乙醇促进酿酒酵母产腺苷蛋氨酸的代谢模型,发现乙醇培养中三羧酸循环和乙醛酸分流的代谢通量水平显著高于葡萄糖培养,更多的ATP 是由乙醇通过氧化磷酸化产生的。 沈宁燕等[84-85]对法夫酵母发酵生成虾青素的前中后期进行代谢通量分析,并对关键节点乙酰辅酶A、α-酮戊二酸以及5-磷酸核酮糖进行研究,得出在发酵前期,法夫酵母JMU-VDL668 的糖酵解途径通量增大,为合成新细胞提供前体物和能量;在发酵中后期,三羧酸循环及磷酸戊糖途径的通量都增大,为细胞内代谢产物的合成提供NADPH和ATP。
4.3 代谢通量方法在其他方面的应用
王景川等[86]建立了螺旋藻合成β-胡萝卜素的代谢网络模型,研究了不同温度对β-胡萝卜素代谢通量的影响。 Cheah 等[87]研究了长球藻PCC 7942 产醛的代谢通量,发现丙酮酸是其产醛的关键节点,在该节点上丙酮酸激酶(PK)和乙酰烯烃合成酶(ALS)与醛产量直接相关,而丙酮酸脱氢酶(PDH)和磷酸烯醇丙酮酸羧化酶(PPC)的通量随着醛产量的增加而变化。
5 讨论
灵芝是我国著名的药用真菌,其含有多种活性成分,目前的研究以灵芝多糖和灵芝三萜较多。 灵芝三萜是羊毛甾烷型萜类物质,其具有广泛的药理活性,主要来源是子实体和孢子粉以及液态发酵的菌丝体和胞外液,液态发酵以发酵周期短、条件易控制、目的产物较稳定等优点成为获得灵芝三萜的主要手段之一。
通过培养基组成、pH、搅拌速度、温度、溶氧量等方面的工艺条件优化可以使灵芝的生物量以及菌丝体三萜含量增加,但单从以上方面进行工艺优化可能需要较高成本,且并不能较大幅度提高单体灵芝酸产量。 通过添加外源物可以从调控灵芝次生代谢产物的关键酶活性、关键酶基因转录水平以及细胞通透性等方面促进灵芝生物量和菌丝体灵芝三萜含量增长,可以避免工业上的成本浪费,降低环境污染等。
目前,外源添加物主要通过活性氧(ROS)、一氧化氮(NO)等信号通路方向进行研究。 通过灵芝三萜合成途径来看,从羊毛甾醇到灵芝三萜生成的中间反应是未知的,无法通过信号通路方面的研究进行解释,寻找一种新的方法对灵芝三萜合成途径进行研究进而揭秘其合成机理是有必要的。 另外,目前围绕灵芝三萜生物合成途径的研究大多集中在基因方面,可对关键酶的基因转录水平进行检测。 由于灵芝三萜合成下游过程中碳环骨架的复杂修饰,从羊毛甾醇到灵芝三萜生成的中间途径较为复杂,目前主要聚焦在P450 家族基因的研究。 代谢通量方法可以围绕次生代谢产物的关键中间前体进行定量分析,作为代谢途径中的一种研究菌种调控生成代谢产物机理的常用方法还未曾在药用真菌的研究中出现过。 笔者通过国家自然科学基金青年基金项目的实施已建立了灵芝三萜代谢网络模型,项目通过灵芝三萜代谢通量分析,强化灵芝三萜类物质合成的代谢流向,为提高灵芝三萜的产量奠定了一定基础。
