基于既定条件和设计空间的非诺贝特胶囊药学变更研究
2023-09-14白秀秀陈歆宇杜宏伟
白秀秀,陈歆宇,王 丹,杜宏伟△
(1. 西安汉丰药业有限责任公司,陕西 西安 710500; 2. 陕西省药品和疫苗检查中心,陕西 西安 710065)
非诺贝特胶囊为氯贝丁酯类调脂药,具有显著降胆固醇及三酰甘油的作用,用于治疗成人饮食控制疗法效果不佳的高胆固醇血症(Ⅱa 型)、内源性高三酰甘油血症、单纯型(Ⅳ型)和混合型(Ⅱb 和Ⅲ型)高脂血症,特别适用于以高密度脂蛋白降低和低密度脂蛋白中度升高为特征的血脂异常和2 型糖尿病合并高脂血症。人用药品注册技术要求国际协调会(ICH)Q 系列技术指南Q8 R2(ICH Q8 R2)关于变更的表述为设计空间内的变动,不视为变更;超出设计空间的视为变更,应启动上市后的变更申请[1]。ICH Q12中关于既定条件的定义为确保产品质量所必需的、具有法律约束力的信息,其任何变更都应提交至监管机构[2],与我国药品注册管理法规[3]及相关指导原则[4-5]中对药品上市后变更的原则和要求[6]一致。随着非诺贝特胶囊临床用量的逐渐增加,原料药供应商的供应能力有限,已不能满足生产需求;另外,制粒设备使用维护烦琐,生产效率低,生产成本较高。为此,本研究中基于既定条件和设计空间的理念进行了非诺贝特胶囊的原料药供应商、生产设备和生产工艺变更,并对变更前后产品的溶出曲线、杂质、关键理化性质等进行分析,为提高产量、降低生产成本提供参考。现报道如下。
1 变更前非诺贝特胶囊生产既定条件与设计空间
1.1 工艺步骤
变更前,非诺贝特胶囊的生产既定条件和设计空间[7-13]及工艺步骤见表1。

表1 非诺贝特胶囊(生产工艺)的生产既定条件与设计空间Tab.1 Established production conditions and design space for Fenofibrate Capsules(production process)
1.2 原辅料
非诺贝特胶囊仅原料药供应商变更,辅料不涉及变更。详见表2。

表2 非诺贝特胶囊(原料及其质量标准)生产既定条件与设计空间Tab.2 Established production conditions and design space for Fenofibrate Capsules(API and its quality standard)
1.3 产品质量标准、过程控制与生产场地
非诺贝特胶囊质量标准和过程控制及生产场地情况见表3。

表3 非诺贝特胶囊(产品质量标准与生产场地)的生产既定条件与设计空间Tab.3 Established production conditions and design space for Fenofibrate Capsules(product quality standards and production sites)
2 非诺贝特胶囊药学变更合理性评估
本研究中对非诺贝特胶囊产能低、生产成本高的影响因素进行了分析。使用鱼骨图法从人、机、料、法、环5 个方面[14]进行分析,认为制粒设备产量低、生产工艺落后和效率低、原料药供应数量不足是影响非诺贝特胶囊产量、生产成本的主要因素。详见图1。
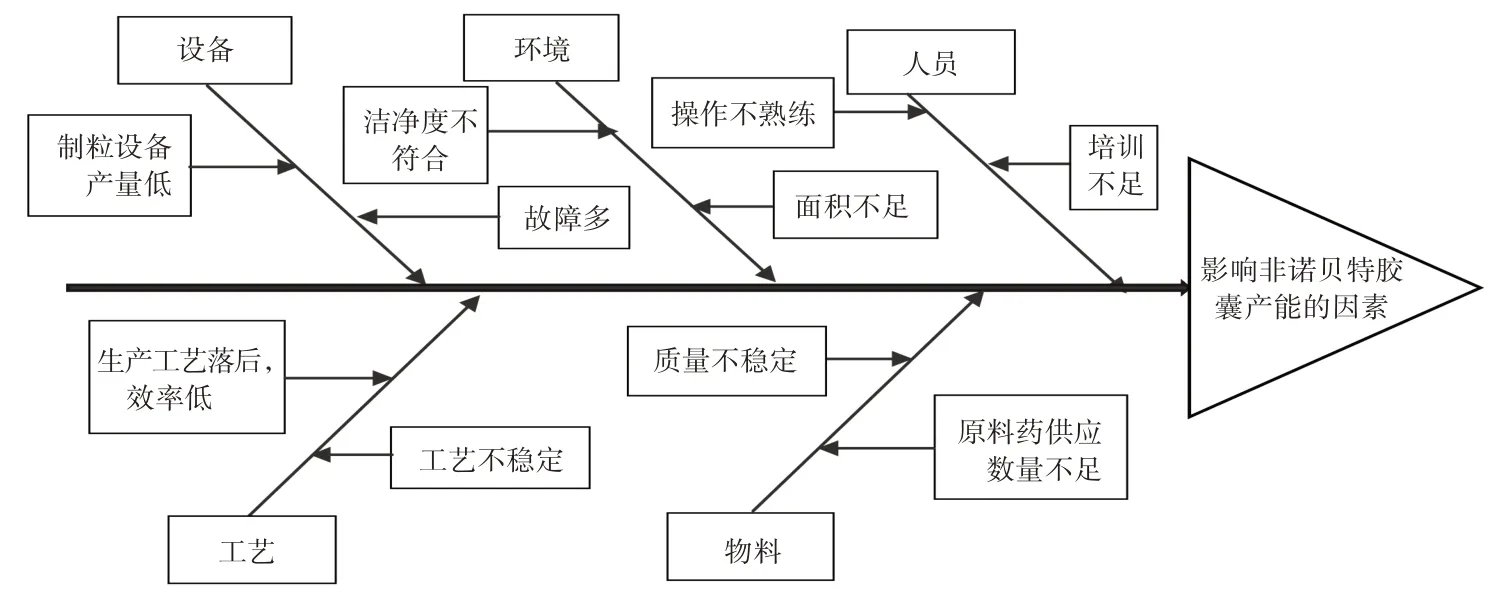
图1 非诺贝特胶囊产量影响因素分析鱼骨图Fig.1 Fishbone chart of the factors affecting the production of Fenofibrate Capsules
基于此,对制粒设备、生产工艺、原料药供应商进行优化,将原滚圆机变更为摇摆式颗粒机,原挤出机制粒变更为摇摆颗粒机制粒,增加1 家原料药供应商。变更后,简化了生产工艺,提高了生产效率,2 个原料药供应商完全能满足原料供应。非诺贝特胶囊填充的内容物为白色颗粒,主要质量控制指标为装量差异和溶出度。挤出滚圆制粒具有粒度均匀、颗粒收率高的优势,但产量小、生产效率低;摇摆式颗粒机制粒产量大、生产效率高,制得颗粒较松散。变更后,在满足非诺贝特胶囊质量要求的前提下,极大地提高了生产效率,降低了生产成本。
非诺贝特胶囊原料药供应商、制粒设备、生产工艺均属非诺贝特胶囊生产的既定条件。增加非诺贝特胶囊原料药供应商和制粒设备由挤出机、滚圆机变更为摇摆式颗粒机均超出设计空间,依据我国相关法规评估属中等变更;增加颗粒干燥后的整粒工序超出设计空间,依据我国相关法规评估属微小变更。在变更研究完成后,合并向药品监管部门备案中等变更。
3 非诺贝特胶囊变更事项与质量对比研究项目评估[7-13]
3.1 非诺贝特胶囊变更事项
非诺贝特胶囊变更事项见表4。

表4 非诺贝特胶囊变更事项分类Tab.4 Classification of change matters to Fenofibrate Capsules
3.2 非诺贝特胶囊变更前后对比
3.2.1 生产工艺
非诺贝特胶囊生产工艺变更前后对比见表5。

表5 非诺贝特胶囊变更前后生产工艺对比Tab.5 Comparison of production processes of Fenofibrate Capsules before and after the change
3.2.2 生产设备
生产设备变更前后对比结果见表6。离心式制丸机结构复杂,操作维护不便,功率小,转速低,产量小,设备使用过程中会发热,可能使物料发生物理变化。摇摆式颗粒机结构简单,操作、维修、拆装、清洗方便,功率大,转速快,产量大,可适应大批量生产。

表6 非诺贝特胶囊变更前后生产设备对比Tab.6 Comparison of equipment for producing Fenofibrate Capsules before and after the change
3.2.3 原料药
原料药质量对比见表7。对A供应商3批原料药、B供应商2 批原料药进行检验,结果性状、熔点、鉴别、乙醇溶液的澄清度与颜色、硫酸盐、氯化物、有关物质、残留溶剂、干燥失重、重金属、含量、微生物限度均无差异,炽灼残渣、粒度相当,晶型一致。结果显示,变更前后的2家供应商原料药晶型一致,粒度相当。
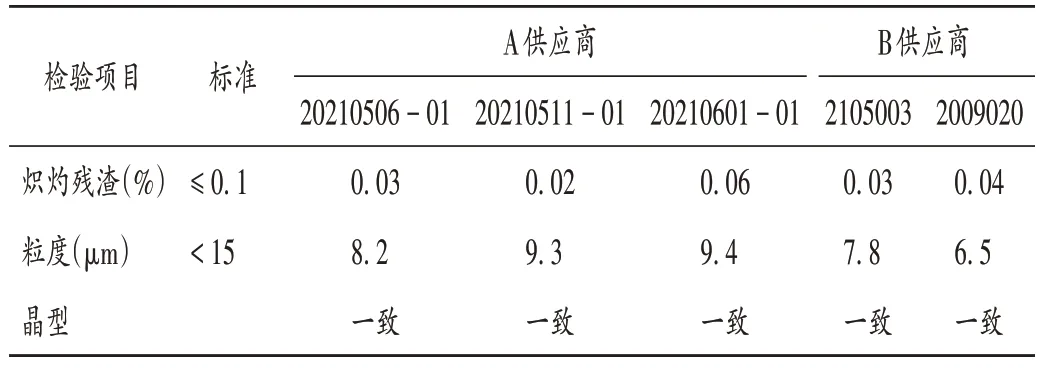
表7 非诺贝特胶囊变更前后原料药质量对比Tab.7 Comparison of API of Fenofibrate Capsules before and after the change
3.3 变更前后非诺贝特胶囊质量对比研究项目评估
为保持非诺贝特胶囊变更前后质量的一致性,依据我国相关已上市药品变更管理法规和ICH相关内容,除按表3 中产品现行质量标准进行变更前后产品质量对比研究外,还应进行溶出曲线的对比研究[16-19]。
4 非诺贝特胶囊变更研究事项
4.1 工艺研究
按变更后的工艺,采用B供应商生产的非诺贝特进行预试验(批量4 万粒),成品检验结果符合质量标准;随后进行工艺验证(共3 批,批量20 万粒),并按现行质量标准进行检验,均符合要求。
4.2 变更前后产品质量对比
分别取工艺验证批产品与按原工艺、原供应商生产的3批产品质量进行对比,结果见表8。

表8 非诺贝特胶囊变更前后产品质量对比Tab.8 Comparison of product quality of Fenofibrate Capsules before and after the change
4.3 变更前后溶出曲线对比
溶液制备:取溶出液10 mL,滤过,精密量取续滤液5 mL,置100 mL 容量瓶中,用溶出介质稀释并定容,摇匀,即得供试品溶液。取非诺贝特对照品10 mg,精密称定,置100 mL 容量瓶中,加无水乙醇10 mL 使溶解,用无水乙醇定容,摇匀,精密量取5 mL,置50 mL 容量瓶中,用溶出介质稀释并定容,摇匀,即得对照品溶液。
测定方法:取供试品溶液与对照品溶液,照2020年版《中国药典(四部)》通则0401 紫外-可见分光光度法[20],于289 nm 波长处分别测定吸光度,计算每个时间点的溶出量。
溶出曲线:非诺贝特在水中几乎不溶,结合其特点及注册标准、《中国药典》标准、进口注册标准、《普通口服固体制剂溶出曲线测定与比较指导原则》(简称《指导原则》)[21],在溶出介质中加入少量十二烷基硫酸钠(0.025 mol/L),采用浆法[转速为50 r/min,介质体积为1 000 mL,温度为(37±0.5)℃]。由于本品溶出较慢,取样点的设置依据产品的溶出量及《指导原则》[21]将取样点设置为15,30,45,60,90,120 min,标准介质条件设置取样点至90 min。标准介质、pH 1.2盐酸溶液、pH 4.5醋酸盐缓冲液、pH 6.8磷酸盐缓冲液4种模式下的溶出曲线见图2。
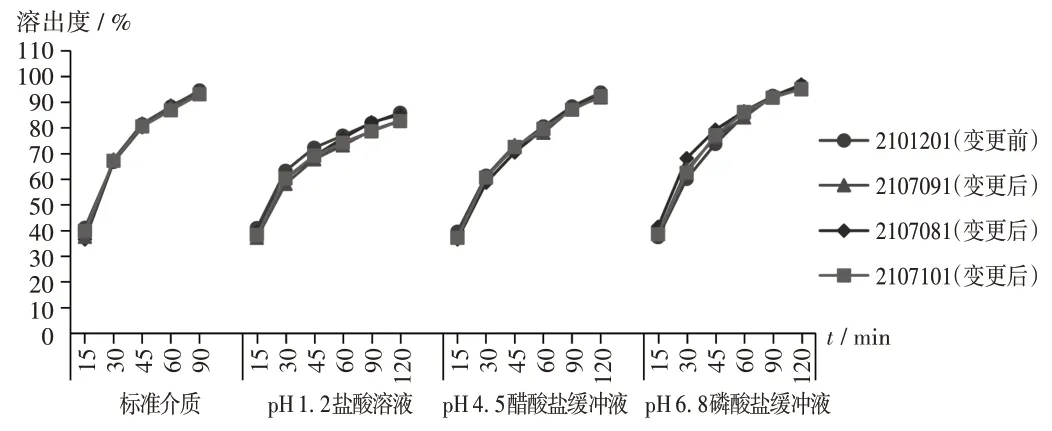
图2 非诺贝特胶囊变更前后溶出曲线对比Fig.2 Comparison of dissolution curves of Fenofibrate Capsules before and after the change
溶出曲线相似性:采用非模型依赖的相似因子(f2)法评价变更前后溶出曲线的相似性。依据《已上市化学药品药学变更研究技术指导原则(试行)》中溶出曲线研究条件的问答[22],将所设取样点均参与计算,变更后3批非诺贝特胶囊与变更前的溶出曲线f2见表9。f2>50,代表2 条曲线具有相似性,提示变更前后具有等效性,溶出行为相似。
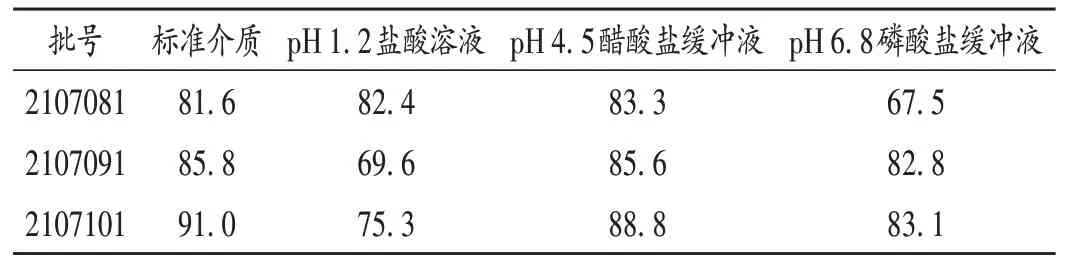
表9 非诺贝特胶囊变更前后溶出曲线的相似因子Tab.9 Similarity factors of dissolution curve of Fenofibrate Capsules before and after the change
4.4 稳定性试验
设置长期试验条件的温度为(25±2)℃,相对湿度为(60 ± 5)%,分别于0,3,6,9,12 个月末取样检测。检测项目包括性状、有关物质、溶出度、含量。长期试验结果显示,变更后非诺贝特胶囊样品(批号分别为2107081,2107091,2107101)的长期稳定性考察项目无明显变化,有关物质未见增长,稳定性良好。与变更前非诺贝特胶囊样品(批号分别为2101201,2101211,2101221)的长期稳定性考察结果比较无显著差异;且各检测项目变化趋势一致,无明显不良趋势,变更后的产品稳定性不低于变更前。
5 结语
本研究中非诺贝特胶囊增加原料药供应商、变更制粒设备、增加整粒工艺步骤的变更,变更前后产品质量稳定,符合非诺贝特胶囊质量标准要求;变更前后产品溶出行为相似,达到了变更目的。本次变更事项中有2个中等变更、1个微小变更,合并向药品监督管理部门提出变更备案,并可按变更后条件开始生产。
随着药品上市后企业对产品知识的积累和对产品工艺的理解,以及制药工艺技术、药用辅料、制药设备等的进步与创新,为了提高生产效率等,会不断提出对药品配方、物料供应商、生产设备、生产工艺、质量标准、包装材料等的变更,但必须保证药品的安全性、有效性、质量可控性不降低。《已上市化学药品药学变更研究技术指导原则(试行)》[4]对上述药学变更提出了原则性要求,给出了部分药学变更事项变更分级、变更研究要求等。但实际工作中变更非常复杂,一个产品可能涉及多个变更,变更之间还可能存在互相影响。ICH 相关指导原则给出的变更分类、既定条件、批准后变更管理方案、产品生命周期管理、变更管理等上市后变更管理工具的可操作性强,具有较好的实践指导作用。
