白消安对仔猪睾丸曲精小管内增殖分化相关蛋白表达与定位的影响
2023-09-13任高雅范小瑞张警文张欣荣贺俊平
任高雅,范小瑞,张警文,张欣荣,贺俊平
(山西农业大学 动物医学学院,山西 太谷 030801)
临床上常使用白消安治疗淋巴瘤、卵巢癌、儿童和成人慢性骨髓性白血病[1-2],其治疗效果很好,但对生殖系统有严重的副作用[3]:它可以黏附在DNA链上抑制细胞分裂[4],具有高分裂活性的器官、组织和细胞如睾丸、生殖细胞等更容易受到白消安毒性的影响[5]。有研究报道,体外分离培养的睾丸曲精小管细胞可用于药物毒性筛选[4],但目前对白消安的体外毒性尚未见报道。在体外分离培养曲精小管细胞的方法在大鼠和小鼠中已有研究报道[1-2]。人类体外试验的理想动物模型是猪,因猪的基因组和器官大小与人类十分相似。但由于猪物种自身结构的特殊性,间质和曲精小管连接紧密,实际操作中难以分离,研究常见的是曲精小管易于分离的鼠,而关于猪曲精小管分离培养尚未见报道,本试验尝试找到分离猪曲精小管的方法并用于白消安生殖毒性研究。
PCNA(增殖细胞核抗原)是DNA复制过程中必不可少的辅助因子[6],可用于检测细胞增殖[7]。PLZF(早幼粒细胞白血病锌指蛋白)是一种转录抑制因子,调节未分化精原细胞的表观遗传状态[8],并直接参与精原干细胞库的自我更新和维护[9]。缺乏PLZF的小鼠表现为曲精小管内精原细胞的渐进性缺乏和精子发生障碍,从而导致不孕[9-12]。GATA-4(含锌指结构的转录调节因子)是一种转录因子,在睾丸支持细胞成熟和睾丸发育中至关重要,表达于睾丸体细胞,尤其是睾丸支持细胞[13-14]。
白消安可影响雄性动物精子发生[15],但分子机制尚不清楚。白消安是否影响猪睾丸曲精小管增殖和分化相关蛋白的表达,从而导致精子发生受损尚无报道。本试验通过对增殖相关蛋白PCNA和分化相关蛋白PLZF在白消安作用下仔猪睾丸曲精小管中的表达变化进行研究,旨在初步探索白消安对猪精子发生、增殖和分化的损伤调控机制。
1 材料和方法
1.1 试验材料
1.1.1 样品采集 于山西省晋中市太谷区养殖场采集杜长大三元杂交(1月龄)仔猪睾丸组织,保存于PBS缓冲液,运输至细胞房。在无菌环境下将组织剪碎,采用组合酶(DNaseⅠ和胰酶)4 °C过夜消化。次日收集曲精小管细胞置于37 °C培养箱内分别培养1、2、3 d。将部分曲精小管组织置于Bouin氏固定液中,4 °C过夜,准备进行免疫组化分析;另一部分投入液氮中速冻,用于提取总RNA和蛋白。
1.1.2 主要仪器和试剂 1×PBS缓冲液、0.25%胰蛋白酶、青链霉素、去DNase/RNase水、PBS购自索莱宝生物公司,DNaseⅠ购自Sigma,DMEM/F12基础培养基购自Hyclong,胎牛血清购自Gibco,白消安购自上海陶素生化科技有限公司,免疫组化试剂盒购自康为世纪生物科技有限公司,多克隆兔抗PCNA(bs-2007R)、多克隆兔抗PLZF(bs-5971R)购自博奥森,多克隆兔抗GATA4(ab84593)购自Abcam,单克隆鼠抗GAPDH(60004-1-Ig)购自武汉三鹰。反转录试剂盒、荧光定量试剂盒、核酸染料购自南京诺唯赞生物技术有限公司,DNA Ladder购自碧云天生物技术有限公司,高灵敏度化学发光试剂盒、显影粉、定影粉购自康为世纪生物科技有限公司。用去DNase/RNase水配制5 mg/mL的白消安溶液,4 °C冷藏备用。
1.2 试验方法
1.2.1 曲精小管的分离培养 将睾丸组织放入超净工作台内,去除附睾和睾丸被膜,剪成约2 mm的均匀小块,放入PBS溶液内。将睾丸组织块溶液、DNaseⅠ和胰酶按照4∶2∶1的比例混匀,4 °C过夜,显微镜下观察到组织块消化出均匀整齐的曲精小管后,立即加入等量终止液终止消化;去除未消化组织块,加入Tris HCl低渗处理,收集曲精小管,铺板培养,分成2组,一组为对照组(不处理),另一组为试验组(滴加50 μL白消安液),37 °C培养箱培养。
1.2.2 石蜡切片及HE染色 将固定好的睾丸曲精小管组织梯度酒精脱水,二甲苯透明后石蜡包埋制作切片,切片厚度为4 μm。HE染色流程:切片经二甲苯脱蜡15 min 2次后梯度酒精水化(100%酒精浸泡3 min重复2次、95%酒精浸泡3 min重复2次、90%酒精浸泡3 min、80%酒精浸泡2 min、70%酒精浸泡2 min、苏木精浸泡5 min、自来水冲洗一次、蒸馏水摇床上清洗2 min重复2次)后再经梯度酒精脱水(70%酒精浸泡2 min、80%酒精浸泡2 min、90%酒精浸泡3 min),伊红染色10 s后95%酒精浸泡3 min重复2次、100%酒精浸泡3 min重复2次,二甲苯透明,中性树脂封片,40倍光学显微镜下观察结果。
1.2.3 免疫组织化学检测 切片经二甲苯脱蜡及梯度酒精水化,PBS冲洗3次,每次3 min,滴加PBS-T,室温孵育15 min后,PBS冲洗3次,每次3 min,置于热柠檬酸钠抗原修复液中加热15 min,PBS冲洗3次,每次3 min,滴加H2O2阻断内源性过氧化物酶,室温孵育30 min,PBS冲洗3次,每次3 min,滴加一抗(多克隆兔抗PCNA∶BSA=1∶200,多克隆兔抗GATA4∶BSA=1∶300,多克隆兔抗PLZF∶BSA=1∶300),4 °C过夜孵育。次日摇床复温,PBS冲洗3次,每次3 min,滴加二抗,37 °C孵育30 min,PBS冲洗3次,每次3 min,滴加DAB显色,蒸馏水冲洗3次,每次2 min。随后采用苏木精染色,1%的盐酸乙醇分化,1%浓氨水返蓝,蒸馏水冲洗3次,每次2 min,梯度酒精脱水,二甲苯透明,中性树胶封片后干燥,显微镜下拍照保存。用Image-Pro Plus 6.0软件分析PCNA、GATA4和PLZF免疫阳性染色的吸光度。阴性对照切片一抗孵育过程使用血清代替。
1.2.4 曲精小管总RNA提取和qRT-PCR的扩增 采用Trizol法提取总RNA并使用琼脂糖凝胶电泳进行质量鉴定,ND-1000(超微量分光光度计)测定浓度。反转录过程根据Vazyme试剂盒说明书操作。去除基因组DNA。反应体系:4×g DNA wiper Mix 2 μL;总RNA 1 μg;加去RNA酶水至8 μL,42 °C孵育2 min。反转录。反应体系:取上面的反应液8 μL加入5×HiScript Ⅲ qRT SuperMix 2 μL,37 °C 孵育15 min后,85 °C下反应5 s。反转录后测定cDNA浓度并稀释至100 ng/μL,-20 °C保存。qRT-PCR过程按照Vazyme公司定量试剂盒步骤进行,使用18S rRNA作为内参基因与目标基因PCNA、GATA4和PLZF共同扩增。
试验结果采用2-ΔΔCT法进行数据统计分析,计算PCNA、GATA4和PLZF在仔猪睾丸曲精小管中的相对表达量。根据NCBI中公布的猪PCNA、GATA4和PLZF的mRNA序列,使用Primer premier 5.0设计引物并送华大基因合成(表1)。
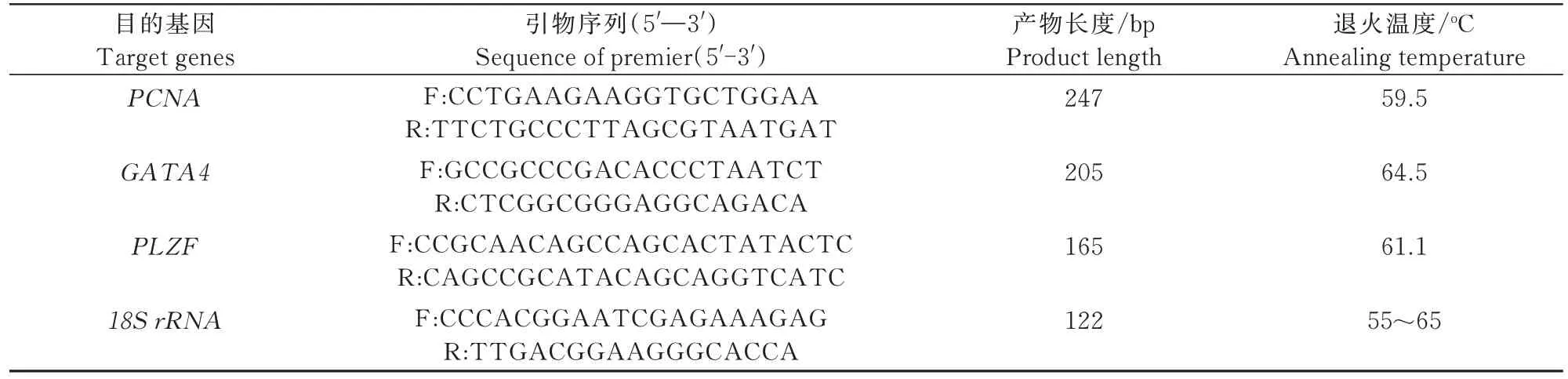
表1 引物序列及扩增条件Tab.1 Primer sequences and amplification conditions
1.2.5 曲精小管总蛋白提取和Western Blot分析收集曲精小管,放入0.5 mL白裂解液和5 μL PMSF的混合液中,冰上静置30 min,离心10 min(4 °C,12 000 g)。取上清测定浓度,后采用1%SDS缓冲液稀释至32 μL,加入3 μL蛋白质上样缓冲液混匀,99 °C水浴变性10 min。配制蛋白质浓缩胶和分离胶,分别加入蛋白质分子量标准和待测样品,电泳获得目标条带,转膜后,室温80 r/min封闭1 h。加入稀释后的单克隆鼠抗GAPDH和多克隆兔抗PCNA、GATA4和PLZF(5%脱脂奶粉溶液分别稀释2 000倍、300倍、800倍和300倍),垂直摇床4 °C过夜。次日取出复温30 min,TBST孵育10 min,重复3次。加入山羊抗兔IgG(TBST稀释18 000倍)和山羊抗鼠IgG(TBST稀释15 000倍),80 r/min 37 °C孵育1 h,TBST 5 min,重复6次,ECL显色,胶片曝光,Image J分析扫描胶片。
1.3 数据分析
采用SPSS 16.0统计软件进行数据单因素方差分析,每个试验重复3次,结果均以平均值±标准差表示,P<0.05代表统计学显著。
2 结果与分析
2.1 仔猪睾丸曲精小管对照组和白消安组的形态学差异
通过HE染色观察对照组和白消安组仔猪睾丸曲精小管的形态学和组织学变化,结果显示,培养1、2 d后,对照组曲精小管内出现细胞质高度浓缩的嗜酸性细胞,但睾丸支持细胞和生殖细胞形态正常(图1-A);培养3 d后,可观察到增大的嗜酸性细胞,但睾丸支持细胞和生殖细胞模糊,不易辨别(图1-C)。培养1~2 d后,白消安组支持细胞增大,生殖细胞数量减少,曲精小管内出现空腔;培养3 d后,可观察到增大的嗜酸性细胞。在对照组和白消安组中,随着培养时间增加,管周肌样细胞形态逐渐消失。
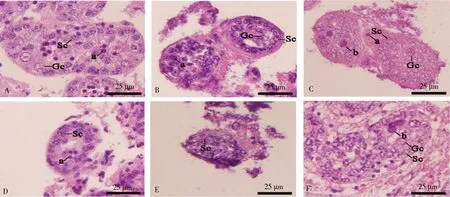
图1 仔猪睾丸曲精小管对照组和白消安组的形态学差异Fig.1 Morphological differences in seminiferous tubules in testis of piglets between the control group and the buanlfan group
2.2 PCNA、PLZF和GATA4在正常组和白消安组的组织细胞学定位
免疫组化结果显示,PCNA定位于支持细胞和生殖细胞的细胞核(图2),对照组1、2、3 d蛋白的相对表达量分别为1.000 2、1.000 7和1.000 9;白消安组1、2、3 d蛋白的表达量相对升高,分别为1.378 7、1.234 4和3.523 4,分别为对照组的1.38倍(P<0.01)、1.23倍和3.52倍(图3)。
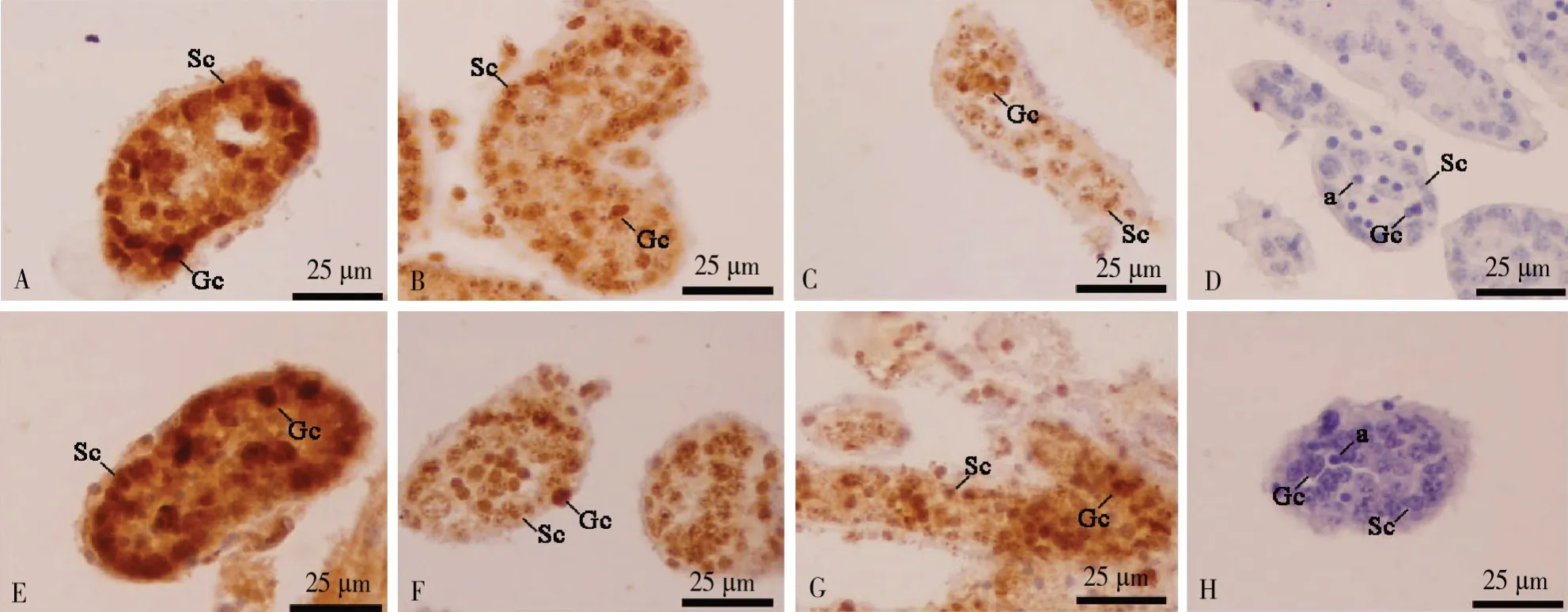
图2 PCNA在仔猪睾丸曲精小管对照组和白消安组的表达与定位Fig.2 Expression and localization of PCNA in seminiferous tubules in testis of piglets in the control group and the buanlfan group
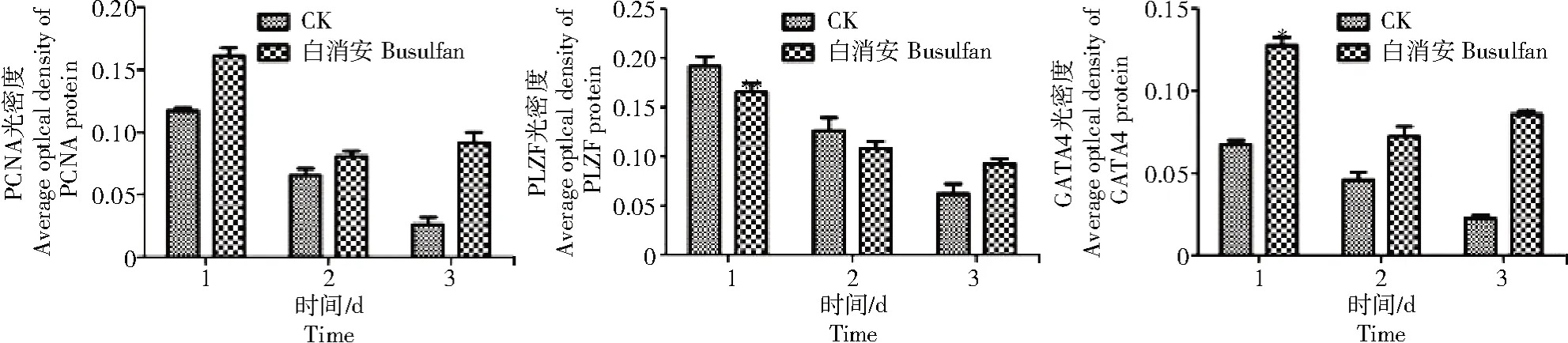
图3 培养1、2、3 d的对照组和白消安组仔猪睾丸曲精小管横截面PCNA、PLZF和GATA4光密度值Fig.3 The optical density values of PCNA,PLZF,and GATA4 in seminiferous tubules in testis of piglets in the control group and the busulfan group cultured after 1,2,3 d
PLZF定位于生殖细胞的细胞核(图4),对照组1、2、3 d蛋白的相对表达量分别为1.010 0、1.000 4和1.001 3;白消安组1、2 d蛋白的表达量相对对照组下降,分别为0.864 3和0.226 3,3 d时白消安组蛋白相对表达量为1.497 3,分别是对照组的0.85倍、0.22倍、1.50倍(图3)。
GATA4定位于支持细胞的细胞核(图5),对照组1、2、3 d蛋白的相对表达量分别为1.001 0、1.010 6和1.000 3;白消安组1、2、3 d蛋白的相对表达量升高,分别为1.889 1、1.578 4和3.828 1,分别是对照组的1.89倍(P<0.05)、1.56倍和3.81倍(P<0.05)(图3)。
2.3 PCNA、PLZF和GATA4mRNA在仔猪睾丸曲精小管中的表达差异
PCNA的qRT-PCR结果显示,对照组1、2、3 d mRNA的相对表达量分别为1.001 3、1.001 7、1.0022;白消安组1、2、3 d的mRNA相对表达量上升,分别为1.400 4、1.440 3和1.376 3,分别是对照组的1.39倍、1.44倍和1.37倍(图6)。
PLZF的qRT-PCR结果显示,对照组1、2、3 d的mRNA相对表达量分别为1.001 5、1.003 2、1.000 5;白消安组1、2、3 d的mRNA相对表达量先降低后上升,分别为0.865 3、1.006 9和1.549 8,分别是对照组的0.86倍(P<0.05)、1.01倍和1.55倍(P<0.01)(图6)。
GATA4的qRT-PCR结果显示,对照组1、2、3 d的 mRNA相对表达量分别为1.002 7、1.001 7、1.000 2;白消安组1、2、3 d mRNA的相对表达量上升,分别为1.158 4、1.429 6和6.902 1,分别是对照组的1.16倍、1.43倍和6.90倍(P<0.01)(图6)。
2.4 PCNA、PLZF和GATA4蛋白在仔猪睾丸曲精小管组织中的表达差异
PCNA、PLZF、GATA4和GAPDH蛋白在对照组和白消安组仔猪睾丸曲精小管的相对表达量如图7所示。
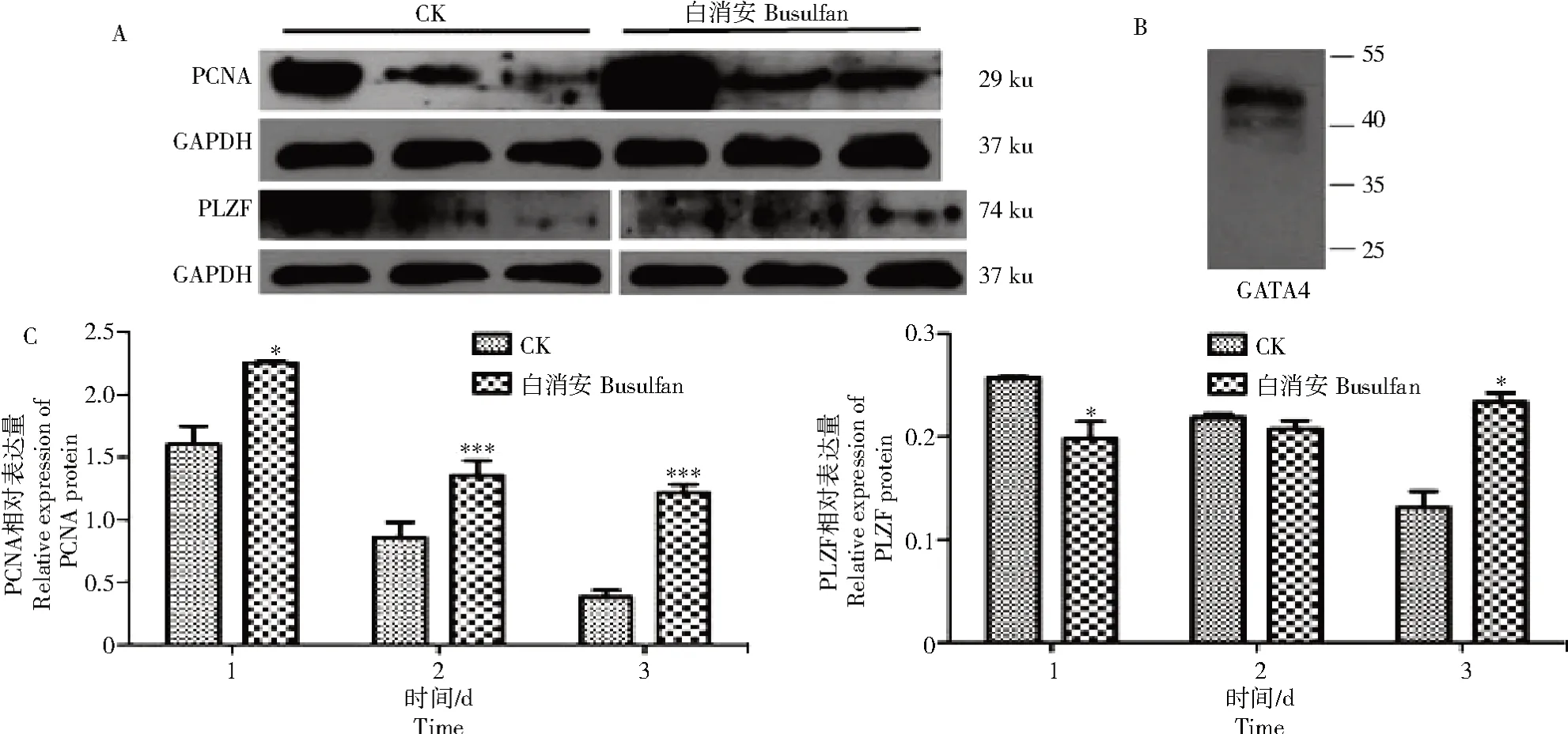
图7 PCNA、PLZF、GATA4和GAPDH蛋白在对照组和白消安组仔猪睾丸曲精小管的相对表达量Fig.7 The relative expression levels of PCNA,PLZF,GATA4,and GAPDH proteins in seminiferous tubules in testis of piglets in the control group and the busulfan group
Western Blot结果显示,对照组和试验组仔猪睾丸曲精小管总蛋白和多克隆兔抗PCNA、多克隆兔抗PLZF、多克隆兔抗GATA4及单克隆鼠抗GAPDH之间有特异性免疫反应,分子质量大小分别为29、74、44、37 ku(图7-A、B)。对照组1、2、3 d,PCNA蛋白的相对表达量分别为1.605 0、0.859 3和0.381 8;白消安组1、2、3 d,PCNA蛋白的相对表达量升高,分别为2.256 9、1.354 2和1.215 3,分别是对照组的1.41倍(P<0.05)、1.57倍(P<0.001)、3.18倍(P<0.001)(图7-C)。对照组1、2、3 d测得的PLZF蛋白的相对表达量分别为0.257 2、0.218 6和0.131 3;白消安组1、2 d,PLZF蛋白的相对表达量降低,分别为0.198 5和0.207 7,3 d蛋白的相对表达量升高为0.233 7,分别是对照组的0.77倍(P<0.05)、0.95倍、1.78倍(P<0.05)(图7-C)。
3 结论与讨论
本研究中,HE染色结果发现,曲精小管细胞形态在培养后发生变化,表现为睾丸支持细胞体积增大,生殖细胞体积略微缩小并伴随数量的减少,管周肌样细胞逐渐消失。OAKBERG等[16]在培养约30 d后观察发现,曲精小管的管周肌样细胞消失,管内有活性的生殖细胞数量下降。这与本研究结果相似。
本研究中,用细胞增殖核抗原PCNA标记细胞增殖,免疫组化结果显示,PCNA表达于正常组和白消安组仔猪睾丸曲精小管内生殖细胞的细胞核,这与CHANDRA等[17]的研究结果一致,同时本研究中PCNA也定位于支持细胞的细胞核,与CHAPMAN等[18]的研究结果一致,提示性成熟前,曲精小管内有活性的支持细胞增殖活跃,支持细胞数量增加。本研究中,白消安组PCNAmRNA和蛋白的表达量大于对照组,提示当睾丸遭受不良刺激时,支持细胞增殖速率增加,以抵御不良损伤。
本研究中,对照组和白消安组PLZF表达于曲精小管内生殖细胞的细胞核,与SHARMA等[19]研究结果一致。培养1、2 d白消安组PLZFmRNA的表达低于正常组,这与白消安制造无精子症模型[20]、消除生殖细胞的结果相一致。培养3 d白消安组PLZFmRNA的表达量高于正常组,与GUTIERREZ等[21]的研究结果一致,提示白消安导致雄性睾丸无精子症,是持续给药的结果,短期用药后,生精能力有恢复的可能。
哺乳动物的性腺发育离不开转录因子GATA4的调控[22]。BIELINSKA等[23]研究发现,在胎儿发育过程中GATA4表达于支持细胞,间质细胞和管周肌样细胞,出生后GATA4通常表达定位于睾丸的支持细胞和间质细胞[24]。本研究结果显示,在对照组和白消安组仔猪睾丸曲精小管中,GATA4蛋白主要定位于支持细胞的细胞核,与BIELINSKA等[23]的研究结果一致。HIRAYANAGI等[25]研究发现,使用40 mg/kg的白消安治疗小鼠60 d后,小鼠体质量降低,免疫组织化学观察发现曲精小管萎缩并且生精细胞变形、凋亡。白消安通过作用于生殖细胞来破坏精子发生[26],长期注射会出现性腺发育停滞和无精子症[27]。本试验研究发现,仔猪睾丸曲精小管的对照组和白消安组中,白消安组GATA4mRNA的表达量高于对照组,与罗小敏等[20]在白消安诱导小鼠无精子症模型的研究结果相一致,提示白消安处理仔猪睾丸曲精小管导致支持细胞的相对数量增加,为植入生殖细胞,恢复生精能力提供充足营养和支持作用。
综上所述,在本研究中,正常培养3 d后仔猪睾丸曲精小管内的PCNAmRNA和蛋白的表达量显著降低,提示该培养条件可以保持曲精小管的活性,但存活质量不高,这可能与缺氧、浸泡时间长等因素有关。PCNA、PLZF和GATA4在对照组和白消安组仔猪睾丸曲精小管内均有表达,白消安导致增殖相关蛋白PCNA表达量增加,导致分化相关蛋白PLZF表达量先降低后增加,提示白消安通过影响增殖分化相关蛋白的表达,导致猪睾丸精子发生受损。
