葡萄VvWRKY70基因生物信息学及表达特性分析
2023-09-13李晋圆李莉娟宋晶晶闫冬梅董志刚仪慧兰
李晋圆 ,李莉娟 ,宋晶晶 ,闫冬梅 ,董志刚 ,仪慧兰
(1.山西大学 生命科学学院,山西 太原030006;2.山西农业大学 果树研究所,山西 太谷 030800)
WRKY基因组成了植物特有的转录因子家族,编码蛋白具有高度保守的WRKYGQK氨基酸序列,参与植物生长发育、物质代谢及非生物(紫外线、低温、H2O2等)和生物(病原菌)胁迫应答[1-2],是植物天然免疫系统的核心成员。近年来,随着植物基因组测序结果的公布,很多物种的WRKY转录因子家族被预测和鉴定,不同物种中WRKY家族拥有的成员数量差异较大,如拟南芥(Arabidopsis thaliana)中有74个[3],苹果(Malus sieversii)中有127个[4],水稻(Oryza sativa)中有102个[5]等。根据N端WRKY结构域数目和C端锌指结构的特征,WRKY转录因子被分为3类,第Ⅰ类通常含有2个WRKY结构域和C2H2型锌指结构,第Ⅱ类和第Ⅲ类含有1个WRKY结构域,C端锌指结构第Ⅱ类为C2H2型,第Ⅲ类为C2HC型[6]。WRKY蛋白可通过特异性结合启动子区Wbox(TTGACT/C)顺式作用元件而激活或抑制下游靶基因的表达[7],也可与其他蛋白形成复合体,使转录因子与DNA的结合活性增强或抑制[8]。此外,WRKY转录因子还可受激酶调控,参与植物对病原菌的响应[8]。
值得注意的是,部分WRKY转录因子已被证明在果实软化和生物胁迫中发挥重要作用。研究表明,野生草莓FvWRKY48可增加果胶裂解酶基因FvPLA的表达,促进细胞壁中果胶质的裂解,加速果实软化[9];FaWRKY25通过负调控茉莉酸信号转导通路,调节草莓果实对灰霉菌的抗性[10]。拟南芥AtWRKY70参与水杨酸(SA)和茉莉酸防御信号途径[11],调控抗病基因(R)介导的抗性、系统防御应答和诱导系统抗性等过程[12-13];番茄SlWRKY70能激活抗病基因Mi-1的表达,增强对线虫和蚜虫的抗性[14],小麦TaWRKY70可激活水杨酸信号转导通路,调节植株对条锈菌的抗性[15]。
葡萄作为全球广泛种植的果树作物,具有重要的经济价值,但鲜食葡萄保鲜机制尚不清楚,影响和限制了葡萄的保鲜处理。依据WRKY家族的分子特征,在葡萄基因组中共预测到59个WRKY家族成员[16],但仅有17个VvWRKYs功能被研究[17-20],其中VvWRKY1、VvWRKY2、VvWRKY33和VvWRKY52等6个WRKYs转录因子通过同源或异源过表达的方式被证实在植株应对生物胁迫过程中发挥调控作用[17,19,21-22]。
课题组前期在SO2保鲜60 d的玫瑰香葡萄果实转录组中发现了差异表达的17个葡萄WRKYs(VvWRKYs)基因,基于AtWRKY70在植物免疫应答中的调控作用[11-13],将其中编码蛋白与AtWRKY70序列同源性相似度最高的一个基因暂命名为VvWRKY70。本研究运用生物信息学技术对VvWRKY70启动子及其编码蛋白质的性能进行预测,并对其转录特征进行分析,旨在为深入研究VvWRKY70的生物学功能及其在鲜食葡萄保鲜中的作用提供依据。
1 材料和方法
1.1 试验材料
葡萄材料取自山西农业大学果树研究所(山西,太谷)。选商用成熟玫瑰香(Vitis viniferaL.cv. Muscat)葡萄果穗,采用二氧化硫(SO2)结合低温(0 ℃)的方式保鲜,对照组处于相同条件只是不加SO2保鲜剂[23]。取SO2保鲜60 d果实和同期对照组果实进行转录组测序,找出差异表达的VvWRKY基因,将编码蛋白与拟南芥AtWRKY70氨基酸序列同源性最高的1个基因暂命名为VvWRKY70,该基因登录号为LOC100255013,编码蛋白质序列登录号为XP_002272504.1。
取玫瑰香葡萄藤条上的根、茎、幼叶、成熟叶、花蕾、幼果及成熟果实的果皮和果肉,用于RNA提取。选色泽接近的成熟果穗分组,分别进行SO2保鲜处理[23],低温(0 ℃)和灰霉菌孢子(5.0×106cfu/mL)喷施处理。处理一定时间后,随机选取果粒,用纯净水冲洗,剥取果皮液氮速冻后于-80 ℃保存备用。
1.2 试验方法
1.2.1 生物信息学分析方法 使用PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)分析基因VvWRKY70启动子区顺式作用元件;在线工具ProtParam(http://web.expasy.org/protparam/)分析VvWRKY70蛋白的理化性质;用ProtScale(http://web.expasy.org/protscale/)分析VvWRKY70氨基酸序列的疏水性/亲水性,NetPhos3.1(http://www.cbs.dtu.dk/services/Net-Phos/)预测VvWRKY70蛋白磷酸化位点,SOPMA(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_sopma.html)预测VvWRKY70二级结构,Conserved Domains(http://www.ncbi.nlm.nih.gov/Structure /cdd/wrpsb.cgi)预测VvWRKY70保守结构域,SWISS-MODEL预测VvWRKY70三级结构,WoLFPSORT(https://wolfpsort.hgc.jp/)预测VvWRKY70亚细胞定位。Bioedit软件分析VvWRKY70及其同源蛋白氨基酸序列特征,软件MEGA7.0的N-J法构建VvWRKY70进化树(bootstrapped=1 000),用到的GenBank登录号如下:拟南芥AtWRKY70(NP_191199.1)、大麦HvRGA5-like(XP_044984274.1)、水稻OsWRKY70(XP_015638920.1)、小麦TaWRKY70(XP_044377883.1)、玉米Zm-unknown(ACF 82210.1)、高粱SbWRKY54(XP_002460069.1)、二穗短柄草BdWRKY70(XP_010228655.1)、大豆GmWRKY70(XP_006599732.1)、番茄SlWRKY80(NP_001352740.1)、苜蓿MtWRKY70(XP_003623 634.1)、毛果杨PtWRKY70(XP_002309186.3)、蓖麻RcWRKY70(XP_002528697.1)、莱茵哈德衣藻CrCHLRE(XP_042925408.1)、翠柏氏藻TrWRKY(KAA6429813.1)、小立碗藓 PpWRKY33(XP_024358453.1)。
1.2.2 基于qRT-PCR的VvWRKY70表达分析葡萄RNA提取采用改良CTAB法[24],使用Prime-Script RT reagent Kit with gDNA Eraser合成cDNA第1链,之后用SYBR Premix Ex TaqTMII PCR Kit进行qRT-PCR检测,引物序列如表1所示。每个反应设3个重复,以Vvactin7为内参基因,采用2-ΔΔCt计算VvWRKY70的相对表达量。

表1 qRT-PCR所用引物序列Tab.1 Primers for qRT-PCR
1.3 数据分析
使用SPSS对检测结果进行方差分析;采用Duncan法分析多组样本间的差异显著性,t检验分析处理组与对照组之间的差异。
2 结果与分析
2.1 VvWRKY70基因启动子区的顺式作用元件
提取VvWRKY70CDS上游2 000 bp序列进行顺式作用元件分析,发现VvWRKY70基因启动子区除含有W-box元件外,还含有水杨酸(SA)、茉莉酸甲酯(MeJA)和脱落酸(ABA)等与植物防御相关的响应元件,以及响应干旱的MYB结合位点(MBS)(图1),说明VvWRKY70转录因子可能在植物防御应答网络中发挥作用,参与植株对生物和非生物胁迫的应答。
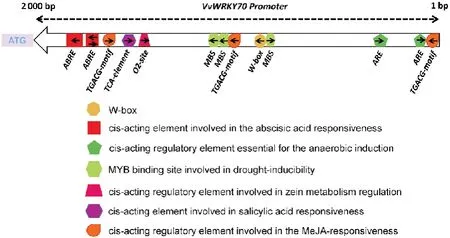
图1 VvWRKY70基因启动子区顺式作用元件Fig.1 Cis-acting elements in the promoter region of VvWRKY70
2.2 VvWRKY70蛋白的理化性质
2.2.1 葡萄VvWRKY70蛋白的基本性质 用Ex-PASyProtParam对葡萄VvWRKY70蛋白的理化性质进行分析,结果显示(图2),VvWRKY70共有322个氨基酸,丝氨酸(Ser)含量最丰富,占总量的14.0%,其次是天冬氨酸(Asp)、亮氨酸(Leu)和苏氨酸(Thr),分别占7.8%、7.1%和6.8%;半胱氨酸(Cys)、脯氨酸(Pro)和色氨酸(Trp)含量较少,分别占2.5%、2.2%和1.2%;带正电荷的氨基酸(His+Arg+Lys)总数为47,带负电荷的氨基酸(Asp+Glu)总数为47。其理论分子质量约为36.57 ku,理论等电点为5.49。不稳定系数为66.07(>40.00),推测为不稳定蛋白。
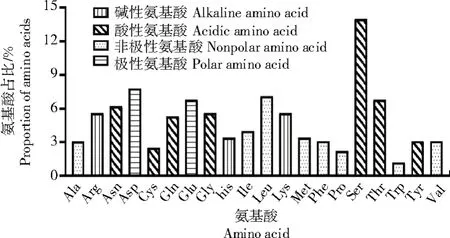
图2 VvWRKY70的氨基酸组成分布Fig.2 Amino acid composition distribution of VvWRKY70
2.2.2 葡萄VvWRKY70氨基酸序列的疏/亲水性预测 了解蛋白质的疏水性/亲水性对其高级结构的形成和功能预测具有参考价值。利用软件ProtScal,根据Kyte & Doolittle算法[25]预测(滑窗=9),在VvWRKY70蛋白中亲水氨基酸在整个蛋白分子中都有分布,约占氨基酸总量的79.9%,明显多于疏水氨基酸(图3),推测VvWRKY70为亲水性蛋白。同时使用ProtParam工具预测到该蛋白平均亲水指数为-0.907,属于亲水蛋白,预测结果与ProtScal一致。VvWRKY70具有一定数量的疏水氨基酸,这有利于其通过疏水作用形成疏水核心,被亲水组分包围,形成一定的空间构象。

图3 VvWRKY70的疏水性/亲水性预测结果Fig.3 Hydrophobic and hydrophilic prediction of VvWRKY70
2.3 葡萄VvWRKY70蛋白磷酸化位点预测
细胞内蛋白质磷酸化在信号转导中发挥着重要作用。利用在线工具NetPhos3.1(得分大于0.5为可能的磷酸化位点)分析,结果发现(图4),VvWRKY70可能存在多个丝氨酸(Ser)、苏氨酸(Thr)和酪氨酸(Tyr)磷酸化位点,其中Ser、Thr和Tyr磷酸化位点分别有34、10、4个,由此推测,VvWRKY70的激活可能与蛋白质磷酸化有关,受细胞激酶信号的调节。

图4 预测的VvWRKY70磷酸化位点Fig.4 Predicted phosphorylation sites of VvWRKY70
2.4 葡萄VvWRKY70的二级结构预测
用SPOMA预测结果发现(图5),葡萄VvWRKY70二级结构包含无规卷曲、α-螺旋、β-折叠片层和β-转角4种结构,分别占蛋白分子的62.73%、22.98%、10.87%和3.42%,其中,无规卷曲是VvWRKY70的主要二级结构,α-螺旋和β-折叠片层结构散在分布于整个肽链中。

图5 预测的VvWRKY70二级结构Fig.5 Predicted secondary structure of VvWRKY70
2.5 葡萄VvWRKY70的结构域和亚细胞定位预测
对葡萄VvWRKY70进行保守结构域分析,发现其第135—195位氨基酸是典型的WRKY保守结构域(图6-A)。SWISS-MODEL软件预测其三级结构发现,第135—195位氨基酸可形成特定的高级结构(图6-B)。

图6 VvWRKY70的保守结构域及其高级结构Fig.6 VvWRKY70 protein conservative domain and its advanced structure
WoLF PSORT预测显示,VvWRKY70定位于细胞核中的预测值为13,在细胞质中的预测值为1,初步推测VvWRKY70可能位于细胞核中,这与转录因子发挥功能的场所吻合。
2.6 VvWRKY70的系统进化树分析与功能预测
BlastP工具检索到与VvWRKY70序列同源性较高的16种植物(分别属于苔藓、地衣、蕨类、单子叶植物和双子叶植物)的WRKY家族成员;利用BioEdit软件分析比较氨基酸序列,发现VvWRKY70蛋白的氨基酸序列N端含有一个保守的WRKYGQK序列,C端含有C2HC型锌指结构(图7-A),属于WRKY第Ⅲ亚家族。使用MEGA 7.0软件构建VvWRKY70系统发育树,发现系统发育树中双子叶和单子叶植物分别聚成一支,而低等植物分支较远,属于远源物种,这与植物物种进化过程一致,说明VvWRKY70在进化上趋于保守(图7-B),在植物中可能发挥着基础的生物学功能。通过类比其他物种同源性相近的WRKY转录因子功能(表2),预测VvWRKY70可能在植物响应非生物胁迫和病原真菌侵染中发挥重要的生物学功能。
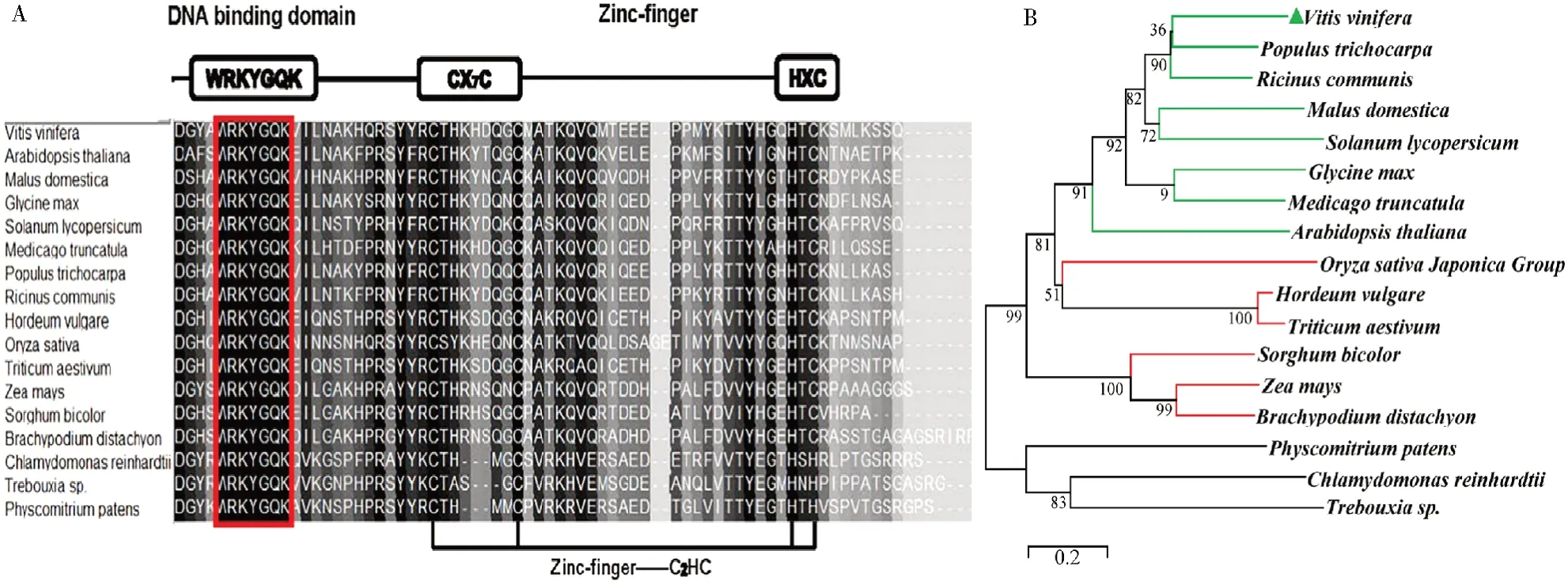
图7 VvWRKY70氨基酸序列分析及系统发育树Fig.7 Analysis of amino acid sequence and phylogenetic tree of VvWRKY70

表2 不同物种中与VvWRKY70相似性较高的蛋白质的功能描述Tab.2 Functional description of proteins with high similarity to VvWRKY70 in different species
2.7 VvWRKY70组织表达模式及在葡萄果实中的诱导表达分析
RT-PCR发现,VvWRKY70在玫瑰香葡萄的根、茎、幼叶、成熟叶、花蕾、幼果及成熟果实的果皮和果肉中均有表达(图8-A),成熟叶中表达量最高。

图8 VvWRKY70的组织表达模式及胁迫应答Fig.8 Tissue expression pattern and stress response of VvWRKY70
选取与葡萄保鲜过程密切相关的3个环境因子低温、灰霉菌和SO2保鲜处理葡萄果实,结果发现,低温处理后,相比于同期对照组,VvWRKY70显著下调表达(图8-B);而SO2保鲜和灰霉菌处理组相比于同期对照组葡萄果皮中VvWRKY70上调表达(图8-C、D)。说明在采后保鲜过程中葡萄果实VvWRKY70被诱导表达,可能对葡萄采后保鲜发挥作用。
3 结论与讨论
植物WRKY转录因子是一类调节蛋白超家族,通过与MAPK和VQ蛋白等联合作用形成基因调控网络,调节着植物对不同环境刺激的响应[1,8]。在葡萄(Vitis vinifera)中,基于公布的12×V. viniferacv.黑比诺(PN40024)基因组序列,预测出59个可能的VvWRKYs转录因子[16],但仅有少数VvWRKYs转录因子的生物学功能通过异源过表达拟南芥、烟草植株或瞬时转化葡萄叶片等手段得到证明,如VvWRKY1、VvWRKY2和VvWRKY33转录因子在植物应对灰霉菌、霜霉菌等病原菌侵染时发挥正调控作用[17,21-22];VvWRKY22和VvWRKY26转录因子参与糖类和类黄酮的生物合成[31-32];转录因子VvWRKY8、VvWRKY11和VvWRKY30正调控植株对紫外线、干旱和盐胁迫的应答[18,33-34]。受葡萄遗传转化困难的限制,葡萄WRKY家族中仅有VvWRKY1、VvWRKY52、VvWRKY8等少数转录因子被证明在葡萄植株抵御营养型病原菌白粉菌和非生物胁迫中发挥调控作用[19,33],VvWRKY70的功能尚不清楚。本研究通过生物信息学分析和基因转录分析,获得了玫瑰香葡萄VvWRKY70的基本特征,为进一步揭示VvWRKY70的功能奠定了基础。
有研究证明,WRKY转录因子的磷酸化在植物免疫中发挥重要的作用,如拟南芥AtWRKY70的Thr22和Ser34位点的磷酸化可激活SARD1表达,增强植株对丁香假单胞菌(PstDC3000)的抗性[35],AtWRKY33磷酸化能激活AtPAD3的表达,介导抗毒素生物合成,增强植物对灰霉菌的抗性[36]。由于VvWRKY70氨基酸序列与AtWRKY70具有较高的同源性,且可能存在多个丝氨酸/苏氨酸的磷酸化位点,可能受激酶磷酸化的调控。
功能性W-box元件主要存在于WRKY基因的启动子区[36],因此,WRKY蛋白可以与自己或其他WRKY基因的启动子区结合以进行自我或交叉调节,如水稻OsWRKY70、辣椒CaWRKY40能够结合自己的W-box实现自激活响应病原菌和热胁迫[37-38]。VvWRKY70基因的启动子区域具有W-box顺式作用元件,说明VvWRKY70可能会受到自身或者其他VvWRKY转录因子的调控。在VvWRKY70的启动子区,除了W-box元件外,还有SA、MeJA、和ABA等激素响应元件。SA和MeJA是植物抗病信号分子,在植物识别病原体过程中不断积累并可以触发特定的下游信号级联反应,诱导防御相关基因表达,产生防御蛋白以及具有抗菌活性的次生代谢物,进而增强植物抗病性[39]。ABA是植物应对非生物胁迫的重要激素,可介导植物对多种非生物胁迫的适应[39]。由此推测,VvWRKY70可能作为植物激素调控的下游基因,参与植物对生物和非生物胁迫的防御应答过程。
VvWRKY70在进化上具有高度的保守性,可能在植物中发挥着基础的生物学功能。其他物种中与VvWRKY70同源性较高的转录因子,被证实通过调控SA受体NPR1,激活依赖于NPR1的水杨酸下游信号通路,调节植物对病原真菌的抗性[2,11-12],或者正调控应激相关基因(如ADC、P5CS和NCED3等)的表达,增加植物对非生物胁迫的抵御能力[27,29]。SO2保鲜玫瑰香葡萄果实60 d后,果实组织中与激素信号、防御应答和苯丙烷合成途径相关的多个基因差异表达;次生代谢产物总酚、类黄酮等含量增加,抗病酶几丁质酶(CHI)、β-1,3-葡聚糖甘酶(BGL)活性升高[23],说明果实保鲜剂SO2处理诱导相关基因表达可提高果实的防御能力。本研究发现,低温抑制葡萄果实VvWRKY70的表达,而灰霉菌能诱导该基因高表达,暗示葡萄果实VvWRKY70可能参与了灰霉菌诱导的防御应答过程。SO2保鲜过程中,同期低温对照组该基因被显著抑制,与低温处理组结果一致,而SO2保鲜组VvWRKY70呈现高表达,说明SO2可能通过提高低温环境下VvWRKY70的转录应答,参与果实采后生理调节和免疫应答反应,但是关于其在葡萄逆境应答及保鲜过程中的调控作用仍需进一步深入研究。
本研究通过生物信息学和表达特性分析,对功能未知的VvWRKY70基因有了初步的了解,预测该基因编码322个氨基酸组成的蛋白质,属于WRKY第Ⅲ亚家族,主要位于细胞核,可能受植物激素茉莉酸、水杨酸以及蛋白质磷酸化的调节;VvWRKY70在葡萄多种组织细胞中表达,参与调节植株生理和果实发育过程;葡萄果实中VvWRKY70受灰霉菌和SO2诱导上调表达,参与葡萄采后生理过程的调节,但基因的具体功能和调节途径有待进一步研究。
