用于诱导纳米金快速聚集比色传感的DNA染料筛选
2023-09-11叶子熠张信凤
叶子熠, 刘 霜, 张信凤
成都理工大学材料与化学化工学院, 四川 成都 610059
引 言
纳米材料具有特殊的尺寸效应和优异的光电性质, 已在传感分析中得到广泛应用[1-2], 特别是金纳米粒子(AuNPs)由于局部表面等离子体共振, 其光学响应会伴随AuNPs形态、 大小以及组成的改变而发生变化[3]。 AuNPs具有极高的消光系数, 且其形状、 大小以及AuNPs之间的距离会影响其溶液所呈现的颜色[4]。 因此AuNPs已被广泛应用于构建比色生物传感器[5-7]。 目前引起AuNPs聚集的方式有两种类型[8-9], 一类是交联作用引起的聚集, 比如Mirkin[10]等借助DNA交联分子, 通过在AuNPs上杂交两条互补的DNA链来触发AuNPs聚集; 也可以通过抗体修饰的AuNPs和目标物之间的相互作用实现AuNPs的聚集[11-12]。 另一类是非交联作用引起的聚集, 主要是盐诱导AuNPs聚集。 盐诱导AuNPs聚集具有方便, 价廉以及颜色变化显著等优点, 在比色传感中得到广泛应用。 然而, 盐诱导AuNPs聚集动力学过程较复杂, 并且聚集后颜色以及吸光度值不断变化, 不利于准确分析[13-15]。
前期实验发现DNA染料诱导AuNPs聚集具有用量少、 速度快并且稳定性好的优势[16]。 DNA染料诱导AuNPs聚集主要通过带正电的染料中和AuNPs表面的电荷, 实现 AuNPs的聚集, 带来颜色变化。 Xing[17]等报道了利用电荷中和诱导AuNPs聚集, 并构建了无标记、 比色传感体系, 用于检测玉米烯酮。 然而, 这些研究工作仅对SYBR Green I (SG)一种DNA染料进行研究。 本研究进一步详细筛选了常见的DNA染料[18-20], 考察了其诱导AuNPs聚集的染料用量“IC50”、 碱基对与染料的结合比及DNA与染料的结合常数, 以筛选出最佳DNA染料。
1 实验部分
1.1 仪器与试剂
UV-5200PC型紫外-可见分光光度计(上海元析仪器有限公司); Nikon D7000型数码照相机(株式会社尼康); ZEN360型纳米粒度电位仪(英国马尔文仪器有限公司); F-7000型荧光分光光度计(日本株式会社日立高新技术科学)。
实验所用试剂均为分析纯, 用水均为超纯水(18.25 MΩ·cm-1, 四川优普超纯科技有限公司)。 四氯金酸(HAuCl4·3H2O, 99.99%), 磷酸二氢钠二水合物(NaH2PO4·2H2O), 噻唑橙(TO), 溴化乙锭(EB)购买于阿拉丁生化科技股份有限公司。 柠檬酸三钠(C6H5Na3O7·2H2O), 二甲基亚砜(DMSO)购买于成都科龙化工试剂厂。 氢氧化钠(NaOH)购买于成都金山化学试剂有限公司。 Picogreen(PG, 10 000×), TOTO-1碘化物(1 mmol·L-1), TOTO-3碘化物(1 mmol·L-1), YOYO-1碘化物(1 mmol·L-1), SYBRGreen(SG, 10 000×)购买于赛默飞世尔科技有限公司。 吖啶橙(AO)购买于西格玛奥德里奇科技有限公司。 本实验所用双链DNA(dsDNA)由上海生工生物工程有限公司合成并纯化, 两条链的序列为TTC CTC TGT GCG CCG GTC TCT CCT和AGG AGA GAC CGG CGC ACA GAG GAA。
1.2 方法
1.2.1 AuNPs的制备
参照文献[21]方法进行制备。 将60 mL质量分数为0.01%的HAuCl4溶液加入三颈烧瓶, 油浴加热煮沸后立即加入800 μL质量分数2%的柠檬酸三钠, 当溶液颜色由蓝色变为酒红色后继续煮沸20 min停止加热, 可获得粒径为14 nm, 浓度为4 nmol·L-1的AuNPs颗粒, 将溶液缓慢搅拌冷却至室温后保存在4 ℃的冰箱中备用。
1.2.2 DNA染料诱导AuNPs聚集
用不同的DNA染料诱导AuNPs聚集, 每种DNA染料取8种不同的浓度, 这8种浓度能使AuNPs产生红色到紫色再到蓝色的颜色变化。 将一定量DNA染料加入到250 μL AuNPs 溶液中, 终体积为300 μL。 用移液枪充分搅拌混匀以上溶液, 随着DNA染料浓度的增大, 溶液产生由红色到紫色再到深蓝色的颜色变化, 随后用数码相机拍摄溶液照片。
1.2.3 不同DNA染料与DNA的结合比
结合比的测定参照文献[22]介绍的方法并加以改进。 取一定量的dsDNA与一定量DNA染料于磷酸缓冲液中, 终体积为300 μL, 保持碱基对与DNA染料的总物质摩尔浓度不变, 改变碱基对与DNA染料的摩尔分数, 在dsDNA与DNA染料的最佳激发波长下测定不同比例的荧光强度, 选出最高荧光强度的条件即为碱基对与DNA染料的结合比n值。
1.2.4 不同DNA染料与DNA的结合常数
取一定量的DNA染料和磷酸缓冲溶液于比色皿中, 终体积为1 000 μL, 测定其DNA染料初始的荧光值Fmin, 然后逐次滴加dsDNA, dsDNA的浓度由低到高, 每滴加一次dsDNA测定一次荧光值, 直至DNA染料和dsDNA的荧光值不再发生变化, 此时的荧光值记为Fmax。
2 结果与讨论
2.1 不同DNA染料诱导纳米金聚集
筛选了一些常见的DNA染料诱导AuNPs聚集, 包括EB、 AO、 TO、 SG、 PG、 TOTO-1、 TOTO-3、 YOYO八种染料, 其分子结构分别如图1所示。
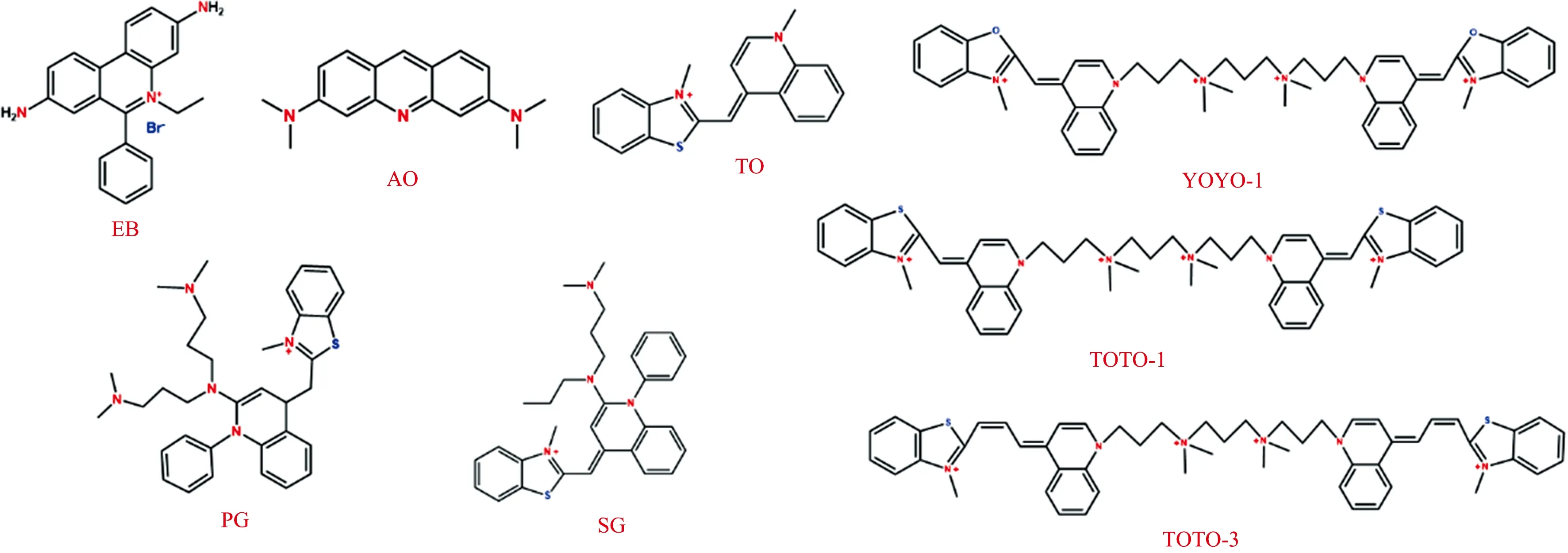
图1 不同核酸的结构式
所考察的8种染料均可诱导AuNPs快速聚集, 使AuNPs颜色由红色变为深蓝色(图2)。 这8种DNA染料诱导AuNPs聚集所使用试剂浓度大小排序为AO(2.6 μmol·L-1), EB(1.6 μmol·L-1), TO(1.1 μmol·L-1), SG(0.59 μmol·L-1), TOTO-1(0.30 μmol·L-1), TOTO-3(0.30 μmol·L-1), PG(0.24 μmol·L-1), YOYO(0.18 μmol·L-1)。 其中, 使用浓度最小的是 YOYO, 诱导 AuNPs 聚集仅需要0.18 μmol·L-1, 使用浓度最大的是AO, 诱导AuNPs聚集也仅需要2.6 μmol·L-1。 传统的 NaCl 和半胱氨酸(Cys)的使用浓度分别为60和20 mmol·L-1。 可见, DNA染料诱导AuNPs聚集的用量仅为NaCl和Cys用量的万分之一。

图2 DNA染料, NaCl, Cys诱导AuNPs聚集可视化图片
2.2 不同DNA染料诱导的聚集效率
为了定量评价DNA染料诱导AuNPs聚集的效果, 考察DNA染料诱导AuNPs聚集效率, 定义一个“IC50”值, 即诱导剂使AuNPs聚集的最大吸光度变化(A680/A520)50%所对应的浓度。 不同浓度的DNA染料诱导AuNPs聚集吸光度比值A680/A520的变化图3(a—h)所示。
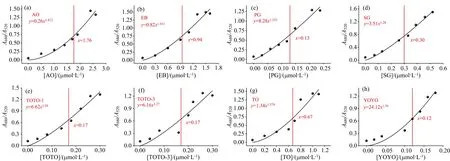
图3 不同浓度的DNA染料诱导AuNPs聚集吸光度比值A680/A520
根据最大吸光度变化(A680/A520)50%所得出各个DNA染料的“IC50”值如表1。 DNA染料诱导AuNPs的“IC50”值越小, 则DNA染料诱导AuNPs聚集的用量就越少。 因此根据诱导AuNPs聚集的DNA染料用量可以得出: YOYO、 TOTO-1、 TOTO-3、 PG、 SG的诱导聚集效果明显优于EB、 TO、 AO。

表1 DNA染料诱导AuNPs的IC50的比较
前期研究[16]发现DNA染料诱导AuNPs聚集依赖于电荷中和效应, 并且带正电的N原子数量对AuNPs的聚集有关键性的作用, 带正电的N原子数量越多, 中和AuNPs时的用量越少。 因此使用Marvin View中microspecies(微观结构式)和microspecies distribution(微观结构式分布)计算出具体带正电的N原子个数。 结果表明, 在pH=7条件下, AO有0.94个N原子带正电荷, EB和TO 有1个N原子带正电荷, SG有2.59个N原子带正电荷, PG有3.08个N原子带正电荷, TOTO-1、 TOTO-3、 YOYO有4个N原子带正电荷, 很好地解释了YOYO、 TOTO-1、 TOTO-3、 PG、 SG的诱导聚集效果明显优于EB、 TO、 AO的原因。
2.3 DNA染料的结合比
DNA染料常与dsDNA结合[23], 因此碱基对与染料的结合比及dsDNA与DNA染料的结合常数会影响游离DNA染料的量, 进而影响对AuNPs聚集调控。 考察碱基对与染料的结合比以及dsDNA与DNA染料的结合常数是非常重要的。
首先通过Job曲线[22]确定碱基对与DNA染料的结合比,XBp表示碱基对物质的量比碱基对和DNA染料总的物质的量, 最高荧光强度的条件即为碱基对与DNA染料的结合比n值。 由图4(a—h)可知, 碱基对与SG、 PG、 TOTO-3、 YOYO的结合比为1∶0.67; 与TO, TOTO-1的结合比为1∶1, 与EB的结合比为1∶1.5, 与AO的结合比为1∶2.3。 结果表明, 相同条件下, dsDNA中的碱基对与8种DNA染料的结合比相差不大。
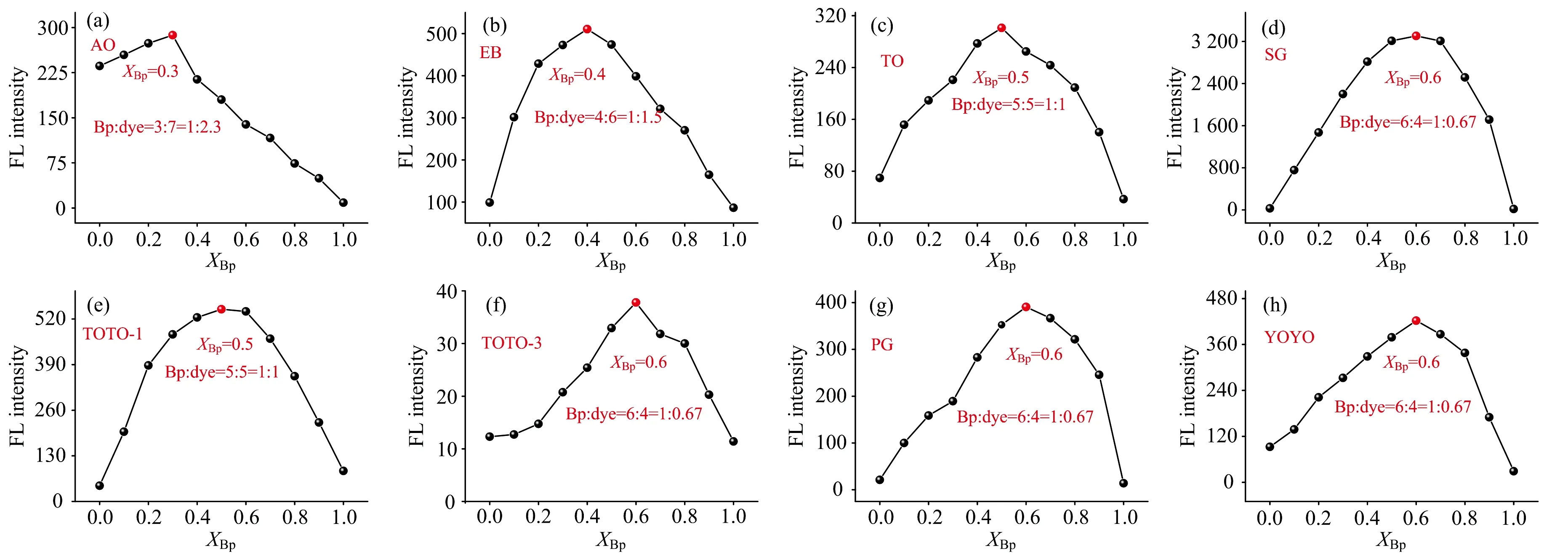
图4 不同DNA染料XBp对FL intensity的Job曲线
2.4 DNA染料的结合常数
研究中通过dsDNA与DNA染料的结合常数评估了两者间的相互作用[24]。 在已知结合比的基础上, 将结合比n值,Fmin,Fmax代入如式(1)—式(5)拟合滴定曲线即可得到结合常数Ka[25]。
(1)
F=Fmin(1-X1)+FmaxX1
(2)
(3)
(4)
(5)
式(1)—式(5)中,X1为结合率,Fmin为没有加入dsDNA时染料的荧光强度,Fmax为加入dsDNA饱和后染料的荧光强度。
由图5(a—h)分别可以看出, PG、 SG、 TOTO-3、 YOYO和TOTO-1的结合常数远大于AO、 EB和TO。 本实验中, 结合常数Ka越大, dsDNA与DNA染料的结合强度越大, dsDNA结合的DNA染料越多, 调控DNA染料诱导AuNPs聚集效果更显著。
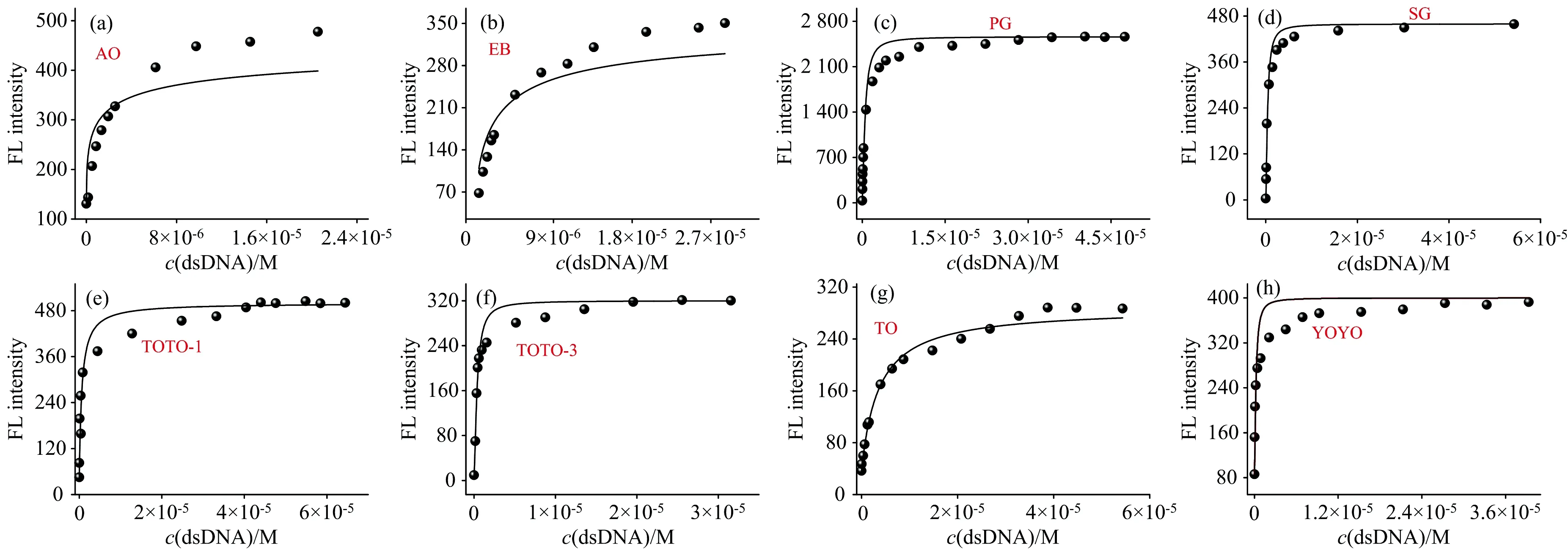
图5 不同DNA染料的实验拟合曲线
将碱基对与DNA染料的结合比、 dsDNA与DNA染料的结合常数总结于表2。 dsDNA 与染料 SG、 YOYO、 TOTO-3和PG的结合常数较大, 分别为3.12×1010, 9.49×109, 4.25×109和2.75×109L·mol-1, 远远大于dsDNA与其他染料的结合常数, 说明当dsDNA与SG、 PG、 YOYO和TOTO-3结合时, 游离的DNA染料相对较少, 在调控AuNPs的聚集上将有更好的效果, 用于检测DNA有更高的灵敏度。
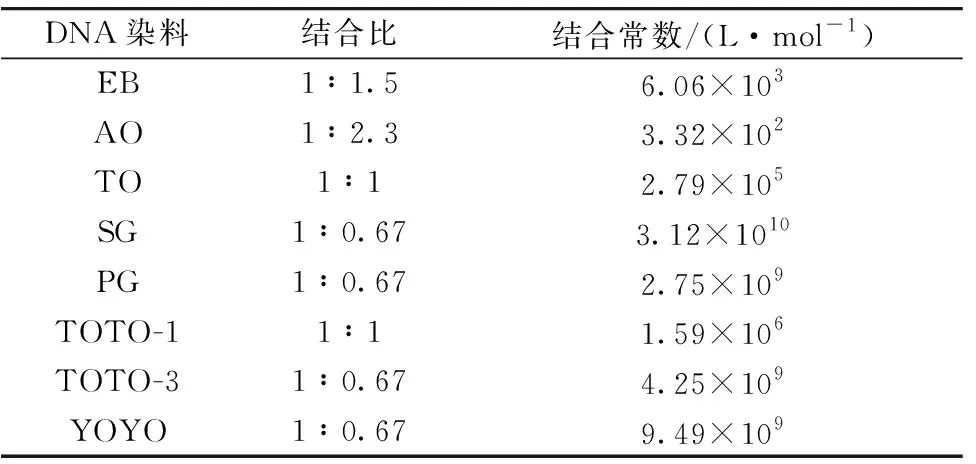
表2 碱基对与DNA染料的结合比以及dsDNA与DNA染料的结合常数
3 结 论
考察了一系列常见DNA染料诱导AuNPs的聚集效率(“IC50”)以及DNA染料与DNA的相互作用。 从DNA染料诱导AuNPs聚集的使用量来看, YOYO、 TOTO-1、 TOTO-3、 PG和SG的用量更少, 诱导AuNPs聚集效果显著; 从dsDNA与DNA染料相互作用来看, dsDNA 与染料SG、 PG、 YOYO及TOTO-3 的结合能力比较强, 用于检测DNA将具有更高的灵敏度。 总之, SG、 YOYO、 PG和TOTO-3在调控AuNPs聚集效果及用于DNA检测的灵敏度将相差不大。 以上四种DNA染料有望用于构建高性能的AuNPs比色传感体系。
