氨基硫脲芳基钌配合物与人血清白蛋白的相互作用机制研究
2023-09-11梁健丹韦雅淑
杨 晶, 李 莉, 梁健丹, 黄 珊, 苏 炜, 韦雅淑, 韦 良*, 肖 琦*
1. 南宁师范大学化学与材料学院, 广西 南宁 530100
2. 广西壮族自治区生殖医院, 广西 南宁 530218
引 言
金属基抗肿瘤药物一直是研究的焦点, 其中金属钌配合物由于具有低毒、 易吸收、 抗肿瘤活性高、 靶向性好等优点, 被认为是继铂之后最有前途的抗癌药物[1-3]。 近年来氨基硫脲配体药物的钌(Ⅱ)芳烃配合物对多种癌细胞显示出明显的体外抗肿瘤活性, 在药物研发和化学生物学等方面发挥着重要作用[4-6]。 Su等[7]合成了一系列新型芳基钌(Ⅱ)-TSC配合物, 该抗肿瘤药物对肝癌细胞(BEL-7404)和胃癌细胞(SGC-7901)有很好的抗肿瘤活性。 Floyd等[8]合成、 表征并研究了氨基硫脲配体的钌(Ⅱ)芳烃配合物的抗增殖和抗肿瘤活性, 发现配合物对人乳腺癌细胞(MCF-7和MDA-MB-231)和结直肠癌细胞(HCT-116和HT-29)具有较好的抗癌效果。 这些结果表明, 钌(Ⅱ)芳烃和氨基硫脲配体的组合是开发新型钌(Ⅱ)基抗癌药物有希望的起点[9-10]。
人血清白蛋白(human serum albumin, HSA)是人体内最丰富的蛋白质之一, 占人体血液中总蛋白的60%[11]。 HSA因其水溶性好、 稳定性好、 制备简单、 易纯化等优点, 被广泛选择作为模型血清蛋白来研究钌配合物与血清蛋白之间的相互作用[12-13]。 近些年, Thangavel等[14]对N-(吡啶-2-基亚甲基)苯胺衍生物和咔唑Ru(Ⅱ)配合物与HSA的结合作用、 构象变化和分子对接进行研究, 结果表明, Ru(Ⅱ)配合物与HSA具有明显的强相互作用。 Huang等[15]采用多种光谱分析方法和电分析法, 在生理条件下系统研究了[(η6-p-对伞花烃)Ru(Ⅱ)苯甲醛-N(4)苯基氨基硫脲)Cl]Cl抗癌药物与HSA之间的相互作用。 由于钌配合物抗肿瘤药物毒性小, 且更易被肿瘤组织吸收, 同时可以模拟铁离子与血浆中的血清蛋白和转铁蛋白结合, 从而使得药物更容易进入癌细胞内, 并显示出对原发癌症和转移性肿瘤较高的的抗癌活性[16-17]。 本工作合成并采用多种光谱技术研究两种氨基硫脲芳基钌(Ⅱ)配合物与HSA的相互作用机制, 同时结合荧光猝灭机理、 相互作用力及构象研究, 探讨这两种氨基硫脲芳基钌配合物对HSA结构的影响。 不仅从相应作用层面进一步分析了该类型配合物具有抗肿瘤活性的本质原因, 并且对新型抗肿瘤药物的设计与合成具有重要的理论指导意义。
1 实验部分
1.1 试剂
[Ru(η6-cymene)Cl2]2, 4-甲基-3-硫代氨基脲和4-苯基-3-硫代氨基脲均从百灵威公司购买, 乙醇法制备配合物储备液[13], 人血清白蛋白(human serum albumin, HSA)、 华法令阻凝剂、 异丁苯丙酸购自Sigma-aldrich公司(美国), HSA溶解于磷酸盐缓冲盐水(Phosphate buffered saline, PBS, 0.1 mol·L-1, pH 7.4), 置于冰箱中保存待用。 其他化学试剂均为分析试剂级, 未经进一步纯化即可使用。 超纯水由Millipore-Q净化装置(18.2 MΩ)制备。
1.2 仪器
LS-55型荧光分光光度计(美国, PerkinElmer Limited公司), Quanta Master 8000型稳态瞬态荧光光谱仪(日本, HORIBA科学仪器事业部), Cary 100型紫外-可见分光光度计(澳大利亚, 安捷伦技术公司), Nicolet Avater FT-360型红外光谱仪(美国, Thermo Scientific公司), Chirascan型圆二色光谱仪(英国, Applied Photophysics公司), PB-10型pH计(中国, 赛多利斯科学仪器有限公司)。
1.3 氨基硫脲基钌配合物的合成
根据文献[2, 18]合成配合物1: 将4-甲基-3-硫代氨基脲(0.45 mmol)和9-蒽甲醛(0.3 mmol)溶于10 mL二氯甲烷中, 常温搅拌6 h, 减压蒸馏部分溶剂, 加石油醚至明显分层, 静置24 h, 重结晶2~3次, 得到配体。 取29.3 mg配体(0.1 mmol)溶于6 mL二氯甲烷, 加31 mg(0.05 mmol)[Ru(η6-cymene)Cl2]2, 常温搅拌6 h, 将反应液减压蒸馏部分溶剂, 加石油醚(明显分层)静置24 h, 析出固体, 得到配合物1。 产量: 33 mg(86%)。
配合物2的合成: 将4-甲基-3-硫代氨基脲换成4-苯基-3-硫代氨基脲(0.45 mmol), 其他合成步骤与配合物1相同。 产量: 38 mg(74%)。
两种氨基硫脲芳基钌(Ⅱ)配合物的结构如图1(a, b)所示。 配合物溶解在二甲基亚砜中, 超声5 min后冷藏备用。

图1 氨基硫脲芳基钌(Ⅱ)配合物1(a)和配合物2(b)的结构
1.4 猝灭机理研究
时间分辨荧光光谱(荧光寿命)法: 激发波长为278 nm, 发射波长为350 nm, 狭缝为5 nm; 两种配合物与HSA的浓度均为2.0×10-6mol·L-1。
稳态荧光光谱法: 以295 nm为激发波长, 扫描波长范围为300~450 nm, 激发与发射狭缝分别为10.0和7.5 nm, HSA的浓度为2.0×10-6mol·L-1; 配合物1的浓度为2.0×10-6mol·L-1, 配合物2的浓度为1.0×10-6mol·L-1。
1.5 二级构象研究
红外吸收光谱法: 在2 000~1 750 cm-1的波长范围内扫描记录HSA溶液的差谱基线进行校正; HSA和两种配合物的浓度均为1.0×10-3mol·L-1。
圆二色光谱法: 扫描速度为500 nm·s-1, 响应时间为0.5 s, 扫描波长范围为200~280 nm。
2 结果与讨论
2.1 氨基硫脲基钌配合物对HSA的荧光猝灭影响
HSA的内源性荧光主要由色氨酸残基、 酪氨酸残基以及苯丙氨酸残基等荧光基团提供。 在小分子配合物与HSA结合作用后改变了HSA的二级结构及氨基酸残基的微环境, 从而使HSA的荧光强度发生改变[15]。 图2(a, b)分别为两种氨基硫脲芳基钌配合物与HSA的荧光猝灭谱, 在相同的实验条件下, HSA在350 nm附近出现强烈的荧光发射峰, 而两个配合物在相应位置几乎没有发射峰出现, 因此可忽略这两个配合物自身对HSA的影响。 随着两个配合物浓度的增加, HSA的荧光强度有规律地下降, 说明配合物对HSA的荧光猝灭影响与配合物的浓度呈线性关系。 当配合物1的浓度为2.0×10-7mol·L-1, 其对HSA的猝灭效率为47.00%, 配合物2为1.0×10-7mol·L-1, 其对HSA的猝灭效率为48.56%, 由此可见, 配合物2对HSA的荧光猝灭效率更强。

图2 (a)不同浓度配合物1与HSA在298 K处相互作用的荧光猝灭图, 1—11: c配合物1=0, 0.2, 0.4, 0.6, 0.8, 1.0, 1.2, 1.4, 1.6, 1.8, 2.0×10-6 mol·L-1, cComplex 1 only=2.0×10-6 mol·L-1; (b)不同浓度配合物2与HSA在298 K处相互作用的荧光猝灭图, c配合物2=0, 0.1, 0.2, 0.3, 0.4, 0.5, 0.6, 0.7, 0.8, 0.9, 1.0×10-6 mol·L-1, cComplex 2 only=1.0×10-6 mol·L-1, 其中, cHSA=2.0×10-6 mol·L-1
2.2 氨基硫脲基钌配合物对HSA的荧光猝灭机理
荧光猝灭主要发生在猝灭剂与荧光基团之间的碰撞或基态复合物的形成过程, 因此猝灭机理可分为静态猝灭和动态猝灭, 其区别在于对温度的依赖性不同, 静态猝灭的猝灭常数随温度的升高而降低, 而动态猝灭反之[11-12]。 为了探讨可能的猝灭机理, 进行了三种不同温度(298, 304, 310 K)下的荧光猝灭实验, 并根据Stern-Volmer方程(1)式分析实验结果。
(1)
式(1)中,F0和F分别是小分子配体加入前后的荧光强度,Ksv为猝灭常数, [Q]为配合物的浓度。
两个配合物与HSA相互作用的Stern-Volmer结果见图3(a, b)所示, 相关数据列于表1。 298 K时, 配合物1的Ksv为4.28×105L·mol-1, 配合物2的Ksv为10.03×105L·mol-1, 随着温度的不断升高, 两种配合物与HSA相互作用的猝灭常数逐渐降低, 这说明氨基硫脲基芳基钌配合物与HSA相互作用的荧光猝灭机理为静态猝灭。 在相同条件下,配合物2与HSA的荧光猝灭常数更大, 可进一步说明配合物2的荧光猝灭能力更强。

表1 两种氨基硫脲芳基钌配合物与HSA相互作用的猝灭常数、 结合常数与热力学参数

图3 不同温度下氨基硫脲芳基钌配合物1(a)和配合物2(b)与HSA相互作用的荧光猝灭Stern-Volmer图
静态猝灭机理还可以根据修正的Stern-Volmer方程(2)式进一步分析验证该结果[13]。
(2)
式(2)中,Ka为小分子配体与HSA相互作用的结合常数, [Q]为小分子配体的浓度,fa为HSA荧光分子可接近猝灭剂的分数。
如图4(a, b)所示, 两种氨基硫脲芳基钌配合物与HSA之间相互作用修正后的Stern-Volmer方程的线性关系良好,Ka值列于表1。 当温度从298 K升到310 K, 两种氨基硫脲芳基钌配合物与HSA相互作用的Ka值却随之下降, 这可以进一步确定为静态猝灭过程。 在相同条件下, 配合物2与HSA的Ka值更大, 进一步说明配合物2与HSA的结合能力更强。
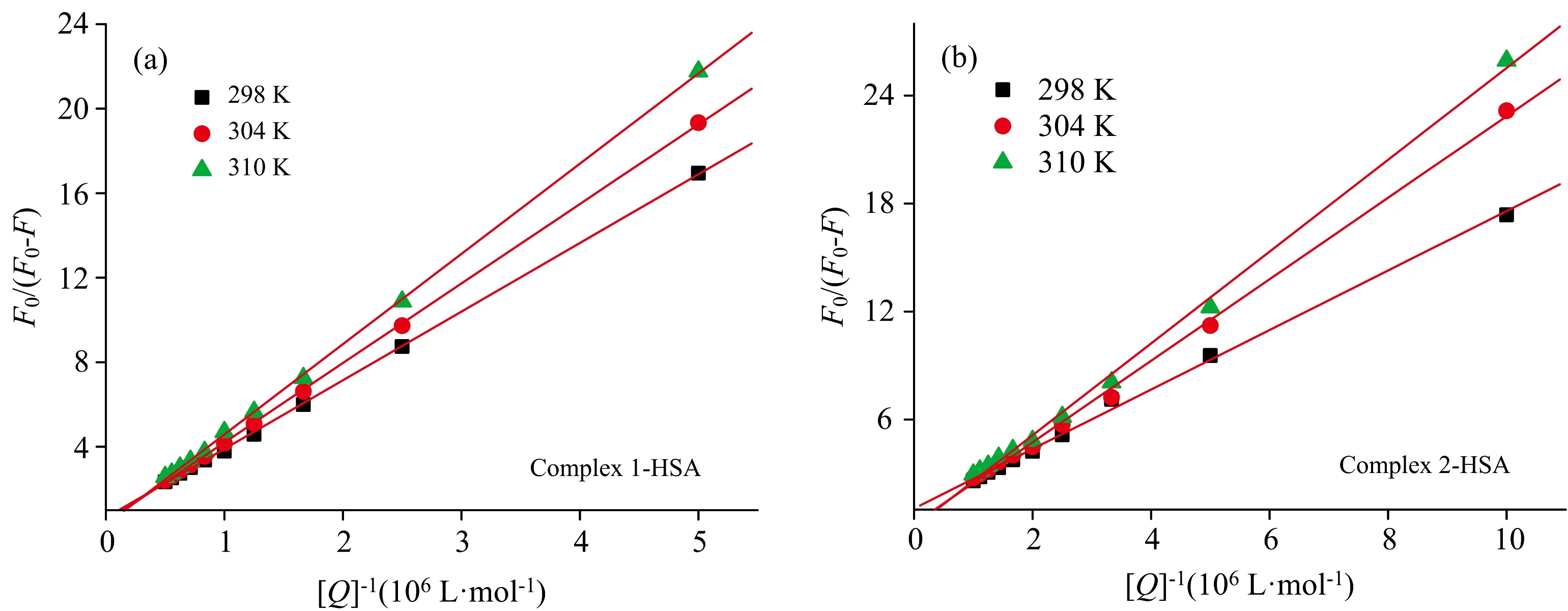
图4 不同温度下氨基硫脲芳基钌配合物1(a)和配合物2(b)与HSA相互作用修正的Stern-Volmer方程图
除了稳态荧光光谱法, 时间分辨荧光光谱法也是探究荧光猝灭机理的一种常用方法。 荧光团的荧光寿命通常在动态猝灭过程中发生变化, 而在静态猝灭过程中保持不变[19]。 如图5及表2所示, 加入两种配合物后, HSA的平均荧光寿命变化很小, 揭示了这两种配合物与HSA作用均为静态猝灭[15]。

表2 两种氨基硫脲芳基钌配合物与HSA相互作用的荧光寿命数据

图5 两种氨基硫脲芳基钌配合物与HSA相互作用的荧光寿命图
2.3 氨基硫脲基钌配合物与HSA的相互作用力研究
内源性配体或外源性配体与HSA的结合力通常包括疏水作用力、 范德华相互作用力、 氢键、 静电相互作用力等, 可以通过改变某些热力学参数来阐明其主要作用力类型[16]。 如果焓变(ΔH)在研究温度范围内保持不变, 熵变(ΔS)和吉布斯自由能变化(ΔG)可以用方程(3)和方程(4)计算[17]。
(3)
ΔG=ΔH-TΔS
(4)
实验结果表明, lnKa与1/T之间存在着良好的线性关系, 如图6所示。 ΔH, ΔS和ΔG等相关数据汇总于表1。 ΔG为负值, 表明两种配合物与HSA之间的结合过程是自发的; ΔH和ΔS均为负值, 表明范德华力和氢键在氨基硫脲芳基钌配合物与HSA的相互作用中起主要作用。
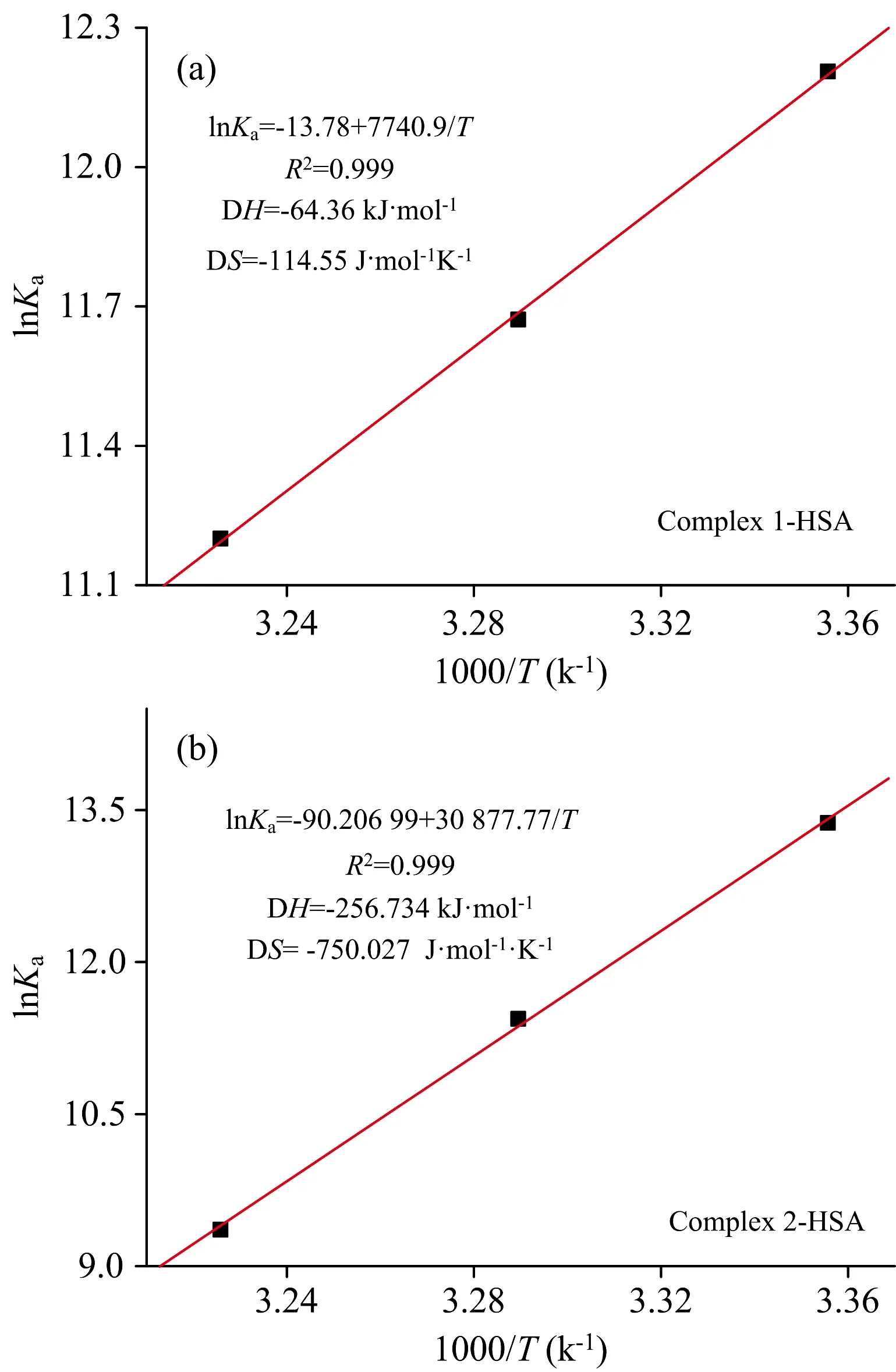
图6 氨基硫脲芳基钌配合物1(a), 配合物2(b)与HSA相互作用的van’t Hoff关系
2.4 氨基硫脲基钌配合物与HSA作用的构象研究

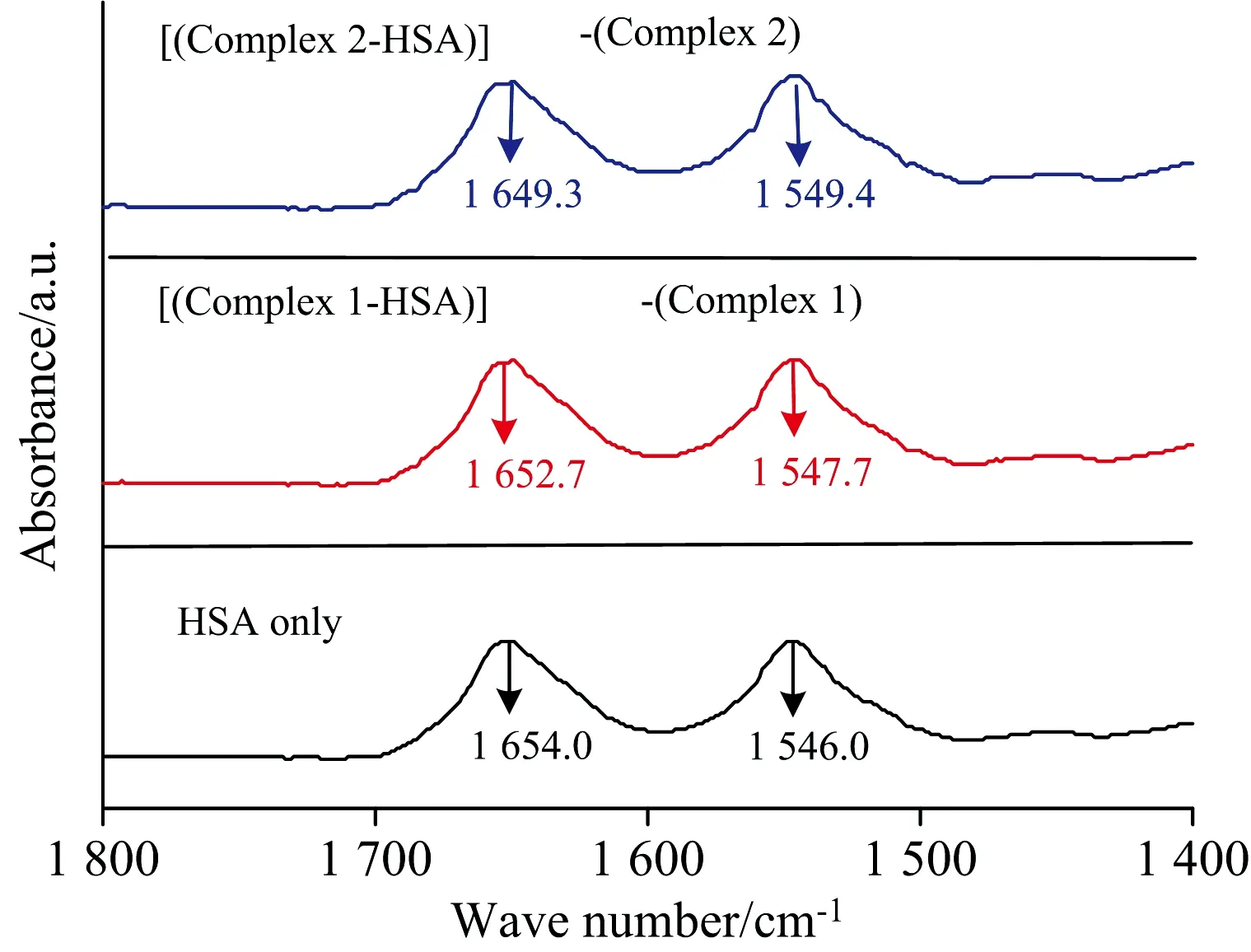
图7 两种氨基硫脲芳基钌配合物与HSA的红外吸收光谱图
圆二色光谱也是验证HSA与其他小分子配体相互作用后结构是否发生变化的一种有效方法。 如图8(a, b, c)所示, HSA在208和222 nm附近有两个α-螺旋结构的特征吸收峰[19]。 待加入两种配合物后, HSA在上述位置的特征吸收峰峰值均明显下降, 这表明HSA的结构发生变化, 尤其是α-螺旋结构含量变化最大[15]。 为了量化HSA的二级结构含量, 结合CDNN软件进行计算, 其结果列于表3。 随着配合物1浓度的增加, HSA的α-螺旋结构含量从63.5%降到55.4%, 但β-折叠、 β-转角及无规则卷曲量却均不同程度增加; 而加入配合物2时, 除β-折叠等量均不同程度增加外, HSA的α-螺旋结构含量从63.5%降到46.4%, 结果表明这两种配合物的加入均改变了HSA原有的二级结构, 使其α-螺旋结构向β-折叠、 β-转角、 无规则卷曲转变, 从而使HSA的二级结构稳定性降低。 相比于配合物1, 配合物2对HSA的二级结构影响更大。
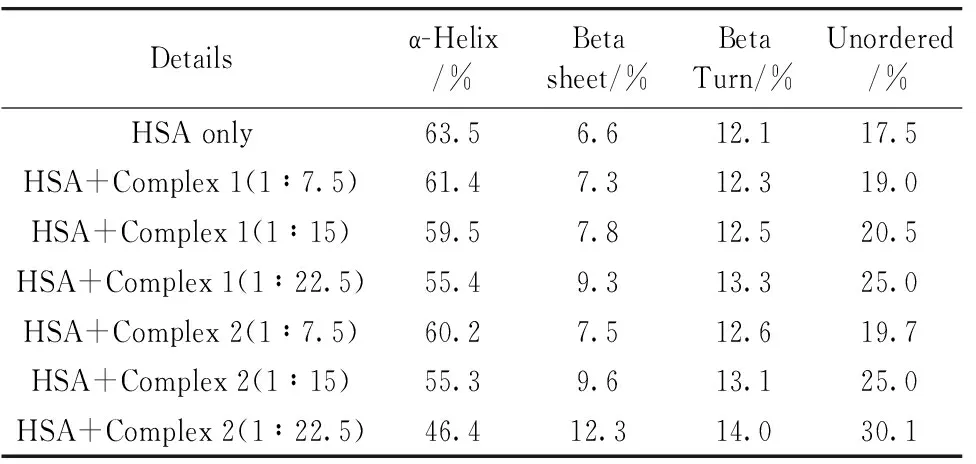
表3 两种氨基硫脲芳基钌配合物与HSA相互作用的圆二色光谱数据

图8 两种氨基硫脲芳基钌配合物与HSA相互作用的圆二色光谱
3 结 论
通过荧光光谱、 荧光寿命、 红外吸收光谱、 圆二色光谱等方法系统研究了两种氨基硫脲芳基钌(Ⅱ)配合物与HSA的相互作用机制。 结果表明, 两种配合物通过浓度依赖的静态猝灭机理有效地猝灭了HSA的内源荧光; 热力学参数表明, 两种配合物主要通过范德华相互作用力和氢键自发地与HSA相互作用, 采用红外吸收光谱和圆二色光谱研究了这两种配合物对HSA的构象均有影响。 配合物2对HSA的荧光猝灭效率更强, 对二级结构变化的影响更大。 研究结论有助于更好地理解芳基钌配合物抗肿瘤药物与HSA之间的相互作用, 对以氨基硫脲为配体的抗肿瘤芳基钌配合物在生物医学和治疗领域的应用发展具有重要意义。
