启膈散增加食管癌对顺铂的敏感性与LncRNA MEG3的关系研究*
2023-09-11王静王美乐尹素改冯书营陈玉龙江华李亚兰李姝璇
王静,王美乐,尹素改,冯书营,陈玉龙,江华,李亚兰,李姝璇
河南中医药大学,河南 郑州 450046
食管癌(esophageal cancer,EC)具有极强的地域性,在2020年恶性肿瘤中发病率排名第七位,总体死亡率排名第六位,中国属于高发病率、高死亡率的国家之一[1-3]。食管癌常见的病理类型主要有鳞癌和腺癌,我国95%以上为鳞癌[4]。食管癌的发病年龄多在40岁以上,多数表现为间断性或进行性吞咽梗阻等特异性症状[5-6]。手术和化疗是常用的治疗手段,但化疗的多药耐药(multi-drug resistance,MDR)已经成为肿瘤切除、转移和复发的关键挑战[7]。
食管癌属于中医“噎膈”范畴,病机包括气郁、痰阻、血瘀、气血津亏。其中,痰气交阻是其发生的主要病机,痰气交阻证是其最常见证候之一。朱丹溪言:“痰之为物,在人身随气机升降,无处不到”,气机不畅,气郁生痰,痰气互阻,久而致瘀是食管癌发病的途径[8]。启膈散具有润燥解郁、化痰降逆之功效,出自清代程国彭的《医学心悟》,“通噎膈,开关之剂,屡效”[9]。启膈散是目前常用于治疗食管癌的经典方剂,在临床治疗中取得了良好效果。研究发现,启膈散可诱导食管癌细胞凋亡并可增加食管癌细胞对顺铂的敏感性,但具体机制仍需深入研究[10-11]。
长链非编码RNA (long non-coding RNA,LncRNA)是目前肿瘤耐药性机制研究的热点。母系表达基因3 (maternally expressed gene 3,MEG3)是第一个被发现具有肿瘤抑制作用的LncRNA。另外,在鼻咽癌的研究中,MEG3充当肿瘤抑制因子,增加人第10号染色体缺失的磷酸酶及张力蛋白同源的基因(phosphates and tensin homologue deleted on chromosome ten gene,PTEN)表达来促进鼻咽癌细胞的自噬和凋亡[12]。但在食管癌中,MEG3的表达是否参与食管癌的发生、发展、预后与转归及启膈散是否通过MEG3干预食管癌细胞增殖并增加食管癌细胞对顺铂的敏感性,目前尚不清楚。
因此,本研究从启膈散对食管癌EC9706细胞增殖和凋亡的影响为切入点,研究启膈散增加顺铂敏感性与LncRNA MEG3的关系及其机制,为开发治疗食管癌的中药提供理论和实验依据,为寻找抗肿瘤药物的作用靶点提供支撑。
1 材料
1.1 细胞人食管癌EC9706细胞株由河南中医药大学分子生物实验中心馈赠。
1.2 药物与试剂顺铂、Annexin V-FITC/PI凋亡检测试剂盒、BCA蛋白浓度测定试剂盒、RIPA裂解液、PMSF蛋白酶抑制剂、5×蛋白上样缓冲液、彩虹245广谱蛋白Marker、ECL Plus超敏化学发光液(北京索莱宝科技有限公司,批号:D8810、CA1020、PC0020、R0010、P0100、P1040、PR1920、PE0010);TRIzol试剂(美国ambion公司,批号:15596);TB Green Premix Ex Taq、Primescript RT Master Mix(日本TaKaRa公司,货号:RR420A、RR036A);SDS-PAGE凝胶快速制备试剂盒(武汉赛维尔生物科技有限公司,批号:G2037-50T);PTEN抗体、GAPDH抗体、HRP 标记山羊抗兔二抗(美国proteintech公司,批号:22034-1-AP,10494-1-AP,SA00001-2)。
1.3 仪器超净工作台(北京世安科林净化技术有限公司,型号:SIX-70);二氧化碳培养箱、PCR仪(美国赛默飞公司,型号:371、Quanti Studio 7 Flex);倒置显微镜(日本Olympus公司,型号:CKX41);酶标仪(美国BIO-TEK公司,型号:Cytation 5);流式细胞仪(美国BD Accuri公司,型号:Accuri C6 Plus);蛋白通用电泳仪(美国BIO-RAD公司,型号:Power Pac Universal 1645070)。
2 方法
2.1 药物制备启膈散药物剂量比例为沙参丹参茯苓川贝母(去心)郁金砂仁壳杵头糠=6623111,采取乙酸乙酯法提取,浓缩干燥,冷藏备用。
2.2 MTT法检测细胞活性取对数生长期的EC9706细胞,以1×104个/孔接种于96孔板中,置于细胞培养箱中培养24 h,吸走旧培养液,加入不同剂量的启膈散及相应浓度的启膈散联合2 mg·L-1顺铂,每组设5个复孔。加药48 h后吸出旧液,按 91 比例用RPMI 1640培养基稀释MTT储存液,MTT终浓度为0.5 g·L-1,继续培养4 h,加入 DMSO 150 μL,酶标仪570 nm下检测吸光度(absorbance,A)值,计算各组抑制率E值,并用金氏Q值公式法评价联合用药是否具有协同作用,选取适当浓度进行后续实验。
E=(1-A药物组/A对照组)×100%
Q=Ea+b/(Ea+Eb-Ea×Eb)
Q>1.15表示联合用药具有协同作用,Q为0.85~1.15表示联合用药具有相加作用,Q<0.85表示联合用药具有拮抗作用(Ea+b:启膈散与顺铂联合用药组的抑制率;Ea:启膈散组的抑制率;Eb:顺铂组的抑制率)。
2.2 流式细胞仪检测细胞凋亡率取对数生长期的EC9706细胞,以3×105个/孔接种于6孔板中,培养24 h,加药培养48 h,收集培养液,加入不含EDTA的胰酶消化并收集细胞,用预冷磷酸盐缓冲液洗涤细胞2次,加入缓冲液500 μL重悬细胞,每管加入Annexin V-FITC 5 μL和PI 5 μL,室温避光孵育5 min,流式细胞仪检测细胞凋亡。
2.3 蛋白免疫印迹实验提取细胞总蛋白,在冰上裂解提取各组总蛋白。BCA法测定样本蛋白浓度。加入5×蛋白上样缓冲液按比例混合样品,100 ℃加热10 min变性,进行聚丙烯酰胺(SDS-PAGE)凝胶电泳,转膜,采用Tris碱缓冲液配置的5%牛奶封闭2 h,添加一抗PTEN(稀释比例12 000)、GAPDH(稀释比例12 500),4 ℃冰箱孵育过夜,次日用TBST洗膜3次,每次10 min。添加二抗(稀释比例15 000)孵育1 h,TBST洗膜3次,每次10 min;加入ECL超敏发光液,凝胶成像仪中曝光各组蛋白条带,用Image J统计条带灰度值。
2.4 实时荧光定量聚合酶链式反应(real-time PCR,RT-PCR)加药48 h后,TRIzol法提取各组细胞样品总RNA,按照TaKaRa逆转录试剂盒说明书合成cDNA,逆转录条件为37 ℃反应15 min,85 ℃ 反应5 s。配制反转录体系总体积20 μL进行扩增反应,PCR反应条件:95 ℃预变性30 s,95 ℃变性5 s,55 ℃退火45 s,共40个循环。结果以GAPDH为内参,引物序列见表1,利用2-ΔΔCt公式计算各个样品中目的基因相对表达量。

表1 基因引物序列
2.5 细胞划痕实验、Transwell实验检测细胞迁移划痕实验:细胞常规培养,将对数生长期EC9706细胞接种在6孔细胞培养板,置于37 ℃、5%CO2细胞培养箱中,待细胞融合度达到90%左右,用 200 μL 的枪头沿直尺画水平线的垂直线,加入PBS缓冲液去除划掉的细胞,轻轻清洗3次,以免冲散单层贴壁细胞。按上述实验分组加药处理细胞,均使用无血清培养基培养,从换为含对应药物的无血清培养基起开始计算,分别于0 h、48 h拍照观察,每次拍照观察前,应再次清洗细胞,去除凋亡的细胞。以Image J软件统计分析划痕面积,计算细胞迁移率。Transwell实验:实验前将细胞饥饿培养24 h,在各组Transwell小室的上室中加入浓度为2×105mL-1细胞悬液0.3 mL,下室加入0.7 mL含10% FBS的完全培养基或含对应药物的完全培养基,培养48 h后甲醛固定,结晶紫染色后PBS洗涤,晾干,显微镜下计迁移细胞数。
细胞迁移率=(初始空白面积-某时间点空白面积)/初始空白面积×100%

3 结果
3.1 药物对食管癌EC9706细胞增殖的影响与对照组比较,当启隔散浓度为12.5 mg·L-1时,可促进EC9706细胞的增殖,但差异不具有统计学意义(P>0.05);启膈散浓度≥50 mg·L-1可显著抑制EC9706细胞的增殖,随着剂量的增大,抑制率逐渐上升(P<0.01),见图1。选取0 mg·L-1、12.5 mg·L-1、25 mg·L-1、50 mg·L-1、100 mg·L-1浓度的启膈散联合2 mg·L-1顺铂作用EC9706细胞48 h后,细胞活力显著降低(P<0.01);与顺铂组比较,50 mg·L-1、100 mg·L-1的启膈散联合顺铂可显著降低细胞的增殖能力,Q值分别为1.15、1.03,具有药物相加作用(P<0.01),见图2。根据实验结果,选取50 mg·L-1的启膈散、2 mg·L-1顺铂、50 mg·L-1的启膈散联合2 mg·L-1顺铂用于后续实验。
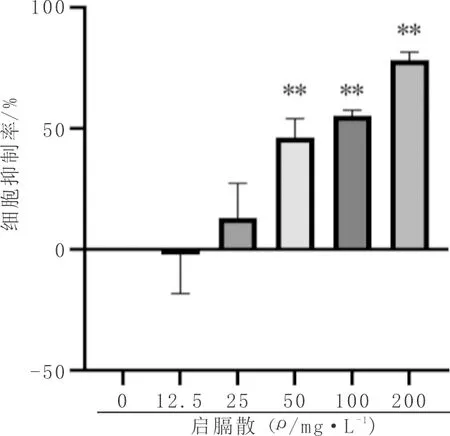
注:与对照组比较,* P<0.05;**P<0.01;与顺铂组比较,# P<0.05,# #P<0.01;图中负值表示促进增殖。
3.2 启膈散和顺铂联合作用诱导EC9706细胞凋亡与对照组比较,启膈散组、启膈散联合顺铂组镜下可看到细胞固缩变圆,凋亡率明显增加(P<0.01);与顺铂组比较,启膈散组和启膈散联合顺铂组的早期凋亡率显著增加,总凋亡率显著增加,具有统计学差异(P<0.01),见图3、图4,表2。
3.3 启膈散和顺铂联合作用可增加食管癌EC9706细胞中PTEN蛋白表达的影响与对照组比较,启膈散组、顺铂组、启膈散联合顺铂组PTEN蛋白表达量均显著升高,差异有统计学意义(P<0.01)。与顺铂组比较,启膈散组、启膈散联合顺铂组PTEN蛋白表达量均显著升高,差异有统计学意义(P<0.01)。见图5。

注:CON:对照组;QGS:启膈散组;DDP:顺铂组;Q+D:启膈散联合顺铂组;与对照组比较,*P<0.05,**P<0.01;与顺铂组比较,#P<0.05,##P<0.01。
3.4 启膈散联合顺铂对食管癌EC9706细胞MEG3mRNA、PTENmRNA表达的影响结果显示,与对照组比较,启膈散组、启膈散联合顺铂组的MEG3mRNA、PTENmRNA表达量显著升高(P<0.01),顺铂组MEG3mRNA表达量增加,但无统计学差异(P>0.05),PTENmRNA表达量增加,具有统计学差异(P<0.05)。与顺铂组比较,启膈散联合顺铂组MEG3mRNA表达量极显著升高(P<0.01),PTENmRNA表达量显著升高(P<0.05)。见图6。

注:CON:对照组;QGS:启膈散组;DDP:顺铂组;Q+D:启膈散联合顺铂组;与对照组比较,*P<0.05,**P<0.01;与顺铂组比较,#P<0.05,##P<0.01。
3.5 启膈散联合顺铂对食管癌EC9706细胞迁移的影响药物作用48 h后,对照组的迁移率增高,划痕面积减少,其余各组划痕面积增大,出现反向迁移现象。与对照组比较,启膈散组、顺铂组和启膈散联合顺铂组细胞迁移率降低(P<0.01);与顺铂组比较,启膈散联合顺铂组迁移率显著降低(P<0.01)。由Transwell迁移实验可知,与对照组比较,启膈散组和启膈散联合顺铂组迁移细胞减少。见图7。
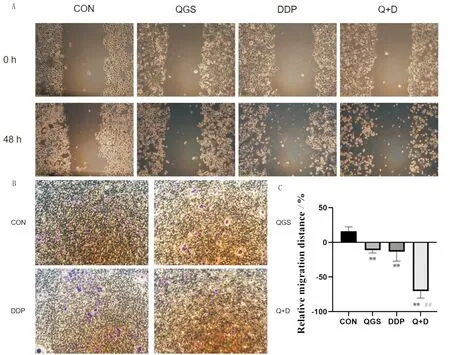
注:CON:对照组;QGS:启膈散组;DDP:顺铂组;Q+D:启膈散联合顺铂组;与对照组比较,*P<0.05,**P<0.01;与顺铂组比较,#P<0.05,##P<0.01。A:细胞划痕实验结果(10×),B:Transwell实验结果(20×),C:细胞划痕统计结果(其中负值表示抑制迁移)。
4 讨论
食管癌是常见的恶性肿瘤之一,手术和化疗是常用的治疗方法,可以取得一定的临床疗效,但其5年生存率仅为15%~20%,MDR是治疗食管癌的主要障碍之一[13]。《诸病源候论》有五噎和五膈记载,气机郁结不畅,气病失运,津凝而为痰,血滞而为瘀,继而痰瘀乃生。食管癌的发病以正气亏虚为主,与痰、瘀、热关系密切,正虚邪实是食管癌的主要病机,临床诊疗中以扶正攻毒为主要治疗原则,司富春研究团队收集研究151篇食管癌相关文章发现:补虚、清热、化痰散结、活血祛瘀类药的使用占65%,主要治疗方剂为启膈散、沙参麦冬汤、通幽汤、补气运脾汤[14]。临床常用方剂启膈散方中沙参养阴润肺,益胃生津;贝母滋阴化痰,砂仁壳性温味辛,行气温中;荷叶蒂平苦和胃,茯苓甘淡渗利健脾为佐,共同促进脾胃运化功能,顾护中焦,使生痰无源;郁金、丹参共行活血祛瘀之效;杵头糠作为引药,可通咽达胃、益气养血健脾,有利于改善病情,提高机体免疫力,减轻吞咽梗塞、疼痛、呕吐等症状,增强消化道功能。大量临床研究资料表明,启膈散在有效抑制食管癌细胞生长及扩散、降低复发转移率的同时,可明显减轻化疗的毒副反应,改善血清中癌胚抗原、鳞状上皮癌相关抗原、卡氏评分,提高患者生活质量,使部分患者处于荷瘤生存状态,提升整体疗效[15-17]。课题组前期研究发现,启膈散可干预食管癌细胞的增殖,因而本文以启膈散为研究对象,探索其内在机制。
LncRNA MEG3是位于人类染色体14q32.3上的印记基因,约1 600个核苷酸片段,是具有肿瘤抑制作用的LncRNA[18-19]。它在许多正常组织高表达,但在一些原发性恶性肿瘤组织如食管癌、胃癌、口腔鳞癌等中低表达甚至不表达,与肿瘤患者的不良预后存在相关性[20-22]。过表达MEG3可增加内质网应激相关蛋白的表达,同时能够抑制细胞生长,诱导EC109细胞凋亡,是ESCC中一种新的诊断和预后生物标志物及治疗靶点,但机制尚不明确[23]。本研究MTT实验、划痕实验及Transwell实验结果显示,启膈散可有效抑制食管癌EC9706细胞的增殖、促进细胞凋亡、改变细胞形态、降低细胞贴壁率、抑制细胞的迁移,且联合顺铂使用达到药物相加作用。qRT-PCR的结果显示,启膈散组及启膈散与顺铂联合用药组可上调LncRNA MEG3的mRNA水平,这表明启膈散可能是通过干预LncRNA MEG3的表达来抑制食管癌细胞的增殖并增加细胞对顺铂的敏感性的,且LncRNA MEG3可能是食管癌防治的重要靶点。
PTEN基因位于10q23.3上,是人第10号染色体的基因,属于抑癌基因,可以抑制肿瘤的生长和转移,并在调节细胞周期和维持基因组稳定性方面发挥作用[24-25]。当肿瘤微环境中的PTEN低表达时,会影响肿瘤相关巨噬细胞(tumor-associated macrophages,TAM)中不同免疫细胞群的数量,诱导M2 TAM的极化并促进肿瘤转移[26]。另有研究表明,MEG3参与调节PTEN水平,在宫颈癌、膀胱癌、胰腺癌的发生发展中发挥重要作用[27-29]。本研究中PTEN的结果显示,启膈散组及启膈散联合顺铂组PTEN蛋白及其mRNA水平均呈上升趋势,可初步推断启膈散可能是通过干预LncRNA MEG3的表达进而上调PTEN,起到抑制食管癌细胞增殖并增加食管癌细胞对顺铂敏感性的作用。
综上所述,启膈散干预EC9706细胞的增殖和迁移,促进凋亡,增加食管癌细胞对顺铂的敏感性,其机制可能与其上调 MEG3进而影响PTEN信号通路有关。课题组下一步准备对LncRNA MEG3进行敲除,观察启膈散是否还具治疗并增加化疗药物顺铂敏感性的作用,进一步探究启膈散的作用机制。
