超滤亲和结合液相色谱-质谱联用和分子对接技术筛选茶叶中α-葡萄糖苷酶抑制肽
2023-09-10昝丽霞王威威张文夷李新生陈小华
昝丽霞 ,王威威,张文夷,李新生,5,6,陈小华,5,6,燕 飞,5,6,付 静,5,6
(1.陕西理工大学,陕西汉中 723001;2.陕西省资源生物重点实验室,陕西汉中 723001;3.陕南秦巴山区生物资源综合开发协同创新中心,陕西汉中 723001;4.陕西理工大学秦巴生物资源与生态环境省部共建国家重点实验室(培育),陕西汉中 723001;5.茶叶种植与加工研究所,陕西汉中 723001;6.陕西省四主体一联合茶产业校企联合研究中心,陕西汉中 723001)
糖尿病(Diabetes Mellitus)是一种复杂的代谢紊乱疾病,其特征是由胰岛素分泌不足或胰岛素作用受损而导致血糖水平较高[1]。截至2021 年,全球成人糖尿病患者人数已达到5.37 亿,其中90%以上属于Ⅱ型糖尿病(T2DM)[2]。在健康人体内,胰岛素帮助细胞从血液中吸收葡萄糖,以维持正常的血糖水平,而T2DM 患者的胰岛素功能障碍阻止细胞对葡萄糖的吸收,导致高血糖症状的发生。
α-葡萄糖苷酶抑制剂和肠上皮细胞钠葡萄糖共转运蛋白(SGLT1)抑制剂均可用于治疗T2DM[1]。葡萄糖苷酶抑制剂通过减缓小肠中碳水化合物的消化而延缓餐后血糖水平上升,对餐后血糖水平难以控制的患者更有效[3]。然而,患者对这类药物有严重的不良反应,如胃肠道气胀、腹泻、肠壁囊肿和低血糖等[4]。因此,开发更有效的生物活性剂作为合成药物的替代品,预防和治疗T2DM 至关重要。
Zhang 等[5]通过通过液相色谱电喷雾串联质谱分析、虚拟筛选和鉴定合成,从山茶籽饼蛋白中制备具有α-葡萄糖苷酶抑制作用的活性肽(LLVLYYEY和LLLLPSYSEF),IC50值分别为 0.33 和 1.11 mmol/L。绿茶,白茶和葡萄茶籽,凤凰丹丛茶以及红茶中提取的肽均可对T2DM 型糖尿病α-葡萄糖苷酶具有抑制潜力[6-8]。经过酶解处理后产生的肽段,如绿茶和乌龙茶在碱性酶、胃蛋白酶和胰蛋白酶的作用下,可以产生具有抗氧化和抗菌活性的肽段[9-10]。茶渣蛋白中也获得了抗菌肽、抗氧化肽、降血脂肽和具有ACE 抑制活性的茶多肽[11-14]。目前生物信息学技术已广泛应用于抗菌肽、抗氧化肽、肽激素、肽药物等领域。然而,关于茶叶蛋白α-葡萄糖苷酶抑制肽的分子对接和活性预测方面的信息仍然有限。α-葡萄糖苷酶抑制肽的信息较少[15-17]。本研究采用响应面法优化茶叶酶解产物制备工艺,结合亲和超滤-液相色谱-质谱技术和生物信息学技术,筛选出具有抑制α-葡萄糖苷酶活性的茶多肽,旨在为治疗糖尿病的肽段开发提供参考。
1 材料与方法
1.1 材料与仪器
茶树鲜叶(平阳特早) 采自陕西省西乡县东裕茶园;α-葡萄糖苷酶(10 万U/mg) 美国Sigma 有限公司;乙腈(色谱纯) 天津科密欧化工有限公司;磷酸氢二钾(分析纯) 天津晶科化工有限公司;磷酸二氢钾(分析纯)、三氟乙酸(分析纯) 天津大茂化工有限公司;碱性蛋白酶(20 万U/g) 河南美罗实业有限公司;对-硝基苯基-α-D-吡喃葡萄糖苷、阿卡波糖 分析纯,南京都莱生物技术有限公司;乙腈(质谱级) 美国费雪化学有限公司;甲酸、碳酸氢铵、二硫苏糖醇、碘乙酰胺 质谱级,美国西格玛奥德里奇有限公司。
FA2104 分析天平 上海恒平科技有限公司;Multifuge-X3R 高速冷冻离心机 美国热电科技有限公司;DK-98-ⅡA 恒温水浴锅 天津泰斯特有限公司;1260 高效液相色谱仪 美国安捷伦有限公司;Ultimate 3000 毛细管高效液相色谱仪、Q Exactive™Hybrid Quadrupole-Orbitrap™ Mass Spectrometer 电喷雾-组合型离子阱Orbitrap 质谱仪 美国赛默飞世尔科技有限公司。
1.2 实验方法
1.2.1 粗茶多肽的制备工艺 称取茶叶粉末,按照40:1(mL/g)的液料比加入蒸馏水,90 ℃提取40 min,过滤,弃去提取液。取茶叶渣烘干后,按照一定液料比加入蒸馏水,用0.1 mol/L NaOH 调节pH 为8.5,加入2%碱性蛋白酶,调节温度酶解一定时间,结束后于沸水浴中灭酶,冷却至室温,用0.1 mol/L HCl将提取液pH 调整为7,8000 r/min 离心15 min,取上清液冷冻干燥,备用。
1.2.2 单因素实验 固定液料比为30:1(mL/g),分别在45、50、55、60、65 ℃提取3 h,考察提取温度对α-葡萄糖苷酶抑制率的影响;固定液料比为30:1(mL/g),提取温度55 ℃,提取时间分别为1.5、2.0、2.5、3、3.5 h 的条件下,考察时间对α-葡萄糖苷酶抑制率的影响;固定提取温度55 ℃,提取时间3 h,考察液料比分别为5:1、10:1、20:1、30:1、40:1(g/mL)的条件下,对α-葡萄糖苷酶抑制率的影响。
1.2.3 响应面试验 在单因素实验基础上,选取提取温度(A)、提取时间(B)和液料比(C)三个因素为自变量,以茶叶酶解产物对α-葡萄糖苷酶的抑制率(αglucosidase inhibition rate,GIR)为响应值,使用Design-Expert 8.0 软件中Box-Behnken 进行三因素三水平响应面设计,因素水平编码表见表1。
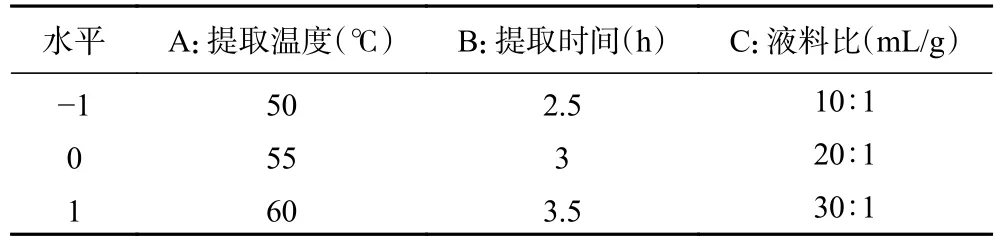
表1 响应面试验因素水平表Table 1 Factors and levels in response surface experiments
1.2.4 粗茶多肽GIR 测定 GIR 的测定参照Wu等[18]的方法,并做适当修改。将响应面法得到的粗茶多肽制备成5 mg/mL 的样品溶液,与α-葡萄糖苷酶(10 U/mL)和10 mmol/L PBS(pH6.8)缓冲液按照1:1:4(v:v:v)混匀,37 ℃水浴5 min;加入与样品溶液等体积的pNPG(1 mmol/L)37 ℃水浴5 min,加入1 mL 0.2 mmol/L Na2CO3溶液中止反应,冷却至室温后,405 nm 测定吸光值。阿卡波糖溶液作为阳性对照,计算公式如下:
其中,A 为样品组的吸光值;A0为空白组的吸光值。
1.2.5 超滤亲和法分离α-葡萄糖苷酶抑制肽组分参考Chen 等[19]的研究,采用超滤亲和法分离α-葡萄糖苷酶抑制肽。取100 μL 2 mg/mL 粗茶多肽溶液与200 μL 10 U/mLα-葡萄糖苷酶,37 ℃搅拌30 min使其混合,30 kDa 超滤离心,10000 r/min 离心10 min,弃去上清液,沉淀加入200 μL 50%乙腈,将结合后的多肽溶解,10000 r/min 离心10 min,取上清,冷冻干燥,得到α-葡萄糖苷酶的抑制肽组分,使用HPLCMS/MS 系统分析。
1.2.6 HPLC-MS/MS 分析条件 采用HPLC-MS/MS对分离的α-葡萄糖苷酶抑制肽进行序列测定。HPLC条件为:色谱柱Acclaim Pe C18(150 μm×150 mm,1.9 μm);柱温25 ℃;A 相(0.1%甲酸),B 相(80%乙腈),流速为0.6 mL/min,进样量10 μL。电喷雾质谱条件:正离子电离模式,扫描范围m/z100~1500 Da,毛细管电压2 kV,ESI+离子源温度320 ℃,碰撞气为氮气。一级质谱参数设置:分辨率70000(FWHM);自动增益控制(AGC)目标值3×106;最大注射时间100 ms;扫描范围为100~1500 m/z。二级质谱参数设置:分辨率75000(FWHM);AGC 目标值1×105;最大注射时间50 ms;选择前20 个离子进行碎裂;碰撞能量值28。质谱原始文件使用Byonic 蛋白质组学分析软件,检索蛋白质数据库,得到氨基酸序列。
1.2.7 分离后肽段GIR 测定 将分离后不同分子量区间的多肽样品冷冻干燥后,用PBS 配制成5 mg/mL的样品溶液,同“1.2.4”项下方法测定GIR。将阿卡波糖、LIGF 和EFGAF 用PBS 分别配制成1、2、3、5 mg/mL 的样品溶液,同“1.2.4”项下方法测定GIR。
1.2.8 生物活性及理化性质预测 使用多种生物信息学工具对肽段进行性质预测和评估。首先采用Peptide Ranker 对肽段的一级结构进行分析,预测其稳定性[20],其次使用ToxinPred(http://crdd.osdd.net/raghava/toxinpred/)、Innovagen(https://www.innovagen.com/service/peptide-property-calculator)和Protparam(https://web.expasy.org/protparam/)等在线工具,预测肽段的潜在毒性、水溶性、等电点和稳定性[19]。最后,使用ADMETLab 2.0(http://admet.scbdd.com)服务平台,对肽段在人体内的吸收、分布、代谢、排泄和毒性等性质进行模拟评价[21]。
1.2.9 分子对接 在PDB 蛋白数据库中选取α-葡萄糖苷酶晶体蛋白(PDB ID: 3AJ7)[2]。使用Autodock软件对蛋白结构进行优化,并定义活性位点。进行多肽与葡萄糖苷酶的分子对接,并根据几何和能量匹配做出评价分析[22]。采用Consensus score 对多肽-酶的结合模型进行打分排序,以筛选出最佳结合模型。最后使用PyMOL 软件对最佳结合模型进行作图,以便更好地观察和分析结合情况。
1.3 数据处理
每组实验设置3 次平行测定,实验结果表示为平均值±标准差。使用IBM SPSS Statistics 进行数显著性分析,采用GraphPad Prism 9.4 进行图表绘制。
2 结果与分析
2.1 单因素实验
考察了茶叶酶解产物制备工艺中提取温度、提取时间和料液比对α-葡萄糖苷酶抑制率的影响,结果如图1 所示。
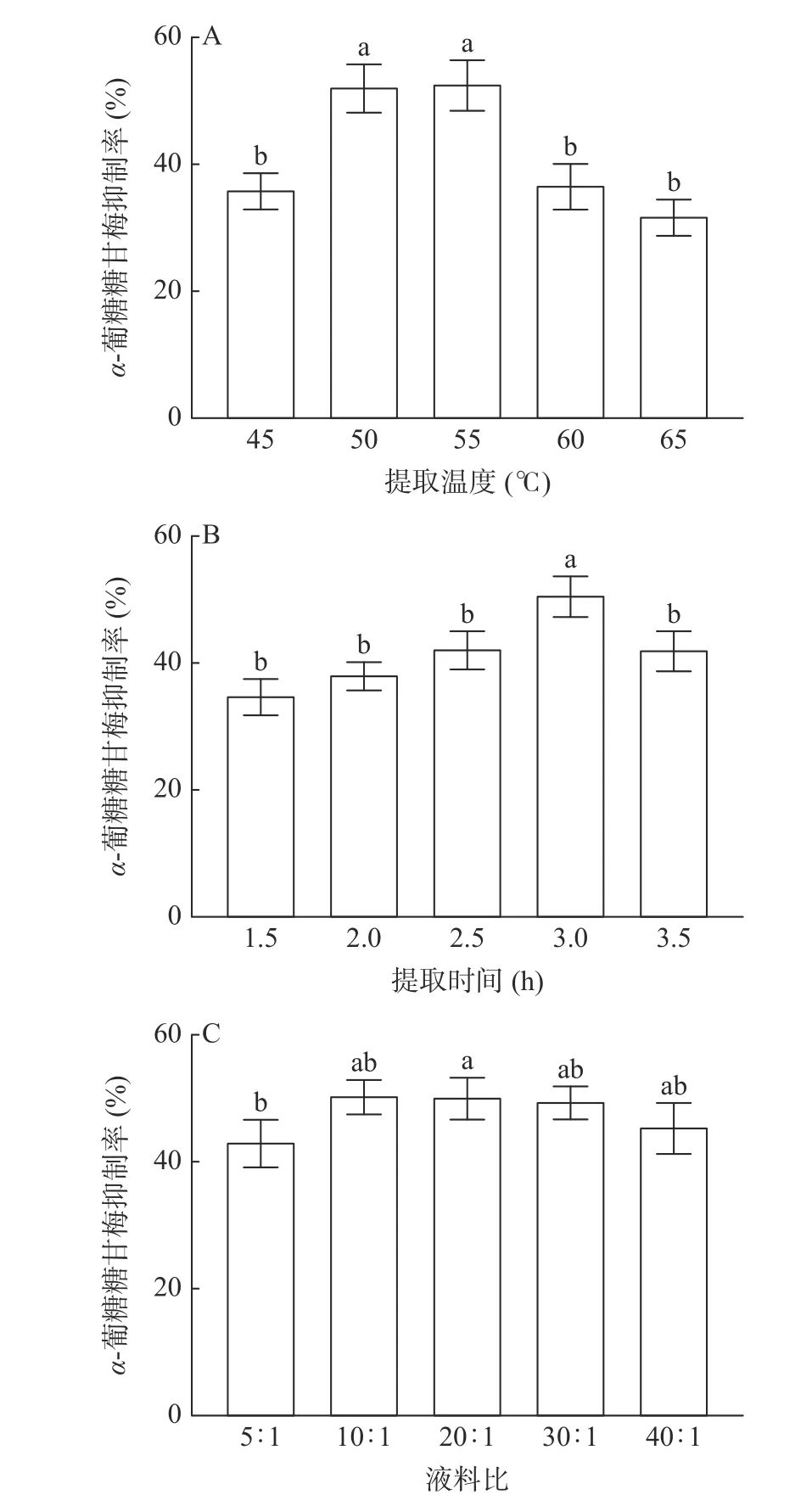
图1 提取温度、提取时间和液料比对α-葡萄糖苷酶抑制率的影响Fig.1 Influence of extraction temperature, extraction time and solvent-to-substrate ratio on the inhibition rate of α-glucosidase
图1A 可知,酶解温度在50 和55 ℃时,产物的α-葡萄糖苷酶抑制率分别为52.13%和52.54%,温度降低或升高会显著降低产物活性,这可能是由于温度过低使反应不完全,温度过高导致蛋白酶变性和失活[23]。因此,酶解温度选择为50、55、60 ℃。
在图1B 中可见,随着时间的延长,酶解产物对α-葡萄糖苷酶的抑制率逐渐升高,在3 h 时达到最高50.51%,超过3 h 后,产物活性开始下降,说明提取时间过长,茶渣底物的浓度会降低,这可能会影响酶促反应,导致反应速率下降,降低产品活性[24],所以时间选择2.5、3 和3.5 h。如图1C 所示,当液料比为20:1,产物对α-葡萄糖苷酶的抑制率最高为50.06%,但在20:1~40:1(g/mL)之间,产物对α-葡萄糖苷酶的抑制率变化并不显著。但当液料比为40:1(g/mL)时,可能因为酶的相对浓度降低导致产物酶解效率和活性较低[24],因此选择10:1,20:1 和30:1(g/mL)进行响应面试验。
2.2 响应面结果分析
通过响应面法对茶叶酶解产物制备工艺进行优化,共进行了17 组实验,结果见2。
从表2 可知,以α-葡萄糖苷酶的抑制率为响应值,回归分析得到二次回归方程:Y=50.83-10.25A-1.48B-0.48C-0.17AB+0.57AC+1.48BC-5.64A2-10.57B2+0.60C2。对方程进行方差分析,结果见表3。

表2 茶叶酶解产物制备工艺的响应面试验结果Table 2 Response surface experimental results for tea peptide preparation process
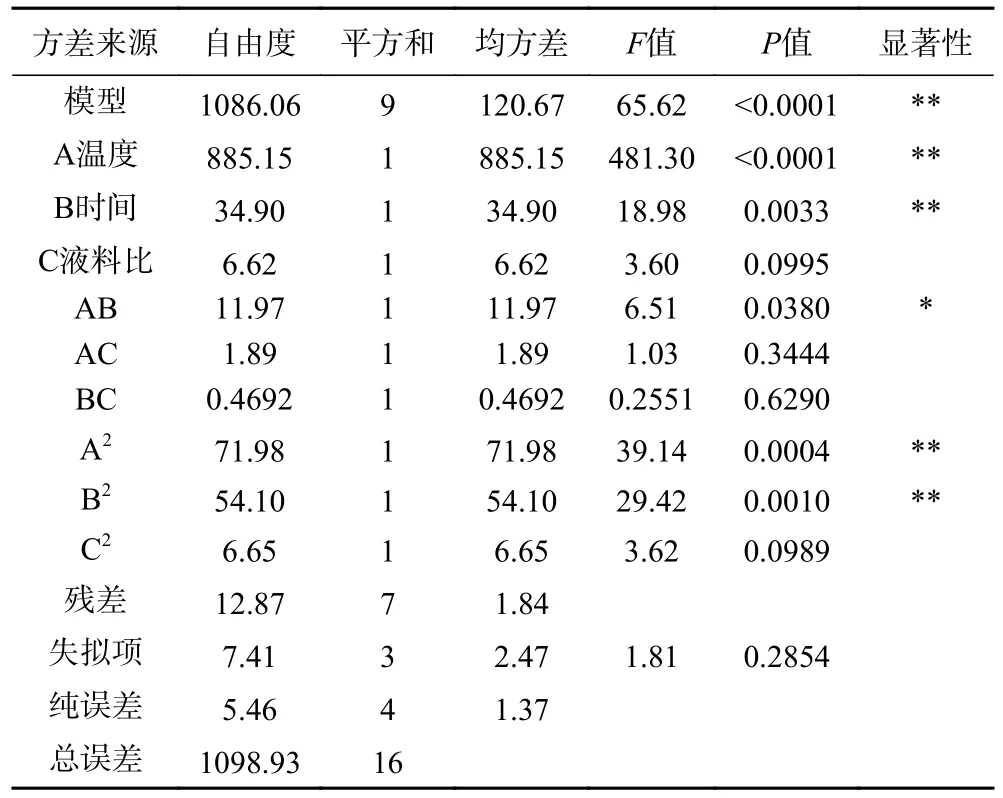
表3 回归模型方差分析Table 3 Analysis of variance (ANOVA) for regression models
由表3 可知,模型P<0.0001,回归模型极其显著;失拟项P=0.9585,不显著,决定系数R2=0.9949,预测值R2=0.9883 与调整后的R2差值小于0.2,说明模型拟合程度良好,能够较准确地预测和分析实际情况。模型的一次项A、B,二次项A2、B2对响应值的影响极其显著(P<0.01);交互项AB 对响应值的影响显著(P<0.05);影响茶多肽提取的因素的作用顺序为A>B>C,即酶解温度>提取时间>液料比。
响应面法预测粗茶叶酶解产物的最佳制备工艺为:酶解温度50 ℃,酶解时间3 h,液料比15:1(mL/g),对α-葡萄糖苷酶抑制率为58.2%。实际实验组中最佳工艺为酶解温度50 ℃,酶解时间3 h,液料比10:1(mL/g),酶解产物对α-葡萄糖苷酶抑制率为57.41%。为检验该模型的可靠性,根据优化所得到最佳条件,开展3 组验证实验,得到对α-葡萄糖苷酶抑制率为56.82%±2.27%,与预测值无显著差异。
2.3 肽段分子量的筛选
经超滤亲和分离-液相色谱-质谱技术分离并鉴定,得到624 条分子量在400~2800 Da 的肽段。图2展示了茶叶酶解产物中肽段分子量和对α-葡萄糖苷酶的抑制活性。这些肽段主要为低聚肽,其中266 条肽段的分子量为800~1200 Da,平均分子量为988 Da,占总肽段的42.63%,其对α-葡萄糖苷酶的抑制活性为67.04%。有157 条400~800 Da 的肽段,平均分子量为670 Da,抑制率显著降低至45.86%(P<0.05)。1600~2000 和2000~2800 Da 肽段,对α-葡萄糖苷酶的抑制活性分别为9.84%和3.04%。因此,400~800 Da 的肽段具有较强的α-葡萄糖苷酶抑制活性。
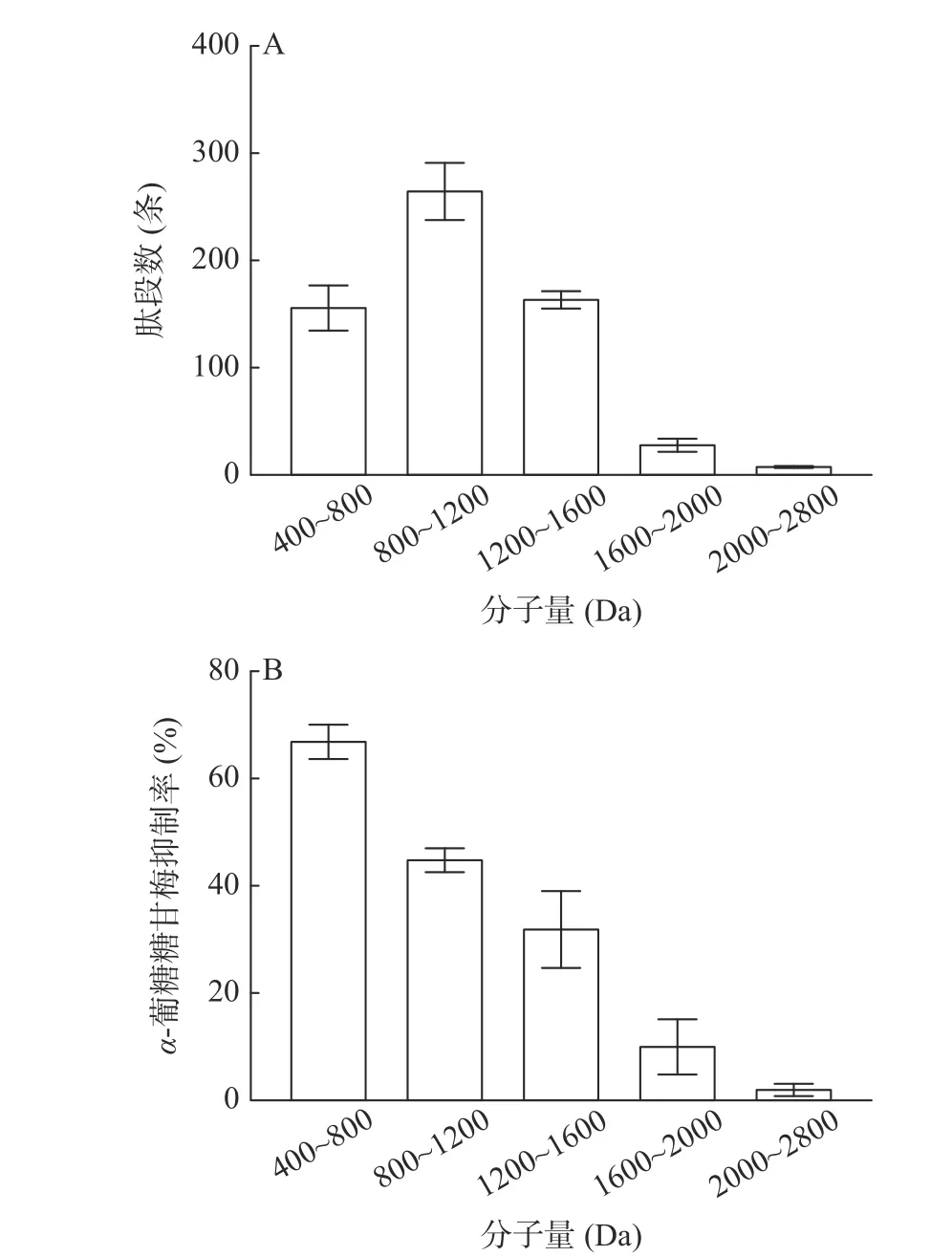
图2 茶叶酶解产物中肽段分子量分布(A)及其对α-葡萄糖苷酶的抑制活性(B)Fig.2 Peptide segments in the tea leaf enzymatic hydrolysis products molecular weight distribution (A) and its inhibition activity on α-glucosidase (B)
2.4 生物活性及理化性质评估
结合分子量小于800 Da 和氨基酸残基小于7个的生物活性肽筛选标准[25],选择具有较强α-葡萄糖苷酶抑制活性的低聚肽(400~800 Da)进行生物信息学虚拟筛选。使用Peptide Ranker 预测,结果显示可能具有生物活性的肽段为35 条。采用Toxinpred和Innovagen 在线工具判断35 条肽段的毒性、溶解性、等电点和稳定性,结果显示所有肽段均无毒,但仅有9 条肽段水溶性较好。根据Expasy 预测,筛选出6 条肽段稳定性指数数小于40 且等电点在0.7~4.9 之间的肽段,该性质肽段有助于多肽酶抑制剂的活性和稳定性[26-27]。
采用ADMET 服务平台评估6 条肽段的人体胃肠道吸收(HIA)和血脑屏障穿透(BBB)等特性[28]。结果表明,6 条肽段的BBB 特性、肠道稳定性都较好,均不是CYP4503A4 酶的抑制剂。这表明这些多肽具有穿过血脑屏障的能力,在通过肠道吸收后,不会被代谢酶CYP4503A4 降解,能够保持稳定性,也不会干扰其他药物的代谢。结合HIA 和30%口服利用度分析,选择表现优秀的两个茶肽LIGF 和EPDAF进行分子对接。
2.5 质谱分析
一级质谱确定肽段LIGF 和EFGAF 的相对分子质量分别为448.28 和569.26。通过UniProt 数据库查询,两个肽段分别来源于山茶(Camellia sinensis)Spatacsin_C (UniProtKB:A0A7J7I5Q8)和Peptidase_S8(UniProtKB:A0A7J7HMN5)的结构域蛋白,分别由基因HYC85_001559 和HYC85_011168 编码。
二级质谱图提供肽段的碎片离子质荷比(m/z),完整肽段在质谱中从肽键位置被打碎为碎片离子,靠近肽段N 端的为b 离子,靠近C 端的为y 离子。图3A通过b 离子(m/z 113.09,227.18,284.20)和y 离子(m/z 166.09,223.10,336.19),确定肽段序列为LIGF(Leu-IIe-Gly-Phe)。图3B 通过b 离子(m/z 130.05,227.12,342.13,413.17)和y 离子(m/z 166.09,237.12),确定肽段序列为EFGAF(Glu-Phe-Gly-Ala-Phe)。
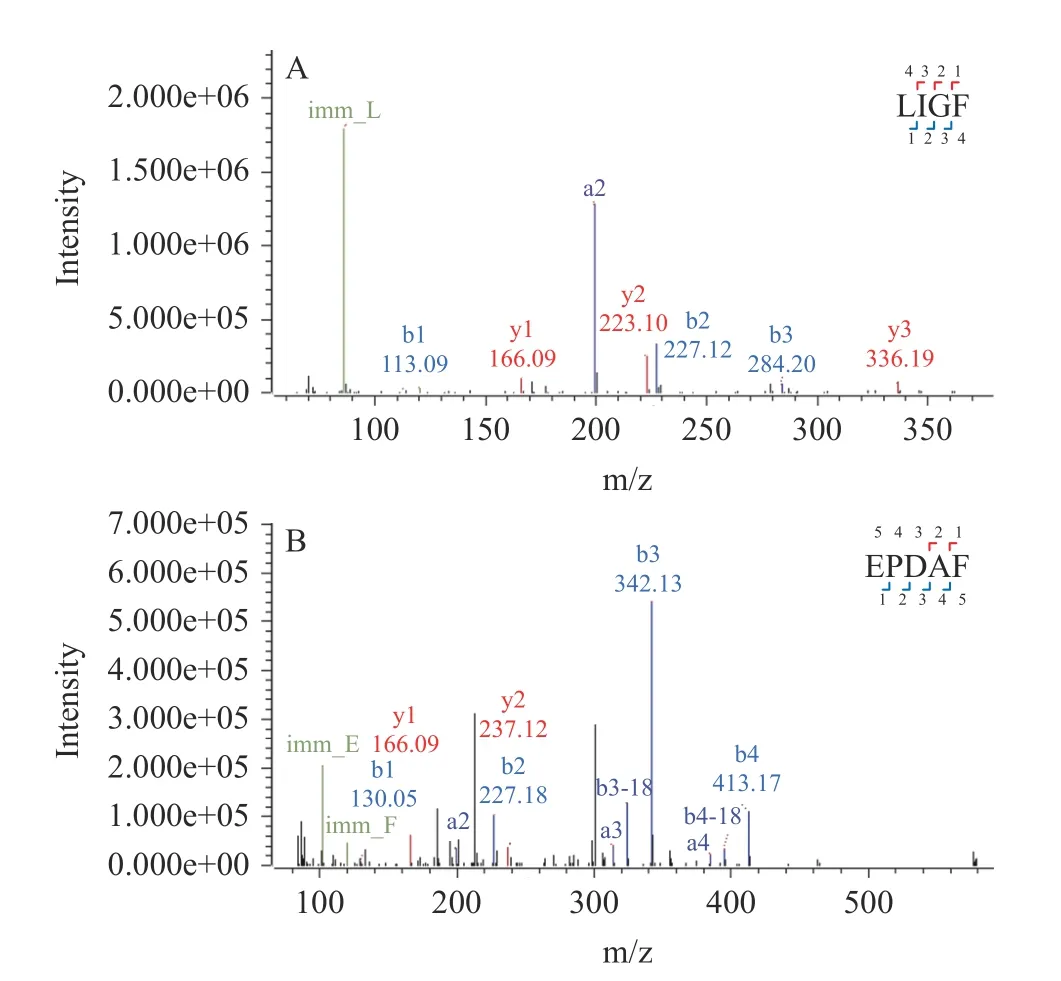
图3 肽段的二级质谱图(A)LIGF(B)EFGAFFig.3 Secondary mass spectrometry (A) LIGF (B) EFGAF
2.6 配体与受体的分子对接
采用分子对接技术构建两种茶肽配体与α-葡萄糖苷酶蛋白受体的结合模型,结果如图4 所示。
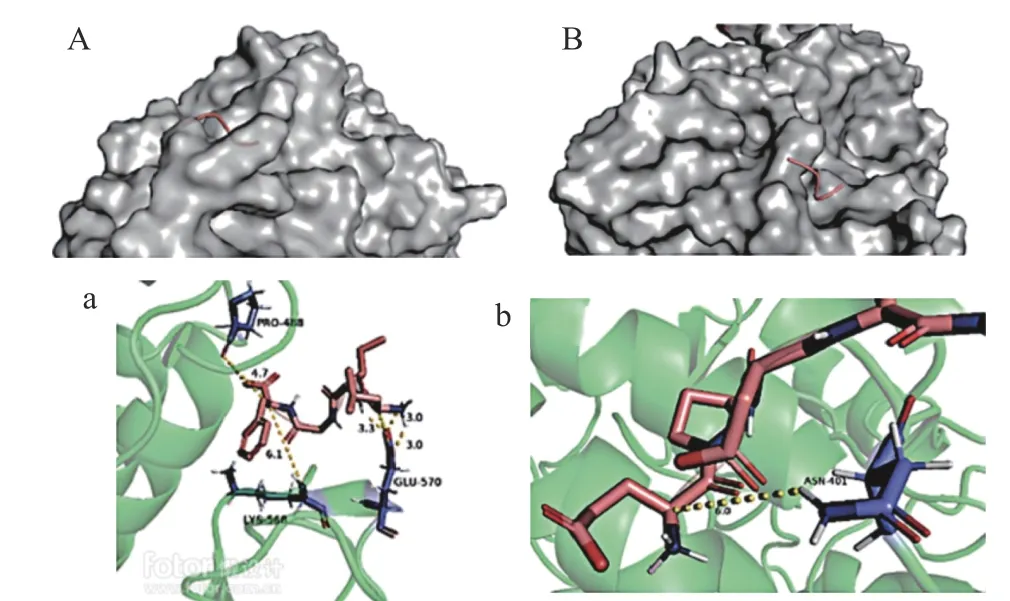
图4 肽段与α-葡萄糖苷酶分子对接模型Fig.4 Molecular docking model of peptides with α-glucosidase
图4A 展示了配体LIGF 与α-葡萄糖苷酶受体对接后的复合物整体外部构象。在图4a 中,结合多肽N 端的苯丙氨酸(F)与α-葡萄糖苷酶上的Pro-488 和Lys-568 残基形成2 个氢键,亮氨酸(L)与Glu-570 残基形成3 个氢键。该对接结果的Dockingscore 为-3.51 kJ。图4B 展示了配体EPDAF 与α-葡萄糖苷酶受体对接后的复合物整体外部构象。在图4b 中,复合物多肽N 端谷氨酸(E)与α-葡萄糖苷酶的Asn-401 残基形成1 个氢键。该对接结果的Dockingscore 为-1.31 kJ。通过对比对接结果可知,LIGF 序列形成的氢键较多,与α-葡萄糖苷酶结合的能力更强,能够形成更加稳定的复合体[25,29]。
2.7 茶肽对α-葡萄糖苷酶的抑制作用
图5 展示了茶肽和阿卡波糖在不同浓度下对α-葡萄糖苷酶的抑制效果。结果显示LIGF 对α-葡萄糖苷酶的最大抑制率为88.13%,比阿卡波糖的最大抑制率高19.59%。阿卡波糖、LIGF 和EFGAF 的IC50值分别为0.98、1.22 和4.10 mg/mL。当浓度高于2 mg/mL 时,LIGF 对α-葡萄糖苷酶的抑制率高于阿卡波糖,这表明在一定浓度范围内,LIGF 具有比阿卡波糖更强的α-葡萄糖苷酶抑制作用。
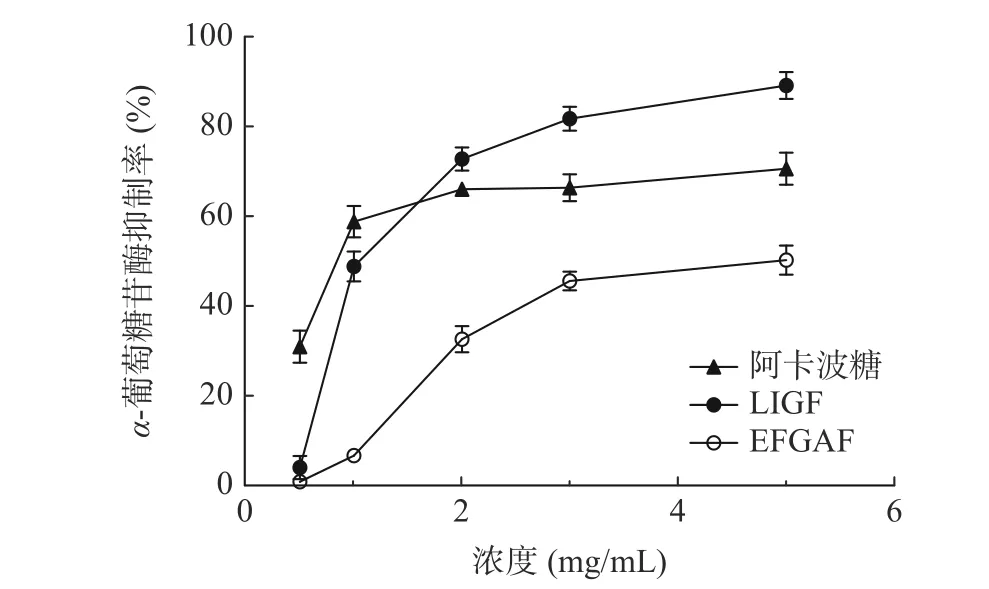
图5 茶肽对α-葡萄糖苷酶的抑制作用Fig.5 Inhibition of α-glucosidase by tea polypeptides
3 结论
本研究采用响应面法确定了茶叶酶解产物的最佳制备工艺。结果表明,碱性蛋白酶解温度50 ℃,酶解时间3 h,液料比10:1(g/mL)条件下,酶解液对α-葡萄糖苷酶抑制率为57.61%。经超滤亲和分离-液相色谱-质谱技术分离并鉴定,得到624 条分子量在400~2800 Da 的肽段。选择具有较强α-葡萄糖苷酶抑制活性的低聚肽(400~800 Da)进行生物信息学虚拟筛选,得到茶肽LIGF 和EPDAF。5 mg/mL LIGF对α-葡萄糖苷酶的最大抑制率为88.13%,比阿卡波糖的最大抑制率高19.59%,IC50值为1.22 mg/mL。分子对接分析显示,LIGF(亮氨酸-异亮氨酸-甘氨酸-苯丙氨酸)与α-葡萄糖苷酶能形成5 个氢键,结合能为-3.51 kJ,具有高的亲和力、稳定性、以及与α-葡萄糖苷酶结合的能力。LIGF 具有成为Ⅱ型糖尿病治疗药物的潜在价值。
