牡丹籽粕中黄酮类化合物的提取工艺优化及膜法分离纯化
2023-09-10陈文涛张迎阳
邹 平,徐 莹,陈文涛,张迎阳,徐 荣
(常州大学石油化工学院,江苏常州 213164)
牡丹籽榨油后的残渣即牡丹籽粕通常被随意堆放、丢弃或用作肥料、动物饲料等,综合利用率极低已被用来研究蛋白和多肽[1],但对其中存在的黄酮类化合物研究很少。有机溶剂萃取法[2]成本较低,操作简单,提取效率较高,且所用有机溶剂安全无毒副作用,适合工业生产中提高生产率降低成本。徐莹等[3]采用75%乙醇-水(v/v)提取橄榄仁红皮的类黄酮化合物,提取物对DPPH·、·OH 以及ABTS+·有较高的清除率。LU 等[4]使用90%的甲醇优化了凤丹牡丹总黄酮的提取工艺,凤丹牡丹总黄酮具有显著的抗氧化、美白和抑菌效果,但甲醇具有毒性,会对人体呼吸道黏膜和视力造成损伤,而且甲醇易燃易挥发,因此高纯度的甲醇具有一定的安全隐患。JI 等[5]采用超声辅助乙醇/磷酸二氢钠混合液萃取银耳中的总黄酮,最大提取量为0.158 mg/g,与单一的乙醇溶液相比,提取量大大降低。这表明选用合适浓度的乙醇-水溶液作为牡丹籽粕总黄酮的萃取液不仅操作简单且提取量高,但在提取过程中一些醇溶性的杂质也会随之被萃取出来,因此将提取液进行分离,期望得到杂质更少,纯度较高的黄酮提取物。
近20 年来迅速发展的膜分离技术是当代新型高效分离技术,与传统的分离技术相比,具有节能、高效、过程易控、环境友好等特点。膜分离方法不需要经过相变或添加辅助剂,仅通过控制膜的孔径提取目标产物,十分节能环保。QUIROS 等[6]采用集成膜工艺,从酿酒厂和橄榄厂废料中分离回收了黄酮多酚。KHEMAKHEM 等[7]通过微滤、超滤、纳滤结合的方法成功从橄榄叶中提取出橄榄苦苷,相较于橄榄叶中含量提高了约10 倍,并发现其具有较好的总抗氧化能力和三价铁离子还原能力。目前,植物中黄酮类物质的提取分离工艺已经相当成熟,但仍存在选择性差,污染环境,工业应用成本高等缺点。因此,本研究尝试将现有的提取工艺与高新技术相结合,建立基于几种分离提取方法的连续分离提取设备,使提取过程更加高效、安全、无污染,使黄酮类化合物成为一种优质的自然资源,得到更广泛的应用。
将牡丹籽粕黄酮(PSMF)应用到医药保健[8]、食品加工[9]、化妆品生产等行业,深入研究其健康价值,不仅可以促进相关研究机构成果转化,还能有效推动当地种植业发展,带动农民增收,具有显著的社会效益,为PSMF 的提取、纯化及高值化综合开发应用提高了参考价值。本论文以牡丹籽粕为研究对象,采用乙醇-水溶液进行萃取,在单因素的基础上通过响应面分析方法得到PSMF 最佳提取工艺,采用不同种类微滤膜进行分离,将分离前后活性物质进行比较,采用LC-MS 技术对最优条件下提取液中黄酮类化合物进行分析,为进一步开展植物黄酮的研究和开发应用打下基础。
1 材料与方法
1.1 材料与仪器
油牡丹籽粕 中国江苏国色天香油用牡丹科技发展有限公司;芦丁、1,2-双(三乙氧基硅基)乙烷阿拉丁试剂有限公司;无水乙醇 上海沃凯生物技术有限公司;磷酸二氢钠、磷酸氢二钠、硫酸亚 上海凌峰化学试剂有限公司;氯化铝·六水、30%过氧化氢、福林酚试剂、去离子水(H2O)、氢氧化钠、硫酸亚 、三羟甲基氨基甲烷(Tris)、水杨酸、邻苯三酚、1,1-二苯基-2-三硝基苯肼(DPPH·)、抗坏血酸(Ascorbic acid,Vitamin C,VC)、邻二氮菲、盐酸、氯化硝基四氮唑兰(NBT)、还原型烟酰胺腺嘌呤二核苷酸(NADH)、5-甲基吩嗪硫酸甲酯(PMS) 国药集团化学试剂有限公司;上述实验试剂均为分析纯。
721N 可见光分光光度计 上海仪电分析仪器有限公司;MDF-U5412 低温冰箱 三洋电机株式会社;SHB-ⅢA 循环水式真空泵 上海聚昆仪器设备有限公司;DF-Ⅱ数显集热式磁力搅拌器 金坛市杰瑞尔电器有限公司;UV-3600 紫外可见近红外分光光度计 日本岛津公司;ATY224 精密电子天平 常州万泰天平仪器有限公司;Tissuelyser-48 高通量组织破碎仪 上海净信实业发展有限公司;Q Exactive质谱仪、Reacti-thermo 氮气吹扫仪 美国Thermo Fisher Scientific 公司;Acquity 高效液相色谱仪 美国Waters 公司;XH-T 漩涡混合器 金坛区白塔新宝仪器厂。
1.2 实验方法
1.2.1 牡丹籽粕中黄酮类化合物的提取工艺 将牡丹籽粕粉碎过80 目筛,选择乙醇-水(v/v)溶液作为溶剂对牡丹籽粕中的天然黄酮类化合物进行浸提,将浸提液离心取上清液,上清液浓缩后在-40 ℃冻干保存,将冻干粉研磨可得到PSMF 冻干粉末。
1.2.2 总黄酮含量测定 总黄酮标准曲线的绘制:取3 mL 芦丁对照品溶液置于10 mm 比色皿,再加入5 mL 1% AlCl3溶液,摇匀后静置10 min,以吸光度值(y)为纵坐标,芦丁含量(x)为横坐标,在415 nm处测定吸光度并绘制标准曲线图。吸光度值与的浓度呈良好的线性关系,回归方程为:y=(0.03±2.01E-4)x+(0.01±0.006),R2=0.999 4。取200 μL 样品溶液加30%乙醇-水(v/v)溶液定容至5 mL 再加入5 mL 1% AlCl3溶液,摇匀后静置10 min,在415 nm 处测定吸光度,可根据公式(1)计算出样品液中总黄酮含量。
式中,A、n 分别代表样品吸光度和稀释倍数。
1.2.3 单因素实验 称取1.0 g PSMF 粉末,固定提取时间30 min、乙醇体积分数70%、提取温度50 ℃,改变料液比(m 牡丹籽粕:V 乙醇)1:5、1:10、1:15、1:25、1:50 g/mL;固定料液比1:15 g/mL、乙醇体积分数70%、提取温度50 ℃,改变提取时间10、20、30、40、50 min;固定料液比1:15 g/mL、提取时间30 min、提取温度50 ℃,改变乙醇体积分数40%、50%、60%、70%、80%;固定料液比1:15 g/mL、提取时间30 min、乙醇体积分数70%,改变提取温度40、50、60、70、80 ℃进行单因素实验,对总黄酮类化合物进行提取并使用紫外分光光度计对PSMF 含量进行计算。
1.2.4 响应面优化总黄酮提取工艺 响应面试验的因素水平取值由单因素实验得出,选择提取时间、提取温度、乙醇体积分数和料液比为影响因子,以黄酮提取量为响应值(见表1),利用Design-Expret 8.0.6软件分别对牡丹籽粕进行曲面响应试验,共29 个试验点。得到二元多项式回归方程,进行重复实验。

表1 响应面试验因素水平设计Table 1 Level of response surface experimental factors
1.2.5 黄酮类化合物的分离纯化
1.2.5.1 微滤膜分离 由于牡丹黄酮提取物中所含成分较多,本研究采用双层滤纸对粗提液进行预处理,以尽量除去固体悬浮物等物质,延长微滤膜的使用寿命,减轻膜的污染。微滤选用微孔膜,平均孔径0.02 μm,能够截留直径0.05~10 μm 的微粒或分子量大于1000 Da 的物质。根据滤膜材质,将聚偏二氟乙烯(PVDF)、聚醚砜(PES)、聚四氟乙烯(PTFE)、聚丙烯(PP)、混合纤维素(MCE)、聚丙烯腈(PAN)、水系醋酸纤维(CA)和聚酰胺(PA)微滤膜分为水系微滤膜、有机系微滤膜和混合系微滤膜三类。水系滤膜系列包括:CA[10](用于乳清和果汁的分离时)、MCE、PES[11](具有良好的分子稳定性、优异的机械性能和成膜性能,去除天然存在的有害有机物)等。常用有机系微孔膜:PTFE[12](已用于膜蒸馏、油水分离和气固分离等多种分离工艺,是目前最常见的膜分离材料)、PVDF(具有出色的化学、热和机械稳定性[13],有利于在不同分离条件下进行有机物的纯化)。混合滤膜过滤:PA[14](具有优异的分离性能,耐高温,聚酰胺树脂是一种从植物中分离黄酮的有效吸附剂)、改性的聚偏氟乙烯、改性的聚四氟乙烯膜等。因此选用PVDF、PES、PTFE、PP、MCE、PAN、CA 和PA 这8 种材料微滤膜对处理液进行分离。
根据8 种微滤膜通量、水接触角以及PSMF 透过液冻干粉的扫描电镜、热重等表征确定分离效果最佳的微滤膜。在操作压力为0.8 MPa,操作温度为25 ℃,流量为9.99 mL/min 的条件下,对膜进行预压30 min 后测定膜通量,根据公式(2)计算膜通量。
式中,J 代表膜通量(kg/(m2·h));W 代表过膜液质量(kg);T 代表取样时间(h);A 代表膜的有效面积(m2)。
1.2.5.2 纳滤膜分离 纳滤分离膜为实验室自制,选择PA 膜为支撑体,采用1,2-二(三乙氧基甲硅烷基)乙烷(BTESE)作为硅源前驱体,正丙醇为溶剂,以盐酸为催化剂,制备了有机硅聚合溶胶。通过超声喷涂法将有机硅溶胶涂覆在PA 撑体上制备BTESE/PA复合膜,对PSMF 溶液进行纳滤膜分离。
1.2.6 微滤膜、溶胶和纳滤复合膜的结构表征
1.2.6.1 扫描电镜分析 分离膜在观察前样品进行喷金处理,采用德国-蔡司SUPRA55 场发射扫描电镜(SEM)观察BTESE 有机硅复合膜的表面和断面形貌。
1.2.6.2 热重分析仪分析 采用热重分析仪(NETZSCH,209F3)对PSMF 溶液、PA 透过液和BTESE/PA 复合纳滤膜透过液的热稳定性进行表征,升温速率为10 ℃·min-1,温度范围为50~800 ℃,在N2氛围下操作。
1.2.6.3 液-质联用组分分析 基于液-质联用(LCMS)非靶向的方式进行检测[15],重复3 次,所得到的数据供生物信息学分析,最终得出代谢物。采用Thermo 超高效液相系统(Vanquish,USA),根据化合物的性质,采用Hyper ODS2 C18 填料,进样量10 μL,流速0.9 mL/min,柱温40 ℃,流动相A 为85%甲酸-水(v/v)溶液,流动相B 为去离子水溶液。质谱采用的是美国Thermo 公司的Qexactive 高分辨质谱检测系统。
1.2.7 黄酮类化合物抗氧化能力测定
1.2.7.1 DPPH·清除能力测定 DPPH·清除能力测定实验参照文献[16],稍作改进。样品为2 mL PSMF 溶液(50、100、150、200、250 μg/mL)和2 mL 0.1 mmol/L DPPH·溶液(95%乙醇溶解)。空白为95%乙醇2 mL+0.1 mmol/L DPPH· 2 mL。室温下避光反应30 min,在波长为517 nm 处测定吸光度。DPPH·清除率根据式(3)计算。
式中,A样、A0分别代表样品和空白的吸光度。
1.2.7.2 ·OH 清除能力测定 ·OH 清除能力测定实验方法参照文献[17],稍作改进。混合液由4 mL 1,10-邻菲咯啉(5 mmol/L)和4 mL FeSO4(5 mmol/L)组成,然后依次加入3 mL 磷酸盐缓冲液(16 mL 0.2 mol/mL 磷酸二氢钠+84 mL 0.2 mol/mL 磷酸氢二钠配制,pH7.4),3 mL H2O2(0.01%)和4 mL PSMF样品液,摇匀后静置1 h,在536 nm 处测量吸光度。对照组用蒸馏水代替PSMF 溶液,其他试剂与样品相同。空白组用蒸馏水代替过氧化氢,其他试剂与样品相同。根据式(4)计算·OH 清除率。
式中,A样、A损和A0分别代表样品、对照和空白的吸光度。
1.2.7.3 O2-·清除能力测定 按照文献[18]修改如下,取1.5 mL 样品液,再分别按顺序加入0.5 mL 0.30 mmol/L NBT (pH8.0 Tris-HCl 配制)、0.5 mL 0.468 mmol/L NADH (pH8.0 Tris-HCl 配制)和0.5 mL 0.060 mmol/L PMS (pH8.0 Tris-HCl 配制),混合均匀后在25 ℃水浴5 min。测定其波长在560 nm 处的吸光度,O2-·清除率计算方程式为:
式中,A样和A0分别代表样品和空白的吸光度。
1.2.7.4 还原力测定 按照文献[19],取1.5 mL 样品液,再分别按顺序加入1 mL 0.20 mol/L 磷酸盐缓冲液(pH8.0 Tris-HCl 配制)、1 mL 1% 氰化钾1 mL,混合均匀后在50 ℃水浴20 min,快速冷却后加10%三氯乙酸(TCA),3000 r/min 离心后取上清液1.5 mL,加入1.5 mL 蒸馏水和0.4 mL 0.1%氯化铁溶液,反应10 min。测定700 nm 处的吸光度, 还原力强弱反应在吸光值上。
1.2.7.5 半抑制浓度计算 按照公式(6)计算IC50值:
式中,Xm代表样品最大浓度的对数;I 代表样品最大浓度与样品相邻浓度之比的对数;P、Pm和Pn分别代表样品浓度之和、样品最大浓度和样品最小浓度(μg/mL)。
1.3 数据处理
采用Origin 9.0 对提取实验和单因素实验数据进行处理;利用Design-Expert 8.0.6 对响应面优化测试数据进行分析。
2 结果与分析
2.1 单因素实验结果
PSMF 提取量的提取受到料液比、提取时间、乙醇体积分数以及提取温度的影响,各因素对其影响关系通过单因素实验表明。按照1.2.1 中条件进行实验,得到结果如图1 所示。

图1 料液比、提取时间、乙醇体积分数和提取温度对PSMF 提取量的影响Fig.1 Effects of solid-liquid ratio, extraction time, ethanol volume fraction and extraction temperature on the extraction amount of PSMF
如图1A 所示,不同小写字母表示PSMF 的提取量在不同料液比时的差异显著(P<0.05),提取量随着浸提溶剂量的增加而减少。由于PSMF 具有易溶于乙醇的性质,所以在料液比较小的时候,溶液中的黄酮类化合物很快溶出达到饱和[20]。考虑到随着浸提溶剂体积的增加,也会增大浓缩工艺的难度,因此浸提溶剂量不宜过大,采用料液比为1:15 g/mL 最为合适。
如图1B 所示,不同小写字母表示PSMF 的提取量在不同提取时间时的差异显著(P<0.05),提取时间在30 min 时,提取量达到峰值(234.84±1.17)μg/mL,超过30 min 有所下降,可能是由于时间的延长,黄酮类化合物中酚羟基结构遭到破坏分解为杂质,导致提取量下降。
如图1C 所示,不同小写字母表示PSMF 的提取量在不同乙醇体积分数时的差异显著(P<0.05),黄酮类物质为典型的有机化合物,易溶于有机试剂[21],因而提高乙醇体积分数,总黄酮的提取量也会随之升高,但过高的乙醇体积分数导致大量有机杂质被溶出并挤占黄酮分子的溶出空间,从而导致活性有所下降。最终萃取剂选择为70%乙醇-水(v/v)溶液。
如图1D 所示,不同小写字母表示PSMF 的提取量在不同提取温度时的差异显著(P<0.05)。由于黄酮类化合物中含有酚羟基结构,适当的温度可以激活羟基自由基活性,但过高的温度会使其氧化分解,50 ℃后黄酮类化学物的结构遭到破坏,导致提取量降低。最终提取温度选择50 ℃。
由单因素实验结果可知PSMF 提取的最佳条件为料液比1:15 g/mL,提取温度50 ℃,乙醇体积分数70%,提取时间30 min,PSMF 提取量最高为(234.84±1.17)μg/mL。
2.2 响应面试验结果
利用 Design-Expert 软件对回归模型进行方差和显著性分析,结果如表2、表3 所示。
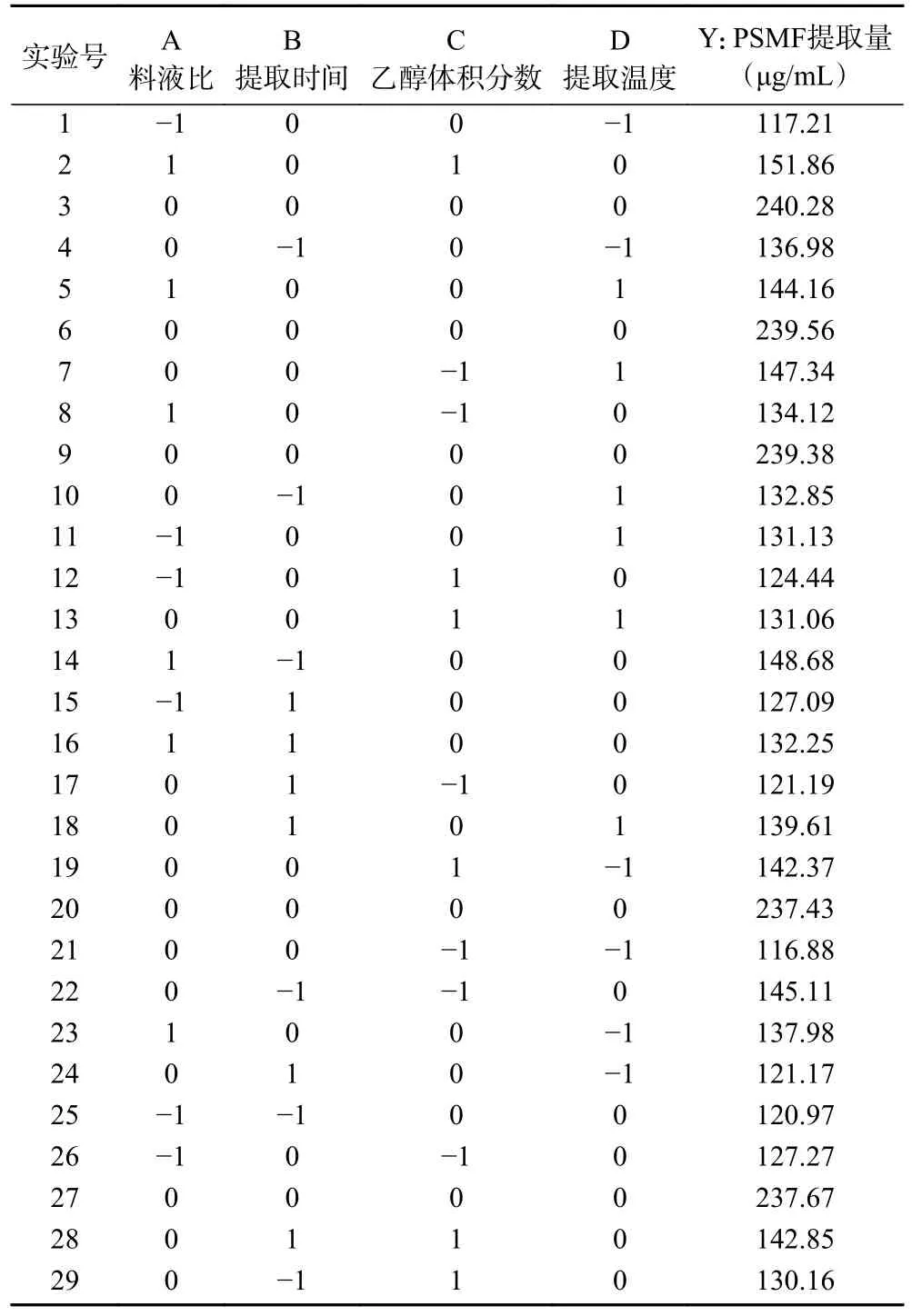
表2 响应面试验设计及结果Table 2 Response surface experimental design and results

表3 回归模型的方差分析及显著性结果Table 3 Analysis of variance and significance results of the regression model
利用 Design-Expert 软件进行多元次拟合分析,得出PSMF 提取量与料液比、提取时间、乙醇体积分数以及提取温度为变量的相关回归方程为:
由表3 可知,模型的P<0.0001,表明该模型具有极显著性,失拟项P值为0.5600,因而该模型拟合程度较好,实验误差小,可用此模型对PSMF 进行预测和分析。在这种情况下,A、B、C、D、AB、AC、AD、BC、BD、CD、A2、B2、D2对响应值具有极显著影响(P<0.01),C2对响应值具有显著性影响(P<0.05)。PSMF 与料液比、提取时间、提取温度和乙醇体积分数的等高图和3D 响应面见图2。
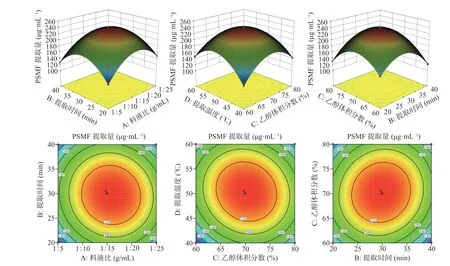
图2 PSMF 的3D 响应面图Fig.2 3D Response surface of PSMF
将所得结果利用 Design-Expert 软件进行响应面预最优点预测,得到料液比1:15 g/mL,提取温度50 ℃,乙醇体积分数70%,提取时间30 min,预测PSMF 提取量(240.28±2.25)μg/mL。
2.3 微滤膜对PSMF 的分离纯化效果
2.3.1 8 种材料微滤膜膜通量分析 膜通量指单位时间内通过单位膜面积上的流体量,对于同一种流体来讲,膜通量越大,溶液透过率就越高,分离的效率越快。8 种不同材料的微滤膜膜通量见图3。

图3 8 种微滤膜的膜通量结果Fig.3 Membrane flux histogram of 8 kinds of microfiltration membranes
如图3 所示,不同小写字母表示膜通量在不同材料微滤膜时的差异显著(P<0.05),可以看出在同样的分离条件下PA 膜的膜通量最高,PP 膜的膜通量最低,膜通量的高低由外加推动力和膜的阻力共同决定,其中膜本身的性质起决定性作用,天然致密的PA 结构表现出优异的离子截留性能,具有选择性水渗透和盐截留的特性[22]。因此推断PA 膜较其他材料而言,对PSMF 溶液有较好的分离效果。
2.3.2 8 种材料微滤膜表面表征分析 与光滑的支撑体相比,在相对粗糙的支撑体表面制备出高质量的BTESE 有机硅涂层无疑是困难的[23]。由图4 表明,PA 表面更光滑且过膜后的PSMF 溶液冻干粉颗粒更均匀,本实验优先考虑PA 作为制备复合聚酰胺纳滤膜的支撑体。

图4 8 种微滤膜表面SEM 图Fig.4 SEM images of the surface of 8 kinds of microfiltration membranes
2.3.3 8 种材料微滤膜分离效果分析 8 种微滤膜对PSMF 的分离效果:PA>PAN>CA>MCE>PVDF>PES>PTFE>PP。由图5(a)为PSMF 原料液-质图,原料液中含有12 种黄酮类化合物。图5(b)~图5(e)分离程度较弱,大部分化合物未被分离。图5(f)~图5(i)分离程度有所提高,其中PA 膜分离效果最好,分离出5 个组分,分别为桑色素、山奈酚、野漆树苷、羟基芫花素和槲皮素。PA 薄膜的这种强的结合亲和力源于酰胺基团与目标化合物分子的供质子基团之间的氢键相互作用[24]。采用场发射扫描电镜观察微滤膜过膜后PSMF 冻干粉的形貌,与其他冻干颗粒相比,PA 冻干粉颗粒更均匀。由膜通量、扫描电镜和液相出峰共同确定了选用PA 膜分离PSMF,可以达到较好的分离效果。
其中桑色素含量最高(Morin)含量最多,其分子式为C15H10O7(表4、图6),桑色素具有许多药理功能,包括抗氧化剂、抗癌剂、抗炎抗菌药物等。ZHANG 等[25]通过对细胞抑制、周期分析、细胞凋亡、mRNA 表达和通过活性氧产生的抗氧化机制研究,验证了桑色素在诱导癌细胞凋亡中起重要作用。JARINYAPORN等[26]发现桑色素可以抑制高脂饮食诱导的肥胖小鼠的脂肪的生成。

表4 PSMF 成分组成分析结果Table 4 Composition of PSMF
2.3.4 BTESE/PA 复合膜表征以及分离效果分析PA 薄膜具有良好的化学稳定性且耐溶剂性强,且对于PSMF 有较好的分离效果,将PA 膜过膜液进行纳滤分离,纳滤膜为实验室自制的BTESE/PA 复合膜,膜表面形貌如图7(右)所示。

图7 PA 膜表面(左)、BTESE/PA 复合膜表面(右)SEM 照片Fig.7 SEM diagram of PA membrane surface (left) and BTESE/PA composite membrane surface (right)
由图7 可知,膜表面小部分针孔被有机硅胶层修饰,膜整体连续、平整无明显缺陷。同时由图7(右)可见,BTESE/PA 复合膜的结构清晰。经过复合膜分离后的PSMF 溶液的液-图以及组分如图8 所示。由图8 可见,BTESE/PA 复合膜过滤后PSMF分离出三个组分。可能是BTESE 纳米粒子增加了PA膜的表面厚度和亲水性,BTESE 纳米粒子改变了PA膜的表面,使其结构更加紧密,截留更小的分子[27]。随着植物黄酮的功效在欧美市场被认可,黄酮类化合物的应用领域越来越广,但由于黄酮类化合物具有水溶性低的天然特性,限制了PSMF 在功能性饮料、化妆、普通食品等领域的应用。通过PA 和BTESE/PA 膜过滤后的溶液,有效的解决了这个问题。溶解度由55.22%提升至90.31%,过滤后的PSMF 水溶性明显提高。过膜后热稳定性好,食品热加工不会破坏其生物活性,同时还保留着部分抗氧化活性,方便储存。PSMF 作为一种天然的食品添加剂,其开发利用价值应给予重视,BTESE/PA 有机纳滤膜在黄酮分离中的应用应当给予肯定。
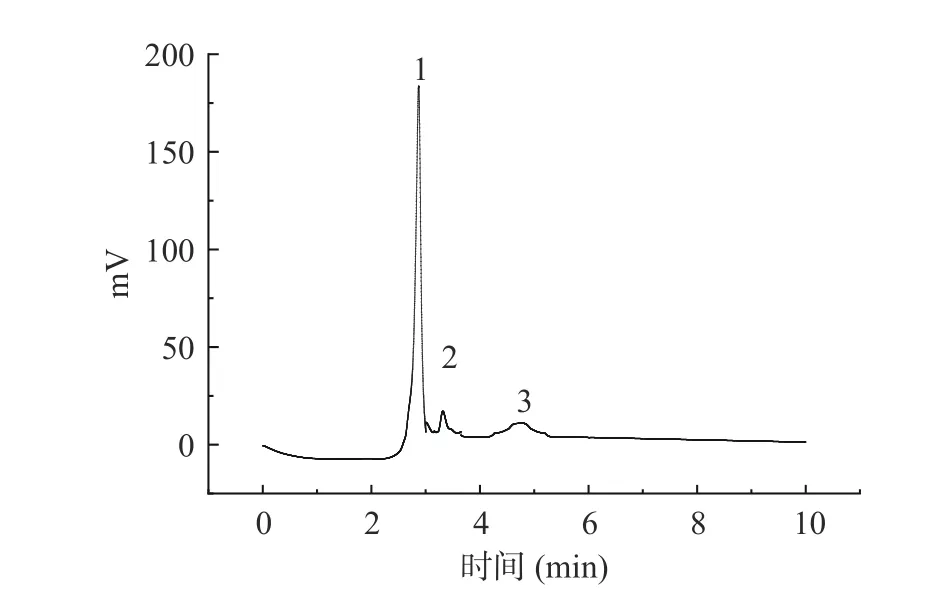
图8 BTESE/PA 复合膜过膜液的液-质联用结果Fig.8 BTESE/PA composite membrane permeate liquid-mass spectrometry diagram
2.3.5 PSMF、PA 过膜液以及BTESE/PA 透过液性能表征 采用热重分析仪分别对PSMF 提取液、微滤膜透过液以及BTESE/PA复合膜过膜液的热稳定性进行表征,温度范围为50~800 ℃,在N2氛围下操作。由图9 可见,100 ℃之前,热失重曲线几乎没有变化,说明在100 ℃之前,提取物稳定,没有出现物质的热分解;100~210 ℃之间,热失重曲线开始出现缓慢下降趋势,说明物料分解温度,开始出现热分解现象,样品失重约为5%;在210~280 ℃之间,热失重曲线大幅度下降,大部分被热分解,样品失重约为42%,此时三种物质的失重速率达到最大,其中PSMF提取液失重速率>PA 透过液失重速率>BTESE/PA复合膜过膜液失重速率,相比较而言,透过BTESE/PA 复合膜的黄酮提取物热稳定性有所提高;280 ℃之后,热失重曲线下降趋势减小,为物料及灰分的热分解。800 ℃以后PSMF 提取液、微滤膜透过液以及BTESE/PA 复合膜过膜液的残留质量分别为1.43%、0.76%和0.26%,由此表明通过BTESE/PA复合膜的PSMF 溶液受热后残留的灰分更少杂质更少,纯度更高,进一步表明BTESE/PA 复合膜对PSMF 溶液有较好的分离效果。

图9 PSMF、PA 过膜液以及BTESE/PA 透过液热重曲线Fig.9 Thermogravimetric curves of PSMF, PA film passing solution and BTESE/PA penetrating solution
2.4 抗氧化活性
由图10 可知,不同小写字母表示PSMF、BTESE/PA 过膜液、VC的抗氧化活性在不同浓度时的差异显著(P<0.05),在所测定浓度范围内,VC对·OH、O2-·和DPPH·始终保持很高的清除能力,随VC的浓度增加,其还原力也随之提高。经过膜过滤后的PSMF 溶液在·OH、DPPH·的清除率和还原力上有所提升:还原力>·OH 清除率>DPPH·清除率,但过膜后O2-·清除率低于PSMF 原料液的清除率。PSMF 过膜液的·OH 清除率略高于原料液,其可能是因为膜将大分子的杂质截留,小分子的黄酮类化合物透过,王帅[28]以白皮杉醇PIC 为例,证明了抽氢反应·OH清除的优势通道,PSMF 富含酚羟基结构,因此清除率有所上升;O2-·清除能力与酚羟基有直接的关系[29],当酚羟基被金属离子螯合时,清除能力下降,PSMF中的邻二酚结构也会抑制O2-·清除;DPPH·[30]清除机理以H 原子转移为主导,因此其清除率曲线与·OH 清除曲线相似;PSMF 过膜液的还原力略高于原料液,其因可能是过膜后的PSMF 溶液呈中性,化合物稳定,不发生自氧化作用,表现出较强的清除能力,随化合物浓度增加而提高。
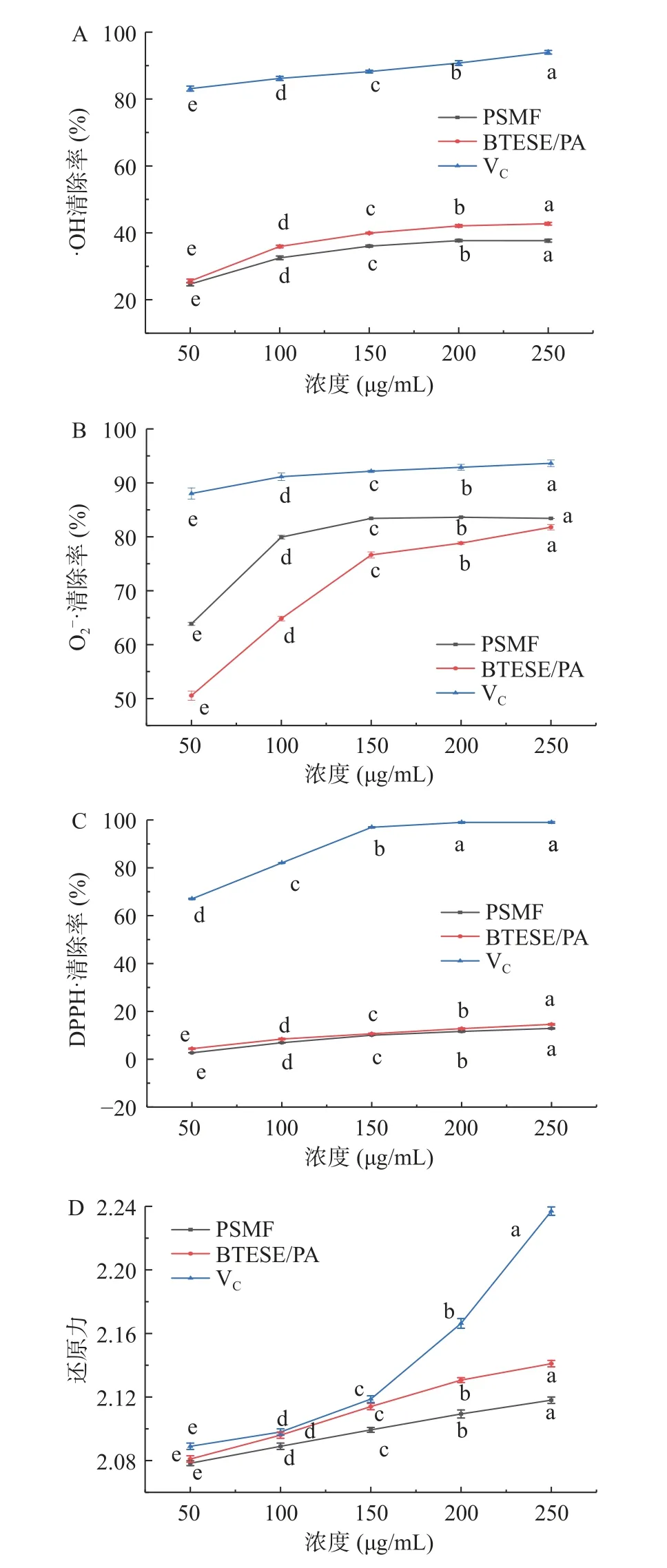
图10 PSMF、BTESE/PA、VC 抗氧化活性曲线Fig.10 Schematic diagram of antioxidant activity test of PSMF,BTESE/PA and VC
综上,PSMF 具有较好的清除自由基的能力,其抗氧化能力随浓度升高而增大,最终趋近于VC的抗氧化能力,PSMF 过膜液对超氧阴离子的清除率低PSMF 于原料液,除此之外过膜液的抗氧化性能均有所提高。PSMF 是将牡丹籽榨油后剩余的残渣回收后进行提取,提高了资源再利用,且具有较强的清除·OH、O2-·、DPPH·和还原力的能力,并均呈一定的量效关系(表5)。
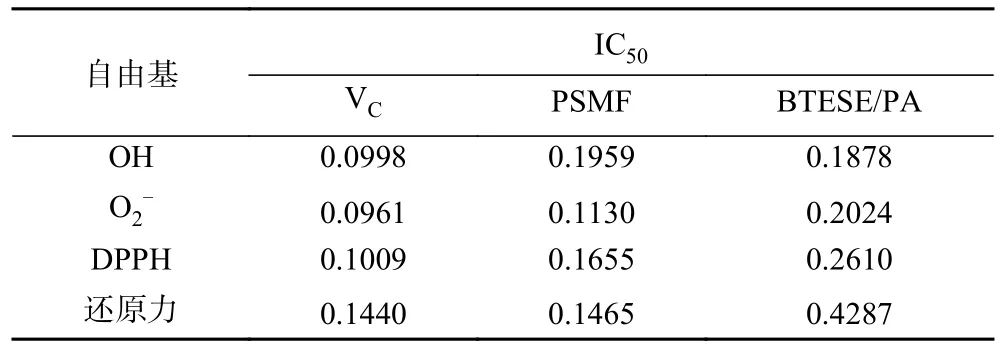
表5 不同抗氧化剂清除自由基的IC50 值Table 5 IC50 values of different antioxidants for scavenging free radicals
3 结论
本研究以总黄酮提取量为参考指标,以乙醇-水(v/v)溶液为提取剂,经过响应面优化得出最佳的提取条件为料液比1:15,提取温度50 ℃,乙醇体积分数为70%,提取时间为30 min,预测总黄酮提取量(240.28±2.25)μg/mL。采用LC-MS 技术分析PSMF共有12 种化合物。筛选了8 种不同的微滤膜进行分离研究,发现PA 膜分离效果较好,其中桑色素的相对含量最多。纳滤膜选用实验室自制的BTESE/PA 复合膜,截留分子量在400 Da 左右,分离后的PSMF纯度和热稳定性略提高,水溶性显著提升。抗氧化测试结果显示BTESE/PA 复合膜的抗氧化效果比未处理的PMSF 有所提升。本研究对牡丹籽粕中的活性成分进行分析,结果表明PSMF 是一种新型的植物黄酮资源,组成丰富,具有一定的研究空间。目前,对牡丹籽粕的研究较少,尤其是在分离提纯和活性探究的空间还很大,例如单一黄酮类化合物的提纯以及对提纯后提取物的抑菌活性、抗氧化、抗癌等方面的分析还有待深入研究。
