动物双歧杆菌联合传统发酵剂对发酵牛乳、牦牛乳品质的影响
2023-09-10陈寒霜露周海栋廖彬旭李巧艳唐善虎李思宁
潘 坤,陈寒霜露,周海栋,廖彬旭,李巧艳,唐善虎,李思宁, ,刘 亮
(1.西南民族大学食品科学与技术学院,四川成都 610041;2.川北医学院,四川南充 637100)
发酵乳是由乳酸菌在代谢过程中产酸,使原料乳经过酸化作用形成的风味独特、营养价值高、易消化的乳制品。益生菌常与传统发酵剂复合用于生产益生菌发酵乳[1]。2001 年,WHO 和FAO 将益生菌定义为“经适量食用后有益于宿主健康的活微生物”[2],益生菌在预防和治疗人类亚健康或疾病方面的应用已经得到了广泛的报道[3]。现如今人们普遍追求更加健康的生活方式,益生菌的地位愈加凸显,而发酵乳制品则是其主要载体。工业生产发酵乳大多使用牛乳作为主要发酵底物,随着市场对含益生菌的非牛乳制品需求不断增加[4],牦牛乳由于含有比牛乳更高的蛋白质、钙、磷、铁、锌等矿物质含量[5],且具有潜在的抗癌、降血压、抗氧化和降低胆固醇的特性,也被广泛用于生产益生菌发酵乳。
近年来,国内外学者对不同发酵组合制备的发酵乳也展开了一些研究。闫瑞宇等[6]采用GC-IMS技术对植物乳杆菌、动物双歧杆菌联合商业发酵剂制备的荞麦发酵乳与普通发酵乳以及商业发酵剂制备的市售发酵乳进行分析,结果表明,荞麦发酵乳中特征性风味物质为3-甲基丁醛、2-甲基丁醛等,市售发酵乳中为2-戊酮、丁醛等,而实验室自制发酵乳中风味物质种类较少;此外,荞麦发酵乳乙酸含量显著高于市售发酵乳。Zhang 等[7]以发酵剂MY105 与发酵乳杆菌HY01 分别制备MY105 发酵牦牛乳、HY01 发酵牦牛乳、共发酵牦牛乳、共发酵牛乳,并以传统发酵牦牛乳作为对照,结果表明,共发酵牦牛乳比传统发酵牦牛乳、HY01 发酵牦牛乳、共发酵牛乳具有更高的表观粘度,同时其共轭亚油酸含量显著高于单种发酵剂发酵乳。任海东[8]以八种商业发酵剂分别发酵豆乳与牛乳,结果发现不同发酵剂在不同底物中表现出不同的发酵特性。目前,暂未见关于动物双歧杆菌联合传统发酵剂共培养对发酵牛乳、牦牛乳及其混合乳品质影响的报道。
本试验研究了动物双歧杆菌与传统发酵剂共培养条件下,发酵乳在4 ℃冷藏28 d 过程中酸化能力、活菌数、持水力、蛋白水解活力、流变特性、物理稳定性、微观结构、挥发性风味物质及感官特性变化,以探讨不同发酵组合对发酵乳品质的影响,为益生菌发酵乳工业化生产提供参考。
1 材料与方法
1.1 材料与仪器
全脂牛乳粉(蛋白质23.8 g/100 g、脂肪28.4 g/100 g、碳水化合物40.6 g/100 g) 新西兰Maxigenes 公司;全脂牦牛乳粉(蛋白质28.0 g/100 g、脂肪26.0 g/100 g、碳水化合物36.5 g/100 g) 红原牦牛乳业有限责任公司;嗜热链球菌和保加利亚乳杆菌混合(1:1)直投式商业发酵剂(SL) Danisco(北京)菌种有限公司;动物双歧杆菌21716(Ba) 中国工业微生物菌种保藏中心;MRS 肉汤培养基、MRS 培养基、MC 培养基 杭州微生物试剂有限公司;BL 培养基 青岛海博生物技术有限公司;酚酞、乙醇、十二烷基硫酸钠、邻苯二甲醛、甲醇、三氯乙酸、L-亮氨酸、异丙醇、石油醚、硫酸、氢氧化钾、氯化钠、戊二醛、乙醇、叔丁醇, 成都科隆化学品有限公司;四硼酸钠 天津瑞金特化学品有限公司;氢氧化钠 成都金山化学试剂有限公司;β-硫基乙醇 百灵威科技有限公司;上述试剂均为分析纯。
MP511 型pH 计 上海三信仪表厂;V1000 紫外可见分光光度计 上海翱艺公司;5804R 冷冻离心机 德国Eppendorf 公司;SW-CJ-1F 超净工作台苏州市安泰空气技术有限公司;MLS-3020 高压灭菌锅 日本三洋电器有限公司;TA-XT plus 质构仪英国Stable Micro Systems 公司;DISCOVERY HR-1 旋转流变仪 美国TA 仪器;LUMiSizer 611 稳定分析仪 德国Lum 公司;DHP-9162D 恒温培养箱上海齐欣科学仪器有限公司;D-37520 真空冷冻干燥机 德国Christ 公司;Apreo 2C 扫描电子显微镜美国Thermo 公司;Trace DSQ 气相色谱质谱联用仪(配Tripplus 自动进样器) 美国Thermo 公司;50/30 μm DVB/CAR/PDMS 萃取头 美国Supelco公司。
1.2 实验方法
1.2.1 菌种活化 动物双歧杆菌在MRS 肉汤中于37 ℃厌氧条件下复活24 h,再在MRS 肉汤培养基中连续活化两代后,转移至灭菌牛乳中,在37 ℃培养8~9 h,使活菌数达到108CFU/g。
1.2.2 试验设计 分别将牛乳粉和牦牛乳粉加入60 ℃温水中(乳粉:水=1:7),搅拌至完全溶解,4 ℃过夜使乳粉充分水合,获得固形物含量为12.5%(w/w)的复原牛乳和复原牦牛乳。使用90 ℃灭菌10 min并冷却至43~45 ℃的牛乳(M)、牦牛乳(Y)、牛乳与牦牛乳1:1 复配乳(M+Y)作为发酵底物。在所有处理中,SL 按原料乳质量的0.1%(w/w)添加,而Ba 不添加或按原料乳质量的107CFU/g 添加,搅拌均匀后于42 ℃发酵至pH4.6,获得SL/M、SL-Ba/M、SL/Y、SL-Ba/Y、SL/M+Y、SL-Ba/M+Y 发酵乳。随后,将各组发酵乳转移至(4±1)℃冰箱冷藏1、7、14、21、28 d,取样测定指标。
1.2.3 酸化能力测定 使用pH 计测定发酵乳的pH。滴定酸度测定参照Li 等[9]的方法。发酵乳样品5.0 g与5 mL 去离子水混匀,加入2 滴0.5%酚酞(95%乙醇溶液作为溶剂),用0.1 mol/L NaOH 标准溶液滴定至持续的淡粉色。根据消耗NaOH 标准溶液的量计算滴定酸度(°T)。
1.2.4 活菌数测定 活菌数参照GB 4789.35-2016[10]方法。发酵乳样品25 g 与生理盐水225 mL 充分混合。吸取1 mL 菌液用生理盐水稀释适宜的倍数后,分别使用MRS 培养基、MC 培养基和BL 培养基对保加利亚乳杆菌、嗜热链球菌和动物双歧杆菌进行平板计数。乳酸菌活菌数以CFU/g 发酵乳表示。
1.2.5 持水力测定 持水力参照吴淼等[1]的方法测定。取一定质量(W0)发酵乳样品于离心管,8000×g离心15 min(4 ℃),倾去上清液,称量剩余样品的质量(W)。按照公式(1)计算持水力(Water holding capacity,WHC)。
1.2.6 蛋白水解活力测定 蛋白水解活力参照Church 等[11]的方法。邻苯二甲醛(OPA)试剂配制:0.1 mol/L 四硼酸钠溶液50 mL、20%十二烷基硫酸钠溶液5 mL、OPA(80 mg 邻苯二甲醛溶解于2 mL甲醇,加入β-疏基乙醇200 μL 与之混匀)2.2 mL 混合后,用去离子水定容至100 mL。发酵乳样品2.0 g和去离子水1 mL 混匀,加入0.75 mol/L 三氯乙酸5 mL,混合均匀并静置10 min,4 ℃、4000×g 离心10 min,收集上清液。取上清液或去离子水(对照)200 μL,加入OPA 试剂4 mL,混匀,室温下反应10 min 后于340 nm 波长处测定吸光度。
1.2.7 流变特性 流变特性参照任然[12]的方法,并略有修改。用HR-1 流变仪测定发酵乳的流变特性。实验条件为:频率扫描在25 ℃环境下,角频率由0.1~100 rad/s,每个数量级点数为16 个;剪切扫描在 25 ℃环境下,剪切速率由1 增加到100 s-1,每个数量级点数为25 个。
1.2.8 物理稳定性 用稳定性分析仪测定发酵乳的稳定性。吸取0.5 mL 发酵乳置于2 mm PC 管中,光源波长865 nm,谱线条数为255 条,时间间隔为每10 s 扫描一次,转速为2500 r/min,温度为25 ℃进行检测。
1.2.9 微观结构 微观结构参考Kristo 等[13]的方法。用勺子挑取冷藏28 d 发酵乳中心凝块,大小约为:2 cm×2 cm×2 cm,在4 ℃条件下于2.5%的戊二醛溶液中固定12 h 以上,然后用生理盐水冲洗两次,每次15 min。分别用50%、70%和90%乙醇进行梯度洗脱,每次洗脱10 min,用100%乙醇洗脱三次,每次10 min,再用叔丁醇置换10 min。将样品放入-80 ℃预冷24 h 以上,再置于真空冷冻干燥机中冷冻干燥12 h 以上。采用离子溅射仪在样品表面镀铂金膜,利用发射扫描电子显微镜观察样品的微观结构。
1.2.10 挥发性风味物质 使用GC-MS 联用仪测定发酵乳的挥发性风味物质,参照任然[12]的方法。发酵乳样品5 g 装入顶空进样瓶内,加入2 g 氯化钠,加盖密封,样品预孵化10 min 后用萃取头吸附30 min,220 ℃解析附3 min,进行GC-MS 分析。色谱条件:采用TR-FFAP 色谱柱(30 m×0.25 mm×0.25 μm);载气为99.999%氦气,流速为1.0 mL/min,采用不分流模式;进样口温度为230 ℃;升温程序:起始温度40 ℃保持3 min,以5 ℃/min 升到140 ℃,并持续3 min,再以7 ℃/min 升到220 ℃,并保持3 min,解析时间2 min。质谱条件:EI,正离子扫描模式,70 eV;离子源温度为250 ℃,质量扫描范围为33~450 amu。发酵乳中风味物质的鉴定以其保留时间和NIST 08 标准库比对确定,最终报道正反匹配因子均大于800的结果。挥发性风味物质含量(%)采用面积归一化法,用各物质的峰面积占总峰面积的百分比表示,即相对峰面积。参照刘登勇[14]的方法,采用相对气味活度值(relative odor activity value,ROAV)法评价不同发酵乳样品的香气组分对主体香味的贡献程度。定义对样品整体风味贡献程度最大的组分ROAVstan为100,对其他风味化合物的ROAV 按公式(2)计算:
式中:Ci和Ti为该挥发性化合物的相对含量(%)和感觉阈值(μg/kg);Cstan和Tstan为对整体风味贡献最大的挥发性化合物的相对含量(%)和感觉阈值(μg/kg)。
1.2.11 感官特性 邀请6 名经过感官评价训练的人员,男女各一半,从产品的色泽、组织状态、滋味以及气味四方面进行感官评定。满分为100 分,感官评分标准参照李思宁等[15]的方法,见表1。
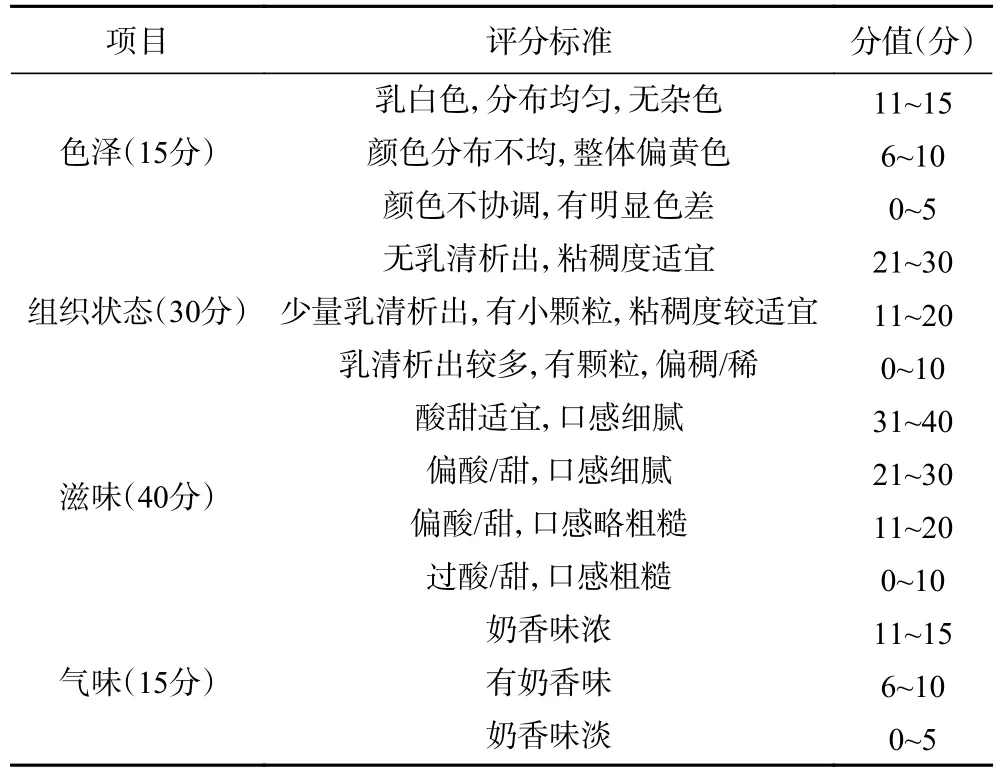
表1 发酵乳的感官评分标准Table 1 Sensory evaluation criteria of fermented milks
1.3 数据处理
所有试验均重复三次,结果以平均值±标准偏差表示。使用SPSS 26.0 单因素方差分析(ANOVA)中的Duncan 法检测各处理平均值的差异显著性;使用一般线性模型中的单变量检测不同组别发酵乳在冷藏期间的差异显著性。P<0.05 表示差异显著。运用Origin 2021 软件作图。
2 结果与分析
2.1 不同发酵剂与发酵底物对发酵乳酸化能力的影响
测定酸化能力能够了解不同发酵剂在发酵体系中产酸速度的快慢。冷藏期间,发酵乳的pH 和滴定酸度变化结果见图1 和图2。从图1 可以看出,随着冷藏时间延长,各组发酵乳pH 显著降低(P<0.05)。对不同发酵乳pH 统计分析表明,采用同一发酵剂条件下,发酵牦牛乳组>发酵混合乳组>发酵牛乳组。牛乳和牦牛乳中的乳糖含量不同,导致酸的积累速度和总量不同[16]。对于相同的发酵底物,动物双歧杆菌参与发酵可显著降低发酵乳的pH(P<0.05),这可能归因于动物双歧杆菌与传统发酵剂共同作用于乳基质,促进了乳糖的分解和乳酸的积累。这与李思宁等[17]报道的结果一致。

图1 发酵乳在冷藏期间的pHFig.1 pH of fermented milk during refrigeration

图2 发酵乳在冷藏期间的滴定酸度Fig.2 Titratable acidity of fermented milk during refrigeration
滴定酸度可以反映包括肽和游离氨基酸残基在内的所有酸性基团总和[18]。由图2 可以看出,随着冷藏时间延长,各组发酵乳的滴定酸度显著增加(P<0.05),其上升趋势与pH 显著降低的趋势相呼应。采用同一发酵剂条件下,不同发酵乳酸度由高到低依次为:发酵牛乳、发酵混合乳、发酵牦牛乳。SLBa/M 组的酸度显著高于SL/M 组,SL-Ba/Y 组的酸度显著高于SL/Y 组,SL-Ba/M+Y 组的酸度显著高于SL/M+Y 组(P<0.05),不难看出,动物双歧杆菌参与发酵可显著增加发酵乳的酸度。
2.2 活菌数
冷藏期间发酵乳中活菌数变化见图3。由图3可以看出,随着冷藏时间增加,所有发酵乳中保加利亚乳杆菌活菌数在1~7 d 显著增加,随后显著下降(P<0.05)。推测在冷藏前期,保加利亚乳杆菌处于对数期,且发酵乳中营养物质充足,保证了乳酸菌的生长繁殖;到冷藏中后期,乳酸菌度过对数生长期,且发酵乳中营养物质逐渐消耗,活菌数减少。武士美[19]也在发酵乳中发现保加利亚乳杆菌有类似的变化趋势。对于相同的乳基质,含有动物双歧杆菌的发酵乳中保加利亚乳杆菌数显著高于不含动物双歧杆菌的发酵乳(P<0.05),可能是共培养体系中,三株菌能够互相促进生长[20],因此添加动物双歧杆菌能够提高并维持嗜热链球菌、保加利亚乳杆菌的数量。SL/M 组发酵乳中保加利亚乳杆菌和嗜热链球菌活菌数显著高于SL/Y 组和SL/M+Y 组,SL-Ba/M 组显著高于SL-Ba/Y 和SL-Ba/M+Y 组(P<0.05),原因是这两种乳酸菌主要利用乳糖作为碳源为其生长提供能量[21],而牛乳中乳糖含量显著高于牦牛乳[16]。
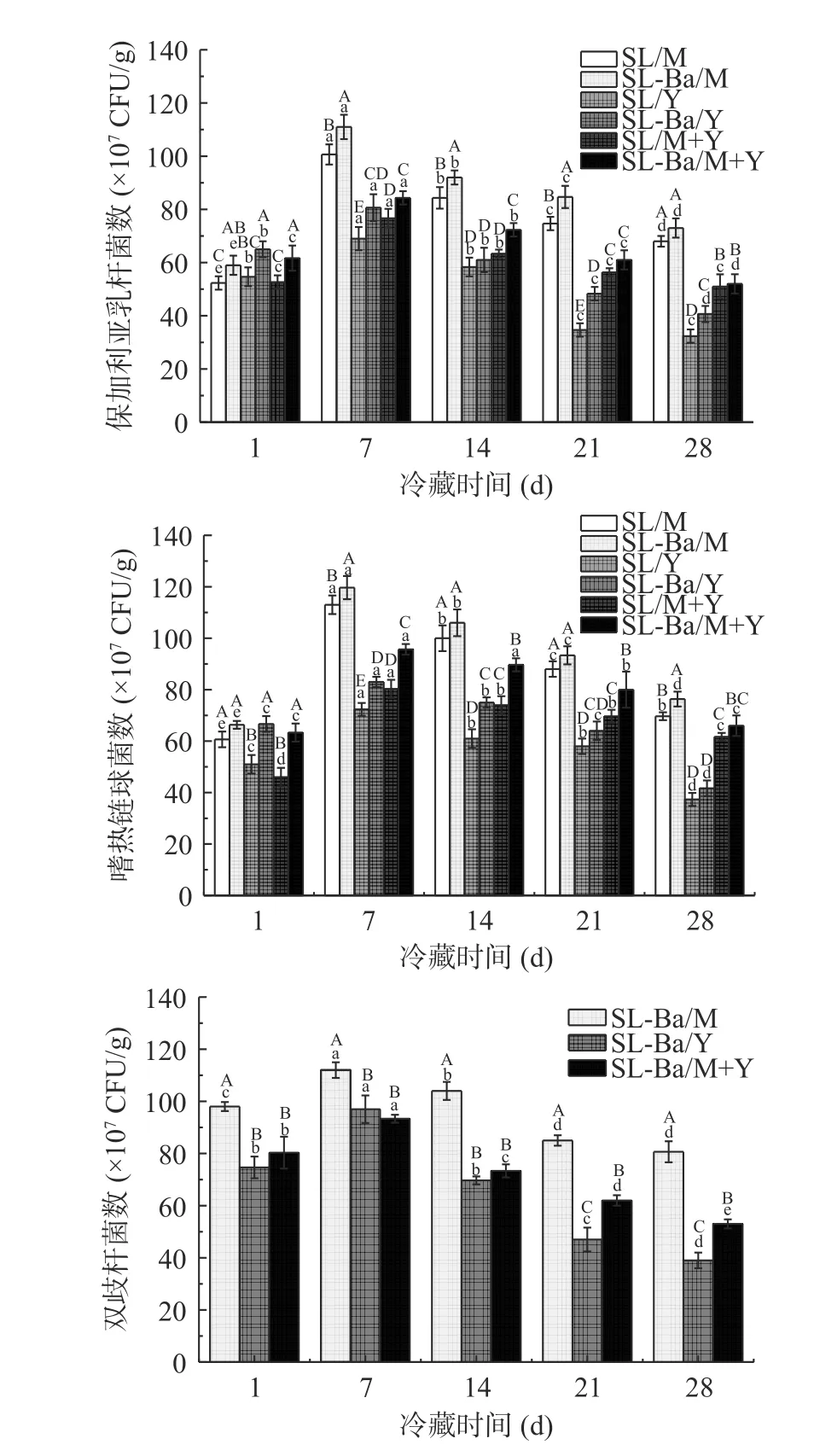
图3 发酵乳在冷藏期间的活菌数Fig.3 Viable bacteria count of fermented milk during refrigeration
嗜热链球菌活菌数在1~7 d 内显著增加,随后显著减少(P<0.05)。这与任然[12]研究结果一致。嗜热链球菌活菌数的下降与发酵乳酸度的升高有关,随着乳酸菌分解乳糖产酸,体系中酸度升高,嗜热链球菌的生长受到抑制,同时,随着储藏时间的延长,体系中嗜热链球菌能利用的营养成分也逐渐减少,导致嗜热链球菌活菌数减少[22]。
各组发酵乳中动物双歧杆菌活菌数在1~7 d 增显著加,随后显著减少(P<0.05)。在整个冷藏期间,SL-Ba/M 组的动物双歧杆菌活菌数显著高于SLBa/Y 和SL-Ba/M+Y 组(P<0.05),推测是乳糖水解后会生成低聚糖[23],而牛乳中乳糖的含量显著高于牦牛乳[16],使得不同乳基质中低聚糖的组成和含量有所区别。又有研究表明,低聚糖可以刺激双歧杆菌的生长[24],进而导致不同的发酵乳中动物双歧杆菌的数量有所不同。
2.3 持水力
酪蛋白形成的三维网状结构决定了发酵乳的持水力,较高的持水力会使发酵乳较长时间保持产品的感官及质地。由图4 可以看出,在冷藏期间,所有发酵乳持水力均在1~7 d 显著增加,随后显著减少(P<0.05)。冷藏初期(1~7 d),酪蛋白胶束之间的吸引力强度较弱,从而保持了凝胶中的较多孔隙,减少自然脱水,导致持水力增加[25]。冷藏7 d 之后,pH 持续降低导致凝胶中蛋白网络重排,粒子-粒子连接数量增加,使得凝胶收缩,排出其间隙液即乳清,从而降低持水力[26]。相同的变化趋势也被潘潇[27]报道。1~21 d,SL/Y 组持水力显著高于SL/M 组和SL/M+Y组(P<0.05);在28 d 时,SL/Y 组与SL/M 组差异不显著(P>0.05),但SL/Y 和SL/M 组持水力显著高于SL/M+Y 组(P<0.05)。在1~14 d,SL-Ba/M+Y 组的持水力显著高于SL-Ba/M组和SL-Ba/Y 组(P<0.05);在21~28 d,SL-Ba/M+Y 组的持水力显著高于SLBa/M 组(P<0.05),与SL-Ba/Y组无显著差异(P>0.05),推测发酵混合乳在SL-Ba 的作用下可能会形成更加细密的网状结构来更好地维持发酵乳的持水力。

图4 发酵乳在冷藏期间的持水力Fig.4 Water-holding capacity of fermented milk during refrigeration
2.4 蛋白水解活力
牛乳中的游离氨基酸和肽仅能支撑乳酸菌繁殖2~3 代,因此乳酸菌需要借助自身蛋白水解系统将乳中酪蛋白降解成氨基酸和肽来满足生长。在这个过程中,因蛋白质水解产生的游离氨基酸和小肽也会改善发酵乳的风味[28]。从图5 可以看出,SL/M 组、SLBa/M 组的蛋白水解活力在冷藏期内持续上升(P<0.05);SL/Y 组、SL-Ba/Y 组、SL/M+Y 组的蛋白水解活力在1~14 d 显著上升,随后显著下降(P<0.05);SL-Ba/M+Y 组的蛋白水解活力在1~14 d 上升,在后续冷藏期内无显著差异(P>0.05)。这表明,发酵乳的蛋白水解活力与发酵剂、发酵底物关系较大。在发酵牛乳组中,SL-Ba/M 组的蛋白水解活力在整个冷藏期显著高于SL/M 组(P<0.05),原因是添加动物双歧杆菌的组总活菌数要多于未添加动物双歧杆菌的组,并且动物双歧杆菌也拥有一定的游离氨基释放能力[17]。在发酵牦牛乳组中,SL-Ba/Y 组的蛋白水解活力在1、21 d 显著高于SL/Y 组(P<0.05),其余时间无显著差异(P>0.05),推断动物双歧杆菌能够很好的维持发酵牦牛乳中的蛋白水解活力,使SL-Ba/Y 组蛋白水解活力的上升速度快于SL/Y 组,下降速度慢于SL/Y 组。在发酵混合乳组中,SL-Ba/M+Y 组的蛋白水解活力在1 d 时显著高于SL/M+Y 组(P<0.05),其余时间无显著差异(P>0.05),推断动物双歧杆菌在发酵混合乳中的蛋白代谢活动仅在冷藏初期较强。
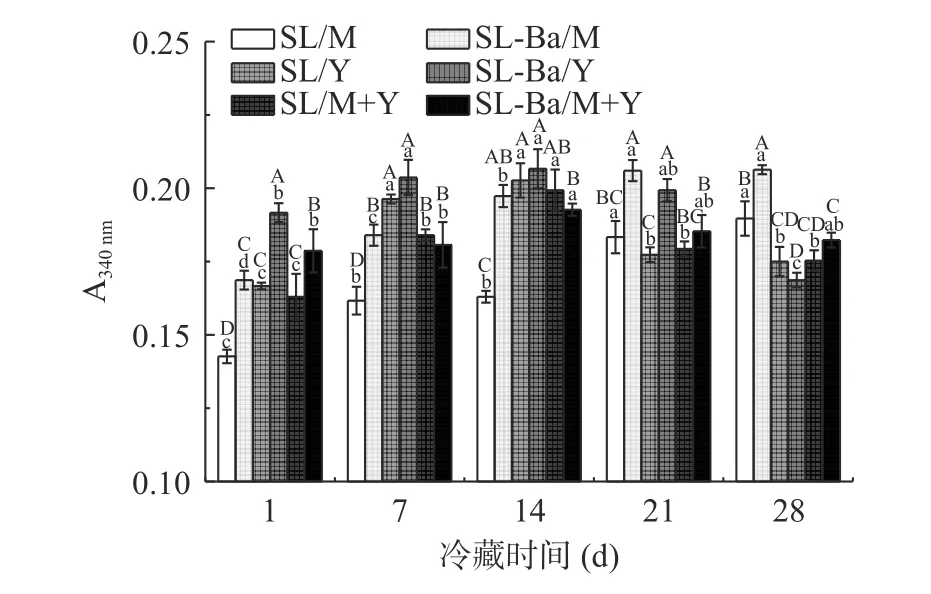
图5 发酵乳在冷藏期间的蛋白水解活力Fig.5 Proteolytic activity of fermented milk during refrigeration
2.5 流变特性
储能模量(G′)也称弹性模量,表示当物体受到外力作用时的形变程度,可以反映样品弹性形变能力的大小;G′越大说明物体受到外力作用时的形变程度越小。损耗模量(G′)也称黏性模量,表示物体受到外力作用时阻碍其流动的特性,可以一定程度上反映样品的黏性;G′′越大说明物体受到外力作用时越不容易流动[29]。从图6 可以看出,各组发酵乳的G′都大于G′′,说明发酵乳的网络结构稳定,能够承受高频率的破坏,表现的更像固体[12]。随着冷藏时间的增加,SL/M 组、SL-Ba/M 组、SL/Y 组的G′和G′上升;SL-Ba/Y组的G′和G′′无明显变化;SL/M+Y 组G′和G′′下降;SL-Ba/M+Y 组的G′、G′′上升。SL/M+Y 组随着冷藏时间的增加,受到外力作用时,更容易发生形变,更容易流动,变得更像液体,其余五组都变得越来越稳定,越来越像固体。后酸化能够促进酪蛋白颗粒不断融合,提升发酵乳的稳定性[30],因此可以推断动物双歧杆菌在发酵混合乳中能够促进发酵乳后酸化过程中酪蛋白颗粒的融合。SL/Y 组在28 d 表现出过高的G′、G′′,推测是大量乳清析出,导致发酵乳凝乳结块。其中SL-Ba/Y 组的G′、G′′低于SL/Y 组,但是高于SL/M 组、SL-Ba/M 组、SL/M+Y 组、SL-Ba/M+Y组,这表明其凝胶结构更多,因此会表现出更加厚重的口感[31]。
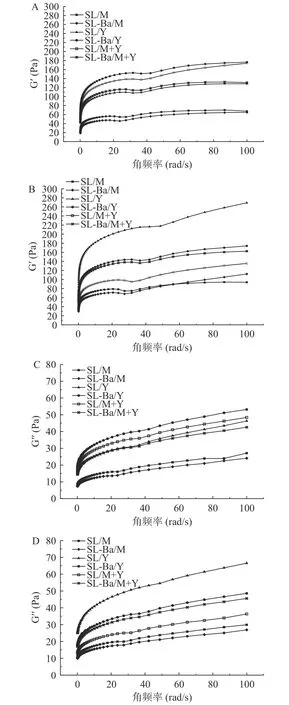
图6 发酵乳在冷藏期间的流变特性Fig.6 Rheological property of fermented milk during refrigeration
2.6 物理稳定性
不稳定指数可以衡量乳液的稳定性。在相同条件下,不稳定指数越接近于1,说明发酵乳分离越快,发酵乳越不稳定[32]。由表2 可知,SL/M 组各相邻冷藏期无显著变化(P>0.05),但21~28 d 相比1~7 d 有显著下降(P<0.05)。SL-Ba/M 组的不稳定指数在14~21 d 显著下降(P<0.05)。SL/Y 组不稳定指数先增加后显著下降(P<0.05),于14 d 达到最大值。SL-Ba/Y组不稳定指数在1~7 d 增加(P<0.05),随后无显著变化(P>0.05)。SL/M+Y 组在21~28 d 下降(P<0.05),其余时间无显著变化(P>0.05)。SL-Ba/M+Y 组不稳定指数在各相邻冷藏期无显著变化(P>0.05),但21 d 对比7 d 有显著下降(P<0.05)。不稳定指数降低,代表发酵乳不易沉淀分层,凝胶网络变得更加稳定,发酵乳持水力升高[32]。SL/Y 组与SL-Ba/Y 组与前述持水力的结果一致,而其余四组推测是发酵乳酸度过高,对蛋白凝胶网络结构的影响过大而导致与持水力结果不符。由表2 可以看出,同种发酵底物,不同发酵剂的发酵乳不稳定指数差别不显著(P>0.05),推断动物双歧杆菌对发酵乳的不稳定指数影响不大。发酵牦牛乳组的不稳定指数显著高于发酵牛乳组(P<0.05),原因是发酵乳中酪蛋白表面大部分带有正电荷,在酸性条件下会相互聚集[33],而牦牛乳中酪蛋白的含量显著高于牛乳[5],更容易聚集成团,形成沉淀。
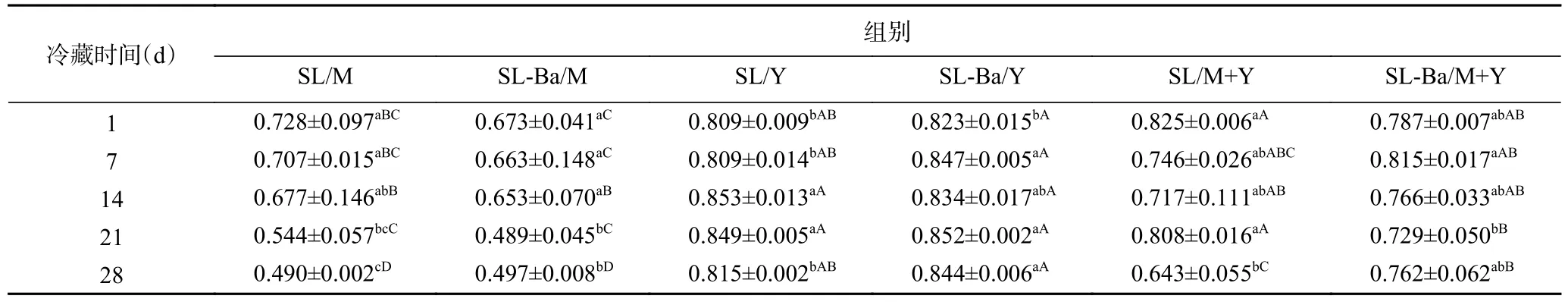
表2 发酵乳在冷藏期间的不稳定指数Table 2 Instability index of fermented milk during refrigeration
2.7 微观结构
凝固型发酵乳具有三维网状结构,且这种网状纤维中间有无数大小不一且呈六棱形的空隙,乳脂肪球与乳酸菌通常贯穿其中,使这种凝胶结构更加严密而坚实,从而提高发酵乳凝胶的持水力[34]。从图7中能看出,所有组的发酵乳都形成了这种网状结构,但这种网状结构都是由球形酪蛋白胶束堆砌而成,很少形成链段,因此这种结构比较脆弱,强度较低[35]。有研究表明,在发酵乳的间隙中主要是由乳清和微生物菌体填充,而冷冻干燥的处理方法会使得乳酸菌菌体爆裂因而无法看见[36],这与本研究的结果一致。在28 d 时,可以看到添加动物双歧杆菌的发酵乳微观结构显得有更多、更大的孔隙,因此会持留更多的水分,降低乳清析出,提高持水力,这与前述持水力的表现一致。与发酵牦牛乳组相比,发酵牛乳组形成的蛋白网络更疏松,凝胶颗粒更细小,因此会更加难以分层,这与前述稳定性分析结果一致。在不同底物发酵乳中,发酵牦牛乳组形成的蛋白凝胶结构更加紧密,表面聚集物形成的结构更大,使得发酵乳更容易沉降,这与前述稳定性分析的结果一致,此种发酵乳的微观结构与盛嘉睿[37]观察到的情况相近。在6 组发酵乳中,SL-Ba/M+Y 组的网络结构最为繁杂,孔隙最多最密集,因此其能够固定更多的水分,这与前述持水力的结果一致。
2.8 挥发性风味物质
风味是评估发酵乳品质的主要指标之一[38]。由表3 看出,冷藏期内不同发酵乳中共检测出131 种挥发性风味物质。包括醛类化合物(27 种)、醇类化合物(22 种)、酮类化合物(16 种)、烃类化合物(23 种)、酯类化合物(13 种)、酸类化合物(8 种)以及其他化合物(12 种)。在各组发酵乳中,醛类、醇类、酮类是占比较大的风味物质。
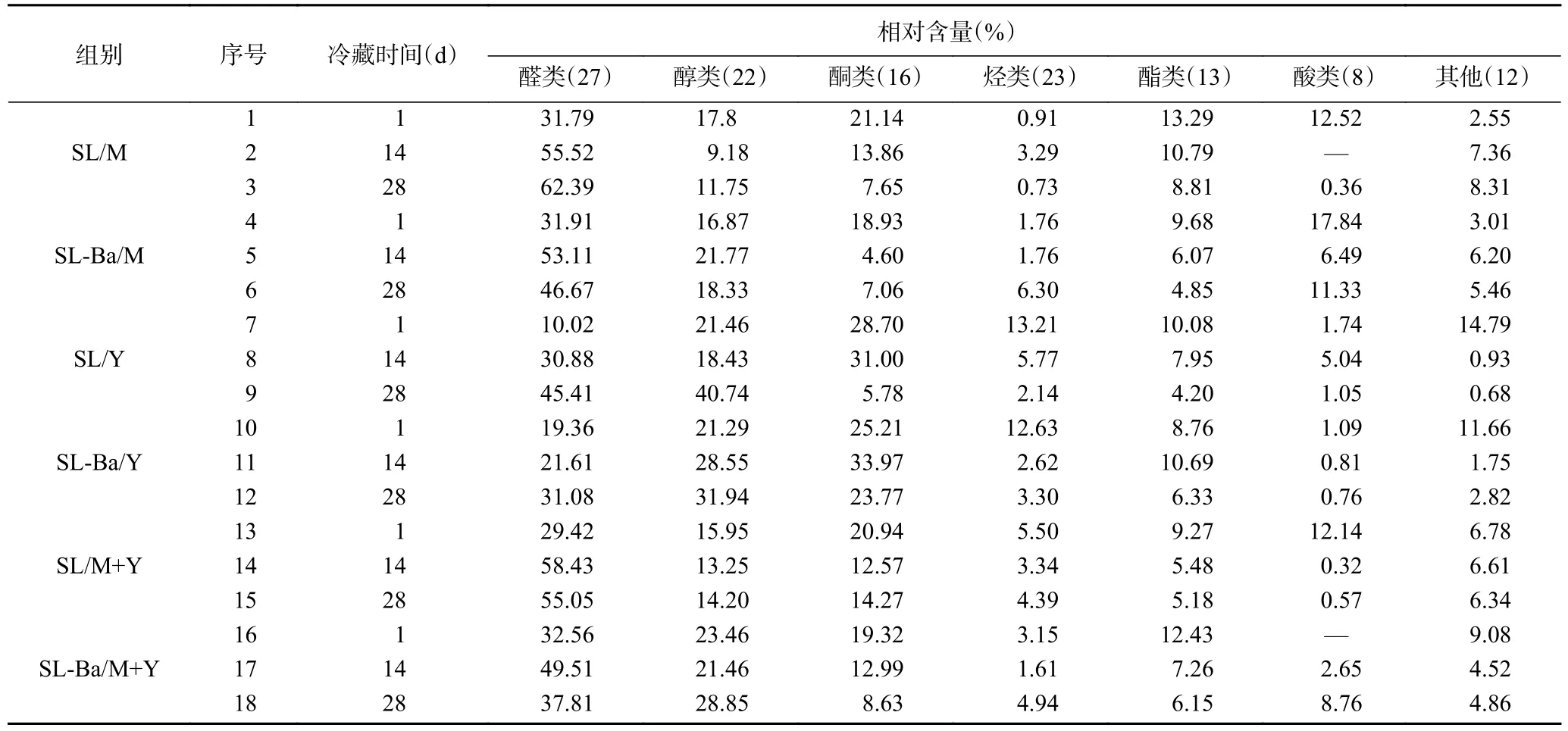
表3 发酵乳在冷藏期间的挥发性风味物质Table 3 Volatiles of fermented milk during refrigeration
对表3 进行主成分分析,取特征值>1 和累计贡献率>70%的物质种类作为主成分[39]。由图8 可知,发酵乳挥发性风味物质有三个主成分,第一主成分(PC1)贡献率为34.958%,构成成分是醛类、酮类、烃类;第二主成分(PC2)贡献率为24.297%,构成成分是醇类和其他;第三主成分(PC3)贡献率为20.979%,构成成分是醇类和酯类。由图9 可以看出,不同发酵乳在不同发酵时间在得分上具有差异。在第1 d,发酵底物相同的组得分接近。SL/M 第28 d 和SL/M+Y 第14 d 在第一主成分上得分较高;SL/M 第1 d 和SLBa/M 第1 d 在第二主成分上得分较高;SL/M 第28 d和SL-Ba/Y 第28 d 在第三主成分上得分较高。

图8 挥发性风味物质的因子载荷分析图Fig.8 Factor loading analysis diagram of volatiles
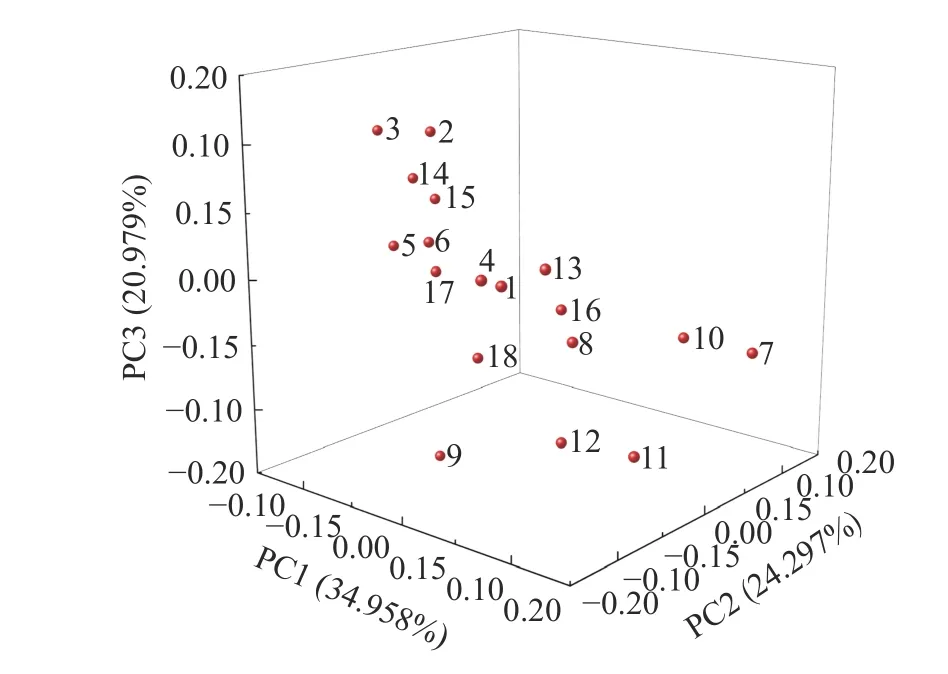
图9 各样品PCA 得分散点图Fig.9 Distribution points of samples on different principal components
不同冷藏时间的发酵乳关键风味贡献物质结果以热图表示。发酵乳中共确定30 种关键风味物质(ROAV≥1)。随着冷藏时间的增加,SL/M 组关键风味物质种类逐渐减少,而SL-Ba/M 组数量保持恒定;SL/Y 组关键风味物质在1~14 d 增加而在14~28 d减少,但SL-Ba/Y 组随冷藏时间增加而增加;SL/M+Y 组的关键风味物质随冷藏时间的增加出现先减少后增加的趋势,而SL-Ba/M+Y 组持续增加。因此可以判断添加动物双歧杆菌有助于关键性风味物质的增加,原因是多种乳酸菌共培养增加了更多的代谢途径使发酵乳产生了更多的风味物质[40]。
醛类化合物是各种氧化风味的来源,可通过如脂质氧化和分解等多种途径产生[41]。各组样品的挥发性风味物质均包括壬醛,壬醛能够给发酵乳带来类似柑橘和脂肪的香味[42],其在各样品中的ROAV 值均大于1,被认为是关键风味贡献物。发酵乳中呈现油脂味的醛类化合物还包括:庚醛、反-2-壬烯醛及反-2-辛烯醛等[43]。正辛醛具有强烈的水果香味,癸醛具有橙皮、牛油香气[43]。
醇类化合物一般由糖类、氨基酸和醛类物质发生还原反应而产生,但醇类物质的阈值较高,所以对发酵乳风味的影响较低[44]。图10 中,关键风味贡献物中的醇类仅叶绿醇、糠醇、1-辛烯-3-醇、庚醇4 种。叶绿醇在SL/M 组1 d 时作为关键风味贡献物质;糠醇在SL-Ba/Y 组1 d 时作为关键风味贡献物质;1-辛烯-3-醇拥有蘑菇风味,可能来自于脂类的分解[19],在SL/M 组1 d 时、SL-Ba/M 组1 d 时、SL/M+Y 组1 d 时作为关键风味物质,可以判断1-辛烯-3-醇仅仅在牛乳或含牛乳的发酵乳中作为关键风味物质,且会受到动物双歧杆菌的影响使得该种脂类更少的被分解为1-辛烯-3-醇。
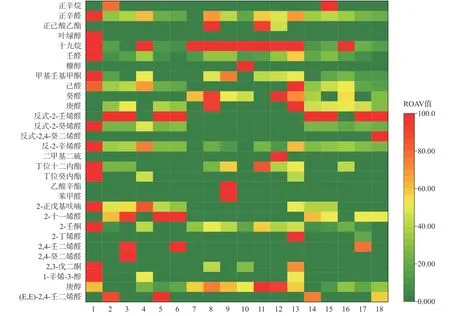
图10 发酵乳在冷藏过程中的ROAV 值Fig.10 ROAV value of fermented milk during refrigeration
酮类化合物具有独特的风味,这些酮类的形成途径是通过氨基酸或不饱和脂肪酸的氧化分解,或是乳酸菌的代谢过程产生的[45]。由图10 可以看出,酮类中的关键风味物质很少,只有甲基壬基甲酮、2-壬酮、2,3-戊二酮3 种,其中甲基壬基甲酮和2-壬酮主要在发酵牦牛乳组和发酵混合乳中出现作为关键风味物质。2,3-戊二酮的特征香气是带有坚果香的奶油焦糖味[46],而甲基壬基甲酮和2-壬酮则具有酸浆芸香、果香、椰子和奶油的香味[47]。
2.9 感官评定
由图11 可知,各组发酵乳的感官评分在1~7 d上升,随后下降(P<0.05)。随着冷藏时间的增加,发酵乳感官品质发生变化,其在冷藏后期的色泽、组织状态、滋味和气味都比冷藏前中期差。添加了动物双歧杆菌的发酵乳感官评分要高于未添加动物双歧杆菌的样品,可以推断动物双歧杆菌的加入使得发酵乳产生了更多的风味物质,拥有更好的感官特征,这点与前述风味的结果一致。在冷藏前中期,SL-Ba/M组的感官高于其他组,这与前述的物理稳定性分析结果一致。在冷藏后期,由于酸度的进一步增加、持水力下降等因素,使得各组发酵乳的感官出现了明显下降(P<0.05)。

图11 发酵乳在冷藏期间的感官评分变化Fig.11 Sensory score changes of fermented milk during refrigeration
3 结论
本文研究了不同发酵剂、发酵底物对发酵乳理化特性、蛋白水解活力、流变特性、物理稳定性、微观结构、挥发性风味与感官特性等指标的影响。结果表明,对于相同发酵底物,动物双歧杆菌联合传统酸奶发酵剂共培养,能提升发酵乳的酸化能力、活菌数及蛋白水解活力,改善发酵乳的凝胶网状结构、挥发性风味与感官品质,但不影响发酵乳的物理稳定性。对于相同发酵剂,牛乳发酵乳活菌数最多,酸化能力、蛋白水解活力与物理稳定性最好;牦牛乳发酵乳粘弹性最优;混合乳发酵乳持水力最高,凝胶网状结构最致密,关键风味物质种类最多。本研究表明,动物双歧杆菌联合传统发酵剂共培养可以改善发酵乳品质,且相比于牦牛乳,牛乳和混合乳更适合作为发酵底物。本文并未从乳酸菌代谢物方面探究发酵乳品质发生变化的原因,未来需要进一步通过代谢组学技术来揭示不同发酵剂作用于不同发酵底物的代谢物变化与发酵乳品质形成的关系。
