苯乳酸对单增李斯特菌生物被膜的影响
2023-09-10姜聪一姜晓冰
姜聪一,康 瑞,于 涛,姜晓冰,
(1.河南师范大学生命科学学院,河南新乡 453007;2.新乡学院生命科学与基础医学学院,河南新乡 453000)
单增李斯特菌(Listeria monocytogenes,Lm)是一种重要的食源性致病菌,在自然界中广泛存在。该菌能够引起人畜共患病——李斯特菌病,典型的临床症状表现为脑膜炎、败血症、流产等[1]。李斯特菌病的发病率不高,但是致死率可高达33%,严重威胁人类身体健康[2]。大量研究表明,食用被Lm 污染的食品是造成李斯特菌病散发和爆发流行的主要原因[3]。Lm 可粘附在食品接触表面形成生物被膜,被膜态的Lm 能够在食品加工环境中存活数月乃至数年之久[4]。被膜态Lm 分泌的胞外聚合物主要由胞外多糖、胞外蛋白和胞外DNA 组成,这些胞外物质可形成物理屏障,阻碍抗菌药物向被膜内扩散,提高Lm 在不利环境中的存活能力[5-6]。Lm 生物被膜是一种潜在的污染源,可能引起食品交叉污染和加工后污染,威胁食品安全[7]。因此,寻找能够有效抑制Lm 及其生物被膜的抗菌物质对预防和控制Lm 引起的食源性疾病显得尤为重要。
苯乳酸(Phenyllactic acid,PLA)广泛存在于许多植物和食品中,如雪莲、天麻、蜂蜜、乳酸菌发酵食品等[8-9]。PLA 抗菌谱广,对革兰氏阳性菌、革兰氏阴性菌以及真菌均表现出良好的抗菌活性[10-12]。研究发现PLA 作用后细菌细胞壁结构被破坏,胞内成分泄漏,表明细胞壁可能是PLA 的作用靶点之一。PLA 还能通过与细菌基因组DNA 结合阻止DNA复制从而干扰细胞正常功能[13-15]。PLA 具有水溶性好、理化性质稳定、安全性高等优点,在食品工业中具有广阔的应用前景[16-17]。
目前的研究主要集中在PLA 对浮游态细菌的抑菌活性和抑菌机制方面[8,13-15],而关于PLA 对细菌生物被膜抑制效果的研究相对较少。本文主要研究PLA 对Lm 生物被膜形成的抑制及成熟生物被膜的清除效果,通过检测生物被膜胞外聚合物的含量、Lm 运动性以及生物被膜相关基因转录水平初步探究PLA 对Lm 生物被膜的作用机制,为PLA 在控制Lm 及其生物被膜方面的应用奠定理论基础。
1 材料与方法
1.1 材料与仪器
Lm 标准菌株EGD-e 和10403S 由华中师范大学罗勤教授惠赠,Lm 食品分离株L1、L44、L46、L60、L69 和L82 由本实验室保存,菌株信息见表1;脑心浸液培养基(Brain Heart Infusion,BHI) OXOID;PALCAM 琼脂 青岛高科园海博生物技术有限公司;草酸铵 山东豪顺化工有限公司;结晶紫 天津市大茂化学试剂厂;无水乙醇 天津富宇精化工有限公司;戊二醛 上海麦克林生化科技有限公司;叔丁醇 天津市大茂化学试剂厂;苯酚 济南鑫沃化学有限公司;胰蛋白胨大豆肉汤培养基(Tryptic Soy Broth,TSB) 青岛高科园海博生物技术有限公司;福林酚 北京索莱宝科技有限公司;小牛胸腺DNA上海麦克林生化科技有限公司;RealMaster Mix(SYBR Green)试剂盒 天根生化科技(北京)有限公司;细菌RNA 提取试剂盒 上海碧云天生物技术有限公司;荧光定量PCR 试剂盒 北京天根生化科技有限公司。

表1 菌株信息Table 1 Strain information
JSM-6390LV 场发射扫描式电子显微镜(Field Emission Scanning Electron Microscopy,FE-SEM)日本株式会社日立高新技术公司;DMi1 倒置显微镜 Leica 公司;LightCycle96 实时荧光定量PCR 仪ABI 公司;Synergy H1 酶标仪 美国安捷伦Bio Tek 公司;SW-CJ-2FD 超净工作台 苏州安泰空气技术有限公司;HZQ-X300C 恒温振荡器 上海一恒科学仪器有限公司;LHS-800C 生化恒温培养箱 上海力辰仪器科技有限公司;JIDI-20R 冷冻离心机广州吉迪仪器有限公司。
1.2 实验方法
1.2.1 最小抑菌浓度(Minimal Inhibitory Concentration,MIC)的测定 采用琼脂稀释法检测PLA 对Lm 菌株的MIC 值[18]。以无菌去离子水为溶剂配制为20 mg/mL 的PLA 母液。配制含有不同浓度PLA(终浓度分别为0、2、4、6 和8 mg/mL)的BHI 平板,取1 μL(稀释比例为1:5)稀释后的菌液接种至BHI平板,37 ℃培养2 d。
1.2.2 PLA 对Lm 生物被膜形成的影响
1.2.2.1 结晶紫法 采用结晶紫染色法测定PLA 对8 株菌生物被膜形成的影响[19]。挑取单个菌落接种于BHI 液体培养基中过夜培养。将过夜培养物按1%的比例加入培养基中,然后加入PLA(终浓度分别为1/10MIC、1/8MIC 和1/4MIC,不添加PLA 作为对照),37 ℃分别孵育1、2、3 d。孵育结束后,用无菌PBS 洗涤3 次以去除浮游细菌。生物被膜经草酸铵结晶紫染色和95%的乙醇脱色后,用酶标仪检测OD595nm,并置于倒置显微镜下拍照观察。
1.2.2.2 FE-SEM 观察Lm 生物被膜 本研究选择菌株10403S 进行FE-SEM 观察生物被膜结构及生物被膜胞外多聚物含量检测的研究。在微孔板中培养菌株10403S 生物被膜2 d 后,小心去除孔中的液体,使用无菌的PBS 缓冲液冲洗3 遍。在每个孔中加入4%戊二醛,充分混匀后4 ℃静置9 h,再用PBS 缓冲液洗涤3 次。乙醇依次以30%、50%、70%、85%、90%和100%的梯度脱水3 次,每次脱水10 min。晾干后用100%叔丁醇置换100%乙醇3 次,每次10 min。将菌体干燥后利用离子喷溅射镀膜仪在样品表面镀100-120 A 的金膜,放置观察室中进行观察[20]。
1.2.2.3 PLA 对Lm 生物被膜胞外多聚物形成的影响 根据Dai 等[21]的方法提取菌株10403S 生物被膜胞外多聚物。分别采用苯酚硫酸法[22]、福林酚法[23]和二苯胺法[24]测定胞外多聚物中胞外多糖、胞外蛋白和胞外DNA 的含量。葡萄糖、蛋白质和DNA 的标曲方程及相关系数分别为y=11.65x+0.0698(R2=0.9984),y=29.229x+0.0441(R2=0.9966),y=0.004+0.0291(R2=0.9902)。
1923年7月,蔡元培偕夫人周养浩(1892—1975)和子女再度赴欧洲学习考察,先居住于比利时布鲁塞尔,次年1月移居法国。1924年8月,蔡元培自法国赴荷兰、瑞典参加一个关于哥伦布未发现新大陆之前美国民族问题的国际民族学会议,巧遇但采尔。此时,但采尔已从莱比锡大学博士毕业,在汉堡大学做教授。
1.2.3 PLA 对Lm 成熟生物被膜的影响
1.2.3.1 结晶紫法 根据Zhou 等[25]的方法制备成熟生物被膜。将8 株Lm 接种到BHI 培养基中,在96 孔板中培养2 d 以形成成熟的生物被膜,用无菌PBS 冲洗生物被膜,然后分别添加不同浓度的PLA(0、1/2MIC、MIC、2MIC),孵育1 h,用PBS 洗涤后用草酸铵结晶紫染色和95%的乙醇脱色后,用酶标仪检测OD595nm,并置于倒置显微镜下拍照观察。
1.2.3.2 FE-SEM 观察生物被膜 将菌株10403S 生物被膜培养2 d 后分别添加0、1/2MIC、MIC、2MIC的PLA,孵育1 h 后用无菌PBS 洗3 遍,然后加入4%戊二醛固定,后续方法同1.2.2.2。
1.2.3.3 PLA 对Lm 成熟生物被膜胞外多聚物的影响 将菌株10403S 生物被膜培养2 d 后分别添加0、1/2MIC、MIC、2MIC 的PLA,孵育1 h,后续按照1.2.2.3 的方法测定胞外多聚物含量。
1.2.4 PLA 对Lm 运动性的影响 含有0.3%琼脂的TSB 平板用于游泳运动性的检测,含有0.5%琼脂的TSB 平板用于群集运动性的检测[26]。在TSB平板中加入不同浓度的PLA(1/10MIC、1/8MIC、1/4MIC)以调查PLA 对Lm 菌株10403S 运动性的影响。取1 μL 菌液点接至培养皿中心,25 ℃培养2 d。使用游标卡尺测量菌圈直径,并计算抑制率。
1.2.5 PLA 对Lm 生物被膜相关基因转录水平的影响 将菌株10403S 菌液(OD600nm约为0.2)分为两组,一组不加任何药物作为对照组,另一组加入3 mg/mL的PLA 作为实验组,继续培养30 min。按照细菌RNA 提取试剂盒的使用说明提取细菌总RNA,利用超微量分光光度计测定RNA 的浓度和纯度。将总RNA 反转录为cDNA,以cDNA 作为模板,使用RealMaster Mix(SYBR Green)试剂盒进行实时荧光定量PCR 检测。以16S rRNA 为内参基因,采用2-ΔΔCT法进行基因转录水平的分析。目的基因在实验组中的转录水平与其在对照组中的转录水平的比值即为该基因的相对转录水平。所需引物参考文献[27]设计,如表2 所示。
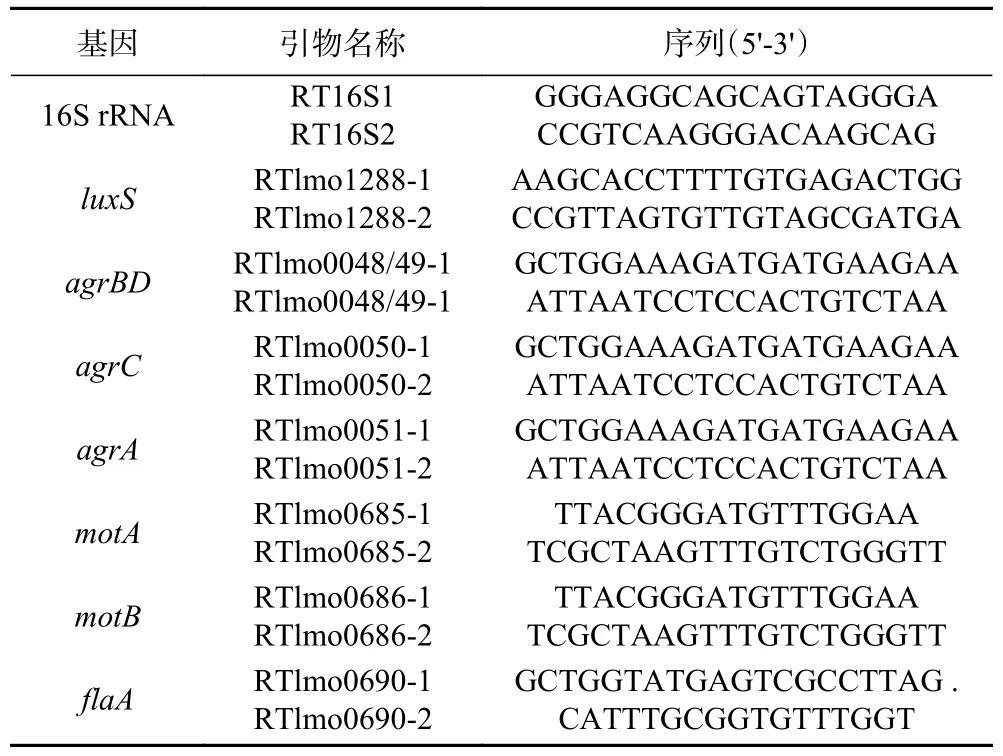
表2 本研究中使用的引物Table 2 Primers used in this study
1.3 数据处理
所有样品均设置3 个平行,处理后的数据以平均值±标准差表示。利用GraphPad Prism8 软件对所得的实验数据进行双尾t检验分析(与对照组相比,*代表P<0.05,**代表P<0.01,***代表P<0.001)。PLA对Lm 生物被膜的抑制率和清除率、胞外多聚物的抑制率和清除率及运动性的抑制率计算公式如下:
式中A0:未经PLA 处理组;A1:PLA 处理组。
2 结果与分析
2.1 PLA 对Lm 生物被膜形成的抑制
测得PLA 对所有受试菌株的MIC 值均为6 mg/mL。如图1 所示:8 株Lm 菌株均能在实验条件下形成生物被膜,但不同菌株的被膜形成能力存在差异,这可能是由于菌株自身特性不同造成的。在亚抑制浓度(低于MIC 的药物浓度)PLA 的作用下,8 株Lm 形成生物被膜的能力受到不同程度的抑制。其中,菌株10403S 为Lm 标准菌株,具有较强的生物被膜形成能力,且PLA 对其生物被膜的抑制效果较好,因此选择菌株10403S 进行后续的FESEM 观察生物被膜结构及胞外多聚物含量检测。当培养2 d 时,1/10 MIC、1/8MIC 和1/4MIC 的PLA对菌株10403S 生物被膜的抑制率分别为45.07%、64.12%和70.32%。结果表明,亚抑制浓度PLA 呈浓度依赖性抑制Lm 生物被膜的形成。
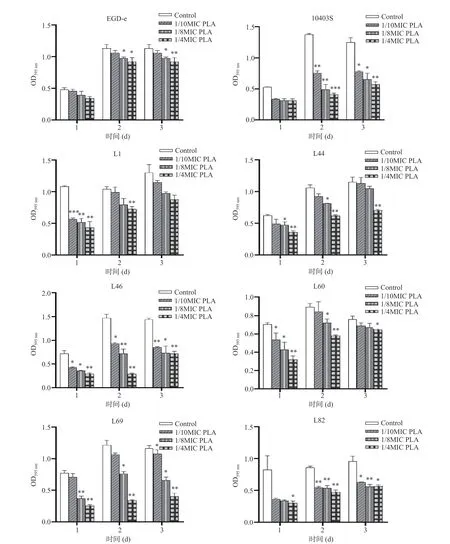
图1 PLA 对Lm 菌株生物被膜形成能力的影响Fig.1 Effects of PLA on the ability to form biofilms of L. monocytogenes strains
利用倒置显微镜观察不同浓度PLA 对Lm 菌株10403S 生物被膜形态的影响。经过2 d 的培养,对照组形成均匀且致密的生物被膜,见图2a。加入PLA 后,菌株形成的生物被膜变得疏松,见图2b~图2d。由FE-SEM 结果可知,未经PLA 处理的菌株10403S 菌株细胞形态完好,大量细胞聚集成团,丰富的胞外聚合物将细菌包裹起来,见图2e。经1/10MIC 和1/8MIC 的PLA 处理后,粘附的细胞减少,胞外多聚物也减少,见图2f~图2g。经1/4MIC的PLA 处理后,粘附的细胞进一步减少,同时能观察到破损的细胞,见图2h。这可能是由于生物被膜中的细胞失去胞外聚合物的保护后直接受到PLA 的作用,导致细胞结构被破坏、细胞壁破裂。

图2 倒置显微镜和扫描电镜下的Lm 菌株10403S 生物被膜Fig.2 Biofilm of strain L. monocytogenes 10403S under inverted microscope and scanning electron microscope
由图3 可知,经1/10 MIC、1/8MIC 和1/4MIC 的PLA 处理后,生物被膜中胞外多糖的含量显著降低(P<0.05)。胞外蛋白仅1/4MIC 组与对照组有统计学差异,而胞外DNA 的含量在1/8MIC 和1/4MIC两个浓度下均与对照组有统计学差异(P<0.05)。
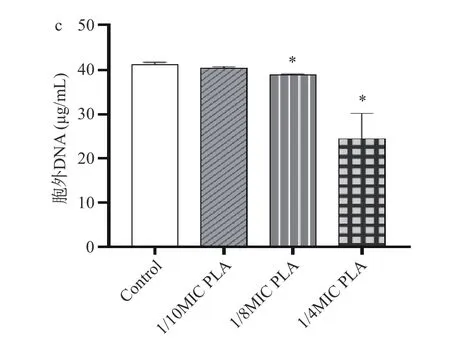
图3 PLA 对生物被膜中胞外多糖(a)、胞外蛋白(b)和胞外DNA(c)含量的影响Fig.3 Effects of PLA on the content of extracellular polysaccharides (a), extracellular proteins (b) and extracellular DNA (c) in biofilms
胞外聚合物主要由胞外多糖、胞外蛋白质和胞外DNA 组成,是生物被膜的重要组成部分,在生物被膜中起稳定结构和保护的作用[28]。胞外聚合物的成分和比例在不同种细菌中存在很大差异。大多数细菌生物被膜的胞外聚合物中占比最高的是胞外多糖[29]。而在Lm 生物被膜的胞外聚合物中胞外蛋白的含量最高,其次是胞外DNA 和胞外多糖[6]。研究表明,胞外蛋白和胞外DNA 在Lm 的初始粘附和生物被膜形成的早期阶段发挥重要作用[30]。本研究中,亚抑菌浓度PLA 能够抑制Lm 生物被膜的形成,进一步研究发现Lm 生物被膜中胞外多糖和胞外蛋白含量降低。以上证据表明,亚抑制浓度的 PLA 可以通过减少胞外多糖和细胞外蛋白的分泌来抑制Lm 生物被膜的形成。
2.2 PLA 对Lm 成熟生物被膜的清除
由图4 可知,Lm 成熟生物被膜经1/2MIC、MIC和2MIC 的PLA 处理后,生物被膜量均减少,其中菌株10403S 和L1 的生物被膜量显著减少(P<0.05)。1/2 MIC、MIC 和2MIC 的PLA 对菌株10403S 生物被膜的清除率分别为24.03%、39.56%和61.32%。相同的作用时间,PLA 的浓度越高,菌株的生物被膜越少,即PLA 对Lm 菌株生物被膜的清除作用呈浓度依赖性。
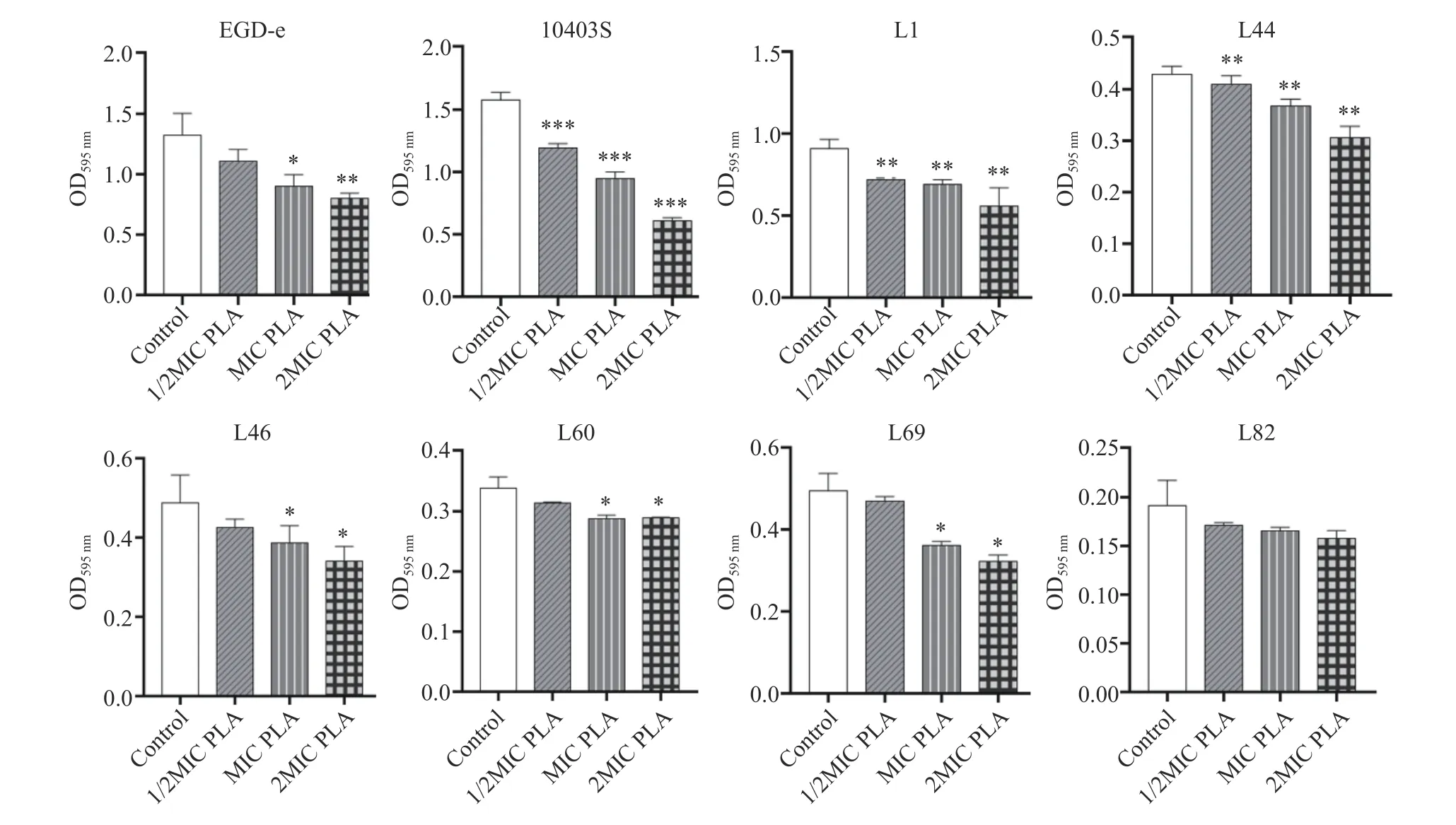
图4 PLA 对Lm 成熟生物被膜的影响Fig.4 Effects of PLA on the mature biofilms of L. monocytogenes
倒置显微镜观察结果显示,与对照相比(图5a),PLA 处理组的生物被膜更加疏松(图5b~图5d)。FE-SEM 结果显示,PLA 处理后,Lm 粘附细胞变少,细胞出现皱缩和塌陷,当PLA 浓度为2MIC 时,这种变化更加明显,甚至能够观察到细胞内容物的外泄(图5f~图5g)。

图5 倒置显微镜和扫描电镜下的Lm 菌株10403S 成熟生物被膜Fig.5 Mature biofilm of strain L. monocytogenes 10403S under inverted microscope and scanning electron microscope
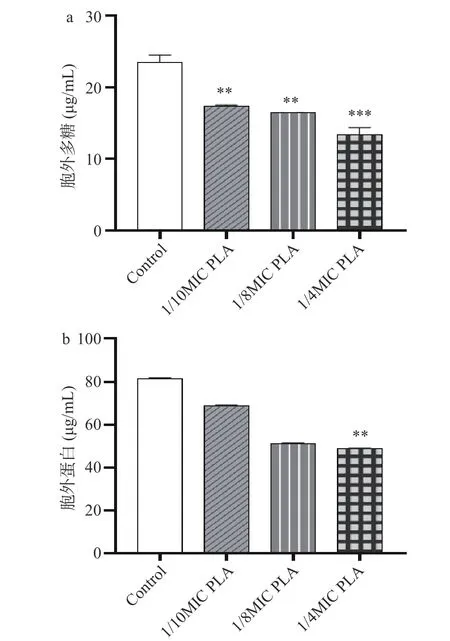
如图6 所示,经MIC 和2MIC 的PLA 处理后,成熟生物被膜中胞外多糖的含量显著降低,分别降低了81.6%和95.3%(P<0.05)。与对照相比,PLA 作用下成熟生物被膜中胞外蛋白的含量明显降低。PLA 处理对成熟生物被膜中胞外DNA 的含量没有产生明显影响(P>0.05)。
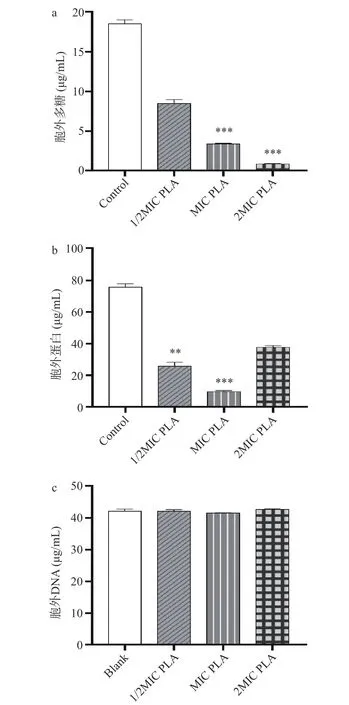
图6 PLA 对成熟生物被膜中胞外多糖(a)、胞外蛋白(b)和胞外DNA(c)含量的影响Fig.6 Effects of PLA on the content of extracellular polysaccharides (a), extracellular proteins (b) and extracellular DNA (c) in mature biofilms
成熟生物被膜对抗菌物质的抵抗力很强,难以清除。本研究结果显示Lm 成熟生物被膜经PLA 处理后生物被膜生物量降低,表明PLA 对Lm 成熟生物被膜具有清除作用。PLA 处理后,Lm 生物被膜中胞外多糖的含量急剧下降。当PLA 的浓度为1/2MIC时,胞外多糖含量减少超过一半;当PLA 的浓度为2MIC 时,几乎所有的胞外多糖被破坏。PLA 处理后,Lm 生物被膜中胞外蛋白的含量也明显降低。值得注意的是,2MIC 的PLA 作用后胞外蛋白的含量高于1/2MIC 和MIC 处理组。这可能是由于在2MIC PLA 作用下Lm 细胞被破坏,细胞内蛋白质泄漏所致。这些结果表明PLA 可以通过作用于胞外多糖和胞外蛋白来破坏Lm 的生物被膜结构。
2.3 PLA 对Lm 运动性的影响
如图7 所示,亚抑菌浓度PLA 作用下Lm 菌株10403S 形成的运动圈直径减小。如表3 所示,在1/10 MIC、1/8 MIC 和1/4 MIC 的PLA 作用下菌株游泳运动性的抑制率分别为31.68%、36.29%和55.68%;群集运动性的抑制率分别为57.94%、62.40%、68.90%。由此可见PLA 对Lm 的运动性有较好的抑制效果。
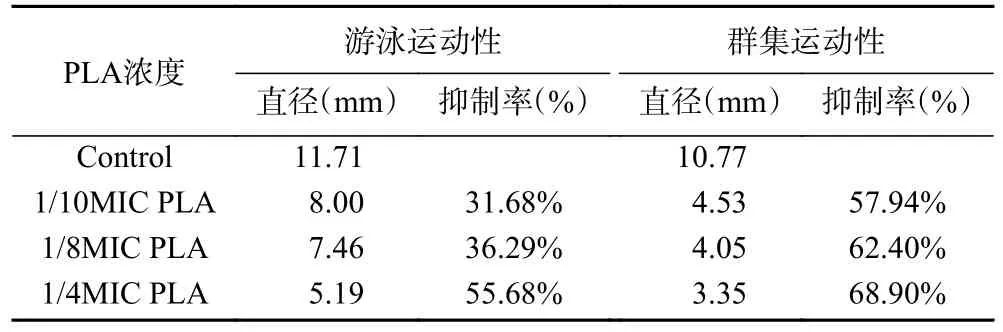
表3 PLA 对Lm 运动性的抑制Table 3 Inhibition of PLA on motility of L. monocytogenes
大量文献表明,鞭毛介导的运动性在细菌生物被膜形成中发挥重要作用[31]。鞭毛介导的运动性可以使细菌向有营养物质存在的表面游动同时克服表面张力达到物体表面,从而促进生物被膜的形成。鞭毛介导的运动性可分为游泳运动性和群集运动性,前者是细菌的个体运动,而后者可以协调细菌在固体表面的运动,因此群集运动性与细菌生物被膜的形成关系更密切[32]。本研究表明PLA 能够抑制Lm 的群集运动性,这可能也进一步导致了Lm 生物被膜形成能力的降低。
2.4 PLA 作用下Lm 生物被膜相关基因的转录水平
采用qRT-PCR 研究PLA 对鞭毛介导运动性的相关基因(motA、motB和flaA)和群体感应相关基因(luxS、agrBD、agrC和agrA)转录水平的影响(图8)。在PLA 的作用下,agr操纵子所有基因的转录水平均显著下降(P<0.01);其余基因的转录水平没有明显变化:luxS和motB的转录水平分别为1.42 和1.36倍(P>0.05);motA和flaA的转录水平分别为0.69 倍和0.93 倍(P>0.05)。
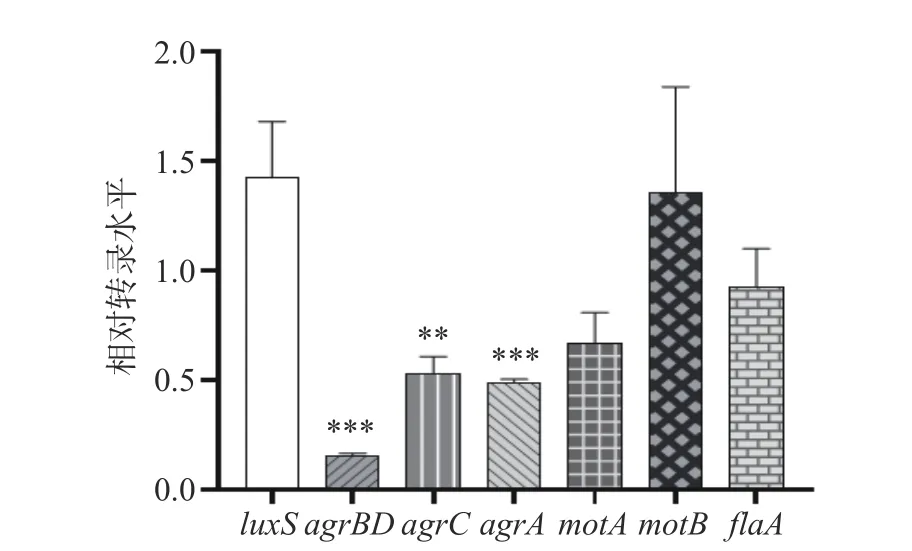
图8 PLA 作用下Lm 生物被膜相关基因的转录水平Fig.8 Transcriptional levels of genes associated with biofilms of L. monocytogenes in the presence of PLA
群体感应是细菌通过自身产生的信号分子进行信息交流和协调群体行为的过程。群体感应系统在调控细菌生物被膜形成过程中发挥至关重要的作用,利用群体感应抑制剂干扰群体感应系统成为控制细菌生物被膜危害的有效策略。目前研究者已在Lm 中发现两个群体感应系统,即LuxS 和Agr 系统。前人研究证实luxS负调控Lm 生物被膜的形成[33]。Agr 系统是由agrBDCA四个基因组成的操纵子,agr基因的缺失导致Lm 生物被膜形成能力降低,即Lm 生物被膜的形成受Agr 系统正调控[34]。PLA 作用下luxS的转录水平没有明显变化,而agr系统所有基因的转录水平均显著降低,表明PLA 可能是Agr 群体感应系统的抑制剂。PLA 作用下flaA、motA和motB的转录水平没有明显变化,推测PLA可能通过抑制其他运动相关基因来抑制Lm 的运动性。
3 结论
本论文主要研究PLA 对Lm 生物被膜的影响及其作用机制。结果表明,PLA 不仅能有效抑制Lm 生物被膜的形成,对成熟生物被膜也表现出良好的清除效果。在PLA 的作用下,生物被膜胞外多糖和胞外蛋白的分泌量减少,同时Lm 运动性及agr群体感应系统的转录水平也明显受到抑制。本研究为PLA 在控制Lm 及其生物被膜方面的应用奠定理论基础。作为一种天然抗菌物质,PLA 在控制Lm 及其生物被膜方面具有潜在应用价值。
