鲟鱼表皮粘液抗菌肽的分离鉴定及抑菌活性分析
2023-09-10段晓琳汪金林姜晓明徐新星张绪清赵元晖
段晓琳,樊 燕,汪金林,姜晓明,徐新星,张绪清,刘 荔,刘 康, ,赵元晖,
(1.中国海洋大学食品科学与工程学院,山东青岛 266003;2.衢州鲟龙水产食品科技开发有限公司,浙江衢州 324002;3.连云港海娃食品有限公司,江苏连云港 222000)
鱼类富含水分、蛋白质、不饱和脂肪酸等营养物质,适宜微生物生长,极易腐败变质。微生物及其代谢产生的蛋白酶、脂酶等在鱼类产品的贮藏过程中共同作用,分解蛋白质、脂质等营养物质,改变肌肉质构特性及营养组成,导致品质劣变[1]。抗生素是抑制微生物繁殖的重要手段。然而随着抗生素的滥用和对耐药细菌缺乏有效的治疗策略,多重耐药菌的出现引发全球关注[2]。耐药菌目前已在土壤、河流、农场附近被发现,并可能在大气中及沿着环境-食物-人类链传播,危害生态环境及人类健康[3-4]。目前天然保鲜剂因兼具高效性及安全性在市场上具有更广泛的需求,但还存在一定的不足,如壳聚糖等自身带有颜色、气味或酸碱性,影响水产品品质[5-6]。因此寻找安全高效的天然保鲜剂对水产品保鲜具有重要意义[7]。
在过去的20 年中,抗菌肽被确定为新型抗菌药物的潜在来源,并因其低耐药性和高功能性而被视为传统抗生素的最佳替代品[8]。抗菌肽是由生物体特定基因编码并且经过外界诱导产生的普遍存在于动植物和微生物中的具有抑菌活性的小分子多肽。鱼类在受到病原微生物的侵害时,粘膜表面会分泌抗菌肽等物质以作为防御和杀伤病原微生物的非特异性免疫因子[9]。迄今为止,许多研究人员已经成功地从鱼粘液中提取了抗菌肽:Go 等[10]从河豚粘液中纯化了由23 个氨基酸组成的新型抗菌肽TpHAMP2,Su[11]从黄鲶鱼的粘液中获得了线性抗菌肽Pelteobagrin。然而,关于鲟鱼粘液中抗菌肽的提取及应用的研究相对较少,目前仅有对粘液中凝集素等混合物抑菌活性的研究,且抑菌机制尚不清楚[12]。
中国是世界上鲟鱼养殖产量最大的国家,鲟鱼作为一种常见的生物资源,具有极高的经济价值和科学研究价值[13]。目前,除了主要产品鱼子酱外,其鱼肉、鱼骨和鱼皮已广泛用于生产胶原蛋白肽、硫酸软骨素等,而副产物粘液尚未得到有效利用[14-15]。本研究以鲟鱼表皮粘液为研究对象,研究了其基本组分及氨基酸组成,制备了表皮粘液抗菌肽粗提物,并应用于三文鱼保鲜;成功分离纯化并鉴定出两种新型抗菌肽,验证了其抑菌活性,旨在为水产品的加工贮藏和人类健康相关应用提供理论依据,也为低值化水产原料的高值化利用提供了新途径。
1 材料与方法
1.1 材料与仪器
养殖鲟鱼(sturgeon) 购自山东省青岛市城阳区水产零售交易批发市场,选取体重为(1.5±0.5)kg,平均体长为(65±10)cm,活鱼充氧保活运至实验室;鲜切三文鱼片 购自蓝吉道供应链集团有限公司;大肠杆菌、枯草芽孢杆菌、希瓦氏菌 中国海洋大学水产品高值化利用实验室保藏;乙腈、三氟乙酸(TFA)(色谱纯) 上海阿拉丁生化科技股份有限公司;盐酸、硫酸、硫酸铜、硫酸钾、苯酚、石油醚、柠檬酸、磷酸二氢钠、磷酸氢二钠、氢氧化钠、无水乙醇、甲基红指示剂、溴甲酚绿指示剂、乙酸钠、苯甲磺酰氟(PMSF)、LB 固体培养基、LB 液体培养基 国药集团化学试剂有限公司;柠檬酸钠、甘氨酸、Triton X-100 北京索莱宝科技有限公司;合成肽HSETLHDV、PLTDWQL(纯度>98%) 吉尔生化(上海)有限公司;实验所用其他化学试剂 均为国产分析纯。
AB135-S 型天平 瑞士梅特勒公司;GL-21M 型离心机 湘仪离心机仪器有限公司;Kjeltec 8100型全自动凯氏定氮仪、Soxtec8000 全自动脂肪测定仪 福斯分析仪器公司;UV-2550 型紫外可见光光度计 日本岛津公司;FDU-1200 型冷冻干燥机 上海爱郎仪器有限公司;DZF-6050 型真空干燥箱 上海海向仪器设备厂;L-8900 型氨基酸自动分析仪日本HITACHI 公司;SpectraMax i3x 型酶标仪 美谷分子仪器(上海)有限公司;WAT036905-Sep-Pak C18固相萃取柱、Q Exactive HF-X 质谱仪 美国ThermoFisher Scientific 公司;ÄKTA pure25 型蛋白纯化仪 美国通用电气医疗公司;Agilent 10 Prep-C18液相色谱柱 美国Agilent 公司;YXQ-75SII 型高压灭菌锅 上海博迅医疗生物仪器股份有限公司;SJ-CJ-2FDQ 型超净工作台 苏洁医疗器械(苏州)有限公司。
1.2 实验方法
1.2.1 鲟鱼表皮粘液的收集和预处理 参考晋高伟[16]的方法进行鲟鱼表皮粘液的收集和预处理。先以蒸馏水冲洗鲟鱼鱼体,再用塑料刮板轻刮鲟鱼的背部收集粘液。将收集的粘液离心(4000×g,10 min)后收集上清液,冻干后装入离心管中密封,-20 ℃保存备用。
1.2.2 鲟鱼表皮粘液基本成分分析 测定鲟鱼表皮粘液冻干粉的基本成分。蛋白质以GB/T 5009.5-2016 自动凯氏定氮仪法测定[16];脂肪以GB/T 5009.6-2016 酸水解法测定[17];总糖以苯酚硫酸法测定(y=0.063x+0.013,R2=0.9969)[18]。
1.2.3 氨基酸组成测定 参考GB 5009.124-2016,使用自动氨基酸分析仪测定鲟鱼表皮粘液冻干粉中氨基酸的含量及组成[19]。称取2 mg 冻干粉于水解管中,加入15 mL 6 mol/L 盐酸溶液(含0.5%巯基乙醇,v/v),充满氮气并密封,于110 ℃水解24 h。水解结束后冷却并过滤至50 mL 容量瓶中,定容至刻度,取1 mL 滤液于试管中,氮吹吹干。用2 mL 0.02 mol/L的盐酸溶液复溶,过0.22 μm 的膜后上机测定。
1.2.4 鲟鱼表皮粘液抗菌肽粗提物的制备 先以蒸馏水冲洗鲟鱼鱼体,再轻刮鲟鱼背部收集粘液于烧杯中。将收集的粘液立即与含0.2 mol/L 乙酸钠、0.2%Triton X-100 和1 mmol/L PMSF 的萃取液混合,0 ℃搅拌萃取24 h[16]。离心(4 ℃,8000×g,30 min)后收集上清液并冻干,得到鲟鱼表皮粘液抗菌肽粗提物,-20 ℃冻藏备用。
1.2.5 抗菌肽粗提物抑菌活性验证 根据牛津杯法验证抗菌肽粗提物的抑菌活性[20]。将1%生长至对数期的枯草芽孢杆菌接种于LB 固体培养基中,在培养皿中摆放牛津杯,在培养皿中倒入约15 mL 上述培养基,待培养基凝固后取出牛津杯。用无菌PBS复溶鲟鱼表皮粘液抗菌肽粗提物至质量浓度分别为50、100、200 mg/mL,将样液分别加入牛津杯孔中,以无菌PBS 缓冲液为阴性对照,盖上培养皿盖,28 ℃过夜培养,观察抑菌圈大小及形态。
1.2.6 抗菌肽粗提物在三文鱼保鲜中的应用
1.2.6.1 样品处理 取三文鱼背脊鱼肉,均匀切为约10 g/片的小片,用无菌水清洗并晾干[21]。将鱼片浸泡于质量浓度为50 mg/mL 的鲟鱼表皮粘液抗菌肽粗提物中10 min,对照组浸泡于无菌PBS 中。浸泡完毕后,将鱼片装入无菌袋中密封,放入4 ℃冰箱中保藏,分别在第0、3、6、9 d 取出并测定相关指标。
1.2.6.2 菌落总数测定 参考GB 4789.2-2016 测定不同保鲜时间下三文鱼菌落总数[22]。
1.2.6.3 挥发性盐基氮(TVB-N)测定 参考GB 5009.228-2016 测定不同保鲜时间下挥发性盐基氮含量[21]。
1.2.7 鲟鱼表皮粘液抗菌肽的分离纯化
1.2.7.1 固相萃取 无菌超纯水溶解抗菌肽粗提物冻干粉至质量浓度为10 mg/mL,用10 mL 含0.1%三氟乙酸(TFA)的80%乙腈(ACN)(缓冲液A)激活Sep-Pak C18(1 g,6 cc)柱体,15 mL 含0.1% TFA的水溶液(缓冲液B)清洗萃取柱。样品进样至固相萃取柱中,10 mL 缓冲液B 冲洗柱体去除杂质,再用10 mL 缓冲液A 洗脱抑菌成分,收集洗脱液并冻干备用。取部分用于测定冻干粉的抑菌活性。
1.2.7.2 凝胶过滤层析 无菌超纯水溶解有抑菌活性冻干粉至质量浓度为10 mg/mL,0.22 μm 滤膜过滤后进样至Sephacryl S-100 层析柱。流动相为超纯水,流速为0.5 mL/min,上样体积500 μL/次。上样前用流动相缓冲液平衡层析柱2 倍柱体积。上样后,在220 nm 下收集各吸收峰并冻干备用。取部分用于测定冻干粉的抑菌活性。
1.2.7.3 反相高效液相色谱 无菌超纯水重新溶解具有抑菌活性冻干组分至质量浓度为1 mg/mL,并用0.22 μm 滤膜过滤后进样至液相色谱。洗脱液为含0.1% TFA 的水溶液(流动相A)和含0.1% TFA的ACN(流动相B)。在10 min 内洗脱(20 mL/min),采用(流动相A:流动相B=1:9)的比例等度洗脱,柱温25 ℃,进样体积900 μL。在220 nm 下收集各吸收峰并冻干备用,取部分用于测定冻干粉的抑菌活性。
1.2.8 抑菌活性测定 牛津杯法:同1.2.5。
平板计数法[23]:在已灭菌的2 mL 离心管中加入10 μL 生长至对数期的枯草芽孢杆菌或大肠杆菌菌液和990 μL PBS 缓冲液,混匀后取50 μL 菌液与溶解的液相色谱纯化后抗菌肽冻干粉1:1(v/v)混合。作用1 h 后,取20 μL 混合液加入到980 μL PBS缓冲液中,混匀后从中取20 μL 溶液充分涂板于PCA 培养基中,以无菌PBS 缓冲液作为阴性对照。将PCA 培养基倒置放于28 ℃培养箱中培养12 h,结束后对菌落进行计数。
1.2.9 鲟鱼表皮粘液抗菌肽结构鉴定 采用LCMS/MS 液质联用设备对分离纯化所得抗菌肽进行鉴定。HPLC 条件:流动相A 液组成为100%质谱水、0.1%甲酸;流动相B 液组成为80%乙腈、0.1%甲酸;流速600 nL/min,上样量3 μL;洗脱条件如表1 所示。

表1 液相色谱洗脱条件Table 1 Conditions of LC elution
质谱条件:采用Orbitrap Exploris 480 质谱仪,Nanospray Flex™(NSI)离子源,设定离子喷雾电压为2.2 kV,离子传输管温度为320 ℃。质谱采用数据依赖型采集模式,质谱全扫描范围为m/z 350~1200,一级质谱分辨率设为60000(200 m/z),AGC为Custom,最大注入时间为50 ms;二级质谱分辨率设为15000(110 m/z),AGC 为Custom,最大注入时间为22 ms,肽段碎裂碰撞能量设为30%。
1.2.10 合成肽样品纯度分析 实验所用多肽HSETLHDV 和PLTDWQL 由吉尔生化(上海)有限公司人工合成制得。通过高效液相色谱C18柱对多肽样品的纯度进行了测定。称取200 μg 多肽样品,溶于200 μL 超纯水,经0.22 μm 滤膜过滤后装至液相瓶中。流动相A 为体积分数0.1%的TFA 水溶液,流动相B 为体积分数0.1%的TFA 乙腈溶液。设置流速为0.5 mL/min,进样量为20 μL,波长为210~400 nm,时间50 min。通过质谱仪对多肽分子量进行了测定[24]。配制浓度为1 mg/mL 的多肽溶液,取1 μL 多肽溶液与饱和的4-羟基-α-氰基肉桂酸(HCCA)溶液1:1(v/v)混合,将混合溶液滴于基板上,置于通风橱中自然风干,后将基板放入质谱仪中进行分析。
1.2.11 合成抗菌肽的抑菌活性验证 纸片法[25]:在无菌培养皿中倒入约15 mL LB 固体培养基,待培养基冷却后取50 μL 生长至对数期的希瓦氏菌均匀涂布于培养基上。用无菌镊子将已灭菌的滤纸片分别浸入浓度为256 μmol/L 的两条合成肽溶液中,无菌PBS 为阴性对照,将滤纸片间隔一定距离贴在平板中。将平板倒置于28℃培养箱中,24 h 后观察抑菌效果。
1.3 数据处理
以上所测数据均为设置了三次平行实验的结果,以平均值±标准差方式呈现。多肽疏水性数值由强耀生物(http://www.chinapeptides.net/tool.aspx)提供技术支持。采用SPSS 25.0 统计软件分别对数据进行处理与分析,Origin 9.0 软件作图。
2 结果与分析
2.1 鲟鱼表皮粘液冻干粉组成
如表2 所示,对鲟鱼表皮粘液冻干粉的基本组成进行分析可知,其蛋白质含量为47.44%±0.59%,脂肪含量为3.68%±0.28%,总糖含量为5.21%±0.92%。结果表明,鲟鱼表皮粘液冻干粉中蛋白质含量丰富,这与韩庆等[26]对于洞庭湖鲶鱼体表黏液营养成分分析结果一致。粘液的组分构成与其抑菌功能密切相关[12]。粘液是鱼类抵御外界病原微生物的第一道屏障,含有大量抑菌蛋白类物质如抗菌肽、溶菌酶、凝集素等[27-29]。鲟鱼粘液中的大量蛋白质为后续提取抗菌肽提供了有效的来源。

表2 鲟鱼表皮粘液冻干粉的组成(%)Table 2 Composition of lyophilized sturgeon epidermal mucus powder (%)
2.2 鲟鱼表皮粘液冻干粉氨基酸组成
对鲟鱼表皮粘液冻干粉酸水解后,通过氨基酸自动分析仪对氨基酸组成进行分析,结果如图1 和表3 所示。粘液冻干粉中含有16 种氨基酸,总量达459.68 mg/g。粘液中赖氨酸、精氨酸、组氨酸三种带正电荷氨基酸含量较高,占总氨基酸含量的15.82%,高于其在洞庭湖鲶鱼体表黏液中的含量(10.32%),后者被证明是一种可靠的抗菌肽来源[16,26]。疏水性氨基酸苯丙氨酸、缬氨酸、亮氨酸、异亮氨酸、丙氨酸和蛋氨酸的含量也较高,占总氨基酸含量的34.61%,高于其在鲶鱼体表粘液中的含量(26.60%)及其在罗非鱼副产物抗菌肽中的含量(27.43%)[26,30]。带正电荷氨基酸与疏水性氨基酸含量高有利于抗菌肽通过静电和疏水作用与细菌细胞膜结合并穿越细胞膜磷脂双分子层,破坏细胞膜正常结构及选择透过功能,促使细菌死亡,发挥抑菌作用[31-34]。因此,鲟鱼表皮粘液中高含量的带正电荷氨基酸及疏水氨基酸为进一步提取粘液抗菌肽,发挥潜在抑菌活性提供了物质基础,为抵抗病原微生物的侵害提供了坚实保障。

图1 氨基酸分析色谱图Fig.1 Chromatogram of amino acid analysis

表3 鲟鱼表皮粘液冻干粉氨基酸组成Table 3 Amino acid composition of lyophilized sturgeon epidermal mucus powder
2.3 鲟鱼表皮粘液抗菌肽粗提物抑菌活性验证
通过枯草芽孢杆菌验证鲟鱼表皮粘液抗菌肽粗提物的抑菌活性,结果如图2 所示。在50、100、200 mg/mL 的浓度梯度下,抗菌肽粗提物对枯草芽孢杆菌均表现了明显抑菌圈,且抑菌圈直径随抗菌肽粗提物质量浓度提高而扩大,呈浓度依赖性。这表明抗菌肽粗提物具有高效抑菌活性,也验证了抗菌肽粗提物中确含有抑菌活性物质,为粗提物的应用及抗菌肽的纯化奠定了基础。

图2 鲟鱼表皮粘液抗菌肽粗提物抑菌活性Fig.2 Antimicrobial activity of crude extract of antimicrobial peptide from sturgeon epidermal mucus
2.4 鲟鱼表皮粘液抗菌肽粗提物对三文鱼的保鲜效果
4 ℃贮藏条件下,鲟鱼表皮粘液抗菌肽粗提物对三文鱼菌落总数及挥发性盐基氮(TVB-N)的影响如图3 所示。如图3a 所示,无处理组及鲟鱼表皮粘液抗菌肽粗提物处理组三文鱼菌落总数均随贮藏时间的延长而升高。无处理组三文鱼菌落总数从初始的3.89 lg CFU/g 显著增加至贮藏结束时的8.32 lg CFU/g,其中贮藏第6 d 菌落总数已超过ICMSF 1986 规定的食品微生物限量值(7.0 lg CFU/g);而抗菌肽粗提物处理组三文鱼菌落总数由第0 d 的4.02 lg CFU/g,缓慢增加至第9 d 的5.51 lg CFU/g,在贮藏结束时仍未超过食品微生物限量值。如图3b 所示,无处理组及鲟鱼表皮粘液抗菌肽粗提物处理组三文鱼TVBN 值均随贮藏时间的延长而升高。GB/T 18108-2019《鲜海水鱼通则》规定,海水鱼优级品为TVBN≤15 mg/100 g,合格品为15~30 mg/100 g。第0 d新鲜三文鱼片的TVB-N 值为7.02±0.04 mg/100 g,属优级品范围;第3 d 无处理组TVB-N 值为16.41±0.09 mg/100 g,属合格品范围,抗菌肽粗提物处理组TVB-N 值为7.24±0.03 mg/100 g,仍属优级品范围;第9 d 无处理组TVB-N 值为36.39±0.04 mg/100 g,超出了合格品限值,而抗菌肽粗提物处理组TVBN 值为18.37±0.05 mg/100 g,远低于无处理组,稍超优级品范围。这表明了鲟鱼表皮粘液抗菌肽粗提物能够有效抑制三文鱼贮藏期间微生物生长及对蛋白质的分解作用,延缓三文鱼变质,延长货架期。

图3 抗菌肽粗提物对三文鱼菌落总数(a)和挥发性盐基氮(b)的影响Fig.3 Effects of crude extract of antimicrobial peptide on total colony count (a) and volatile basic nitrogen (b) of salmon
2.5 分离纯化后抗菌肽抑菌活性
鲟鱼表皮粘液抗菌肽的分离纯化分为固相萃取、凝胶层析和反相高效液相色谱三个步骤,每步纯化后的抑菌活性测定结果如图4 所示。如图4a 所示,经过固相萃取及凝胶过滤层析后,抗菌肽仍保留明显抑菌圈,表明纯化过程中均保留了抗菌肽抑菌活性。凝胶过滤层析后抑菌圈直径略有缩小,这是因为固相萃取后抗菌肽中含有具有抑菌作用的溶菌酶或大分子蛋白在凝胶过滤层析后被去除[16]。反相液相色谱纯化后抗菌肽抑菌活性如图4b 所示,为了更加直观准确地得到抑菌率,使用平板计数法验证抑菌活性,液相色谱纯化后最高抑菌活性组分对枯草芽孢杆菌的抑菌率达92.40%±4.50%,对大肠杆菌的抑菌率为75.43%±5.02%。这表明,分离纯化后的抗菌肽对革兰氏阳性菌枯草芽孢杆菌及革兰氏阴性菌大肠杆菌的生长均有明显的抑制作用,对枯草芽孢杆菌的抑制性最佳。

图4 鲟鱼表皮粘液抗菌肽固相萃取及凝胶过滤层析(a)和反相液相色谱(b)纯化后的抑菌活性Fig.4 Antimicrobial activities of antimicrobial peptides of sturgeon epidermal mucus purified by solid phase extraction and gel filtration chromatography (a) and reverse phase high performance liquid chromatography (b)
2.6 鲟鱼表皮粘液抗菌肽结构鉴定
本实验采用LC-MS/MS 测定氨基酸序列,得到两条新型抗菌肽HSETLHDV 和PLTDWQL,二级质谱见图5。HSETLHDV 的氨基酸序列为组氨酸-丝氨酸-谷氨酸-苏氨酸-亮氨酸-组氨酸-天冬氨酸-缬氨酸,命名为HV-8。HV-8 的主要碎片离子包括b2+(225.10)、y3+(370.17)、b4+(455.19)、b5+(568.27)、b6+(705.33)、y7+(800.37)。PLTDWQL 的氨基酸序列为脯氨酸-亮氨酸-苏氨酸-天冬氨酸-色氨酸-谷胱酰胺-亮氨酸,命名为PL-7。PL-7 的主要碎片离子包括b2+(211.14)、y2+(260.17)、b3+(312.19)、y3+(446.24)、y4+(561.26)、b5+(613.29)、y5+(662.31)、b6+(741.37)、y6+(775.39)。
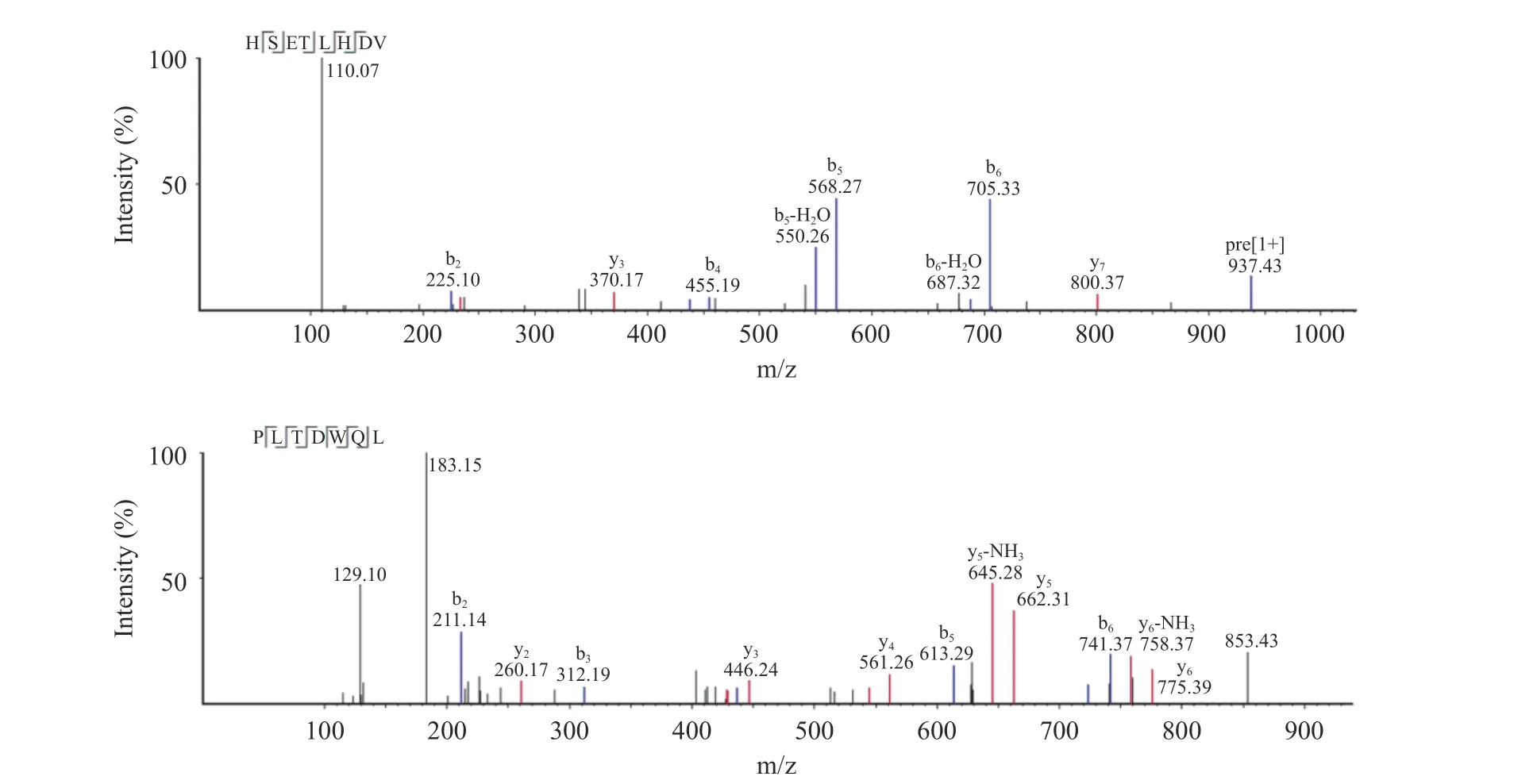
图5 抗菌肽二级质谱Fig.5 MS/MS of antimicrobial peptides
2.7 人工合成抗菌肽
如图6 所示,使用液相色谱法验证人工合成抗菌肽纯度,两条肽分别均只有单峰出现,且通过积分峰面积计算得出两条多肽纯度均大于98%,可用于下一步实验分析。一级质谱分析结果表示,HV-8 的[M+2H]2+的理论分子量为469.48 Da,实际分子量为469.4 Da,PL-7 的[M+H]+理论分子量为872.97 Da,实际分子量为872.70 Da,两条肽的理论分子量与实验所得数据一致,表明合成肽确为目标多肽分子。
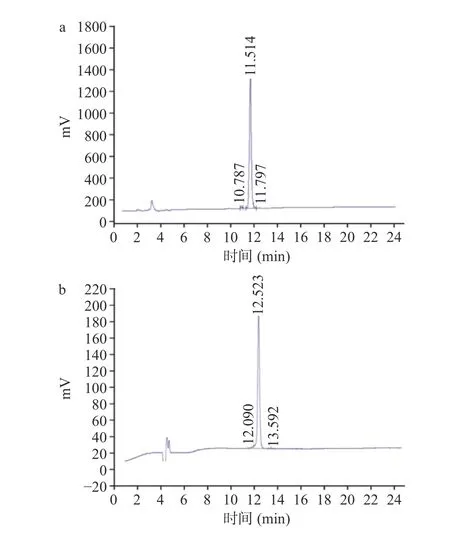
图6 HV-8(a)与PL-7(b)多肽反相高效液相色谱图Fig.6 RP-HPLC of HV-8 (a) and PL-7 (b) peptides
2.8 合成抗菌肽抑菌活性验证
通过纸片法验证了两条新型抗菌肽对枯草芽孢杆菌、大肠杆菌、希瓦氏菌的抑制活性,结果如表4所示。HV-8 和PL-7 对三种受试菌株均表现了明显抑菌圈。其中,在对希瓦氏菌生长的抑制实验中,HV-8 抑菌圈直径更大,抑菌活性更高。抗菌肽抑菌活性与其结构密切相关,带正电荷氨基酸有助于抗菌肽与细胞膜通过静电吸引相互靠近,与细胞膜上带负电荷脂多糖的磷酸基团发生作用,破坏细胞膜结构,促进细胞死亡;疏水性氨基酸可与细菌细胞膜之间通过疏水相互作用导致细菌细胞膜脂多糖和磷脂大量释放,改变细菌细胞膜通透性,使细菌死亡[35-37]。HV-8 和PL-7 的结构如图7 所示,HV-8 疏水性为62%,PL-7 疏水性达71%,二者均具有较高疏水性,可能通过疏水作用促进细菌死亡[38]。同时HV-8 含有2 个带正电的组氨酸,可通过静电作用、疏水作用协同增效抑菌,这可能是其具有更佳抑菌效果的原因[39]。
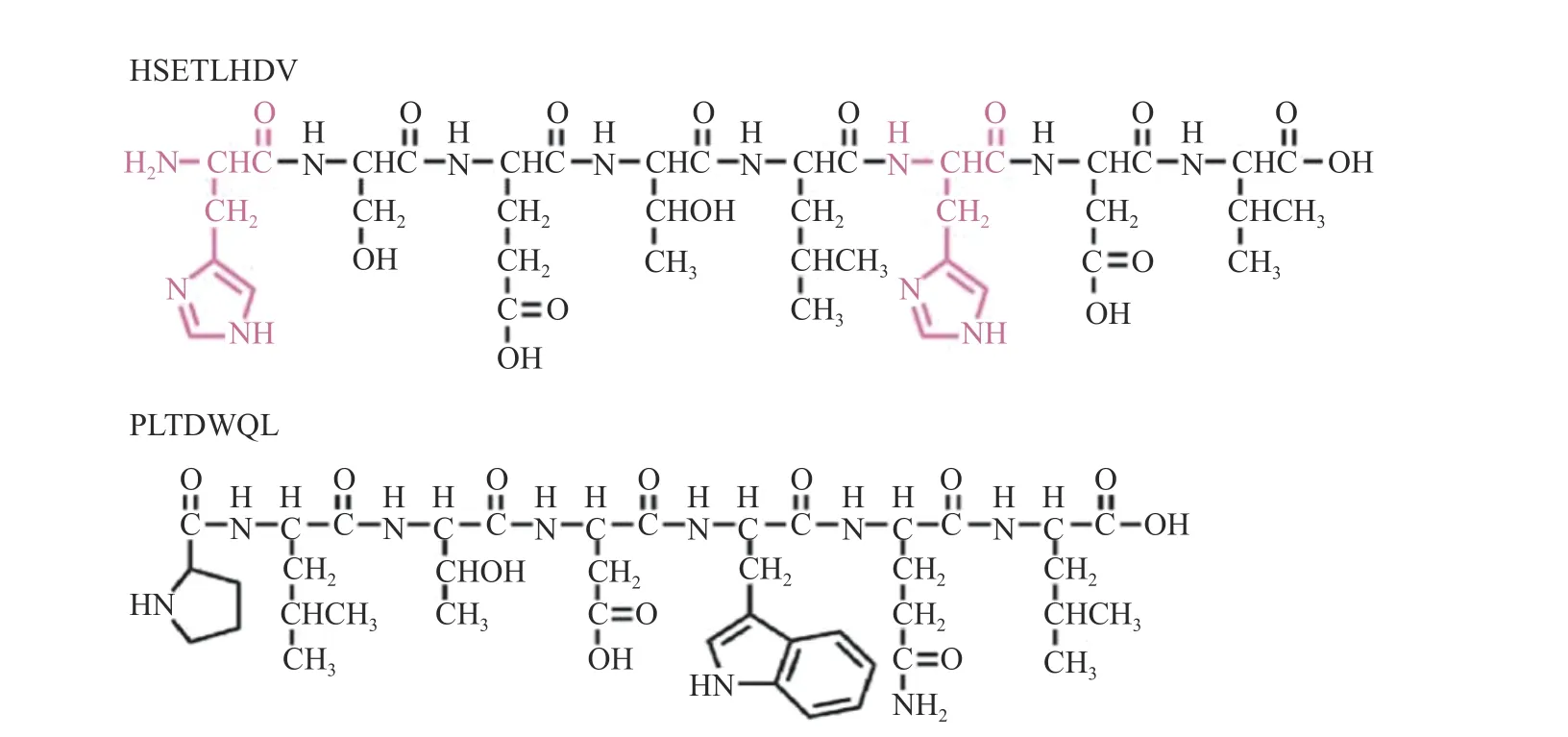
图7 合成抗菌肽化学结构Fig.7 Chemical structures of synthetic peptides
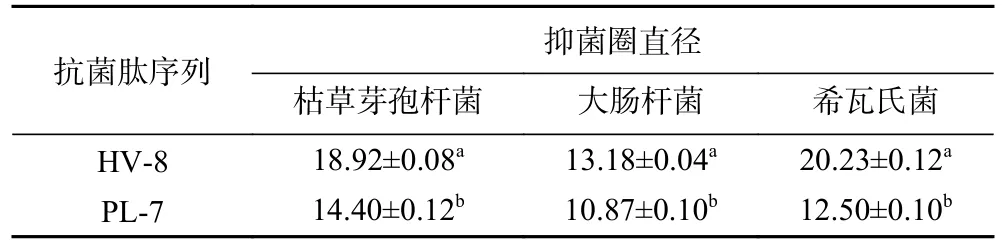
表4 合成抗菌肽抑菌圈直径(mm)Table 4 Diameter of inhibition zone of synthetic antimicrobial peptides (mm)
3 结论
本研究分析了鲟鱼表皮粘液的基本组分及氨基酸组成。粘液中主要成分为蛋白质,含量占47.44%±0.59%,且粘液中带正电荷氨基酸及疏水氨基酸含量高,分别占总氨基酸含量的 15.82%和 34.61%。制备了鲟鱼表皮粘液抗菌肽粗提物,发现其能有效抑制三文鱼贮藏期间微生物的增殖及蛋白质降解。同时成功纯化并鉴定了两种新型抗菌肽HSETLHDV(HV-8)和PLTDWQL(PL-7)。结果表明两种合成抗菌肽对枯草芽孢杆菌、大肠杆菌及希瓦氏菌均具有显著抑菌作用。本研究为鲟鱼表皮粘液抗菌肽作为抗生素替代物及食品保鲜剂提供支撑,同时也为水生生物资源的开发和利用开辟新途径。下一步将利用合成抗菌肽对鲟鱼表皮粘液抗菌肽的抑菌机制进行研究。
