固本平喘膏对慢性阻塞性肺病气道炎症的作用及机制
2023-09-10文高艳朱佳王星
文高艳,朱佳,王星
(1.南京医科大学附属脑科医院<胸科院区>呼吸内科,江苏 南京 210029;2.南京中医药大学附属医院呼吸内科,江苏 南京 210029;3.中国药科大学药学院药理系,江苏 南京 211198)
慢性阻塞性肺病(chronic obstructive pulmonary disease,COPD)以进行性和部分可逆的气流受限为特征,具有较高的发病率和致死率,异常的炎症反应导致肺功能低下[1],因此,控制炎症过程是抑制COPD进展的潜在途径。然而,目前预防COPD进展或逆转的策略是有限的。
固本平喘膏(Guben Pingchuan Ointment,GPO)由党参、肉桂、熟地、沉香曲、紫石英、紫丹参、黄连、桃仁、杏仁、苏子、陈皮、紫菀、白果、穿山龙组成,COPD稳定期,肺脾肾三脏虚损,肺气胀满不利。GPO全方务根本以求治,平气不忘开化,降逆不忘收持,温补不忘反佐,助益不忘调和,以成平喘固本之功。研究发现GPO能缓解COPD症状,但是机制尚未明确。国外研究表明P2X7受体(P2X7receptor,P2X7R)在COPD的发生、发展中起着重要作用[2],因此本文通过建立大鼠COPD模型,观察GPO对COPD气道炎症的治疗作用并基于P2X7R探讨其作用机制。
1 材料与方法
1.1 实验材料与仪器GPO购自南京中医药大学附属医院药房,并由南京中医药大学附属医院煎药中心进行制备;地塞米松购自上海阿拉丁生化科技股份有限公司;大鼠白介素-1β(interleukin-1β,IL-1β)、IL-6、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、酶联免疫吸附(enzyme-linked immunosorbent assay,Elisa)测定试剂盒购自武汉伊莱瑞特生物科技股份有限公司;兔抗-P2X7R一抗购自Invitrogen;兔抗-髓样分化蛋白88(myeloid differentiation factor 88,MyD88)、核因子κB抑制因子α(inhibitor of nuclear factor κBα,IκBα)、磷酸化IκBα(p-IκBα)、c-Jun氨基末端激酶(Jun N-terminal kinase,JNK)、p-JNK、核转录因子-κB p65(nuclear factor-κB p65,NF-κB p65)、p-NF-κB p65、p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38 MAPK)、p-p38 MAPK、细胞外信号调节激酶1/2(extracellular signal-regulated kinase 1/2,ERK1/2)、p-ERK1/2、3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)一抗、辣根过氧化物酶(horseradish peroxidase,HRP)标记的羊抗兔通用二抗购自Cell Signaling公司;二喹啉甲酸(bicinchoninic acid,BCA)法蛋白测定试剂盒。Spirometer和Powerlab多导生理测试仪购自AD Instruments公司;Multiskan FC酶标仪购自Thermo Fisher公司。
1.2 动物无特定病原体(specific pathogen-free,SPF)级雄性Sprague-Dawley(SD)大鼠(体重180~200 g)购自上海市计划生育科学研究所实验动物经营部[实验动物生产许可证号:SCXK(沪)-2018-0006],在进行动物实验研究之前,所有的动物均在实验室条件下适应7 d[实验动物使用许可证号:SYXK(苏)2018-049]。动物饲养在相对湿度(50%±10%)、温度(25±2)℃、光照(12 /12 h光暗周期)条件下的塑料笼子中,自由饮水和摄食。动物实验经南京中医药大学动物伦理与使用机构委员会批准(批准证书编号:202006A013)。
1.3 GPO的制备党参10 g、肉桂3 g(后下)、熟地15 g、沉香曲5 g、紫石英25 g(先煎)、紫丹参15 g、黄连1 g、桃仁10 g、杏仁10 g、苏子10 g、陈皮6 g、紫菀10 g、白果9 g、穿山龙15 g,以上中药饮片加水(8~10倍)浸泡4 h,常温常压下武火煮沸转文火提取两次,第一次60 min,第二次40 min,合并两次提取液,过滤(100目筛网),静置4 h,取上清液,浓缩至相对密度1.15~1.20的清膏,过滤(120目筛网),加入炼蜜、糖、细粉等,浓缩至原生药含量计1.296 g·mL-1,4 ℃冰箱储存备用,所用药物剂量基于大鼠-人体表面积换算法换算。
1.4 动物造模和分组按照文献方法建立大鼠COPD模型[3],40只雄性SD大鼠在自制密封箱中吸烟(红梅烟,每支含13 mg CO、13 mg焦油),每次30 min,每天2次,每次间隔6 h,连续造模12周。造模第7周,将40只雄性SD大鼠随机分成5组,每组8只,即:模型组、GPO高、中、低给药组(25 920、12 960、6 480 mg·kg-1)和阳性药地塞米松组(0.5 mg·kg-1),GPO和地塞米松在造模后1 h灌胃给药,每天1次,直至实验结束。造模前另随机抽取8只大鼠作为正常组,暴露于正常空气中,正常组和模型组均灌胃给予等量生理盐水。实验过程中监测各组大鼠体重变化。
1.5 大鼠肺功能测定第12周,各组大鼠以3%的水合氯醛麻醉,仰卧固定,采用Spirometer和Powerlab多导生理测试仪,测定分钟通气量(maximal voluntary ventilation,MVV)、吸气阻力(inspiration resistance,Ri)、呼气阻力(expiration resistance,Re)和肺顺应性(lung compliance,CL)、呼吸峰流速(peak expiratory flow,PEF)和0.3 s用力呼气量(forced expiratory volume in 0.3 second,FEV0.3)和用力肺活量(forced vital capacity,FVC)。
1.6 大鼠血清、肺泡灌洗液(BALF)及肺组织的收集大鼠颈总动脉取血后,静置1 h后,于10 000 r·min-1离心10 min,-80 ℃冰箱储存备用。切开颈部暴露出气管和双肺,采用4 ℃预冷的磷酸缓冲盐缓冲液(phosphate buffer solution,PBS)获取BALF。并且在显微镜下采用血球计数板计数BALF中白细胞总数,并统计各类白细胞的个数,算出各类白细胞所占的百分比。颈椎脱臼法处死大鼠后,在冰台上分离出肺组织,一部分固定于4%多聚甲醛固定液中,用于后期病理检测;剩余的部分-80 ℃冰箱储存备用。
1.7 肺组织苏木素-伊红(hematoxylin eosin,HE)染色将肺组织固定于4%多聚甲醛固定液中,过夜,然后将组织固定包埋于石蜡中,切成4 mm厚的切片。然后去石蜡,用HE染色,来观察肺损伤和肺部炎症细胞的浸润情况。
1.8 血清和BALF炎症因子的测定血清和BALF中IL-1β、IL-6和TNF-α含量按照试剂盒说明书采用Elisa法进行测量。
1.9 蛋白质免疫印迹法(Western blot,WB)分析肺组织相关蛋白表达采用RIPA裂解液提取肺组织中总蛋白,BCA法测定蛋白含量。蛋白样品进行SDS-PAGE电泳并转移至二氟化树脂(PVDF)膜,5%脱脂奶粉室温封闭2 h,分别与P2X7R、MyD88、IκBα、p-IκBα、JNK、p-JNK、NF-κB p65、p-NF-κB p65、p38 MAPK、p-p38 MAPK、ERK1/2、p-ERK1/2、GAPDH等一抗孵育,膜经TBST漂洗后再与HRP标记的二抗反应,经TBST漂洗后再用ECL发光试剂显影,灰度成像软件(Bio-Rad,美国)测定主带的灰度值,以计算上述蛋白在肺组织中的表达水平。
1.10 数据分析所有数据均以平均值(mean)±标准误(s)表示,采用SPSS 22.0进行数据分析,组间差异比较采用单因素方差分析和LSD多重比较检验,P<0.05为差异具有显著性。用GraphPad Prism 8 软件作图。
2 结果
2.1 GPO对COPD大鼠体重的影响如图1所示,与正常组比较,第12 周时COPD大鼠体重显著降低(P<0.01),而GPO中(P<0.01)、高剂量(P<0.01)和地塞米松(P<0.01)可以显著提高COPD大鼠的体重。

图1 GPO对COPD大鼠体重的影响
2.2 GPO对COPD大鼠肺功能的影响如图2所示,与正常组比较,COPD组大鼠MVV(P<0.01)、CL(P<0.001)、PEF(P<0.001)及FEV0.3/FVC(P<0.05)显著下降,而GPO和地塞米松可以不同程度改善COPD大鼠的MVV(GPO中剂量:P<0.05;GPO高剂量和地塞米松:P<0.01)、CL(GPO中、高剂量和地塞米松:P<0.001)、PEF(GPO中剂量:P<0.01;GPO高剂量和地塞米松:P<0.001)及FEV0.3/FV(GPO高剂量:P<0.05;地塞米松:P<0.05);且与正常组比较COPD组大鼠Ri和Re显著增高(P<0.001),而GPO中(P<0.01)、高剂量(P<0.001)和地塞米松(P<0.001)可以显著降低COPD大鼠升高的Ri和Re指标。

图2 GPO对COPD大鼠MVV(A)、Ri(B)、Re(C)、CL(D)、PEF(E)及FEV0.3/FVC(F)的影响
2.3 GPO对COPD大鼠BALF中炎症细胞的影响如图3所示,与正常组大鼠相比,COPD大鼠BALF中的白细胞、中性粒细胞、淋巴细胞和单核-巨噬细胞计数均显著上升(P<0.001),而GPO中、高剂量和地塞米松可以显著降低COPD大鼠BALF中白细胞(GPO中剂量:P<0.01;GPO高剂量和地塞米松:P<0.001)、中性粒细胞(P<0.001)、淋巴细胞(GPO中剂量:P<0.01;GPO高剂量和地塞米松:P<0.001)和单核-巨噬细胞(GPO中剂量:P<0.01;GPO高剂量和地塞米松:P<0.001)等炎症细胞的表达。
2.4 GPO对COPD大鼠血清和BALF中炎症因子表达的影响如图4所示,与正常组比较,COPD大鼠血清和BALF中炎症因子-IL-1β、IL-6和TNF-α表达显著增加(P<0.001),而GPO中(P<0.01)、高剂量(P<0.001)和地塞米松(P<0.001)可以显著改善上述炎症因子的异常表达。

图4 GPO对COPD大鼠血清和BALF中炎症因子IL-1β(A、D)、IL-6(B、E)和TNF-α(C、F)含量的影响
2.5 GPO对COPD大鼠病理的影响HE染色结果表明,正常组大鼠肺组织标本中肺泡间隔薄,肺泡正常,无炎症细胞浸润,而COPD大鼠肺组织标本显示肺泡间隔受损,肺泡增大,炎细胞浸润,GPO中、高剂量组和地塞米松可以不同程度改善COPD大鼠的病理变化(见图5)。
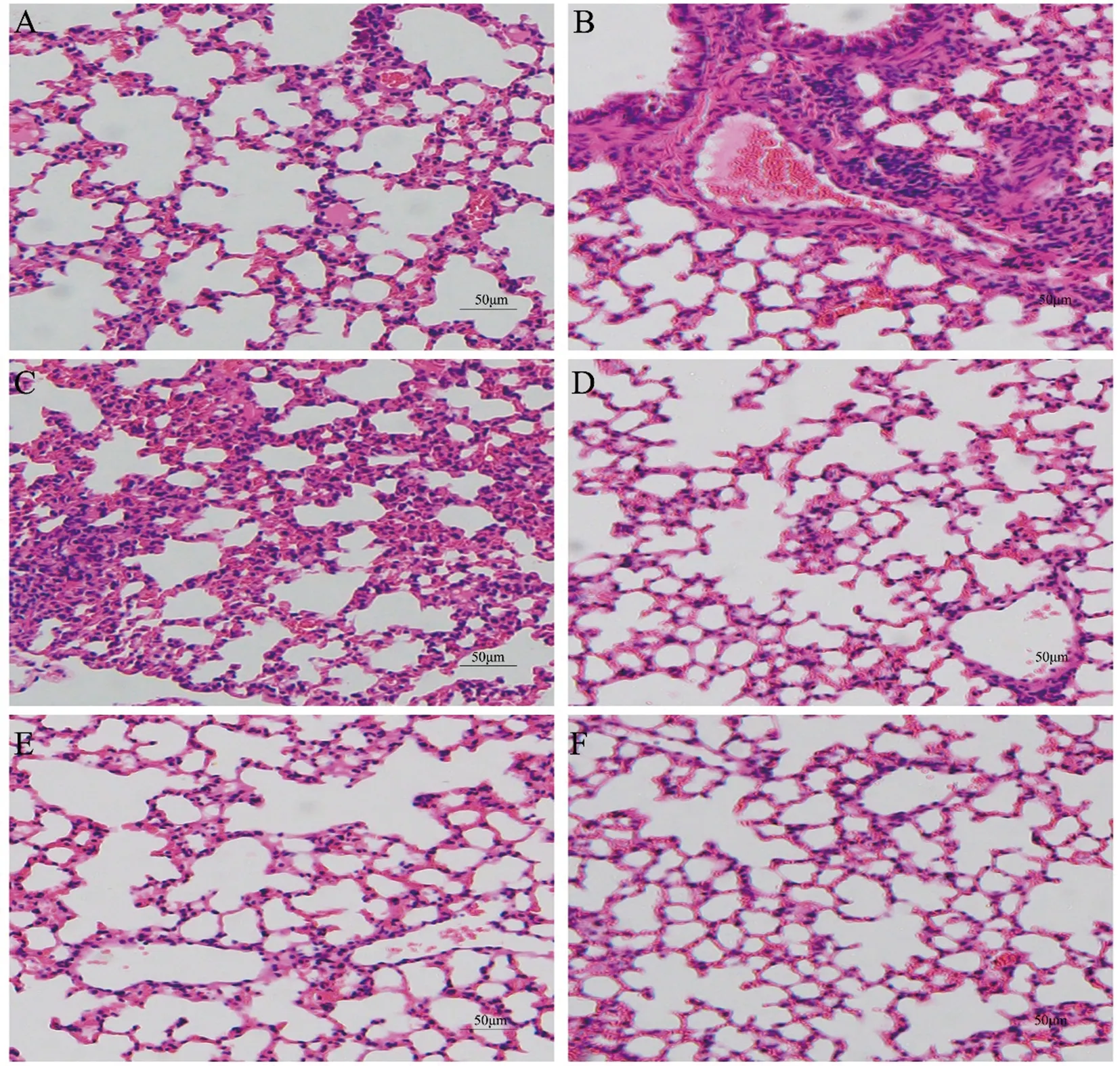
A.正常组;B.模型组;C.GPO低剂量组(6 480 mg·kg-1);D.GPO中剂量组(12 960 mg·kg-1);E.GPO高剂量组(25 920 mg·kg-1);F.地塞米松组
2.6 WB检测GPO对COPD大鼠P2X7R及其下游蛋白表达的影响如图6所示,与正常组比较,COPD大鼠肺组织P2X7R(P<0.001)、MyD88(P<0.001)、p-IκBα(P<0.01)、p-JNK(P<0.001)、p-NF-κB p65(P<0.001)、p-p38 MAPK(P<0.001)和p-ERK1/2(P<0.001)蛋白表达水平显著上升,IκBα蛋白表达水平显著下降(P<0.001);而GPO中、高剂量和地塞米松显著逆转了COPD大鼠肺组织P2X7R(GPO中剂量:P<0.01;GPO高剂量和地塞米松:P<0.001)、MyD88(GPO中剂量:P<0.01;GPO高剂量和地塞米松:P<0.001)、IκBα(P<0.001)、p-IκBα(GPO中剂量:P<0.05;GPO高剂量:P<0.01;地塞米松:P<0.01)、p-JNK(GPO中剂量:P<0.01;GPO高剂量和地塞米松:P<0.001)、p-NF-κB p65(P<0.001)、p-p38 MAPK(P<0.001)和p-ERK1/2(P<0.001)的异常表达。

图6 WB检测GPO对COPD大鼠大鼠P2X7R(A、B)、MyD88(A、C)、IκBα(A、D)、p-IκBα(A、E)、p-JNK(A、F)、p-NF-κB p65(A、G)、p-p38 MAPK(A、H)、p-ERK1/2(A、I)蛋白表达的影响
3 讨论
COPD的特征是气道和实质炎症,导致黏液生成过多和肺气肿,本课题组在SD大鼠中进行了为期12周的接触香烟烟雾的研究,成功地形成了COPD的特征,观察到免疫细胞的流入增加,表明肺部炎症的发展,病理结果显示正常组小鼠肺中的肺泡结构完整,几乎没有炎性细胞浸润。相反,暴露于香烟烟雾的小鼠的肺显示出严重的肺气肿,肺泡间隙增大、肺泡壁变薄、纤毛倒伏、炎性细胞浸润和肺泡明显破坏,且第12周时,COPD小鼠的体重显著低于正常组。而且,在实验过程中发现,正常组皮毛光滑、眼睛明亮、呼吸平稳、肌肉发达、反应迅速。在香烟烟雾暴露组中,暴露4周后,大鼠开始打喷嚏和咳嗽,随着暴露时间的延长,大鼠呼吸加快、呼吸困难、皮毛变干变黄、体力活动减少、反应减慢、食物和水摄入量减少、尿液变深黄色。同时,COPD大鼠的Ri和Re指标均高于正常组,而MVV、CL、PEF及FEV0.3/FV均低于正常组,表明COPD大鼠肺功能受损。
免疫细胞(中性粒细胞、淋巴细胞和巨噬细胞等)在肺内的聚集是COPD慢性炎症发展的关键标志。气道炎症始于气道和血管功能的破坏,导致肺部免疫细胞的浸润[4]。在香烟烟雾暴露的急性期,中性粒细胞增加,第二周开始,巨噬细胞开始增多,中性粒细胞开始减少,但尚未完全消退,表明慢性炎症开始发展[5]。在本研究中,白细胞、中性粒细胞、淋巴细胞和单核-巨噬细胞计数增加,免疫细胞主要聚集在肺泡区,而不是支气管周围和血管周围,破坏了肺泡壁,导致肺气肿。
COPD是一种慢性炎症性疾病,异常的炎症反应容易导致肺功能低下,因此,控制炎症过程是抑制COPD进展的潜在途径。此外,气道上皮细胞被香烟烟雾和其他刺激物激活,并通过自分泌和旁分泌机制释放促炎细胞因子,如IL-1β、IL-6、TNF-α[6]。本研究采用香烟烟雾建立雄性SD大鼠COPD模型,测定血清和BALF中促炎症细胞因子的水平来检查肺部炎症反应,结果发现COPD大鼠IL-1β、IL-6、TNF-α水平显著升高。
根据2020年慢性阻塞性肺疾病全球倡议,COPD患者应该接受药物治疗,接受肺康复,并进行适当的运动,以改善肺功能,提高活动耐量。然而,一些接受了适当治疗的患者没有显示出积极的结果。此外,口服激素、氨茶碱和支气管扩张剂治疗COPD可能会对患者产生不良反应。例如,气管扩张剂治疗已被证明总体上是安全的,但在临床研究中也出现了不良心脏事件。这些不可避免的后果促使人们探索治疗COPD的替代疗法。
在中国,许多中药经常用于COPD患者的治疗。多项临床试验表明,中医药可能对COPD患者有治疗作用,包括改善症状、生活质量和肺功能[7-8],并且没有重大不良反应的报道。COPD在中医中被归类为“肺胀”[9]。在中医理论中,内虚外实是肺胀的基本病理属性。COPD稳定期以内虚为主,外实主要对应急性加重期[9]。GPO组方中党参具有补中益气、健脾益肺的功效,主要成分党参多糖可改善巨噬细胞功能,降低COPD急性加重的风险[10];肉桂、熟地黄具有补虚、益气血功效;沉香曲可以用来治疗胸闷脘胀[11];紫石英、桃仁、杏仁、苏子、陈皮、紫菀、白果、穿山龙具有温肺祛痰止咳平喘的效果,并且紫菀提取物可以改善COPD患者的痰液表征[12];紫丹参、黄连具有清热解毒的功效。整方具有补肺益肾、纳气平喘的功效,该方为江苏省中医院协定方,朱佳教授在临床实践中,通过辨证论治将GPO恰当地运用到COPD患者身上,发现患者咳嗽、咳痰、气喘、乏力等症状得到明显改善。本研究发现GPO具有较好的抗COPD疗效,可以改善COPD大鼠异常的体重、肺功能、BALF中炎症细胞、血清和BALF中炎症因子及病理。
ATP是一些嘌呤能受体的配体,这些受体在肺中广泛表达,如P2XRs。当ATP与P2XRs结合时,巨噬细胞和中性粒细胞分泌促炎分子和组织降解介质,所有这些都导致了COPD的慢性炎症[13]。P2XRs共有7种亚型,其中最常见的是P2X7R。P2X7R主要位于细胞内,当单核细胞分化为巨噬细胞时,它们转移至质膜上。一旦与P2X7R结合,炎症小体被激活,从而导致IL-1β的成熟和释放[14]。COPD患者BALF中的巨噬细胞和中性粒细胞上P2X7R表达较高,且研究表明,P2X7R激活后可以促进中性粒细胞、巨噬细胞等向肺募集,介导了香烟烟雾所致肺部炎症和肺气肿的发生发展[2]。Myd88可以和P2X7R的C末端结合后被激活[15]。MAPKs是丝氨酸/苏氨酸蛋白激酶的一个家族,包括JNK、p38 MAPK和ERK1/2,介导各种细胞过程对外部应激信号的反应,活化的MAPKs磷酸化各种底物蛋白,包括促炎转录因子;此外,MAPKs参与了NF-κB转录活性的正向调节。而MyD88可以通过磷酸化IκBα和MAPK信号通路激活NF-κB和MAPKs[16]。MAPKs和NF-κB信号通路被激活后,可以上调气道上皮细胞中的炎症基因;而香烟烟雾诱导黏液过度产生的机制是通过激活TNF-α转换酶后裂解前体从而释放TNF-α,进而激活表皮生长因子受体,从而导致粘蛋白的产生。因此综上所述,P2X7R及其下游靶蛋白在COPD发生发展中起到关键调节作用。本研究发现COPD大鼠肺中P2X7R、MyD88、p-IκBα、p-JNK、p-NF-κB p65、p-p38 MAPK和p-ERK1/2蛋白表达水平显著上升,IκBα蛋白表达水平显著下降。
研究发现陈皮提取物及其有效成分可以通过MAPK、NF-κB通路产生抗肺纤维化作用[17],黄连提取物小檗碱可以抑制IκBα、JNK的磷酸化[18],丹参提取物丹参酮Ⅱa通过ERK1/2、p38和JNK通路抑制LPS诱导的RAW 264.7细胞NF-κB活化[19],因此,GPO可能通过P2X7R及其下游靶蛋白干预COPD。本研究发现采用GPO可以抑制COPD大鼠肺组织中P2X7R、MyD88、p-IκBα、p-JNK、p-NF-κB p65、p-p38 MAPK和p-ERK1/2蛋白的表达,而促进IκBα蛋白的表达。
综上所述,GPO可以改善COPD气道炎症反应,其可能通过抑制P2X7R信号通路发挥作用。
