荔枝果渣可溶性膳食纤维去结合酚前后结构和功能性质的比较
2023-09-09许涵婷唐语谦胡腾根余元善杨继国陈晓维
许涵婷,唐语谦,胡腾根,余元善*,杨继国,陈晓维
(1.华南理工大学食品科学与工程学院,广东广州 510640)(2.广东省农业科学院蚕业与农产品加工研究所,农业农村部功能食品重点实验室,广东省农产品加工重点实验室,广东广州 510610)(3.华工利亚(佛山)生物科技有限责任公司,广东佛山 528012)
荔枝是一种具有传统食药用价值的岭南佳果,含有多种对人体有益的生物活性成分[1],主要分布于我国南方地区,我国荔枝的种植面积和产量均位列世界第一[2]。荔枝采收季节集中,但采后易褐变和腐烂,据统计,荔枝每年有20%以上因腐烂变质造成损失[3]。随着农产品加工技术不断创新和发展,荔枝加工产品的种类越来越丰富,荔枝酒、荔枝果汁等荔枝饮品深受广大消费者喜爱,但在荔枝加工过程中会产生大量的可食用的荔枝果渣,产率为40%~50%[4]。目前工业上荔枝榨汁后产生的荔枝果渣大多被丢弃,造成环境的污染和资源浪费[5]。荔枝果渣富含膳食纤维等活性成分,具有很高的营养价值,可作为理想的膳食纤维来源,值得高度开发利用[6,7]。
膳食纤维是具有10个或10个以上单体单位的碳水化合物聚合物,其不能被内源性酶水解[8]。膳食纤维根据溶解性分为可溶性膳食纤维(SDF)和不可溶性膳食纤维(Insoluble Dietary Fiber,IDF)两部分[5]。SDF可以溶于温水和热水中,而IDF不溶于水,二者均不能被人体消化系统水解[9]。研究表明膳食纤维可通过调节肠道菌群结构,增加菌群多样性,从而有利于机体代谢平衡[8]。例如Zhu等[10]的研究发现从甘薯渣中提取的SDF可以减少小鼠肠道中的气球菌属等可诱发炎症性疾病的有害细菌的丰度,并促进具有抗炎作用的有益细菌如乳酸杆菌和粪杆菌的增殖。
多酚是一大类广泛存在于自然界、具有大量酚羟基结构单元的植物次生代谢产物[11]。按照结构分为类黄酮和非类黄酮化合物两大类[12],按性质可分为游离酚和结合酚。游离酚能够通过简单溶剂进行提取,结合酚与植物基质共价结合,不能被提取到水或有机溶剂[13]。许多研究已经报道了与游离酚类相比,结合酚类更强的抗氧化能力[9]。当食物中的结合酚进入人体时先在胃和小肠中消化,由于其不能被人体内酶系统消化,后进入到结肠,结肠中的肠道菌群降解植物基质的同时将其释放出来[13]。因此,目前越来越多的研究聚焦于膳食纤维中结合的多酚在调节人体肠道健康方面发挥的作用。
荔枝果渣富含膳食纤维和多酚类物质,但目前关于荔枝果渣中可溶性膳食纤维及其结合酚的报道较少,为了进一步探明结合酚对荔枝果渣可溶性膳食纤维的结构和功能性质的影响,本研究以荔枝果渣中SDF为研究对象,揭示了去除结合酚对SDF表面形貌、傅里叶红外、单糖组成、流变特性、抗氧化及益生活性的影响,为荔枝果渣可溶性膳食纤维和结合酚在调控肠道菌群与防治疾病关系方面提供理论基础,为提高荔枝副产物的高值化利用提供实践依据。
1 材料与方法
1.1 材料与试剂
荔枝果渣,购于广州顺昌源绿色食品有限公司,为荔枝(品种为怀枝)去皮去核榨汁后产生的果渣,储存于-20 ℃备用。Folin-Ciocalteu、中性蛋白酶(100 U/mg)、α-淀粉酶(4 000 U/g),购于上海源叶生物科技有限公司;酿酒酵母RV002,购于安琪酵母股份有限公司;单糖标准品,美国Sigma公司;氢氧化钠、DPPH、ABTS、碳酸钠、95%乙醇及其他试剂均为国产分析纯。本研究中,嗜酸乳杆菌和植物乳杆菌、鼠李糖杆菌均由实验室保藏提供。
1.2 仪器与设备
PB-10标准型pH计,德国Sartorius公司;ALC-210.4电子分析天平,德国ACCULAB公司;JW-1042低速离心机,安徽嘉文仪器装备有限公司;SU8000超高分辨场发射扫描电子显微镜,日立高新技术公司;VERTEX70红外光谱仪器,德国Bruker公司;HWS24电热恒温水浴锅,上海一恒科学仪器有限公司;ST85B3-1真空冷冻干燥机,美国Milirock公司;XDW-6B低温粉碎机,济南达微机械有限公司;LC-20A高效液相色谱仪,日本岛津公司;SW-CJ-2FD无菌操作台,苏净集团苏州安康空气技术有限公司;UV1800紫外分光光度计,日本岛津公司;SPX-250B-Z生化培养箱、YXQ-LS-5OS型立式蒸汽灭菌锅,上海博迅实业有限公司医疗设备厂。
1.3 试验方法
1.3.1 荔枝果渣SDF的制备
参考Li等[14]的方法略作调整。将荔枝果渣与蒸馏水(1:20,m/V)混合,加入0.02%(m/m)活化的酿酒酵母28 ℃下发酵24 h。随后,加入0.2%(m/m,2 000 U/g)α-淀粉酶在pH值6.0、60 ℃、150 r/min下水解1 h。此后,再加入1.0%(m/m,100 U/mg)中性蛋白酶并在pH值7.0、50 ℃下孵育1.5 h。将处理过的混合物以6 000 r/min离心10 min。上清液真空浓缩并以4倍体积的φ=95%乙醇在25 ℃下放置12 h。5 000 r/min离心10 min后,收集沉淀物用85%的乙醇反复洗涤后溶解在蒸馏水中,通过真空旋转蒸发除去乙醇,然后冷冻干燥,得到荔枝果渣可溶性膳食纤维(SDF)。
1.3.2 脱酚可溶性纤维的制备
参考徐灼辉等[15]的方法略作调整。干燥的SDF称重,按1:20(m/V)的比例加入4 mol/L的NaOH溶液,孵育90 min。将样品以8 000 r/min离心10 min,保留上清液用于测量结合酚含量,沉淀加水装入300 U的透析袋中透析至电导率和蒸馏水无差别后,冻干即得去结合酚荔枝果渣可溶性膳食纤维记为SDF-DF。
1.3.3 结合酚含量测定
参照Kwaw等[16]的方法,通过福林-酚试剂比色法测定结合酚的含量,含量以没食子酸毫克当量表示。
1.3.4 单糖组成
参考张启月等[17]的方法测定。准确称取0.01 g待测样品于螺纹顶空瓶,加入2 mL 2 mol/L三氟乙酸,100 ℃水解5 h后转至旋转瓶中。旋转蒸发至干燥后,再加入1 mL甲醇旋转蒸发至干燥,重复两次,然后加入蒸馏水定容至1 mL,离心待用。采用外标法定量分析单糖含量,称取一定量的标准品,用水稀释至不同浓度衍生化处理后配置成混标制作标曲。
PMP衍生处理:取100 μL样品液/标准单糖溶液于离心管中,加入200 μL 0.5 mol/L PMP甲醇溶液,混匀后加入300 μL 0.3 mol/L NaOH溶液,混匀后于70 ℃水浴1 h,冷却10 min后拿出,再加入300 μL 0.3 mol/L HCl溶液中和,随后加入1 mL氯仿涡旋振荡萃取,8 500 r/min离心10 min,保留上清液,重复萃取三次。上清液用0.22 μm滤膜过滤后,待上机。
检测条件:色谱柱为Wondasil C18(4.6 mm×250 mm,5 μm);流动相为0.05 mol/L pH值6.85磷酸盐缓冲溶液:乙腈=82:18(V/V),流速为1.0 mL/min;进样量为20 μL;柱温为30 ℃;波长为250 nm。
1.3.5 静态流变特性
样品表观粘度通过配备锥面几何系统(直径40 mm,间隙1 mm)的AR1500EX流变仪测定。在稳定剪切试验中,分析了在0.1~100 s-1剪切速率范围和25 ℃下测量不同含量(2%、4%和8%,m/V)样品溶液的表观粘度。
1.3.6 扫描电子显微镜
用导电胶带将样品固定后对样品进行喷金处理,于扫描电子显微镜1 000×观察样品表观结构,并拍照采集图像。
1.3.7 傅里叶变换红外(Fourier Transform Infrared,FT-IR)光谱
通过Bruker Vertex 70,在370~4 000 cm-1下扫描样品,分辨率为4 cm-1,累积32次,测定FT-IR光谱曲线。
1.3.8 抗氧化活性测定
1.3.8.1 DPPH自由基清除能力测定
DPPH自由基清除能力参照Yan等[18]的方法并作适当修改。用无水乙醇制备130 μmol/L的DPPH溶液,用去离子水配置浓度为1、2、4、6、8、10 mg/mL样品溶液。调零:1 mL样品稀释液+5 mL乙醇;空白:1 mL水+5 mL DPPH;样品:1 mL稀释后的样品+5 mL DPPH,测定517 nm吸光值。清除率按公式(1)计算。
式中:
C1——DPPH自由基清除率,%;
A样品1——1 mL稀释后的样品+5 mL DPPH溶液吸光度;
A空白1——1 mL水+5 mL DPPH溶液吸光度。
1.3.8.2 ABTS+自由基清除率能力测定
ABTS阳离子自由基清除能力参照李斌等[19]的方法并作适当修改。用去离子水制备7.4 mmol/L的ABTS溶液,与2.45 mmol/L过硫酸钾溶液混合,避光静置过夜。用无水乙醇稀释上述溶液直至在734 nm波长处吸光度为0.70±0.02。用去离子水配置质量浓度为1、2、4、6、8、10 mg/mL样品溶液,取0.1 mL样品溶液与3.6 mL的ABTS稀释液混合,避光条件下反应20 min,于734 nm波长处测定吸光度。
式中:
C2——ABTS+自由基清除率,%;
A样品2——0.1 mL稀释后的样品+3.6 mL ABTS溶液吸光度;
A空白2——0.1 mL水+3.6 mL ABTS溶液吸光度。
1.3.9 SDF和SDF-DF的体外益生发酵
参考Li等[14]的方法。首先,制备无碳源MRS基础培养基。然后,将1%(m/V)样品添加到无碳源MRS基础培养基中,而无碳源MRS基础培养基作为空白对照。所有MRS培养基均在121 ℃高压灭菌20 min并冷却至50 ℃,然后接种2%(V/V)的细菌悬浮液并在37 ℃下恒温培养。取0、12、24 h菌液,通过测量发酵液的pH值和在600 nm处光密度(OD)来监测菌株的生长情况。
1.3.10 数据分析
每组实验三个平行,数据计算采用Microsoft Excel 2021,实验结果表示为平均值±标准差。采用SPSS 26.0软件进行数据显著性分析,并采用Duncan多范围检验方法,以P<0.05表示差异显著,用Origin 2021软件绘图。
2 结果与讨论
2.1 结合酚含量
本实验结果表明荔枝果渣可溶性膳食纤维中结合酚含量为4.53 mg GAE/g,龚小洁[20]通过碱水解测得怀枝果渣中结合酚的含量为5.41 mg GAE/g,徐灼辉[15]通过碱水解测得荔枝干果肉可溶性膳食纤维中结合酚的含量为0.29~3.66 mg GAE/g。
2.2 SDF和SDF-DF的微观结构
图1为SDF和SDF-DF的扫描电镜下的微观结构。SDF和SDF-DF都呈碎片状,但SDF-DF呈卷曲薄片,结构更松散和碎裂,这可能是由于碱水解时氢氧化钠的强氧化作用导致[21],在强碱性环境下SDF中许多以结合形式存在的活性物质被释放,且SDF被碱水解出现部分碎裂[15]。结果表明结合酚的存在有利于维系SDF表面形貌的稳定[15]。

图1 SDF和SDF-DF的扫描电子显微镜图Fig.1 The scanning electron microscopy of SDF and SDF after removal of bound polyphenols
2.3 SDF和SDF-DF的FT-IR光谱分析
SDF和SDF-DF的FT-IR光谱如图2所示。可以看出,SDF和SDF-DF的大多数特征键是相似的。3 431 cm-1附近的宽振动峰是O-H基团的伸缩振动峰,1 200~1 400 cm-1范围内为C-H角振动引起的吸收峰,这代表了碳水化合物骨架的典型结构[14],2 937 cm-1处为C-H糖亚甲基的伸缩振动[22],代表半纤维素的典型结构。1 748 cm-1是羧基生成的C=O的伸缩振动,1 620 cm-1附近的吸收峰是C=O的伸缩振动吸收,表明SDF和SDF-DF中存在多糖糖醛酸[23]。1 749.44、1 419.61、1 242.16 cm-1一般为低甲基果胶引起的吸收峰[17]。综上所述,这些结果表明SDF和SDF-DF的主要成分为果胶和半纤维素,在碱水解去除结合酚的过程中未出现主要的官能团转化,这与徐灼辉[15]和Liu等[24]的结果一致。
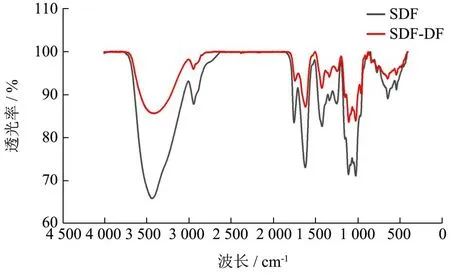
图2 SDF和SDF-DF的红外光谱图Fig.2 Fourier transform infrared spectroscopy analysis of SDF and SDF-DF after removal of bound polyphenols
2.4 SDF和SDF-DF的单糖组成
表1分析了SDF和SDF-DF的单糖的组成和含量。研究发现,SDF和SDF-DF的单糖组成相同,但部分单糖含量有差异。SDF和SDF-DF中主要检测到了8种单糖,其中阿拉伯糖的含量最高。SDF-DF中半乳糖醛酸(56.68 mg/g)和阿拉伯糖(216.93 mg/g)含量显著高于SDF(P<0.05)。半乳糖醛酸、半乳糖、阿拉伯糖和鼠李糖是果胶的典型成分[25],果胶是一种重要的水溶性膳食纤维,主链由半乳糖醛酸经α-1,4-糖苷键链接形成,侧链是由半乳糖、鼠李糖和阿拉伯糖等中性多糖组成[26]。碱水解去结合酚的过程中可能促使了一部分可溶性半纤维素的降解,使去酚后的SDF保留了更多的果胶结构。
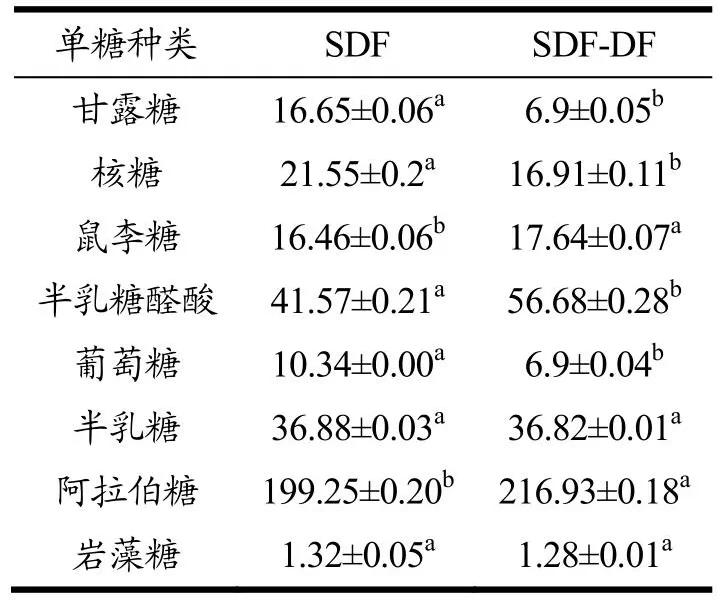
表1 SDF和SDF-DF中单糖含量(mg/g)Table 1 Monosaccharide content in SDF and SDF-DF
2.5 SDF和SDF-DF静态流变分析
如图3所示,SDF和SDF-DF表观黏度随着剪切速率的增加而降低,随着样品浓度的降低而降低,呈现出剪切稀化现象,这表明二者都为具有假塑性特性的非牛顿流体[14];SDF和SDF-DF的表观粘度也随着浓度的增加相应增加,与Feng等[25]的实验结果一致。在相同浓度和相同剪切速率下,SDF的表观黏度远大于SDF-DF,是由于SDF和SDF-DF在高剪切速率下分子骨架发生重排,SDF-DF的微观结构更松散不能形成更细的网络从而导致黏度降低[14],SDF的功能性质很大程度上取决于黏度[17,27]。
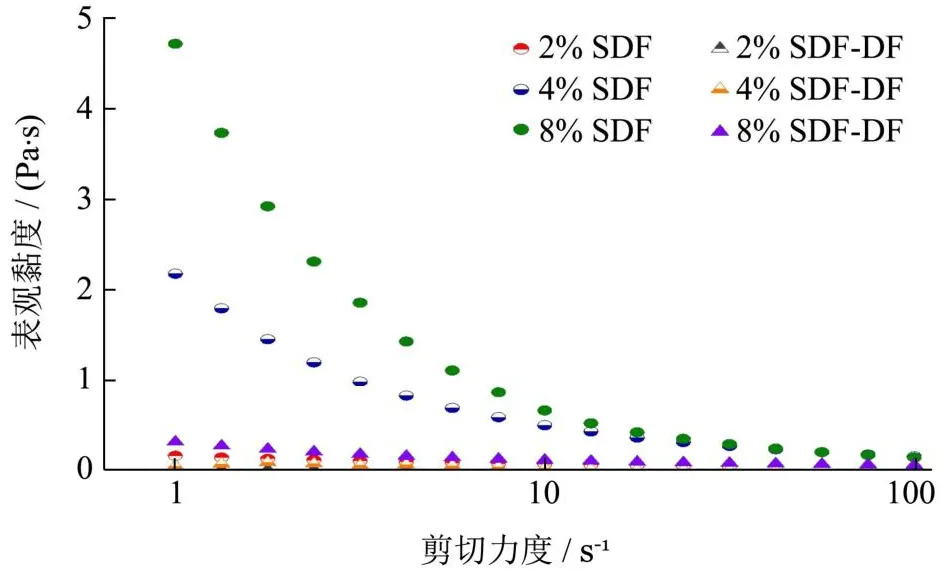
图3 不同质量浓度SDF和SDF-DF水溶液的黏度曲线Fig.3 The viscosity curves of S SDF and SDF-DF aqueous solution with different mass concentrations
2.6 SDF和SDF-DF抗氧化能力
本实验通过测定ABTS阳离子自由基清除能力和DPPH自由基清除能力来比较碱水解去除结合酚前后SDF的体外抗氧化活性。由图4和图5可以发现,随着样品浓度的增加,SDF和SDF-DF对DPPH自由基清除能力及对ABTS阳离子自由基清除能力逐渐增加。而SDF对ABTS阳离子自由基清除活性随浓度的变化没有显著变化(P>0.05),维持在85.01%~90.59%,显著高于SDF-DF的清除活性(6.03%~48.53%)(P<0.05);同时,SDF的DPPH自由基清除活性在56.13%~85.95%,而SDF-DF的清除活性在27.11%~70.88%之间。上述结果表明,SDF较SDF-DF有更高的抗氧化活性,这是由于结合酚被释放引起的,有研究表明结合酚的去除会影响胡萝卜膳食纤维的抗氧化活性[24]。

图4 SDF和SDF-DF的DPPH自由基清除能力Fig.4 DPPH radical scavenging activities of SDF and SDF-DF
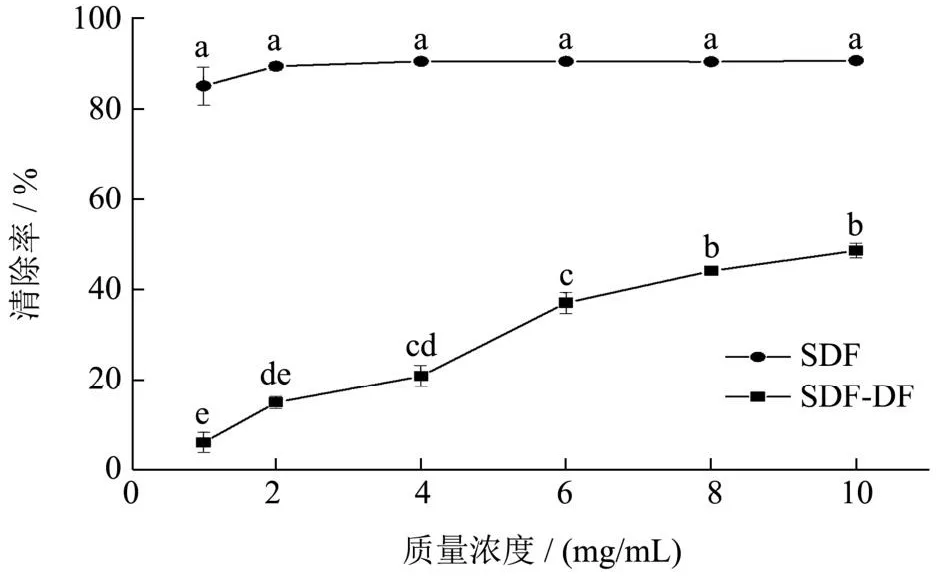
图5 SDF和SDF-DF的ABTS自由基清除能力Fig.5 ABTS radical scavenging activities of SDF and SDF-DF
2.7 SDF和SDF-DF体外益生活性
由图6和图7可知,益生菌在SDF培养基中的生长速度在0~12 h较快,在12~24 h生长速度趋于平缓;相比于SDF,益生菌在以SDF-DF为碳源的培养基中生长速度较缓慢,在无碳源培养基中几乎不生长(P>0.05)。在SDF培养基中,益生菌的增长量远高于以SDF-DF为碳源的培养基(P<0.05),这可能是由于益生菌发酵SDF时释放出了结合多酚从而更好的促进益生菌的生长;比较培养基中pH值的变化可以发现,SDF培养基中pH值的降低程度显著高于SDF-DF培养基,这是由于SDF培养基促进益生菌的生长效果更好,益生菌的产酸量高于SDF-DF培养基(P<0.05)。

图6 三种益生菌在不同碳源培养基中OD600的变化Fig.6 Change of OD600 of three probiotics in different carbon source medium
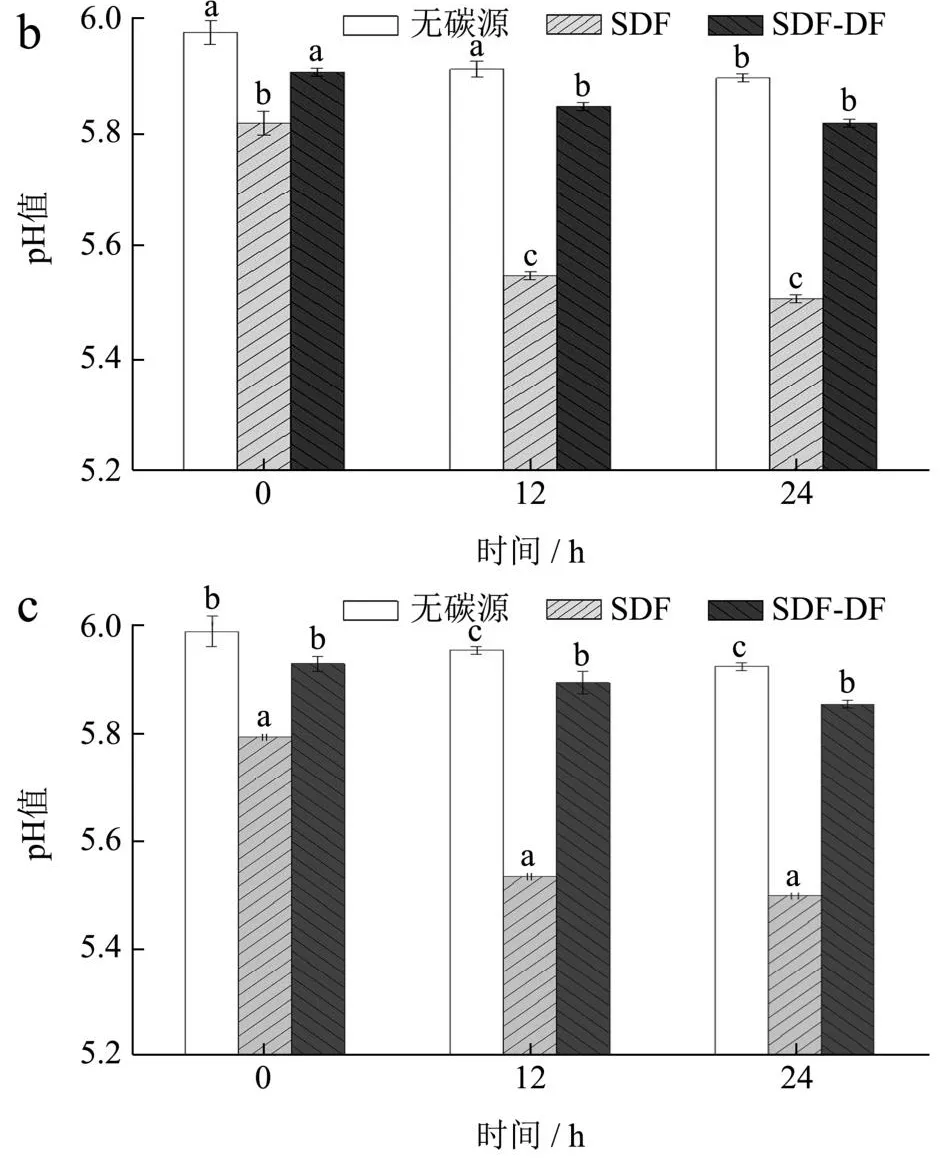
图7 三种益生菌在不同碳源培养基中pH值的变化Fig.7 Change of pH of three probiotics in different carbon source medium
综上,通过体外益生实验发现,3种益生菌在无碳源培养基中无明显增长,在以SDF培养基中生长的最好,并且3种益生菌在SDF和SDF-DF培养基中的生长情况以及pH值的变化具有显著差异。尽管不同的菌种对逆环境的耐受能力不同可能会导致其对菌种的生长增殖产生影响[28],SDF对3种益生菌的促生长效果都显著优于SDF-DF。结果表明结合酚的去除极大的影响了其益生活性,这证实结合酚对可溶性膳食纤维的益生活性具有重要影响,这与Liu等[24]的结论一致。

3 结论
本文通过碱水解去除SDF中的结合酚,并研究了去除结合酚前后SDF结构和功能性质的变化。碱水解去除结合酚后,SDF的整体结构更加松散和碎裂,但没有出现官能团的转化。SDF和SDF-DF的单糖组成相同,但SDF-DF更加疏松的结构使其表观黏度低于SDF。SDF去结合酚后,DPPH自由基清除能力和ABTS阳离子自由基清除能力明显下降,并且3种益生菌在SDF-DF培养基中的生长情况都不如SDF培养基,表明结合酚在SDF的抗氧化活性和益生活性中起着重要作用。综上所述,结合酚与荔枝果渣可溶性膳食纤维的营养价值息息相关,本研究将为评价荔枝果渣可溶性膳食纤维作为肠道益生元提供理论依据。
