天然榛香物质微囊粉表征及稳定性与缓释性能分析
2023-09-09岳鑫颖王冠吕春茂孟宪军宣景宏高嘉彤孔美
岳鑫颖,王冠,吕春茂*,孟宪军,宣景宏,高嘉彤,孔美
(1.沈阳农业大学食品学院,辽宁沈阳 110866)(2.辽宁省绿色农业技术中心,辽宁沈阳 110034)
天然榛香物质是由榛子粕酶解液与还原糖通过美拉德反应制备得到的一种纯天然食品添加剂,其具有醇厚榛香气味的同时还符合产品的天然性和可持续性[1]。由于天然榛香物质内含有易挥发的挥发性化合物,对氧气、温度与光照等外部条件敏感,易发生降解和挥发使得香味缺失,从而影响产品质量,难以贮藏[2]。微胶囊技术可以将液体物质转变为粉末状,起到保护产品的作用,从而提高产品在贮藏过程中的稳定性[3]。榛子提油后的副产物棒子粕含有丰富的蛋白质,但大部分被用作动植物肥料,利用率低[4]。动植物蛋白都是制备微胶囊的优质壁材,但有研究指出动物蛋白在生产过程中对环境影响大且成本较高,而植物蛋白来源广泛、成本低,并且对环境的影响较小[5]。相关研究指出榛子粕蛋白持水性、溶解性、乳化稳定性与大豆蛋白、乳清蛋白等的功能特性相同[6]。此外,榛子粕蛋白提取生物活性肽具有较强的抗氧化能力,这使其成为一种潜在优质的蛋白壁材[7]。β-CD由于本身结构特点,且生产成本低,在包埋芳香物质方面应用广泛[8]。单一壁材制备的微胶囊功能特性较弱,蛋白质与多糖二者进行复配,壁材间发生协同作用能够弥补单一壁材的不足,在提高包埋率的基础上还可以节约成本[9]。
结合模拟不同食品体系中的释放情况与释放动力学模型可以直观的观察微胶囊的释放机理[10]。目前常用于释放动力学的模型主要包括零级释放模型、一级释放模型、Higuchi模型、Ritger-peppas模型[9]。Fick扩散第一定律用于稳态扩散,指扩散过程中各处的浓度及浓度梯度不随时间变化;第二定律也称(非菲克扩散)用于非稳态扩散,指扩散过程中各处的浓度和浓度梯度随时间发生变化[11]。鉴于此,本文开发一种由榛子粕蛋白和β-CD组成的新型复合壁材来包埋天然榛香物质,以制备天然榛香物质微囊粉,并对其结构、稳定性和缓释规律进行分析,以期为该天然榛香物质的开发与应用提供理论参考。
1 材料与方法
1.1 原料与试剂
榛子粕由朝阳安泰林药开发有限公司提供;榛子粕蛋白、天然榛香物质(实验室自制);β-环糊精,河南万邦化工科技有限公司。
正己烷(分析纯)、无水乙醇(分析纯),国药化学试剂有限公司;中性蛋白酶,沈阳市浑南区索莱宝得试剂销售中心。
1.2 仪器与设备
CR21N2400604高速冷冻离心机,日本HITACHI;YP5102电子天平,上海光正医疗仪器有限公司;pHS-25雷磁数显pH计,上海精密科学仪器有限公司;TU-1810紫外分光光度计,北京普析通用仪器有限公司;FD-1A-50冷冻干燥机,北京博医康实验仪器有限公司;MS7-H550-Pro数显恒温磁力搅拌器,爱来宝济南生物技术有限公司;Zetasizer2000动态衍射激光粒径仪,英国马尔文仪器有限公司;XMTD-8222电热鼓风干燥箱,上海仪器制造有限公司;VETEX80傅里叶变换红外光谱仪,德国布鲁克公司;牛津X-MaX场发射扫描电子显微镜,日本日立(HITACHI)公司;KQ5200B型超声波清洗器,昆山市超声仪器有限公司。
1.3 试验方法
1.3.1 天然榛香物质制备
参考杨易俗等[12]的方法,取一定量榛子粕磨碎成粉,置于40 ℃恒温干燥箱中烘干后(过筛40目),置于4 ℃冰箱中备用。取一定量干燥后的榛子粕粉溶于水,料液比为1:30(m/m),置于恒温水浴锅内90 ℃水浴10 min,取出冷却至室温。调节至中性蛋白酶适宜状态的pH值至7.5,加入中性蛋白酶(16 000 U/g),搅拌均匀,置于43 ℃水浴锅水解1.5 h后放置90 ℃水浴锅内灭酶10 min,冷却至室温,调节pH值至7.5,6 000 r/min离心15 min取上清液,即为得到的酶解液。
取100 mL酶解液,加入还原糖14%(还原糖比例果:葡1:2),谷氨酸10%,丙氨酸10%,亮氨酸3%,精氨酸2%(质量比),反应温度100 ℃,反应时间120 min制备得到天然榛香物质。
1.3.2 榛子粕蛋白的提取
参考彭倩等[13]的方法,将脱脂后的榛子粕粉溶解于蒸馏水中,料液比条件为1:30(质量比),调节体系内pH值为8.0,45 ℃超声60 min,6 000 r/min离心15 min,取上层清液,冷却后,调节体系内pH值为4.5并搅拌,6 000 r/min离心15 min,取离心管内沉淀,并用蒸馏水溶解沉淀,再使用φ=1% HCl调节溶液的pH为中性,置于-80 ℃超低温冰箱内冷冻24 h后放置冷冻干燥机内冻干48 h即为榛子粕蛋白。
1.3.3 天然榛香物质微囊粉制备
参考Xiao等[14]的方法,取一定量榛子粕蛋白加入40 ℃蒸馏水中,待榛子粕蛋白完全溶解后加入β-环糊精(榛子粕蛋白:β-CD的质量比为1:1)搅拌至全部溶解。将天然榛香物质溶液(芯材)缓慢添加至复合壁材溶液中(芯壁比的质量比为1:9);将磁力搅拌器控温至45 ℃,搅拌速率为900 r/min,反应3 h,得到微胶囊乳液;将微胶囊乳液置于4 ℃冰箱中过夜,经过真空抽滤后在35 ℃干燥箱中干燥1.5 h,得到天然榛香物质微囊粉。
1.3.4 天然榛香物质微囊粉包埋率的测定
参考 Zjab等[15]的方法,将0.1 g考马斯亮蓝G-250与50 mL 95%乙醇(V/V)和100 mL 85%磷酸(V/V)混合,加蒸馏水定容至1 000 mL,得到考马斯亮蓝溶液。以牛血清蛋白为标准蛋白,分别配制质量浓度为0、20、40、60、80、100 µg/mL的蛋白质标准溶液,不同浓度的标准溶液各取1 mL与4 mL考马斯亮蓝溶液混合后,静置5 min,在595 nm下测定吸光度值,绘制蛋白的标准曲线。
参考陈雨露等[16]的方法,芯材总量的测定:称取100 mg微囊粉置于烧杯中,加入20 mL无水乙醇并密封,40 ℃超声30 min,使其充分溶解。随后,通过离心机在6 000 r/min转速下,溶液离心15 min,取上清液,稀释10倍后,通过紫外可见分光光度计测定溶液在595 nm处的吸光度。根据标准曲线y=0.006 8x+0.006 7,R2=0.998 3计算含量。
产品表面芯材含量:称取100 mg微囊粉于离心管,加入20 mL乙醇漩涡震荡1 min。随后,通过离心机在6 000 r/min离心15 min,取上清液,稀释10倍后,通过紫外可见分光光度计测定溶液在595 nm处的吸光度。根据标准曲线y=0.006 8x+0.006 7,R2=0.998 3计算含量。
式中:
EE——包埋率,%;
A1——产品表面芯材含量,mg;
A2——芯材总量,mg。
1.3.5 天然榛香物质微囊粉表征分析
1.3.5.1 天然榛香物质微囊粉粒径及Zeta电位测定
参考崔婷婷等[17]的方法,将制备好的天然榛香物质微囊粉用去离子水稀释至透明状溶液,将其放入激光粒度分析仪的槽中,对其颗粒大小和Zeta电位进行了测量。对每一种样品进行3次测量,取其平均值。
1.3.5.2 扫描电镜形态观察
参考陈福泉等[18]的方法,使用扫描电子显微镜对比观察复合壁材和天然榛香物质微囊粉粉末的形貌特征。在观察前需要将微囊粉粉末/复合壁材均匀分散至硅片上,并进行喷金处理。加速电压5 kV、工作距离8.7 mm、放大倍数2.50 k。
1.3.5.3 傅里叶红外光谱测定(FT-IR)
参考陈福泉等[18]的方法,准确称取各样品(复合壁材、天然榛香物质、天然榛香物质微囊粉)2.0 mg,使用ATR法在4 000~400 cm-1波长下,分辨率为2 cm-1条件下测定并记录各样品的红外光谱图。所有样品均平行测试3次。
1.3.6 天然榛香物质微囊粉贮藏稳定性与释放规律分析
1.3.6.1 芯材的含量及保留率的测定
芯材含量的测定同1.3.4。
式中:
R——芯材保留率,%;
A3——贮藏一段时间后的芯材含量,mg;
A4——初始芯材含量,mg。
1.3.6.2 温度对天然榛香物质与微囊粉稳定性的影响
参考唐宏刚等[19]的方法,设置3个不同的温度条件,分别为4、25和50 ℃,然后取适量天然榛香物质和微囊粉置于铝箔密封袋中,每个条件下的样品均制备3份,放置于不同的温度环境中避光、密闭、相对湿度32%下进行贮藏35 d,每隔7 d取样品进行芯材保留率的测定。
1.3.6.3 湿度对天然榛香物质与微囊粉稳定性的影响
参考廖霞等[20]的方法,设置3个不同相对湿度(Relative Humidity,RH):氯化镁(33%),溴化钠(58%)和氯化钾(84%)的饱和溶液。然后取适量天然榛香物质和微囊粉放置于不同湿度的密闭容器内,每个条件下的样品制备3份,温度25 ℃,密闭,避光保存35 d,每隔7 d取样进行芯材保留率的测定。
1.3.6.4 光照对天然榛香物质与微囊粉稳定性的影响
参考Aslan等[21]的方法,设置2个不同的光照条件,分别为有光和无光,然后取适量天然榛香物质和微囊粉品分别置于铝箔密封袋与透明密封袋中,每个条件下的样品均制备3份,然后在温度25 ℃,密闭,相对湿度32%下将装在铝箔密封袋中的样品进行避光贮藏,将透明密封袋中置于自然光下进行贮藏35 d,每隔7 d取样品进行芯材保留率的测定。
1.3.6.5 氧气对天然榛香物质与微囊粉稳定性的影响
参考Debebe等[22]的方法,设置2个不同的氧气条件,分别为避光有氧和避光真空,然后取适量天然榛香物质和微囊粉分别放置于有氧和真空条件下,每个样品配制3份,25 ℃,避光,相对湿度32%贮藏35 d,每隔7 d取样进行芯材保留率的测定。
1.3.7 天然榛香物质微囊粉在食品模拟体系中释放量的分析
通过借鉴Chen等[23]的方法:选择(T1-模拟高醇的食品体系:526 mL 95%乙醇溶液(V/V),加入去离子水定容到1 000 mL制成50%乙醇;T2-模拟高水分活度食品体系:105 mL 95%乙醇溶液(V/V)加去离子水到1 000 mL制成10%乙醇溶液(V/V);T3-模拟水分活度为0.6~0.7的食品体系:600 mL丙三醇加去离子水到1 000 mL制成60%甘油溶液(m/m);T4-模拟脂肪类的食品体系:1 000 mL正己烷)这四种食品体系为代表。在释放0、5、15、20、25、30、35 min后取样,离心后测定595 nm处的吸光值,代入标准曲线y=0.006 8x+0.006 7,R2=0.998 3计算芯材含量。根据公式来计算释放率。
式中:
D——释放率,%;
A5——微胶囊中芯材含量,mg;
A6——各体系中微胶囊包含的总芯材含量,mg。
1.3.8 数据分析
使用SPSS 23.0软件进行数据分析计算,测定3组平行试验,结果用平均值±标准差表示。P<0.05表示差异显著,P>0.05表示差异不显著,并应用Origin 2021软件作图。
2 结果与讨论
2.1 复合壁材比对天然榛香物质微囊粉包埋率的影响
从图2可以看出,在壁材比为3:1时包埋率为64.86%,低于2:1(76.25%)和1:1(83.24%)的包埋率。原因是榛子粕蛋白具有乳化性可作为乳化剂使用,适量的榛子粕蛋白有助于香气物质在水溶液中与芯材反应,使得乳液更加稳定。但是过多的蛋白会增加乳液的黏度,阻碍分子的迁移,使得包埋率较低[24]。当壁材比为1:2与1:3时包埋率分别为70.94%和62.53%低于1:1的包埋率,这一结果与Mustafa等[25]的研究结果相似,由于β-CD较榛子粕蛋白的黏度低,过多的β-CD会导致乳液稳定性下降从而影响包埋率。
2.2 芯壁比对天然榛香物质微囊粉包埋率的影响
由图3可以看出,芯壁比在1:3~1:9之间时,包埋率从56.41%增加到87.28%。原因是随着壁材比例增加,芯材被充分的包埋在壁材内,当芯壁比为1:9时包埋率为87.28%,达到了最大值。当芯壁比为1:11时,包埋率下降至81.35%,这是由于有限的芯材不能充分利用过多的壁材,造成壁材堆积过剩从而降低了包埋的效果[26]。
2.3 芯壁比对天然榛香物质微囊粉PDI值与Zeta电位的影响
PDI值通常用来表示粒径的分布(宽度),当PDI值越大,说明粒径分布越宽,PDI值越小说明粒径分布越窄[27]。从图4中可以看出随着芯壁比的增加,PDI值逐渐减小,在芯壁比为1:9时PDI最小为0.242,处于单分散体系。这是由于壁材逐渐增加,香气物质与壁材间的分子作用力增大,有助于包埋反应进行,使得体系内粒径分布均匀。但当芯壁比为1:11时PDI值增大至0.387,这与Eh等[28]的研究结果一致,由于壁材过多,使得整个体系黏度增加,阻碍分子运动,导致粒径分散。
Zeta电位体现胶粒表面的带电特性,绝对值越大静电斥力越强说明体系较稳定,反之则不稳定[29]。由图3可知,Zeta电位绝对值随芯壁比的增加而增加,在1:9时有最大的Zeta电位-33.93 mV。这表明壁材的比例增加会加强天然榛香物质微囊粉的表面电荷,使得体系稳定性升高。但当壁材添加量较少时,芯材与壁材间的分子作用力小,使得体系不稳定。同样Zx等[30]的研究也发现,过量的壁材所带大量电荷会削减微囊粉的表面电荷,导致微囊粉发生团聚黏结,使得其粒径分布不均一,体系不稳定。因此,选择芯壁比1:9为最佳比值。在上述实验分析基础上进一步分析后面的结构表征及缓释效果。
2.4 天然榛香物质微囊粉粒径分析
从图5中可以得知天然榛香物质微囊粉的粒径分布图为一大一小的双峰曲线,粒径在7.5~57.5 µm之间的微胶囊占总体的比值较大,粒径在62.5~72.5 µm的微胶囊占总体比值较小。平均粒径为29.31 µm,总体而言粒径不太均匀且分布略宽。造成这一问题的原因可能是在制备微囊粉过程中,壁材(β-CD)与芯材的乳液在冷藏过程中,壁材结晶并以不同形式堆积,从而形成大小不均匀的粒径,这一研究结果与张维[31]的研究一致。
2.5 天然榛香物质微囊粉扫描电镜分析
图6和图7分别表示复合壁材和天然榛香物质微囊粉在不同倍数下的扫描电子显微镜图像。二者相比较,6a中的复合壁材除不规则柱状结构外还分布着较多不成型的微小颗粒,规整性差。与图6a不同,图6b中微囊粉的外观均为不规则的柱状和菱形片状,整体规整性较好。经放大2.5 k倍后,可以观察到图7a中复合壁材表面附着很多小颗粒,而图7b中微囊粉表面较光滑,且粒径变小,二者之间的差异表明形成了包合物[18]。
2.6 傅里叶红外光谱分析
从图8可以看出复合壁材在3 223 cm-1处有极强且宽的特征峰,这对应的是β-CD上-OH伸缩振动。2 925、1 640、1 150与1 024 cm-1处的吸收峰值分别对应的是C-H的拉伸振动、H-O-H结合水的振动、C=O键的反对称伸缩振动以及C-O-C拉伸振动[32]。1 657 cm-1与1 541 cm-1处吸收峰是榛子粕蛋白质中酰胺I带和酰胺Ⅱ带的C=O与N-H引起的特征峰伸缩震动。
通常天然榛香物质含有较多香气化合物如(醇类、酯类和醛类)。在红外光谱图中可见,天然榛香物质在3 346、1 658和1 150 cm-1处出现明显的吸收峰,分别对应的是-OH、C=C、C-O的伸缩振动。类似于Zhang等[33]的报道,2 957、2 927、2 873 cm-1处的峰值是由于香气物质亚甲基的C-H伸缩振动。
天然榛香物质微囊粉红外光谱中,位于3 311、2 927、1 639、1 150 cm-1处的吸收峰与复合壁材的红外光谱吸收峰相符。但其位于1 639 cm-1处的峰与天然榛香物质中1 658 cm-1处的峰相比,峰值较强且发生偏移,此外天然榛香物质2 873 cm-1处的特征峰在其光谱中消失,整体趋势上峰值与峰面积变弱。这一结果与Zjab等[15]的研究一致,说明复合壁材的光谱更强与天然榛香物质的峰值发生重叠并掩盖,同时天然榛香物质与β-CD之间相互作用形成氢键。以上结果表明,天然榛香物质被有效地包埋在复合壁材中形成了包合物。
2.7 天然榛香物质微囊粉贮藏稳定性与释放规律
2.7.1 温度对贮藏稳定性的影响
从图9中可以看出,天然榛香物质微囊粉在4 ℃与25 ℃下贮藏35 d后保留率分别为96.73%和90.32%,变化不明显(P>0.05)。但在50 ℃时有较明显的下降趋势,保留率由最初的94.31%在35 d后仅为74.28%(P<0.05)。这表明,当贮藏温度逐渐升高,加速了天然榛香物质微囊粉表面水分的蒸发,使壁材形成的包膜破损,氧气扩散并接触到芯材,这一结果与唐宏刚等[19]报道的结果相似,由于高温使芯材获得较多活化能,布朗运动加快,释放速率增加。天然榛香物质在4 ℃下贮藏35 d后的保留率为92.67%,25 ℃与50 ℃下贮藏35 d后,保留率显著下降(P<0.05),分别为78.65%和57.89%,这表明天然榛香物质微囊粉能够对香气物质起到保护作用,避免外界温度过高而使其发生降解发应[34]。
2.7.2 湿度对贮藏稳定性的影响
从图10中可以看出天然榛香物质微囊粉在RH33%(相对湿度)下贮藏35 d后保留率依然维持在95.68%(P>0.05)。而在RH58%与RH84%下贮藏7 d后保留率就开始显著下降(P<0.05),35 d后下降至87.45%和56.37%。这是由于随着微胶囊产品吸水量增多,壁材吸湿后团聚结块,其保护强度减弱,芯材释放与氧气接触发生氧化。天然榛香物质在RH33%、RH58%与RH84%下保留率都显著降低(P<0.05),在35 d后保留率仅剩68.27%、44.93%和35.78%。以上变化趋势与廖霞等[15]的报道类似,这表明高湿条件对天然榛香物质的破坏程度明显高于天然榛香物质微囊粉。同时微胶囊能够在一定程度上保护香气物质,避免芯材吸湿从而影响产品质量[35]。
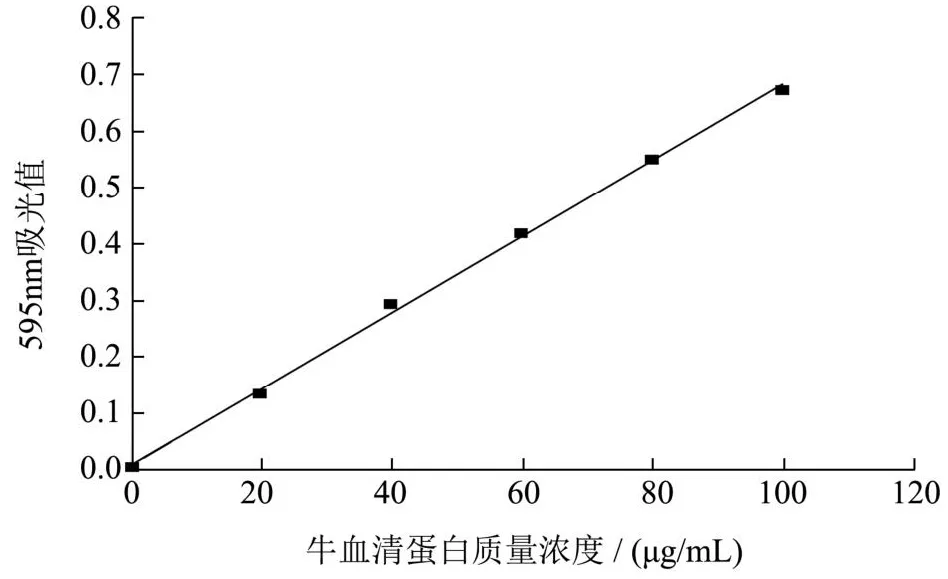
图1 牛血清蛋白标准曲线Fig.1 Standard curve of bovine serum protein
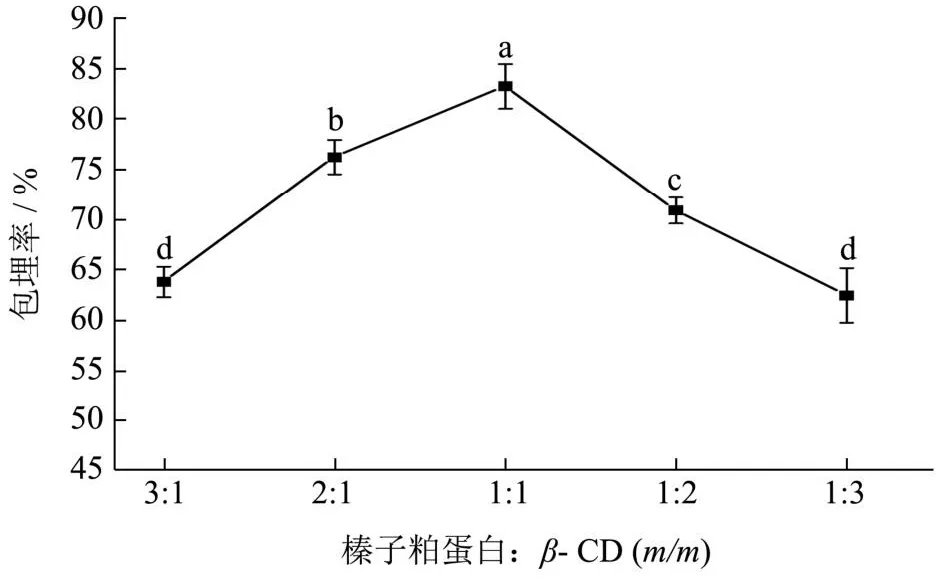
图2 复合壁材比对天然榛香物质微囊粉包埋率的影响Fig.2 Effect of composite wall ratio on the encapsulation rate of natural hazelnut substance microencapsulated powder
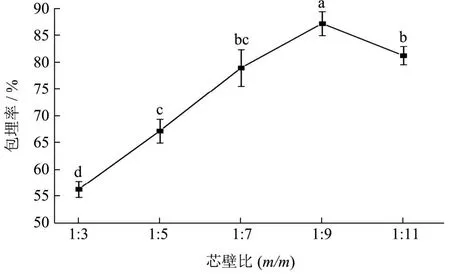
图3 芯壁比对天然榛香物质微囊粉包埋率的影响Fig.3 Effect of core-to-wall ratio on the encapsulation rate of natural hazelnut aromatic substance microencapsulated powder
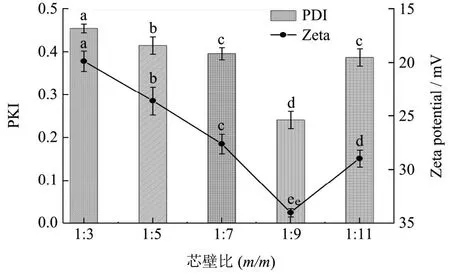
图4 芯壁比对天然榛香物质微囊粉PDI值与Zeta电位的影响Fig.4 Effect of core-to-wall ratio on the PDI and Zeta potential of natural hazelnut aromatic substance microencapsulated powder
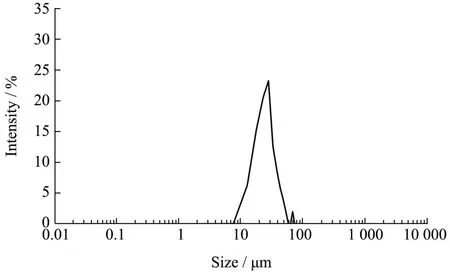
图5 天然榛香物质微囊粉粒径分析Fig.5 Particle size analysis of natural hazelnut substance microencapsulated powder

图6 扫描电镜Fig.6 Scanning electron microscope (×100)

图7 扫描电镜Fig.7 Scanning electron microscope (×2.50 k)
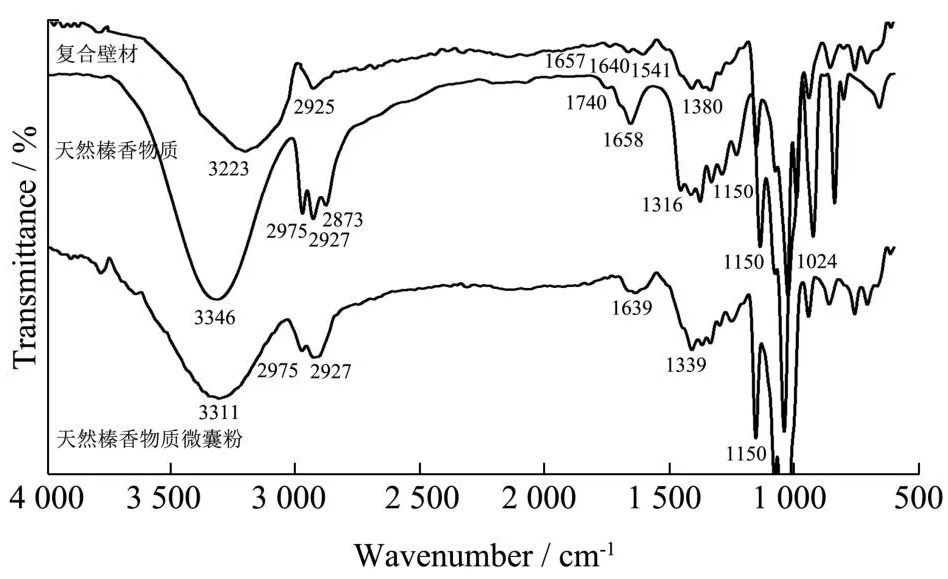
图8 傅里叶红外光谱图(复合壁材、天然榛香物质、天然榛香物质微囊粉)Fig.8 Fourier infrared spectra (composite wall material, natural hazelnut substance, natural hazelnut substance microencapsulated powder)
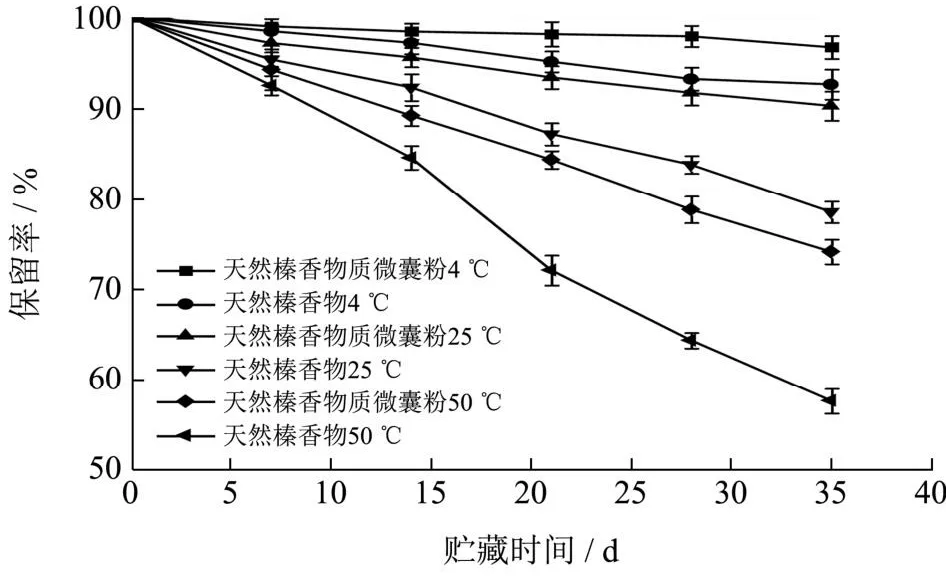
图9 不同温度对微囊粉与天然榛香物质保留率的影响Fig.9 Effect of different temperatures on the retention of microencapsulated powder and natural hazelnut aromatic substances

图10 不同湿度对微囊粉与天然榛香物质保留率的影响Fig.10 Effect of different humidity levels on the retention of microencapsulated powder and natural hazelnut aromatic substances
2.7.3 光照对贮藏稳定性的影响
从图11中可以看出天然榛香物质微囊粉避光条件下的保留率在14 d前保持很稳定(P>0.05),为98.54%,在35 d后保留率下降至95.79%(P<0.05)。天然榛香物质在贮藏7 d后保留率变化明显(P<0.05),35 d后降至79.27%。但二者与阳光接触后即发生了显著变化(P<0.05),并在7 d后出现了不同程度的氧化分解,最终测得二者在贮藏35 d后的保留率分别为79.36%和47.89%。Aslan等[21]也发现了这一变化规律,表明天然榛香物质微囊粉囊壁对香气物质起到了一定的封存和隔离作用,避免自然光直接照射内部芯材而造成其挥发。
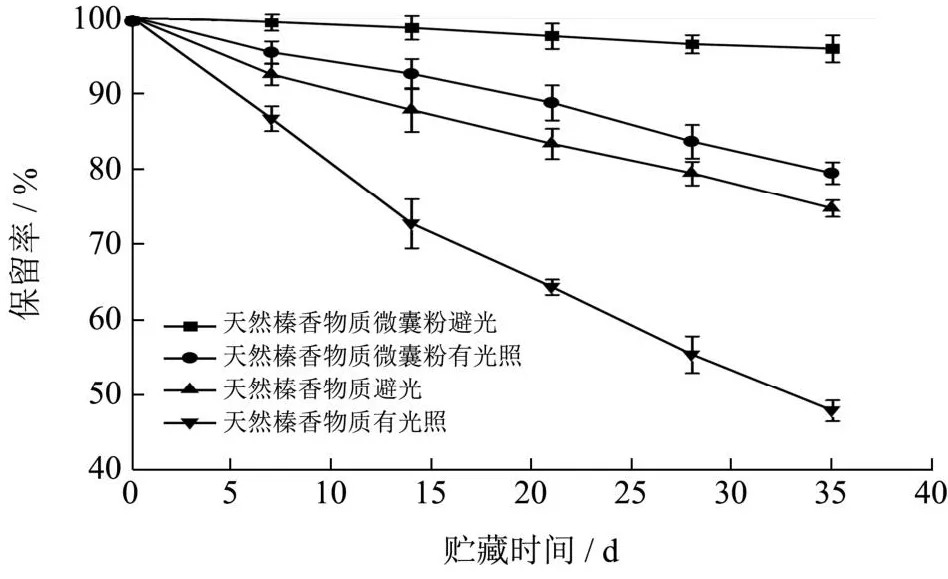
图11 光照对微囊粉与天然榛香物质保留率的影响Fig.11 Effect of light on the retention of microencapsulated powder and natural hazelnut aromatic substances
2.7.4 氧气对贮藏稳定性的影响
从图12可以看出天然榛香物质微囊粉在真空条件下随着贮藏时间的增加保留率一直很稳定(P>0.05),在35 d后保留率仍为95.86%。天然榛香物质在真空贮藏14 d后保留率变化明显(P<0.05),35 d后降至86.24%。天然榛香物质微囊粉与空气接触14 d后,出现了不同程度的氧化分解,天然榛香物质与氧气接触后即发生了显著变化(P<0.05)。测得二者最终保留率分别为74.66%和40.23%。这说明壁材可以在一定程度上隔绝外界的氧,从而有效防止芯材分解,但由于天然榛香物质微囊粉表面残留有香气物质,会使暴露在空气中的香气物质被氧化,从而使其保留率降低[22]。
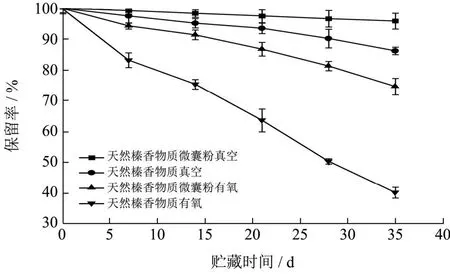
图12 氧气对微囊粉与天然榛香物质保留率的影响Fig.12 Effect of oxygen on the retention of microencapsulated powder and natural hazelnut aromatic substances
2.8 天然榛香物质微囊粉在食品模拟体系中释放
2.8.1 天然榛香物质微囊粉体外释放规律
如图13可以看出四种食品模拟体系中天然榛香物质微囊粉的整体释放率在前20 min内先快速释放,在后15 min内持续释放,并逐渐稳定。这一释放规律与Zhang等[33]的研究相似,表明微囊粉中的榛香物质在这些食品模拟体系中的释放是可预测的。
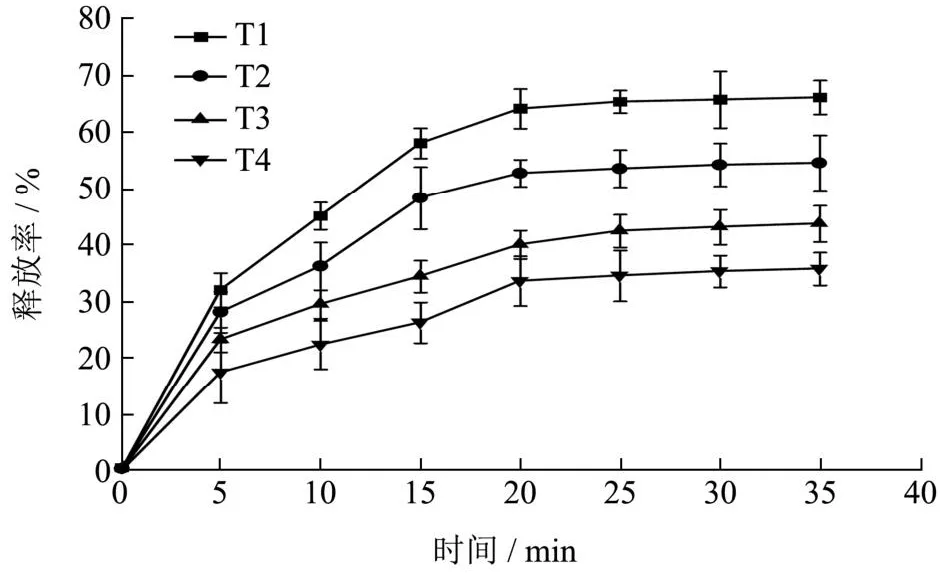
图13 天然榛香物质微囊粉体外释放规律Fig.13 In vitro release pattern of natural hazelnut aromatic substance microencapsulated powder
天然榛香物质微囊粉在T1(高醇)体系和T2(高水分活度)体系中的释放率高于其他的体系[36]。四种体系中T1(高醇)体系的释放率最高,在20 min时释放率达到64.37%,随后逐渐平稳(P>0.05)。其次是T2(高水分活度)体系,在10~15 min内释放速率陡然上升(P<0.05),释放率在53%左右逐渐平稳(P>0.05)。T3与T4体系释放水平较低,释放率分别在43%和34%左右达到稳定状态(P>0.05)。这表明天然榛香物质微囊粉在水和脂肪类食品体系中具有更好的稳定性,在高醇体系内释放速率较快。在Rahayuningsih等[37]的研究中也发现微胶囊在高醇食品体系内释放速率高于脂肪类食品体系。
2.8.2 天然榛香物质微囊粉体外释放动力学方程
表1~4表示4种食品模拟体系的释放速率分别与4种释放动力学模型拟合所得到的释放动力学方程。R2为动力学方程拟合得到的相关系数,比较R2值可知四种体系的释放规律有所差异[38]。在T1和T2体系内使用一级释放动力学模型进行拟合,其R2有最大值,方程分别为ln(Q∞-Q)=68.36+0.13t、ln(Q∞-Q)=56.01+0.12t;在T3和T4体系内使用Ritger-Peppas模型拟合,其R2有最大值,拟合方程分别为Q=18.41t0.32、Q=14.25t0.33。图14为4个模拟食品体系释放速率的动力学方程最优拟合曲线。在Ritger-Peppas模型中,n为释放机制参数,当n<0.43时,产品释放以Fick扩散为主;当0.43<n<0.85时,产品释放以非Fick扩散为主,当n>0.85时,产品释放以骨架溶蚀为主。表1~4 Ritger-Peppas模型的标准释放动力学方程中n值均低于0.43,表明四种食品模拟体系释放是通过Fick扩散发生的,属于稳态扩散。在Mm等[39]、龙门等[40]的研究中也发现在模拟食品体系内微胶囊的释放规律均符合Fick扩散。

表1 动力学释放模型拟合(T1)Table 1 Kinetic release model fitting (T1)

表2 动力学释放模型拟合(T2)Table 2 Kinetic release model fitting (T2)

表3 动力学释放模型拟合(T3)Table 3 Kinetic release model fitting (T3)

表4 动力学释放模型拟合(T4)Table 4 Kinetic release model fitting (T4)
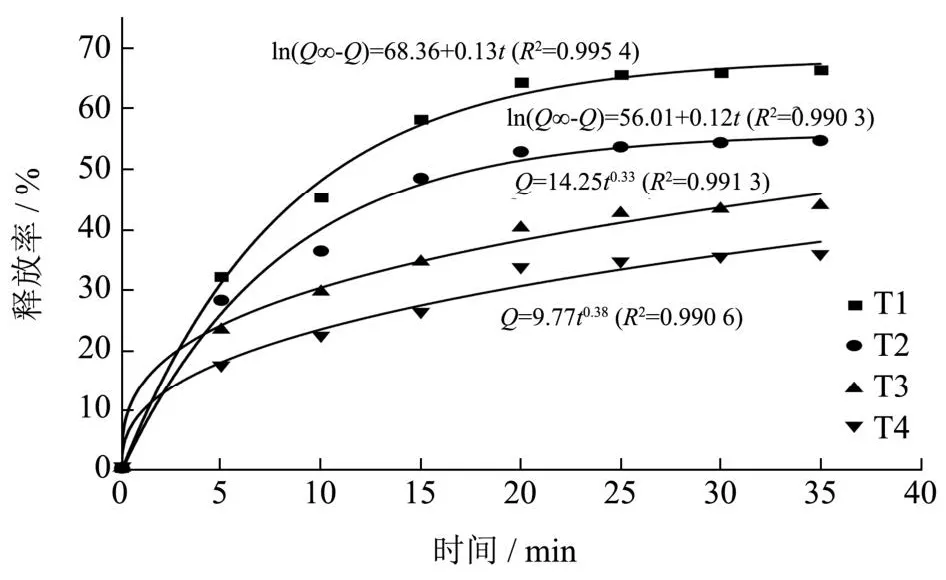
图14 天然榛香物质微囊粉体外释放规律动力学方程拟合Fig.14 Kinetic equation fitting for the in vitro release pattern of natural hazelnut substance microencapsulated powder
3 结论
通过对天然榛香物质微囊粉结构与稳定性分析,得到以下结果:在最佳条件下(芯壁比1:9,壁材比1:1)制备出的天然榛香物质微囊粉被复合壁材成功包埋,其表面光滑呈不规则柱状。
在高温、高湿、光照和氧气的贮藏条件下贮藏35 d后,相比较天然榛香物质来说微囊粉具有较好的稳定性,且在不同食品模拟体系中,微囊粉均能稳定释放。通过释放动力学方程拟合发现T1、T2体系中一级动力学方程拟合优度R2最大,T3、T4体系中内采用Ritger-Peppas模型进行拟合所得到的拟合优度R2最大。且四种食品模拟体系的释放模型中的n值均低于0.43表明释放动力学符合Fick扩散。
由此可知,以榛子粕蛋白与β-环糊精为复合壁材制备的微胶囊可显著提高天然榛香物质的稳定性,为进一步利用植物蛋白作为壁材进行微胶囊化的研究提供了参考,并且为榛子副产物的综合利用提供了新途径。
