3种方法制备的龟甲胶的理化与结构特性比较
2023-09-09于梦洁南海军张业辉赵甜甜焦文娟杨春丽陈晓瑛
于梦洁,南海军*,张业辉,赵甜甜,焦文娟,杨春丽,陈晓瑛
(1.广东药科大学中药学院,广东广州 510006)(2.广东省农业科学院蚕业与农产品加工研究所,农业农村部功能食品重点实验室,广东省农产品加工重点实验室,广东广州 510610)(3.岭南现代农业科学与技术广东省实验室,广东广州 510642)(4.广东省农业科学院水产研究所,广东广州 510645)
明胶(Glutin)是一种通过水解动物皮肤、软骨骨骼和肌腱中胶原蛋白得到的水溶性天然高分子聚合物。明胶提取通常包括两个步骤,即明胶化和热提取,胶原明胶化是指通过一定的作用力破坏胶原稳定的三螺旋结构,明胶化程度对明胶的物理和化学结构有很大的影响[1]。在胶原蛋白转化为明胶时,胶原蛋白分子间和分子内键、肽键被破坏,提取条件越剧烈,多肽键的水解度就越大[2]。明胶溶于热水,冷却后可形成凝胶,提取明胶的凝胶特性不同的原因是脯氨酸和羟脯氨酸含量的不同。我国明胶生产采用的主要方法有酸碱法和酶法。酸碱法需要排放大量废水污染物,污染环境。于淑池等[3]利用酶法从金鲳鱼鱼骨中提取明胶,通过正交试验确定了最佳提取工艺,其中酶解温度45 ℃、酶解pH值6.5、加酶量4.0%,此法提取率为21.87%。曾小芳等[4]利用超声辅助酶法从猪骨中提取骨明胶,明胶得率显著提高。胶原是一种结构蛋白,只有高温、酸、碱或胶原酶才能使胶原发生分子内分解。胶原间的交联都是在胶原分子末端的1/4处,而木瓜蛋白酶的作用位点也在这一位置[5]。
石金钱龟,又名黄喉拟水龟、黄板龟等,是传统的药用、食用品种,广东省内多地有养殖。龟甲,为龟的干燥腹甲及背甲,是传统的名贵中药材,含有丰富的胶原蛋白。龟甲胶是一种类似于明胶的块状制品,由龟甲经过前处理后,经煎煮、过滤、浓缩和干燥后得到的胶块,其主要成分也是胶原蛋白。龟甲胶性凉,味咸、甘,具有滋阴潜阳、益肾健骨、养血补心、补血活血的功效[6]。龟甲胶多用于食品,其传统的提取工艺提取率低且耗时较长。一些研究改常压提取为高温高压提取,有利于胶原蛋白的提取,出胶率高于传统工艺[7]。龟甲胶的产品性质和其他明胶相比有很大的差别,目前,关于龟甲胶的凝胶强度、流变学特性等方面也少有研究。因此,本研究从龟甲胶性质出发,探究冷凝回流法、高温高压法、酶法联合高温高压处理三种提取方式对龟甲胶蛋白含量、色泽、氨基酸组成、凝胶强度、流变学特性等理化性质的影响,旨在为龟甲胶产业开发利用提供一定的理论参考。
1 材料与方法
1.1 原料与试剂
龟甲,购自于广东云浮市完璧金钱龟养殖有限公司;木瓜蛋白酶(2 000 U/mg),购自于生工生物工程有限公司;硫酸、盐酸等其他试剂均为国产分析纯。
1.2 仪器与设备
Kjeltec 8400全自动凯氏定氮仪,福斯(FOSS)分析仪器公司;AR-1500 EX流变仪,美国TA公司;TA-XT Plus物性分析仪,英国Stable Micro Systems公司;Nicolet IS50-Nicolet Continuum傅里叶变换红外光谱仪,赛默飞世尔科技公司;S-3400N扫描电子显微镜,日本Hitachi公司;L-8900全自动氨基酸分析仪,日本Hitachi公司;PB-10台式pH计,德国Sartorius公司;Zeta电位仪(Zetasizer Nano ZSE),英国马尔文帕纳科公司;CR-400手持式色差仪,日本Konica-Minolta公司。
1.3 实验方法
1.3.1 龟甲胶的制备
1.3.1.1 高温高压煎煮制备
将粉碎后的龟甲精密称取100 g,固定料液比为1:5(龟甲重量与水体积比为1:5),使用高压锅进行煎煮,煎煮两次,每次3 h,趁热过滤分离,真空抽滤得到滤液,收集等待浓缩。将收集的滤液加热浓缩,期间不断搅拌,防止焦化,然后将胶液倒入事先称重过的凝胶盘内,在烘箱内干燥24 h,温度设为60 ℃,再于干燥器内放置两天,即得高温高压法制备的龟甲胶(Tortoise Shell Glue Prepared By High Temperature And High Pressure Method,HTSG)。
1.3.1.2 冷凝回流制备
将粉碎后的龟甲精密称取100 g,固定料液比为1:5(龟甲质量与水体积比为1:5),100 ℃加热冷凝回流提取两次,每次3 h,达到时间后停止加热,倒出提取液,后续操作同1.3.1.1,即得回流法制备的龟甲胶(Tortoise Shell Glue Prepared By Condensation Reflux Method,RTSG)。
1.3.1.3 酶法联合高温高压处理制备
将粉碎后的龟甲精密称取100 g,根据4 000 U/g加入木瓜蛋白酶,固定料液比为1:5(龟甲质量与水体积比为1:5),在50 ℃、pH值为7的条件下酶解1.5 h,然后将酶解产物转入高压锅中进行煎煮,煎煮两次,每次3 h,趁热过滤分离,后续操作同1.3.1.1,即得酶法制备的龟甲胶(Enzymatic Tortoise Shell Glue Prepared by the Combination of Enzymatic as Well as High Temperature and High Pressure Method,ETSG)。
1.3.2 龟甲胶得率及蛋白含量测定
龟甲胶得率计算见下式:
式中:
Y——龟甲胶得率,%;
m1——龟甲胶干质量,g;
m0——龟甲粉质量,g。
参考GB 5009.5-2016,胶原蛋白含量采用凯式定氮法测定,称取固体样品0.1 g至消化管中,依次加入10 mL硫酸、消化片,置于消化炉进行消化,升温至420 ℃后,消化2.5 h,待其冷却于蛋白质分析仪上测定。
1.3.3 龟甲胶氨基酸组成分析
参考GB 5009.124-2016,称取20 mg龟甲胶样品于水解管中,加入6 mol/L的盐酸溶液5 mL,充氮后封管。在110 ℃油浴中水解22 h,拿出冷却到室温,过滤,取1 mL滤液60 ℃油浴脱酸,再加入1 mL超纯水油浴蒸干两次,加入缓冲液稀释10倍,混合均匀后用针管吸取少量,经0.22 μm有机滤膜过滤,全自动氨基酸分析仪检测。
1.3.4 龟甲胶色度的测定
配制6.67%(m/V)的龟甲胶溶液,使用手持式色差仪测定龟甲胶的色泽。
1.3.5 龟甲胶Zeta电位的测量
参考杜翰[8]的方法,每组分别制备5 mg/mL的龟甲胶溶液,并用蒸馏水稀释至0.5 mg/mL,使用1 mol/L NaOH和1 mol/L HCl溶液将pH值调节为3.0、5.0、7.0和9.0,然后将样品加到毛细管Zeta池中,使用Zeta电位仪测其Zeta电位。
1.3.6 龟甲胶凝胶强度测定
配制6.67%的龟甲胶溶液,在室温下充分溶胀1 h,60 ℃水浴加热30 min至完全溶解,冷却后放入4 ℃冰箱,并在此温度保持16~18 h,立即取出测定其凝胶强度。选用P05的探头,触发点负载为5 g,下压速率1 mm/s,下压距离4 mm,测后速率2 mm/s,测定三次,计算平均值。
1.3.7 龟甲胶流变性质的测定
1.3.7.1 粘弹性
参考Abdelmalek等[9]的方法,配制质量分数为6.67%的龟甲胶溶液,使用40 mm平板夹具,在25 ℃,剪切速率0.1~100 rad/s,应变0.5%的条件下进行动态频率扫描。
1.3.7.2 表观粘度
参考Huang等[10]的方法,使用40 mm平板夹具,在25 ℃,剪切速率为0.01~100 rad/s的条件下进行表观粘度的测定。
1.3.7.3 温度扫描
参考Sha等[11]的方法,使用流变仪温度扫描模式测定龟甲胶的胶凝温度和熔化温度。温度变化分为三个部分,分别为降温、恒温和升温,其中降温阶段为40~4 ℃,在4 ℃保持5 min,升温阶段为4~40 ℃,频率为1 Hz,应变为3 Pa,冷却和加热速率为2 ℃/min。绘制储能模量(G')和损耗模量(G″)随温度变化的曲线。
1.3.8 傅里叶变换红外光谱
取适量样品,在干燥灯下与KBr充分研磨成粉末状,在压片机中手动压片,将压片后样品置于样品室内测定分析。扫描范围为4 000~500 cm-1,分辨率为2 cm-1。
1.3.9 扫描电镜观察
将冻干后的龟甲胶样品粘于导电胶上,二氧化碳干燥,离子喷射仪喷金,扫描电子显微镜在15 kV的加速电压下观察样品微观结构。
1.3.10 数据分析
采用SPSS 24对数据进行数据处理,结果以平均值±标准偏差的形式表示,采用Duncan多重检验法进行显著性分析,使用Origin 2021进行分析和绘图。
2 结果与讨论
2.1 不同提取方法对龟甲胶得率及蛋白含量的影响
如图1所示,RTSG、HTSG和ETSG的得率分别为8.69%、12.28%和12.80%,蛋白含量分别为59.53%、74.45%和77.57%(wt%)。与RTSG相比,HTSG和ETSG的得率及蛋白含量显著增大(P<0.05),表明高温高压法比冷凝回流法得到的龟甲胶得率和蛋白含量高;与HTSG相比,ETSG蛋白含量也显著增大(P<0.05),这可能是由于胶原蛋白分子连接紧密,木瓜蛋白酶可以切除胶原分子末端肽,导致胶原蛋白的三螺旋结构被破坏,有利于胶原蛋白的提取[12]。在郑洁[13]的研究中,龟甲胶对照药材的胶原蛋白含量为79.62%,HTSG、ETSG的蛋白含量与之接近,而RTSG偏低,这可能是由于回流法提取不彻底,可增加提取时间使龟甲胶提取完全。

图1 不同提取方法对龟甲胶得率及蛋白含量的影响Fig.1 Effects of different extraction methods on the protein content and yield of tortoise shell glue
2.2 不同提取方法对龟甲胶水解氨基酸组成的影响
三种方法提取的龟甲胶氨基酸组成分析见表1。由表1可知,三种方法提取的龟甲胶有着极为相似的氨基酸组成,甘氨酸的含量最高,这是因为龟甲胶来源于胶原蛋白,甘氨酸存在于其三螺旋结构序列的每三个残基[14]。此外龟甲胶的氨基酸组成有一个特点,即含有脯氨酸和羟脯氨酸(亚氨基酸),羟脯氨酸和脯氨酸是胶原蛋白独有的[15],脯氨酸是仅次于甘氨酸的第二丰富的氨基酸,羟脯氨酸经盐酸水解后转变为脯氨酸,因此结果中显示的脯氨酸即为亚氨基酸含量[16]。高温提取会导致胶原蛋白分子的部分氨基酸被水解,酶解也会切除胶原蛋白末端肽,导致亚氨基酸含量降低[17]。亚氨基酸含量较高的龟甲胶表现出更好的粘弹性和更强的凝胶结构[18]。
2.3 不同提取方法对龟甲胶色泽的影响
龟甲胶的色度分析结果如表2所示,L*表示样品亮度,a*表示红绿色差,b*表示蓝黄色差,RTSG与HTSG的L*值显著高于ETSG(P<0.05),表明与ETSG相比,RTSG和HTSG的颜色偏亮、偏白,ETSG相比RTSG和HTSG有更低的b*值,表明其颜色为偏黄[19],与所测结果一致。

表2 不同方法提取对龟甲胶氨基酸的影响Table 2 Effects of different extraction methods on amino acids of tortoiseshell glue
2.4 不同提取方法对龟甲胶Zeta电位的影响
不同方法提取的龟甲胶的Zeta电位随pH值的变化如图2所示,龟甲胶溶液在其等电点处净电荷为零[20]。由结果可知,RTSG、HTSG、ETSG的等电点分别为4.8、4.7、4.6。在低于等电点的pH值下,所有龟甲胶样品都被质子化,这导致龟甲胶产生净正电荷,另一方面,龟甲胶分子去质子化并在高于其等电点的pH值时带负电[21]。RTSG、HTSG、ETSG的等电点处于酸性pH值,这可能是谷氨酸和天冬氨酸导致的,谷氨酸和天冬氨酸在高温下由谷氨酰胺和天冬酰胺分别水解而来,所以等电点值降低[22]。
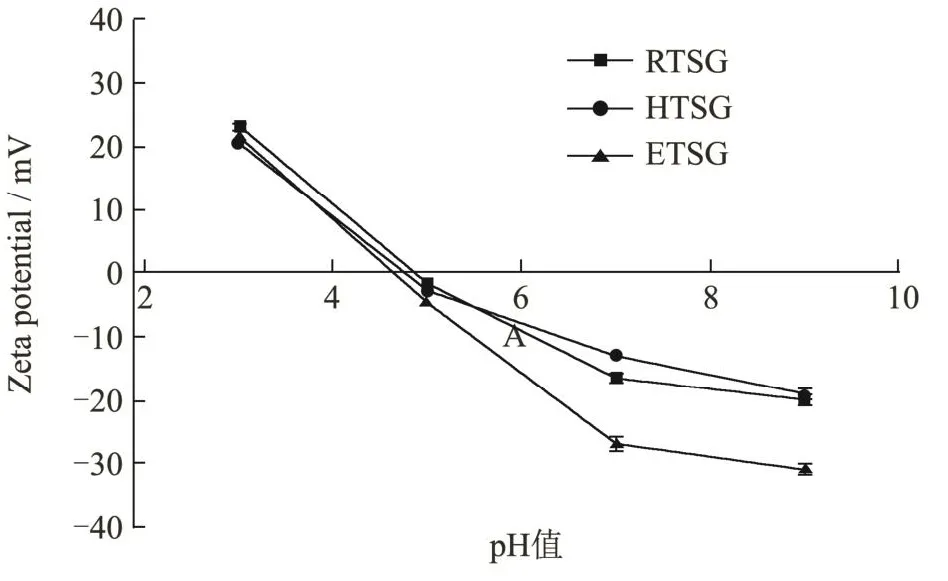
图2 不同提取方法对龟甲胶Zeta电位的影响Fig.2 Effects of different extraction methods on Zeta potential of tortoise shell glue
2.5 不同提取方法对龟甲胶凝胶强度的影响
凝胶强度是评价明胶的重要指标,提取温度对明胶的凝胶强度有显著影响,提取温度越高,胶原亚基组分被分解,凝胶强度就会降低[23]。龟甲胶样品的凝胶强度如图3所示,RTSG凝胶强度达到最大值93.29 g,这可能是因为高温高压法比冷凝回流法提取的温度高,随着温度的升高,龟甲胶分子发生降解,分子链变短,所以HTSG、ETSG的凝胶体系内部作用力变小,凝胶强度降低[24]。ETSG凝胶强度最低,这可能是由于木瓜蛋白酶破坏了胶原蛋白的非螺旋区,导致三螺旋结构松散,小分子成分含量高,凝胶强度低[25]。
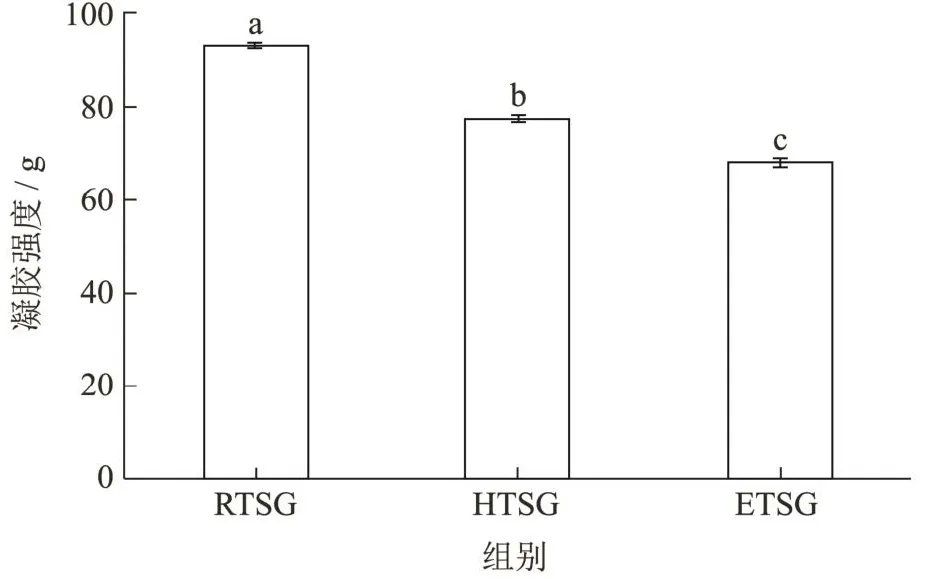
图3 不同提取方法对龟甲胶凝胶强度的影响Fig.3 Effects of different extraction methods on the gel strength of tortoise shell glue
2.6 不同提取方法对龟甲胶流变学特性的影响
2.6.1 不同提取方法对龟甲胶粘弹性的影响
龟甲胶溶液具有一定的粘弹性,G'表示储能模量,G″表示损耗模量。如图4所示,随着频率的增大,三种龟甲胶的G'和G″都呈上升的趋势,与HTSG、ETSG相比,RTSG的G'和G″较高,这可能是由于提取温度高,反应条件剧烈,导致凝胶网络的内部交联度降低,G'和G″降低,所以HTSG和ETSG的G'和G″较低,说明龟甲胶的内部交联强,凝胶稳定性好[26]。
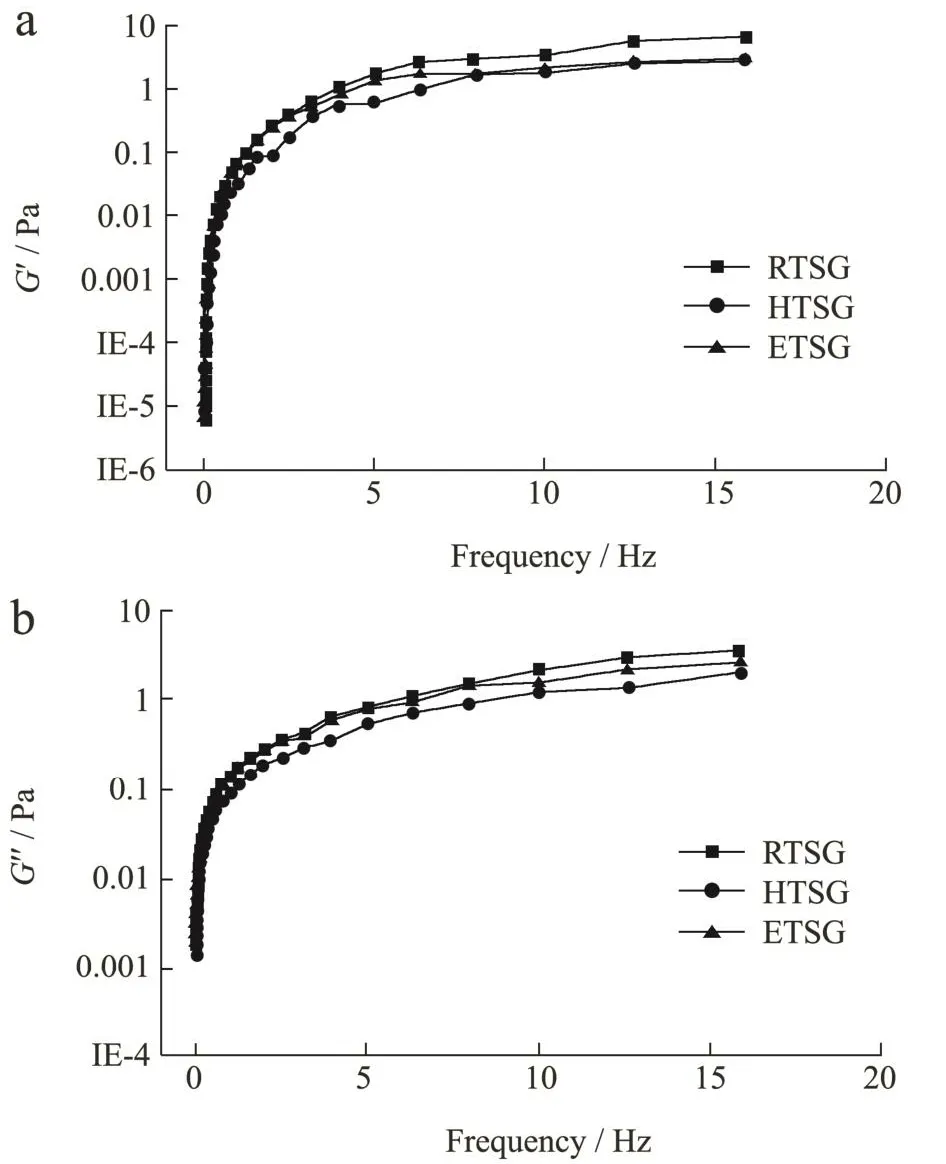
图4 不同提取方法对龟甲胶粘弹性的影响Fig.4 Effects of different extraction methods on the viscoelasticity of tortoise shell glue
2.6.2 不同提取方法对龟甲胶表观粘度的影响
粘度是明胶的第二个重要的物理特性,受肽的分子量和分散性控制,较高的分子量会增加粘度[27]。粘度的变化反映了蛋白质分子间力的变化,分子引力越大,蛋白质的粘度越高。由图5可知,三种样品的粘度一直处于较低的状态,这是典型的剪切稀化行为,说明该明胶体系为假塑性流体。与RTSG相比,HTSG和ETSG粘度较低,这可能是因为随着剪切频率的变化,聚合物链将在剪切流的方向上对齐,含有低分子量肽的龟甲胶可以很容易地排列并表现出较低的粘度[28],Jamilah[27]等的研究同样表明粘度部分受肽的分子量和多分散性控制,较高的分子量会增加粘度。

图5 不同提取方法对龟甲胶表观粘度的影响Fig.5 Effects of different extraction methods on the apparent viscosity of tortoise shell glue
2.6.3 不同提取方法对龟甲胶降温和升温过程中G'和G″的影响
图6中显示了在加热和冷却过程中G'和G″的变化趋势,G'和G″均在降温过程中增大,在加热过程中减小。这与Norziah等[29]的研究结果相同。随着温度的降低,G'和G″逐渐增加,这个过程表明凝胶正在形成。在升温过程中,G'和G″逐渐降低,当温度升高至一定温度时,G'和G″出现交点,凝胶开始融化。当温度较高时,龟甲胶的储能模量低于损耗模量,此时龟甲胶处于液态,说明龟甲胶分子为单链。

图6 不同提取方法对龟甲胶降温和升温过程中G'和G″的影响Fig.6 Effects of different extraction methods on G' and G''during cooling and heating of tortoiseshell gum
以上结果表明,龟甲胶为热可逆凝胶,凝胶和溶胶的过程就是α链从单链组成螺旋结构以及从螺旋结构解旋成单链的过程[30]。我们通常把温度变化过程中G'和G″的交点当作凝胶点和融化点。如图6所示,RTSG凝胶点为5.56 ℃,融化点14.86 ℃;HTSG凝胶点为4.76 ℃,融化点14.33 ℃;ETSG凝胶点为5.47 ℃,融化点14.71 ℃。与凝胶强度相似,胶凝温度和熔化温度同样与亚氨基酸含量和分子质量有关[31],RTSG的胶凝点和融化点略高于HTSG和ETSG,但差异不显著,这可能是由于RTSG的亚氨基酸组成较高,增加了亚氨基酸残基和水分子结合形成的氢键,从而生成更稳定的分子间结构,更容易形成凝胶[15]。
2.7 不同提取方法对龟甲胶红外光谱的影响
由图7可知,三种方法提取的龟甲胶的光谱图类似,但它们的峰值位置和幅度略有不同,都具有胶原蛋白的特征振动模式。

图7 不同提取方法对龟甲胶红外光谱的影响Fig.7 Effect of different extraction methods on the infrared spectrum of tortoise shell glue
酰胺A是一个宽吸收带,通常出现在3 400~3 440 cm-1之间,它是由N-H伸缩振动产生的,当酰胺A参与氢键的形成时,可能会往低波数移动[32]。RTSG、HTSG、ETSG的酰胺A带位置分别位于3 431、3 444和3 435 cm-1。随着提取温度升高,反应条件剧烈,酰胺A带发生蓝移,说明提取温度升高会在一定程度上破坏龟甲胶分子间的氢键[33]。酰胺B带是由C-H的不对称收缩振动引起的。
一般而言,酰胺Ⅰ带应该出现在1 600~1 700 cm-1之间,主要与C=O的伸缩振动有关[34]。它可能是反映龟甲胶二级结构的主要区域,因为酰胺Ⅰ的位置说明了氢键和蛋白质的结构构象。酰胺Ⅰ带与蛋白肽链骨架的有序程度密切相关,有序度越高,则酰胺Ⅰ带的波数越大[35]。RTSG、HTSG、ETSG的酰胺Ⅰ带位置分别位于1 641、1 639和1 639 cm-1,表明RTSG分子更加有序。酰胺Ⅱ带由N-H和C-N基团的伸缩振动产生[22],酰胺Ⅲ带代表C-N伸缩振动和N-H弯曲振动,以及甘氨酸主链和脯氨酸侧链的CH2振动[32]。RTSG、HTSG、ETSG的酰胺Ⅲ带分别位于1 242、1 249和1 244 cm-1,这说明与RTSG相比,HTSG、ETSG的三螺旋结构被破坏更严重[36]。
2.8 不同提取方法对龟甲胶微观结构的影响
通过扫描电子显微镜观察到三种龟甲胶的微观结构,结果如图8所示。HTSG和ETSG都呈现多孔网络状结构,ETSG孔径较多,且大小不一呈不均匀分散,表明酶可能使胶原蛋白的部分结构发生了变化,但网络结构还得以保持[37]。RTSG有更小和更少的空隙,也就是说具有较高凝胶强度的龟甲胶具有更小和更少的空隙,表明有更好的凝胶网络[15],类似的结果也被Kaewruang等[38]报道,他指出随着提取温度和时间的增加,明胶的凝胶网络变得更粗糙,具有更大的空隙。
3 结论
本研究分析对比了不同提取方法对龟甲胶理化性质的影响。RTSG具有较高的凝胶特性,氨基酸组成分析刚好与之对应,龟甲胶中亚氨基酸含量较低,所以胶凝温度和熔化温度较低。红外光谱图显示,不同方法提取的龟甲胶在酰胺区都具有胶原蛋白的特征振动模式。三种方法提取的龟甲胶呈多孔网络状结构,具有较高凝胶强度的RTSG有更小和更少的空隙,表明有更好的凝胶网络。不同提取方法通过改变龟甲胶的蛋白含量及氨基酸的多少影响龟甲胶的内部结构,进而影响龟甲胶的凝胶强度、流变学特性等理化性质,综上所述RTSG具有较好的性质,本研究结果可为龟甲胶质量标准控制提供参考。
