基于TGF-β1/PI3K/Akt通路探讨加味沙参麦冬汤对慢性萎缩性胃炎大鼠的影响
2023-09-09刘远婷丁甜甜李国英
刘远婷, 李 慧, 丁甜甜, 赵 磊, 李国英
(新疆医科大学第七附属医院, 1. 医务科, 2. 中医科, 4. 药学部, 新疆 乌鲁木齐, 830028;3. 新疆医科大学校医院, 新疆 乌鲁木齐, 830011)
慢性萎缩性胃炎(CAG)是一种常见的消化系统疾病,病理特征是胃黏膜慢性炎症、黏膜萎缩和肠化生改变[1]。CAG属于癌前病变,如果治疗不及时可演变为胃癌。CAG病因复杂,目前认为主要与幽门螺杆菌感染、摄入过多亚硝酸盐类食物、饮酒、吸烟等有关。西医主要以根治幽门螺杆菌、保护胃黏膜等对症处理,但副作用大,效果差强人意。因此,寻找新的治疗方法显得尤为重要。中医学认为CAG属于“胃萎”“胃痞证”范畴,胃阴不足是主要病因,治疗原则为滋阴健胃[2]。沙参麦冬汤出自《温病条辨》,具有润肺止咳、滋阴养血、理气化瘀的功效,不仅在治疗小细胞肺癌、食管癌等肿瘤中效果明显,在治疗肺炎、胃炎方面也有一定的疗效[3-5]。研究[6]发现,沙参麦冬汤可促进CAG大鼠胃黏膜胃肠激素的产生,逆转胃黏膜萎缩,增加胃黏膜血流量。体内实验[7]已经证实沙参麦冬汤可在一定程度上改善CAG,但具体机制尚不清楚。转化生长因子-β1(TGF-β1)是一种多肽生长因子,在调节细胞增殖、分化,维持胃肠道环境稳定中发挥重要作用[8]。研究[9]表明, TGF-β1可阻止胃腺体的生长,促进肌成纤维细胞向平滑肌细胞转化,最终导致CAG发生。此外,胃癌细胞高表达TGF-β1,TGF-β1表达水平与幽门螺杆菌诱导的慢性胃炎严重程度呈正相关[10]。人磷脂酰肌醇三羟基激酶(PI3K)/Akt通路是TGF-β1的下游通路,在胃炎的发生发展过程中被激活。幽门螺杆菌可通过PI3K/Akt途径负调控Sival蛋白破坏胃上皮细胞[11]。因此,本研究探讨沙参麦冬汤对1-甲基-3-硝基-1-亚硝酸胍(MNNG)诱导的CAG大鼠的治疗作用及其对TGF-β1/PI3K/Akt信号通路的影响,以期为沙参麦冬汤的临床应用提供参考。
1 材料与方法
1.1 实验动物
60只8周龄的SPF雄性SD大鼠,体质量150~170 g, 购自上海市计划生育科学研究所实验动物事业部,实验动物证书编号为20180006020302, 生产许可证号: SCXK(京)2019-0010。饲养条件: 温度为(25.0±0.5) ℃, 相对湿度为(55±5)%, 交替光照(12 h光照, 12 h暗照循环),安静环境,自由获取食物和水。动物饲养于福建中医药大学SPF动物实验中心[SYXK(闽)2019-0007], 本实验经福建中医药大学动物伦理委员会批准(FJTCMIACUCC2020075)。
1.2 药物、试剂及仪器
加味沙参麦冬汤主要由北沙参12 g、玉竹9 g、麦门冬9 g、生扁豆9 g、天花粉9 g、桑叶6 g、生甘草3 g、白芍9 g和木瓜9 g组成。将药材放入旋转蒸发器(上海亚荣生化仪器有限公司)中,获得了浓度为2 g/mL的药物溶液,该溶液在90 ℃、0.07 MPa下浓缩,高压灭菌后4 ℃冰箱储存。试剂及仪器: 维酶素片(广西大海阳光药业有限公司), MNNG(上海跃腾生物技术有限公司),苏木素伊红(HE)染色试剂盒(上海双赢生物科技有限公司),大鼠白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)酶联免疫吸附测定(ELISA)试剂盒(上海纪宁生物科技有限公司),胃动素(MTL)、胃泌素(Gas)、生长抑素(SS)ELISA试剂盒(上海纪宁生物科技有限公司),兔抗大鼠TGF-β1、PI3K、Akt、p-PI3K、p-Akt及β-actin抗体、山羊抗兔二抗(美国Affinity公司),增殖细胞核抗原(PCNA)、B淋巴细胞瘤-2(Bcl-2)(美国Abcam公司),TGF-β1、PI3K、Akt、p-PI3K、p-Akt及GAPDH引物(广州锐博生物有限公司), RIPA裂解液(上海碧云天生物有限公司),蛋白酶、磷酸酶抑制剂(北京索莱宝生物有限公司),BeyoFastTMSYBR Green qPCR Mix试剂盒(上海碧云天生物有限公司)。Olympus光学显微镜(日本Olympus), ABI 7500 PCR仪(美国ABI公司),天能VE-586曝光机(上海天能公司)。
1.3 建模、分组及处理
60只大鼠适应性饲养7 d后,随机选取12只作为空白组。空白组大鼠正常饮食、活动。其余大鼠均构建CAG模型,具体步骤如下: 大鼠自由食用MNNG(170 μg/mL, 溶液放置于棕色瓶子中),并结合不规律饮食(1 d饱食, 1 d禁食),并每隔1 d给予MNNG灌胃(1 mL/100 g), 持续10周。安乐死大鼠后对胃黏膜组织进行病理学观察,胃黏膜变薄,黏膜固有腺体和上皮细胞减少,出现点片状红斑及出血点,腺体排列紊乱说明建模成功。建模成功后的大鼠随机分为4组(12只/组): 模型组、阳性对照组、低剂量组及高剂量组。空白组大鼠给予等体积(10 mL/kg)生理盐水灌胃, 1次/d, 共12周。阳性对照组大鼠给予维酶素溶液(50 mg/kg)灌胃, 1次/d, 共12周。低剂量组及高剂量组大鼠分别给予加味沙参麦冬汤5、10 g/kg灌胃, 1次/d, 共12周。
1.4 观察指标
1.4.1 HE染色观察胃组织病理改变: 最后一次给药结束,各组大鼠安乐死后剖腹取出胃组织,首先进行大体观察,然后剖开胃观察胃皱褶、颜色。随后将胃组织用福尔马林浸泡48 h, 石蜡包埋,制备5 μm切片, 37 ℃烤箱过夜,依次通过二甲苯、梯度酒精、苏木素、盐酸酒精、氨水、伊红,再通过梯度酒精、二甲苯,最后封片,显微镜下观察胃组织病理改变。
1.4.2 ELISA检测大鼠血清MTL、Gas及SS含量: 最后一次给药结束,采用摘眼球采血方法收集各组大鼠外周血, 1 200转/min离心10 min, 保留上清, -20 ℃保存,根据试剂盒说明书步骤检测MTL、Gas及SS水平。
1.4.3 ELISA检测大鼠胃组织IL-6、TNF-α水平: 最后一次给药结束,各组大鼠安乐死后剖腹取出胃组织,用无菌剪刀剪碎组织,然后研磨成均浆,加入红细胞裂解液, 12 000转/min离心10 min, 保留上清, ELISA检测胃组织IL-6、TNF-α含量,具体步骤按照试剂盒说明书进行。
1.4.4 免疫组化检测胃组织PCNA、Bcl-2表达: 最后一次给药结束,各组大鼠安乐死后剖腹取出胃组织,随后将胃组织用福尔马林浸泡48 h, 石蜡包埋,制备5 μm切片, 37 ℃烤箱过夜,依次通过二甲苯、梯度酒精,高压进行抗原修复,山羊血清室温封闭1 h, 加入PCNA(1∶200)、Bcl-2(1∶200)一抗4 ℃冰箱过夜,次日将暗盒复温1 h, 磷酸盐缓冲液(PBS)洗涤3次后加入二抗室温1 h, PBS洗涤3次,然后依次通过苏木素、盐酸酒精、氨水、伊红,再通过梯度酒精、二甲苯,最后中性树胶封片,显微镜下观察。使用半定量分级方法来量化PCNA、Bcl-2表达水平。阳性细胞比例: 通过计数在高倍视野(400倍)下随机观察到的5个场中的阳性细胞数和总细胞数比值。根据阳性细胞的百分比进行评分: 0分为≤5%, >5%~25%为1分, >25%~50%为2分, >50%为3分。根据阳性细胞的染色强度评分: 0分为未染色, 1分为淡黄色, 2分为棕黄色, 3分为棕色。将阳性细胞百分比评分与染色强度评分相乘得到最终分数: 0分为阴性(-), 1~2分为弱阳性(+), 3~4分为中度阳性(), 5~6分为强阳性()。
1.4.5 实时荧光定量聚合酶链反应(RT-qPCR)检测胃组织TGF-β1、PI3K、Akt、p-PI3K、p-Akt表达水平: 用无菌剪刀剪碎组织,然后研磨成均浆,加入1 mL Trizol, 利用一步法提取总RNA, 检测浓度,根据试剂盒说明书合成cDNA, 反应条件为30 ℃ 10 min, 42 ℃ 30 min, 99 ℃ 5 min, 4 ℃ 5 min。按照荧光定量试剂盒说明进行PCR, 循环条件: 95 ℃ 5 s, 60 ℃ 34 s, 共40个循环,构建溶解曲线,相对表达量用2-△△Ct法计算。内参使用GAPDH。引物序列见表1。

表1 引物序列
1.4.6 蛋白质印迹法(Western blot)检测胃组织TGF-β1、PI3K、Akt、p-PI3K、p-Akt表达: 用无菌剪刀剪碎组织,然后研磨成均浆,加入RIPA细胞裂解溶液提取总蛋白, 100 ℃煮5 min, 测定蛋白浓度及纯度,加入5×loading稀释蛋白, -20 ℃保存。制备分离胶、浓缩胶,每孔加入30 μg样品,先设置电压70 V, 待蛋白maker分离后,调整电压为120 V, 蛋白loading到达分离胶边缘时停止电泳,小心切胶,放在滤纸、聚偏二氟乙烯(PVDF)膜上, 150 mA条件下转膜1 h, 5%脱脂奶粉常温封闭1 h, 加入TGF-β1(1∶1 000)、PI3K(1∶1 000)、Akt(1∶1 000)、p-PI3K(1∶1 000)、p-Akt(1∶1 000)孵育4 ℃过夜,次日洗膜3次后,加入二抗室温孵育1 h。洗涤3次后,加入曝光液,上机ECL法发光, Image J分析条带灰度值,以β-actin作为参照,分析目的蛋白表达水平。
1.5 统计学分析

2 结 果
2.1 各组大鼠胃组织病理形态变化
大体观察,空白组大鼠胃组织红润,可见褶皱。模型组大鼠胃组织苍白,褶皱明显减少。与模型组比较,阳性对照组和加味沙参麦冬汤高、低剂量组胃组织颜色变得红润,褶皱增多,且剂量越高,改变越明显,见图1。

图1 各组大鼠胃大体观
病理组织学观察显示,空白组大鼠胃黏膜腺体相对较厚且数量众多,上皮细胞排列整齐,无缺陷或剥落,腺体形状规则,大小一致。模型组大鼠胃黏膜萎缩变薄,腺体减少,出现水肿、表面剥落,可见炎症细胞浸润。阳性对照组大鼠胃黏膜组织萎缩改善,上皮细胞排列欠规则,少量剥落,腺体的形状基本规则,尺寸和形状基本一致。与模型组比较,加味沙参麦冬汤高、低剂量组大鼠胃黏膜各层结构基本恢复,腺体排列较规则,腺体萎缩好转,且剂量越高,组织病理学恢复越佳,见图2。

图2 各组大鼠胃黏膜组织病理改变(HE染色)
2.2 各组大鼠血清MTL、Gas及SS水平
与空白组比较,模型组大鼠血清MTL水平升高, Gas、SS水平降低,差异有统计学意义(P<0.01); 与模型组比较,阳性对照组、低剂量组及高剂量组大鼠血清MTL水平降低, Gas、SS水平升高,差异有统计学意义(P<0.01); 与低剂量组比较,高剂量组大鼠血清MTL水平降低, Gas、SS水平升高,差异有统计学意义(P<0.01), 见表2。
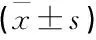
表2 各组大鼠血清MTL、Gas及SS水平比较 pg/mL
2.3 各组大鼠胃组织IL-6、TNF-α水平比较
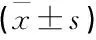
表3 各组大鼠胃组织IL-6、TNF-α水平比较 pg/mL
与空白组比较,模型组大鼠胃组织IL-6、TNF-α水平升高,差异有统计学意义(P<0.01); 与模型组比较,阳性对照组、低剂量组及高剂量组大鼠胃组织IL-6、TNF-α水平降低,差异有统计学意义(P<0.01); 与低剂量组比较,高剂量组大鼠胃组织IL-6、TNF-α水平降低,差异有统计学意义(P<0.01), 见表3。
2.4 各组大鼠胃组织PCNA、Bcl-2蛋白表达比较
与空白组比较,模型组大鼠胃组织Bcl-2蛋白表达升高,PCNA蛋白表达降低,差异有统计学意义(P<0.05); 与模型组比较,阳性药物组、低剂量组及高剂量组大鼠胃组织Bcl-2蛋白表达降低,PCNA蛋白表达升高,差异有统计学意义(P<0.05); 与低剂量组比较,高剂量组大鼠胃组织Bcl-2蛋白表达降低, PCNA蛋白表达升高,差异有统计学意义(P<0.05), 见图3、表4。
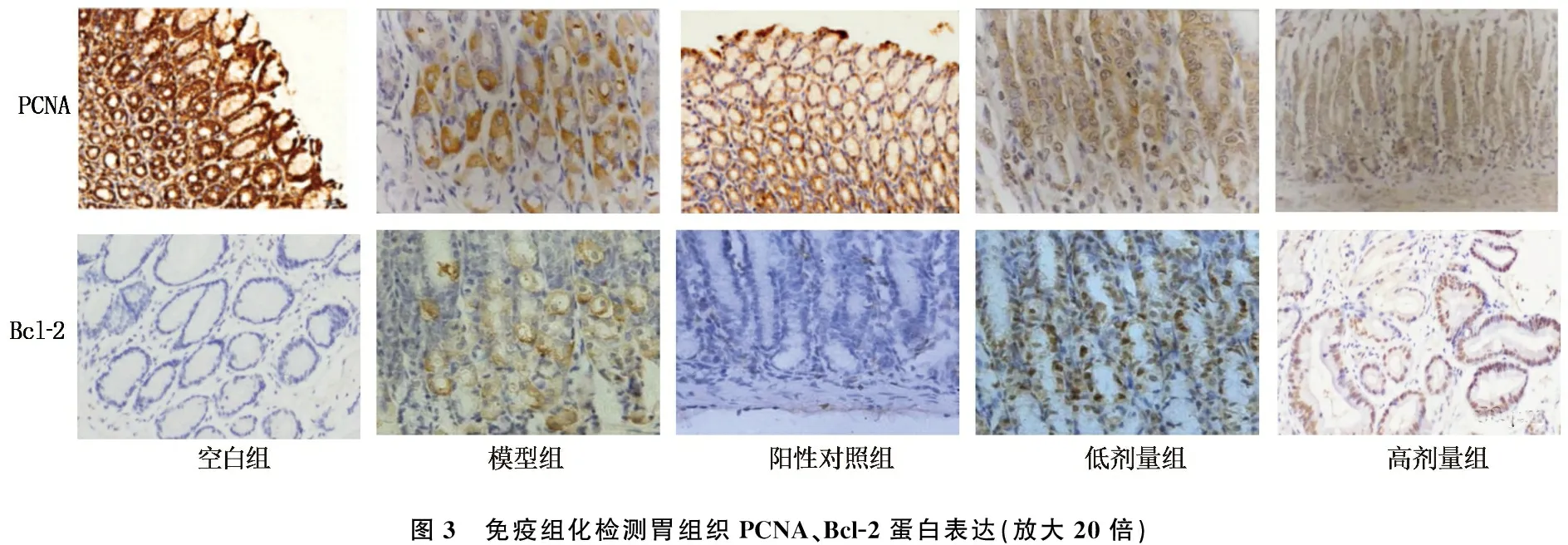
图3 免疫组化检测胃组织PCNA、Bcl-2蛋白表达(放大20倍)

表4 各组大鼠胃组织PCNA、Bcl-2蛋白表达比较
2.5 各组大鼠胃黏膜组织TGF-β1/PI3K/Akt通路mRNA表达水平比较

表5 各组大鼠胃黏膜组织TGF-β1/PI3K/Akt通路蛋白表达水平比较
与空白组比较,模型组大鼠胃组织TGF-β1、PI3K、Akt、p-PI3K、p-AktmRNA水平升高,差异有统计学意义(P<0.01); 与模型组比较,阳性对照组、低剂量组及高剂量组大鼠胃组织TGF-β1、PI3K、Akt、p-PI3K、p-AktmRNA水平降低,差异有统计学意义(P<0.01); 与低剂量组比较,高剂量组大鼠胃组织TGF-β1、PI3K、Akt、p-PI3K、p-AktmRNA水平降低,差异有统计学意义(P<0.01), 见图4。
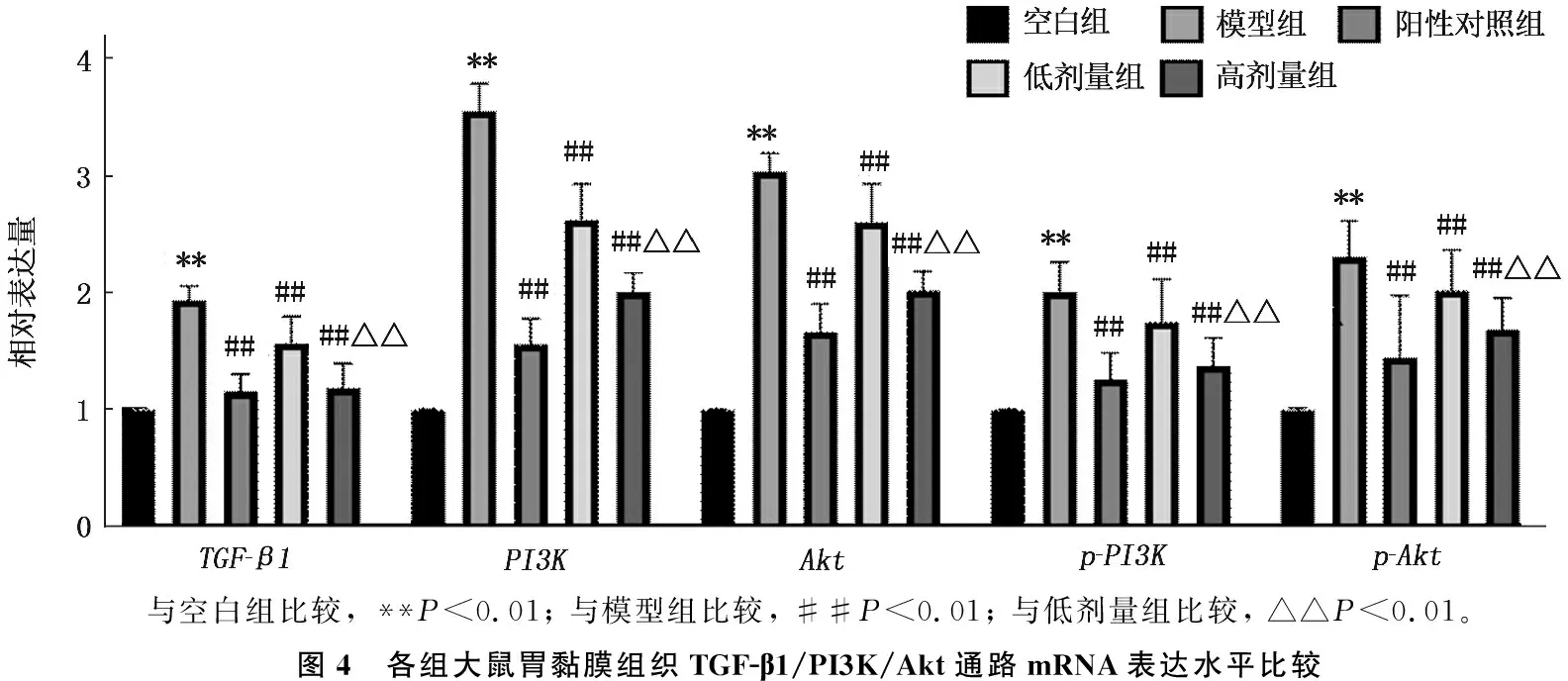
与空白组比较, **P<0.01; 与模型组比较, ##P<0.01; 与低剂量组比较, △△P<0.01。图4 各组大鼠胃黏膜组织TGF-β1/PI3K/Akt通路mRNA表达水平比较
2.6 各组大鼠胃黏膜组织TGF-β1/PI3K/Akt通路蛋白表达水平比较
与空白组比较,模型组大鼠胃组织TGF-β1、p-PI3K/PI3K、p-Akt/Akt蛋白水平升高,差异有统计学意义(P<0.01); 与模型组比较,阳性对照组、低剂量组及高剂量组大鼠胃组织TGF-β1、p-PI3K/PI3K、p-Akt/Akt蛋白水平降低,差异有统计学意义(P<0.01); 与低剂量组比较,高剂量组大鼠胃组织TGF-β1、p-PI3K/PI3K、p-Akt/Akt蛋白水平降低,差异有统计学意义(P<0.01),见图5、表5。

图5 Western blot检测胃组织TGF-β1/PI3K/Akt通路蛋白表达
3 讨 论
CAG是一种常见的消化道疾病,发病隐匿,病程长,病情容易出现反复。CAG是正常胃黏膜到胃癌的过渡性病理阶段,如果治疗不及时、不彻底,容易导致胃癌发生。目前西医的治疗原则主要为对症处理、幽门螺杆菌根治,但临床疗效并不满意。因此,寻找新的治疗方法迫在眉睫。
中医认为CAG常为七情内伤、饮食不节造成阴津枯竭、气血运行受阻,热邪内结、湿毒瘀滞导致,故治疗当以清养肺胃、解毒散结为主。加味沙参麦冬汤主要由北沙参12 g、玉竹9 g、麦门冬9 g、生扁豆9 g、天花粉9 g、桑叶6 g、生甘草3 g、白芍9 g及木瓜9 g组成。方中沙参甘润而偏苦,归肺胃两经,能补阴清热; 麦冬可养阴生津,二者共为君药,可起到生津解毒散结之效; 玉竹、天花粉养胃阴而生津,胃阴得复,则阴精可经脾气正常输布; 桑叶能散热清燥,生扁豆甘能补脾,香能舒脾,温能燥脾而达健脾化湿之效,配伍甘草益气健脾,阳中求阴,促进阴液生成,健脾益气。再加芍药补血污肝益脾,木瓜性温、味酸,入肝脾,健脾消食而通络,诸药合用共奏滋阴护胃、清热解毒、化瘀通络[12-14]。沙参麦冬汤已经广泛应用于临床,并在肿瘤、呼吸系统疾病及消化系统疾病中发挥一定的疗效[15-17]。研究[18]表明,沙参麦冬汤可改善CAG患者的临床症状,不良反应少。本研究结果发现,加味沙参麦冬汤可以显著保护胃黏膜结构,降低组织IL-6、TNF-α水平,且这种保护作用呈剂量依赖性,提示加味沙参麦冬汤可能通过抑制炎症反应修复损伤的胃黏膜。GAS、SS和MTL是胃肠道分泌的常见激素,在维持胃黏膜完整性、胃酸分泌及胃肠道运动中发挥重要作用[19]。本研究结果显示, CAG大鼠血清GAS、SS含量减少, MTL含量增加,主要原因为胃黏膜萎缩,腺体数量锐减,经过加味沙参麦冬汤治疗后GAS、SS含量显著增加, MTL含量降低,间接证明加味沙参麦冬汤保护胃黏膜,促进黏膜恢复。
目前,加味沙参麦冬汤治疗CAG的机制尚不清楚。TGF-β1与胃肠道炎症、癌症有关的信号通路,可促进细胞炎症反应及肿瘤细胞浸润[20]。目前认为, TGF-β1可抑制胃腺体的良性增殖,破坏胃腺体组织,可以将纤维母细胞激活为平滑肌细胞,因此TGF-β1在CAG发生发展中扮演着重要角色。研究[21]发现, CAG大鼠胃组织TGF-β1高表达,上调TGF-β1可促进CAG向胃癌的转化。此外,幽门螺杆菌感染的胃黏膜组织高表达TGF-β1[22]。以上报道提示TGF-β1通路与CAG发生发展过程中起到至关重要的作用。PI3K/Akt信号通路是TGF-β1下游最重要的通路之一,参与细胞增殖、凋亡过程,同样在CAG发生发展中发挥重要角色。研究[23]表明,幽门螺杆菌可通过PI3K/Akt通路抑制胃黏膜上皮细胞增殖、促进细胞凋亡。研究[24]发现, CAG胃黏膜组织PI3K/Akt通路蛋白表达水平高于非萎缩性胃炎,胃癌组织PI3K/Akt通路蛋白表达水平高于CAG, 提示PI3K/Akt通路在胃炎向胃癌转变过程中扮演着重要角色。本研究结果显示,模型组TGF-β1、PI3K/Akt通路蛋白水平、蛋白磷酸化水平均显著升高,加味沙参麦冬汤治疗后这些蛋白水平则显著下降,其中高剂量组下降最显著,提示加味沙参麦冬汤可能通过TGF-β1/PI3K/Akt信号通路发挥保护胃黏膜作用。
CAG的发生发展机制复杂,胃黏膜上皮细胞的增殖、凋亡在其中扮演着重要角色。研究表明,促增殖、抗凋亡是中药治疗CAG的主要途径。TGF-β1/PI3K/Akt通路激活后可干扰下游增殖、凋亡相关基因的表达,其中Bcl-2是一种抑制细胞凋亡的基因,其过表达可抑制细胞凋亡,提示细胞向恶性转化[25]。研究[26]表明, CAG胃黏膜组织高表达Bcl-2, 经中药复方治疗后Bcl-2水平可显著降低。PCNA是常用的细胞增殖指标,其变化与细胞内DNA复制一致。有文献[27]报道, CAG胃黏膜组织中PCNA低表达,与疾病严重程度有关。本研究结果显示,加味沙参麦冬汤治疗可提高胃黏膜组织中PCNA表达,降低Bcl-2表达,说明加味沙参麦冬汤可能通过调控胃黏膜上皮细胞增殖-凋亡轴发挥治疗作用。
综上所述,加味沙参麦冬汤可通过抑制TGF-β1/PI3K/Akt通路,上调PCNA基因的表达,下调Bcl-2基因的表达,抑制炎症因子的产生,最终发挥治疗CAG的作用。
