长链非编码RNA GATA3-反义RNA 1调控结直肠癌细胞SW620增殖、迁移和侵袭的机制研究
2023-09-09盛华明邓立春
盛华明, 李 森, 邓立春, 姚 勇
(东南大学医学院附属江阴医院, 1. 肿瘤内科, 2. 肛肠外科, 江苏 江阴, 214400)
结直肠癌是男性第3大常见癌症和女性第2大常见癌症[1], 有约40%患者会死于结直肠癌[2], 故亟需探寻基于结直肠癌进展潜在机制的新疗法。研究[3]证实,长链非编码RNA (lncRNA)广泛参与关键的生理病理过程,例如细胞增殖和凋亡、细胞生长和衰老以及免疫激活或失活,并且与肿瘤等疾病的发生和发展密切相关。lncRNA发挥作用的明确机制之一是通过与竞争性内源RNA(ceRNA)竞争海绵微小RNA(miRNA), 从而影响其调节功能[4]。miRNA是长度约22个核苷酸的非编码小RNA, 通过直接结合特定靶基因的3′UTR参与基因表达的调节,从而影响细胞分化、发育、凋亡、增殖和其他生物学活性[5]。研究[6]表明, lncRNA GATA3-反义RNA 1(lncRNA GATA3-AS1)是一种新的反义基因,与GATA3共享启动子区域,是GATA3高效转录所必需的。lncRNA GATA3-AS1已被证实是胰腺癌[7]、肝癌[8]的致癌基因,然而lncRNA GATA3-AS1在结直肠癌中的表达水平和功能尚未明确。微小RNA-574-3p(miR-574-3p)在结直肠癌组织中表达下调,可作为结直肠癌的新型候选治疗剂[9], 但其与lncRNA GATA3-AS1的关系尚未明确。本研究观察结直肠癌组织中lncRNA GATA3-AS1的表达情况,并探讨lncRNA GATA3-AS1在结直肠癌细胞SW620增殖、迁移和侵袭中的作用与机制,以期明确lncRNA GATA3-AS1在结直肠癌中的生物学作用及可能涉及的miRNA调节机制。
1 材料与方法
1.1 主要材料
收集2019年8月—2021年10月在本院进行手术切除的43例结直肠癌患者(男29例,女14例,均未接受过任何相关性治疗)的结直肠癌组织和癌旁组织,所有组织储存于-80 ℃环境。本研究经医院伦理委员会审核批准,且所有患者知情同意。
结直肠癌细胞株SW620(美国类型培养物保藏中心), Lipofectamine 2000试剂、Super Script第一链cDNA试剂盒(美国Invitrogen), SYBR Premix ExTaq Ⅱ试剂盒(大连宝生物工程), Taq Man microRNA试剂盒(美国Applied Biosystems),细胞计数试剂盒8(CCK-8)(日本Dojindo), si-NC、si-GATA3-AS1、miR-NC、miR-574-3p模拟物、anti-miR-NC、anti-miR-574-3p、pcDNA、pcDNA-GATA3-AS1(上海GenePharm), pmirGLO载体、双荧光素酶报告基因检测试剂盒(美国Promega), 二辛可宁酸(BCA)蛋白测定试剂盒(上海碧云天),聚偏氟乙烯(PVDF)膜(美国GE Health), 抗E-cadherin抗体、抗N-cadherin抗体(美国Abcam), Matrigel(美国BD Biosciences)。
1.2 细胞培养与分组处理
将结直肠癌细胞SW620培养于含10%胎牛血清的RPMI-1640培养基,置于37 ℃、5%CO2的培养箱中。将SW620细胞分为si-NC组、si-GATA3-AS1组、miR-NC组、miR-574-3p组、si-GATA3-AS1+anti-miR-NC组、si-GATA3-AS1+anti-miR-574-3p组。根据Lipofectamine 2000试剂说明步骤进行转染,在6孔板中接种1×105个SW620细胞,待其融合至约70%时,分别用si-NC、si-GATA3-AS1、miR-NC、miR-574-3p模拟物、anti-miR-NC与si-GATA3-AS1、anti-miR-574-3p与si-GATA3-AS1转染48 h, 后续进行细胞评价。
1.3 逆转录-定量聚合酶链反应(RT-qPCR)检测lncRNA GATA3-AS1和miR-574-3p表达
根据制造商Invitrogen的说明,使用Trizol试剂从结直肠癌组织、癌旁组织和结直肠癌细胞SW620中提取总RNA。使用Super Script第一链cDNA试剂盒将合格的RNA[260 nm与280 nm处光密度(OD)比值(OD260 nm/280 nm)为1.8~2.0]转化为cDNA。使用SYBR Premix ExTaq Ⅱ试剂盒在Applied Biosystems 7500实时PCR系统上进行qPCR, 以GAPDH量化lncRNA GATA3-AS1的相对表达。miR-574-3p水平使用Taq Man microRNA试剂盒按照制造商的说明进行检测,以U6量化miR-574-3p的相对表达。使用2-△△Ct方法计算相对表达量。引物序列: lncRNA GATA3-AS1正向5′-TTGTTCCCTCTTCGCTCCT-3′, 反向5′-TTGTTCCTTCACCGCATG-3′; miR-574-3p正向5′-ATCGGAAGTTGAGTGAGCCGCGTC-3′, 反向5′-GCCGTGAGTCAGGAGTGGT-3′。GAPDH正向5′-AGAACGGGAAGCTTGTCATC-3′, 反向5′-CATCGCCCCACTTGATTTTG-3′。U6正向5′-GCTTCGGCAGCACATATACTAAAAT-3′, 反向5′-CGCTTCAGAATTTGCGTGTCAT-3′。
1.4 CCK-8法检测细胞增殖活性
转染后,在96孔板中接种1×104个SW620细胞。孵育48 h后,加入10 μL CCK-8溶液, 37 ℃保持1 h。通过Synergy H4多功能酶标仪检测450 nm波长处OD(OD450 nm)。
1.5 克隆形成实验检测细胞克隆形成数
转染后,在6孔板中接种200个SW620细胞。孵育14 d后,将细胞用4%甲醛37 ℃固定10 min, 0.5%结晶紫37 ℃染色15 min, 于显微镜下观察细胞克隆形成数。
1.6 细胞划痕实验检测划痕愈合率
通过细胞划痕实验评估SW620细胞的体外迁移能力。转染后,将1×105个细胞接种到6孔板中,待细胞融合成单层,用移液器吸头垂直刮擦细胞单层。用磷酸盐缓冲液洗涤后,继续培养24 h。使用显微镜观察0 h和24 h的划痕,通过ImageJ图像分析软件检测划痕愈合率。
1.7 Transwell实验检测细胞侵袭能力
37 ℃条件下,用30 μg Matrigel对Transwell腔室膜预处理30 min, 形成重建的基底膜。将1×105个结直肠癌细胞(置于200 μL不含胎牛血清的RPMI-1640中)接种到Transwell腔室的上孔,下孔填充600 μL含有10%胎牛血清作为趋化剂的RPMI-1640。孵育48 h后,将细胞在4%甲醛中固定30 min, 然后用结晶紫染色15 min。用湿棉签小心地从Transwell上表面(内部)去除非侵袭细胞,用显微镜(放大倍数200倍)对侵袭细胞进行计数。
1.8 蛋白质印迹法(Western blot)检测迁移侵袭相关蛋白E-cadherin和N-cadherin表达
转染后,将SW620细胞在冰上裂解缓冲液中裂解,再将裂解液进行离心(10 min, 12 000转/min, 4 ℃), 并进行BCA法定量。总蛋白通过8%~12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,样品在转移缓冲液中电转移到PVDF膜上。将PVDF膜用5%脱脂牛奶于37 ℃封闭2 h, 4 ℃条件下与抗E-cadherin(1∶1 000)、抗N-cadherin(1∶1 000)和抗GAPDH(1∶2 000)抗体孵育过夜。然后,将条带与HRP偶联的山羊抗兔IgG于37 ℃孵育2 h,通过增强化学发光检测系统对条带进行可视化。
1.9 双荧光素酶报告基因实验检测lncRNAGATA3-AS1与miR-574-3p的靶向关系
运用生物信息学软件LncBase Predicted v. 2预测lncRNA GATA3-AS1与miR-574-3p的靶向结合关系。将含有miR-574-3p潜在位点的lncRNA GATA3-AS1野生型(WT)或突变型(MUT)序列插入到pmirGLO载体中,合成WT-GATA3-AS1或MUT-GATA3-AS1。将1×104个SW620细胞接种到6孔板中,并使用Lipofectamine 2000将WT-GATA3-AS1或MUT-GATA3-AS1与miR-574-3p模拟物或对照miR-NC共转染。转染48 h后,收获细胞,使用双荧光素酶报告基因检测试剂盒检测荧光素酶活性。另向SW620细胞中分别转染pcDNA、pcDNA-GATA3-AS1、si-NC、si-GATA3-AS1,分别设为pcDNA组、pcDNA-GATA3-AS1组、si-NC组、si-GATA3-AS1组, 48 h后通过RT-qPCR检测miR-574-3p表达。
1.10 统计学分析
2 结 果
2.1 lncRNA GATA3-AS1和miR-574-3p在结直肠癌组织中的表达
结直肠癌组织中lncRNA GATA3-AS1表达量高于癌旁组织(增加约3.24倍), miR-574-3p表达量低于癌旁组织(减少约0.62倍),差异有统计学意义(P<0.05), 见表1。
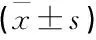
表1 lncRNA GATA3-AS1、miR-574-3p在结直肠癌组织和癌旁组织中的表达
2.2 干扰lncRNA GATA3-AS1表达对结直肠癌细胞SW620增殖能力的影响
si-GATA3-AS1组SW620细胞中lncRNA GATA3-AS1表达量、细胞增殖活性和克隆形成数均低于si-NC组,差异有统计学意义(P<0.05), 见图1、表2。
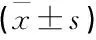
表2 干扰lncRNA GATA3-AS1表达对结直肠癌细胞SW620增殖能力的影响
2.3 干扰lncRNA GATA3-AS1表达对结直肠癌细胞SW620迁移和侵袭能力的影响
si-GATA3-AS1组SW620细胞的划痕愈合率、侵袭细胞数和N-cadherin蛋白表达量均低于si-NC组,而E-cadherin蛋白表达量高于si-NC组,差异有统计学意义(P<0.05), 见图2、表3。

A: 细胞划痕实验检测划痕愈合率; B: Transwell实验检测细胞侵袭能力; C: Western blot检测迁移侵袭相关蛋白E-cadherin和N-cadherin表达。图2 干扰lncRNA GATA3-AS1表达对结直肠癌细胞SW620迁移和侵袭能力的影响
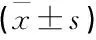
表3 干扰lncRNA GATA3-AS1表达对SW620细胞迁移和侵袭能力的影响
2.4 lncRNA GATA3-AS1靶向调控miR-574-3p的表达
LncBase Predicted v.2预测结果显示, lncRNA GATA3-AS1与miR-574-3p含有互补配对的碱基序列,见图3。miR-574-3p模拟物与WT-GATA3-AS1共转染的荧光素酶活性低于miR-NC与WT-GATA3-AS1共转染,差异有统计学意义(P<0.05), 但miR-574-3p模拟物或miR-NC分别与MUT-GATA3-AS1共转染的荧光素酶活性比较,差异无统计学意义(P=0.850), 见表4。pcDNA组、pcDNA-GATA3-AS1组、si-NC组、si-GATA3-AS1组SW620细胞中miR-574-3p表达量分别为(1.00±0)、(0.41±0.05)、(0.98±0.06)、(2.84±0.24), pcDNA-GATA3-AS1组miR-574-3p表达量低于pcDNA组,si-GATA3-AS1组miR-574-3p表达量高于si-NC组,差异均有统计学意义(P<0.05)。

图3 lncRNA GATA3-AS1与miR-574-3p的靶向关系预测结果
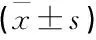
表4 双荧光素酶报告基因实验检测结果
2.5 miR-574-3p过表达对结直肠癌细胞SW620增殖、迁移和侵袭能力的影响
miR-574-3p组SW620细胞的miR-574-3p表达量高于miR-NC组,细胞增殖活性、克隆形成数、划痕愈合率、侵袭细胞数和N-cadherin蛋白表达量均低于miR-NC组, E-cadherin蛋白表达量高于miR-NC组,差异有统计学意义(P<0.05), 见图4、表5。

图4 miR-574-3p过表达对SW620细胞迁移侵袭相关蛋白表达的影响
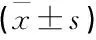
表5 miR-574-3p过表达对结直肠癌细胞SW620增殖、迁移和侵袭能力的影响
2.6 抑制miR-574-3p表达对干扰lncRNAGATA3-AS1表达的SW620细胞增殖、迁移和侵袭的影响
si-GATA3-AS1+anti-miR-574-3p组SW620细胞的miR-574-3p表达量低于si-GATA3-AS1+anti-miR-NC组,细胞增殖活性、克隆形成数、划痕愈合率、侵袭细胞数和N-cadherin蛋白表达量均高于si-GATA3-AS1+anti-miR-NC组, E-cadherin蛋白表达量低于si-GATA3-AS1+anti-miR-NC组,差异有统计学意义(P<0.05), 表明抑制miR-574-3p表达逆转了干扰lncRNA GATA3-AS1表达对结直肠癌SW620细胞增殖、迁移和侵袭的作用,见图5、表6。
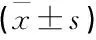
表6 抑制miR-574-3p表达对干扰lncRNA GATA3-AS1表达的SW620细胞增殖、迁移和侵袭的影响

图5 抑制miR-574-3p表达对干扰lncRNA GATA3-AS1表达的SW620细胞迁移侵袭相关蛋白表达的影响
3 讨 论
将合适的lncRNA作为诊断生物标志物或干预靶点,或可为结直肠癌的诊断和治疗提供新的思路。CONTRERAS-ESPINOSA L等[10]利用转录组分析将lncRNA GATA3-AS1鉴定为与局部晚期乳腺癌患者新辅助化疗耐药相关的lncRNA。ZHU Y P等[11]发现, lncRNA GATA3-AS1在人膀胱癌组织中显著上调。lncRNA GATA3-AS1在胰腺癌[7]、肝癌[8]和三阴性乳腺癌[12]组织和细胞中过表达,敲低lncRNA GATA3-AS1可抑制胰腺癌、肝癌和三阴性乳腺癌细胞增殖,并减弱胰腺癌细胞侵袭能力和肝癌细胞迁移能力。本研究发现,结直肠癌组织中lncRNA GATA3-AS1表达显著上调,提示其异常表达可能有助于结直肠癌的进展(类似其在胰腺癌、肝癌和三阴性乳腺癌中的致癌作用)。为了更好地了解lncRNA GATA3-AS1在结直肠癌中的生物学作用,本研究进一步开展体外细胞实验,发现干扰结直肠癌细胞SW620中lncRNA GATA3-AS1表达能明显抑制细胞增殖活性和克隆形成、迁移、侵袭能力,下调N-cadherin表达和上调E-cadherin表达,表明干扰lncRNA GATA3-AS1表达可抑制结直肠癌细胞SW620的迁移和侵袭能力。由此证实, lncRNA GATA3-AS1作为致癌基因而加速结直肠癌的进展。
据报道, miR-574-3p可在上皮性卵巢癌[13]、食管癌[14]和肝癌[15]中充当抗肿瘤因子,抑制癌细胞增殖和转移。miR-574-3p在结直肠癌组织中低表达,上调其表达可抑制结直肠癌细胞的增殖和迁移,促进细胞凋亡[16]。miR-574-3p在卵巢癌组织和细胞中低表达,过表达miR-574-3p可抑制卵巢癌细胞增殖、迁移和侵袭[17]。miR-574-3p过表达上调了胃癌细胞中E-cadherin的表达,同时下调了波形蛋白的表达[18]。本研究结果显示, miR-574-3p在结直肠癌组织中表达降低,且miR-574-3p过表达可抑制结直肠癌细胞SW620的增殖、迁移和侵袭能力,表明miR-574-3p在结直肠癌进展中起抑制作用。
lncRNA作为特定miRNA的ceRNA, 可调节基因表达[19]。例如, LINC00997通过与miR-574-3p相互作用,可促进宫颈癌细胞增殖、迁移、侵袭和自噬[20]。lncRNA ZEB2-AS1通过miR-574-3p/HMGA2轴促进食管鳞状细胞癌细胞的增殖、迁移和侵袭[21]。为了深入了解lncRNA GATA3-AS1的潜在调控机制,本研究通过生物信息学软件预测了miR-574-3p与lncRNA GATA3-AS1的靶向关系,发现两者含有互补配对的碱基序列,且该结果得到双荧光素酶报告基因实验的证实。本研究中,结直肠癌细胞SW620中lncRNA GATA3-AS1可负向调控miR-574-3p的表达,这意味着lncRNA GATA3-AS1可直接结合miR-574-3p, 并破坏miR-574-3p的稳定性。本研究还发现,抑制miR-574-3p表达后,干扰lncRNA GATA3-AS1表达抑制结直肠癌细胞SW620增殖、迁移和侵袭的结果被逆转。由此表明, lncRNA GATA3-AS1在结直肠癌细胞SW620中充当miR-574-3p的ceRNA, 从而发挥对结直肠癌细胞增殖、迁移和侵袭的调控作用。
综上所述, lncRNA GATA3-AS1在结直肠癌中表达上调,可通过调控miR-574-3p促进结直肠癌细胞SW620的增殖、迁移和侵袭,提示lncRNA GATA3-AS1可能作为癌基因在结直肠癌中发挥作用,具有作为结直肠癌诊断生物标志物的潜在价值。
