骨髓分化因子88通过核因子-κB/活化蛋白-1信号通路调控结直肠癌细胞增殖、迁移和侵袭的机制研究
2023-09-09秦蕾,秦鑫
秦 蕾, 秦 鑫
(1. 北京老年医院 普外科, 北京, 100095; 2. 山西医科大学, 山西 太原, 030001)
结直肠癌(CRC)是世界上最常见的恶性肿瘤之一,其中晚期结直肠癌患者的预后仍然不佳[1-2]。研究[3]显示包括病毒和细菌感染、酒精、烟草烟雾、衰老、溃疡性结肠炎、久坐的生活方式以及基因突变等因素均可能与结直肠癌有关。CRC的发病与3种类型的遗传畸变有关,即染色体不稳定(CIN)、微卫星不稳定(MSI)和CpG岛甲基化表型(CIMP)[4]。髓样分化因子88(MyD88)是白细胞介素-1(IL-1)和Toll样受体(TLR)信号传导的必要适配分子[5]。TLRs是一个模式识别受体家族,可识别各种病原体相关分子模式(PAMPs), 并激活宿主对病原体入侵的先天免疫防御。MyD88信号通路在激活的CD4+T细胞存活过程中介导全身和心脏细胞因子反应,促进肿瘤细胞增殖、侵袭、转移,并与肝细胞癌(HCC)患者介导的炎症通路损伤和神经退行性组织损伤的预后密切相关[6-9]。
研究[10-11]证明MyD88表达是卵巢癌的不良预后因素,且在腺病毒角膜炎中发挥作用。另有研究[12-13]表明,MyD88是炎症性肺部疾病的治疗靶点,且在眼表稳态维持中发挥重要作用。既往研究[14]显示MyD88在结直肠癌患者癌组织及癌旁正常结直肠组织中表达,且癌组织中的表达水平明显高于癌旁组织;MyD88表达水平与结直肠癌患者的临床分期、T分期、M分期及淋巴结转移密切相关,MyD88高表达的结直肠癌患者的生存率明显低于MyD88低表达的患者。本研究探讨MyD88在结直肠癌患者中的作用,通过敲除结直肠癌细胞中MyD88基因以了解其在细胞中的功能作用,并分析MyD88敲低导致相关信号通路改变的机制,现将结果报告如下。
1 材料与方法
1.1 主要实验材料
SW460细胞(上海中科院细胞库);MyD88-siRNA重组腺病毒载体及阴性对照质粒购自上海吉玛生物有限公司; DMEM培养基(TOYOBO); Trizol试剂盒(TaKaRa); Hoechst 33258 染色试剂; Western印迹试剂盒(美国Sigma公司); 全蛋白抽提试剂盒; Lipofectamine3000转染试剂(Invitrogen, 美国); 磷酸盐缓冲液(PBS, 美国Amresco公司); BCA 蛋白定量试剂盒 (Thermo Fisher Scientific); CCK-8 (Dojindo); Matrigel(BD Bioscience),细胞裂解抽提试剂(碧云天), PMSF(Amresco)。
1.2 主要实验器材
苏净 Airtech超净工作台(北京六一仪器厂); SANYO MCO-15AC细胞培养箱(美国强生公司); Nikon Ti-U/Ti-s倒置荧光显微镜(日本三菱公司); 5810R型高速离心机(日本岛津公司); 微量移液枪(美国 Promega公司); 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE, 美国Corning公司); E-Gel Imager凝胶成像仪(美国Beckma公司)。
1.3 实验方法
1.3.1 慢病毒感染和稳定细胞系筛选: SW480细胞株培养于含10%胎牛血清(FBS)的DMEM培养基中,置于生化培养箱中培养,条件为37 ℃、5%CO2浓度。在HEK293T细胞中将MyD88敲除质粒和空载体与psPAX2和pMD2.G共转染,培养2 d后将上清液过滤。采用上清感染SW480细胞,嘌呤霉素筛选2周后提取蛋白和mRNA进行验证。将转染空载体和MyD88敲除质粒的SW480细胞分别作为对照组和MyD88-siRNA组。
1.3.2 细胞总RNA提取和实时荧光定量聚合酶链式反应(RT-qPCR)检测: 利用TRIZOL提取2组细胞中总RNA, 具体实验步骤参照试剂盒说明书。采用Nanodrop测定的260 nm与280 nm下吸光度比值(OD260/280 nm比值)计算总RNA的纯度,采用琼脂糖凝胶电泳检测RNA的完整性。取2 μL RNA按照逆转录试剂盒说明书进行逆转录以构建cDNA文库,以cDNA为模板进行实时定量反应,以GAPDH基因作为内参基因。PCR反应条件: 95 ℃下2 min预变性; 95 ℃下15 s, 60 ℃下30 s, 设置40个循环; 以2-△△CT方法计算基因的相对表达水平。
1.3.3 细胞总蛋白提取和蛋白质印迹法(Western blot): 将细胞采用含1%PMSF的细胞裂解缓冲液进行冰上裂解30 min, 随后将裂解液在4 ℃、12 000 g离心10 min, 提取上清液,使用BCA蛋白检测试剂盒进行蛋白定量,并加入5×SDS煮沸10 min。将50 μg蛋白采用12% SDS-PAGE凝胶进行电泳分离,将凝胶转移至0.45 μm PVDF膜中。采用1%的牛血清白蛋白对PVDF膜进行常温封闭1 h, 随后采用稀释后的抗体在4 ℃摇床上过夜孵育。采用TBST(0.1% Tween-20)将PVDF膜洗涤3次,每次10 min; 采用山羊抗兔IgG H&L (HRP)二抗常温孵育1 h, 随后采用TBST(0.1% Tween-20)将PVDF膜洗涤3次。最后采用增强的化学发光底物检测液对蛋白条带进行检测。
本研究所用抗体及稀释浓度为: MyD88(1∶1 000, AF5195; Affinity)、GAPDH(1∶1 000, ab181602; Abcam)、NF-κB p65(1∶1 000, AF5006; Affinity)、p-NF-κB p65(1∶1 000,#3033; Cell Signaling)、c-jun(1∶1 000,bs-0670R; Bioss)、p-c-jun(1∶1 000, bs-3172R; Bioss)、goat anti-rabbit IgG H&L (HRP) (1∶2 000, ab7090; Abcam)。
1.3.4 细胞增殖检测: 调整各组细胞浓度至1.0×104个/孔并接种于96孔板中,每组分别设置6个复孔,置于生化培养箱中培养,条件为37 ℃、5%CO2浓度。在培养24、48、72、96 h后,弃掉上层培养基,添加100 μL的10% CCK-8无血清培养基,孵育1 h后使用微生物板阅读器(Bio-Tek)计算细胞增殖。
1.3.5 细胞迁移的愈合实验: 将各组细胞接种于6孔板中,每组分别设置6个复孔,待细胞生长至100%时,用20 μL移液管尖划伤细胞层,将含10%FBS的培养基替换为无血清培养基。拍摄细胞在培养0、48 h后的图像,计算细胞的迁移能力。
1.3.6 细胞侵袭实验: 在培养基上室涂上Matrigel, 调整各组细胞浓度至9.0×104个/孔接种于上室,下室为含20% FBS的DMEM培养基。在37 ℃、5% CO2条件下孵育48 h后,取出Transwell室,将培养基丢弃并用无钙PBS清洗,而后用甲醇固定细胞30 min, 用0.1%结晶紫染色20 min, 再用棉签轻轻拭去上面未迁移的细胞,并在显微镜下计数。
1.4 统计学分析
2 结 果
2.1 siRNA干扰后MyD88蛋白及mRNA表达水平
在转染siRNA 48 h后,检测2组细胞内MyD88的蛋白及mRNA表达水平。RT-qPCR和Western blot检测结果显示,转染MyD88-siRNA后, MyD88的mRNA和蛋白表达水平均降低,差异有统计学意义(P<0.000 1), 见图1。

A: MyD88蛋白水平; B: MyD88 mRNA水平(2组比较, ****P<0.000 1)。图1 MyD88敲除后2组细胞蛋白和mRNA表达水平比较
2.2 MyD88-siRNA干扰后抑制SW480细胞的增殖
CCK-8实验结果显示,与对照组相比,MyD88-siRNA组细胞增殖率、细胞存活率均降低,差异有统计学意义(P<0.05), 说明MyD88沉默能够显著抑制结直肠癌的细胞增殖。见图2。
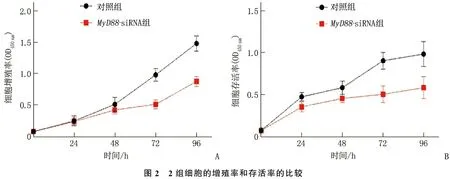
图2 2组细胞的增殖率和存活率的比较
2.3 MyD88-siRNA干扰后抑制SW480细胞的迁移
划痕实验结果显示,MyD88-siRNA组的划痕愈合速度低于对照组,差异有统计学意义(P<0.000 1), 见图3。

图3 2组细胞划痕试验后细胞愈合情况比较
2.4 MyD88-siRNA干扰后抑制SW480细胞的侵袭
Transwell实验结果显示,MyD88-siRNA组结直肠细胞通过基底膜迁移的细胞数量低于对照组,差异有统计学意义(P<0.05), 说明MyD88敲除可以显著抑制SW480细胞的侵袭。见图4。

图4 2组细胞的侵袭能力比较(放大200倍)
2.5 MyD88对NF-κB和AP-1信号通路的影响
Western blot结果显示, NF-κB(p65)、p-NF-κB(p-p65)、AP-1(c-jun)和p-AP-1(p-c-Jun)蛋白在MyD88-siRNA组的表达水平低于对照组,差异有统计学意义(P<0.05), 说明MyD88沉默可以抑制NF-κB和AP-1信号通路的蛋白表达水平。见图5。
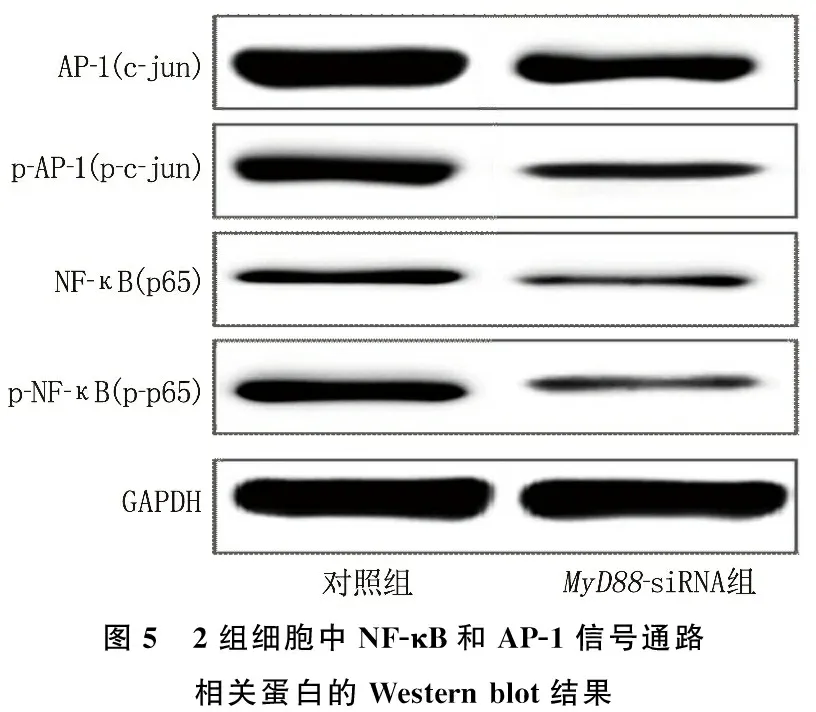
图5 2组细胞中NF-κB和AP-1信号通路相关蛋白的Western blot结果
3 讨 论
MyD88在先天免疫反应中发挥核心作用,其参与调节NF-κB信号通路活性[15]和MAPKs-c-jun(AP-1)信号通路[16]。MyD88和MyD88相关信号通路已被证明参与内源性和外源性炎症反应,以及癌症相关细胞的进展和癌变过程。此外,MyD88异常表达的检测可用于预测各种人类癌症(如淋巴癌、肝癌)的预后[17]。因此,MyD88可作为潜在的致癌标志物进行相关研究,对结直肠癌的治疗有积极的影响。
本研究成功敲除了MyD88,并通过RT-qPCR和Western blot对敲除效率进行了验证分析,并进一步验证MyD88敲除是否会影响结直肠癌细胞的生物学特征,结果表明敲除MyD88可抑制结直肠癌细胞的增殖、侵袭和迁移,证实MyD88在结直肠癌细胞增殖、侵袭和迁移中发挥重要的作用。临床研究[18]发现MyD88的SNP位点与结直肠癌患者的生存率较差密切相关。此外,MyD88沉默可以降低胰腺癌细胞的侵袭性和迁移能力[19]。MyD88的高表达与结直肠癌患者肝转移及不良预后相关[20]。
然而,MyD88诱导结直肠癌生物学行为的具体机制尚不清楚。有研究[16]通过比较IL-18-/-、IL-18R1-/-和MyD88-/-结直肠癌相关小鼠模型以及野生小鼠发现,MyD88可以通过IL-18/MyD88通路保护肠道免受肿瘤发生的影响。相反的,在LPS处理后的MyD88敲除小鼠中,MyD88可通过TLR/MyD88通路促进结肠炎向结直肠癌的恶性转化[21]。目前,MyD88在结直肠癌进展过程中的双重功能尚不清楚,其内在机制需要进一步研究。
MyD88信号在调节肠道正常上皮细胞和癌细胞的生长中发挥作用。NF-κB的上调与很多肿瘤进展过程相关,参与肿瘤细胞的增殖和侵袭; AP-1, 特别是c-Jun同样影响肿瘤细胞的增殖、迁移和侵袭[22-23]。多项研究表明,丝裂原活化蛋白激酶(MAPKs)和核因子κB(NF-κB)信号通路是导致脂多糖(LPS)诱导的急性肺损伤(ALI)[24]、破骨细胞生成[25]、神经炎症[26]、动脉粥样硬化[27]、前列腺癌和胶质母细胞瘤的发生[28]以及人类树突状细胞激活[29]的关键因素。MyD88敲除可影响结直肠癌细胞的生物学特征,包括细胞的增殖、侵袭和迁移; 在MyD88敲除的细胞系中,p65、磷酸化p65、c-jun和磷酸化c-jun蛋白表达均有不同程度的下降。敲低MyD88基因可以影响MyD88介导的NF-κB (p65)和NF-κB的激活AP-1(MAPKs-c-jun)通路,从而有效延缓肿瘤的侵袭性转化。
综上所述,MyD88可作为结肠癌发病机制的独立因子,并可作为潜在的诊断和预后生物标志物。敲除MyD88基因可以影响结直肠癌细胞的增殖、侵袭和迁移,并降低NF-κB和AP-1通路的活性。
