SLC1A5协同TM4SF1通过mTOR信号通路调控食管鳞癌细胞迁移
2023-09-09胡效林李文倩赵恬恬侯思聪
胡效林, 郝 鑫, 李文倩, 赵恬恬, 侯思聪
(1. 扬州大学附属医院 消化内科, 江苏 扬州, 225001; 2. 扬州大学医学院 临床医学系, 江苏 扬州, 225001;3. 江苏省宝应县人民医院 消化内科, 江苏 宝应, 225800)
食管癌是全球主要恶性肿瘤之一,致死率在肿瘤性疾病中居第6位,中国是食管癌高发地区,主要的病理类型是鳞状细胞癌(ESCC), 食管癌患者的5年生存率仅为15%~20%[1]。因此,鉴定ESCC转移过程的关键分子并探索潜在机制,将为临床寻找新的干预靶点提供科学参考。氨基酸转运载体溶质载体家族1成员5(SLC1A5)是一种以谷氨酰胺为底物、Na+依赖性的中性氨基酸转运蛋白[2], 可介导细胞对中性氨基酸的摄取,目前已被证明[3-5]在肺癌、卵巢癌、结肠癌等多种上皮来源的恶性肿瘤中高表达。既往研究[6]表明,SLC1A5主要通过胞内转运谷氨酰胺及正向调控转录因子参与恶性肿瘤的侵袭、转移。此外,SLC1A5还可以与衔接因子相关蛋白复合物1γ1亚基(AP1G1)、表皮生长因子受体(EGFR)形成异源三聚体复合物,通过增强癌细胞对谷氨酰胺的摄取,上调细胞内谷胱甘肽水平,促进细胞增殖。
本课题组前期质谱结果[7]发现, SLC1A5是四跨膜蛋白超家族成员1(TM4SF1)的潜在相互作用蛋白。TM4SF1主要通过与整合素、受体酪氨酸激酶(RTKs)等蛋白相互作用形成的富含四跨膜蛋白的微结构域(TEMs)介导肿瘤黏附、侵袭和迁移[8]。因此,本课题推测SLC1A5可能通过与TM4SF1相互作用参与ESCC转移。本研究检测SLC1A5在ESCC中的表达情况,分析其与临床病理资料的相关性,旨在探索SLC1A5参与调控ESCC细胞转移的分子机制。
1 资料与方法
1.1 组织标本
收集扬州大学附属医院2012年12月—2015年12月收治的84例ESCC术后标本,所有癌组织及癌旁正常组织石蜡切片均取自扬州大学附属医院病理科,组织病理已确诊,采用免疫组织化学(IHC)进行标本染色,所有患者具有完整临床资料,术前均未接受放化疗。收集2019年12月—2020年12月接受手术患者的18对新鲜组织标本,包括ESCC组织和临近的非癌组织(距离癌组织>5 cm), 标本收集后,放于-80 ℃冰箱保存用于后续研究。本研究通过扬州大学医学院伦理委员会审批。
1.2 细胞系和细胞培养
本研究所使用的ESCC细胞系(Eca-109)来自中国科学院细胞库。使用含有10%胎牛血清(FBS)(杭州天杭生物科技股份有限公司,中国)的RMPI-1640培养基培养。HEK293T用无血清培养基DMEM培养。培养条件均为37℃、5%CO2恒温培养。
1.3 在线数据库分析
使用TNM plot在线数据库(https://www.tnmplot.com/)比较161个ESCC组织和418个正常组织中SLC1A5基因表达水平。
1.4 构建过表达质粒
TM4SF1的相应过表达质粒来自实验室前期的构建[7]。SLC1A5的全长cDNA是以Eca-109细胞总cDNA为模板扩增得到,然后亚克隆到pDONR201载体中。随后通过Gateway技术将SLC1A5的cDNA从pDONR201载体中置换到pLenti-CMV-Puro DEST(w118-1)(Addgene,#17452)或pLenti-CMV-Hygro DEST(w117-1)(Addgene, #17454)载体中,从而得到相关慢病毒表达载体。
1.5 构建病毒包装感染以及稳转细胞系
基于慢病毒的TM4SF1或SLC1A5过表达载体与pCAG-HIVgp和pCMV-VSV-G-RSV-Rev共同转染至HEK293T细胞。转染48 h后,收集慢病毒上清液。用所得病毒上清液感染相应细胞72 h后,通过潮霉素B或嘌呤霉素对细胞进行筛选,最终获得相应抗性的稳转细胞系。
1.6 IHC
取石蜡包埋的标本切片,将组织切片脱蜡和水化,进行高压抗原修复, SLC1A5一抗(CST, 美国,货号#8057, 稀释比例1∶150)在4 ℃冰箱孵育过夜,二抗工作液37 ℃孵育30 min, 3, 3-二氨基联苯胺盐酸盐(DAB)显色和苏木素复染,最后脱水、透明、封片。SLC1A5染色结果判读方法如下: 阳性细胞数的百分比分5个等级,即0分(0%)、1分(>0%~25%)、2分(>25%~50%)、3分(>50%~75%)、4分(>75%~100%); 染色强度分4个等级,即0分(无色)、1分(淡黄色)、2分(棕黄色)、3分(棕色或棕褐色); 最终染色分数=染色强度分数×阳性细胞百分比分数。0~3分为低表达, 4~12分为高表达。
1.7 实时荧光定量逆转录聚合酶链反应(qRT-PCR)
采用TRIzol试剂(Invitrogen,美国)从组织中提取总RNA,按照制造商说明,使用iScript cDNA合成试剂盒(Bio-Rad, 美国)对分离的RNA进行逆转录,采用iTaq Universal SYBR Green Kit(Bio-Rad, 美国)进行qRT-PCR。以GAPDH为内参基因进行分析。相关引物序列见表1。

表1 qRT-PCR相关的引物序列
1.8 蛋白质免疫印迹(WB)
从收获的细胞中提取总蛋白,用BCA蛋白测定试剂盒(Pierce, 美国)测定蛋白浓度,通过SDS聚丙烯酰胺凝胶电泳(伯乐系统,美国)分离并转移到聚偏二氟乙烯(PVDF)(Sigma, 美国)膜上。在室温下封闭1 h, 一抗在4 ℃下孵育过夜,二抗在室温下孵育1 h。用ECL发光液(Pierce, 美国)检测目标蛋白。所用一抗包括: TM4SF1(R&D, 美国,货号AF7514, 稀释比例0.5 μg/mL); SLC1A5, p-mTOR, mTOR, p-S6和S6(CST, 美国; 货号分别为#8057, #2971, #2972, #2211和#2217; 稀释比例均为1∶3 000)以及β-actin(Santa Cruz Biotechnology,美国,货号#sc-47778, 稀释比例1∶1 000)。
1.9 免疫共沉淀(IP)
收集1 mg(约1 000 μL)细胞裂解液中,吸取1/10上清液(约100 μL), 作为Input, 放入-20 ℃冰箱备用,将剩余上清液加入100 μL预处理的protein A/G琼脂糖珠(Santa Cruz Biotechnology,美国)中,在4 ℃轮转仪上轮转30 min,离心后留取上清液,分别加入相应的抗SLC1A5抗体(CST, 美国,货号#8057, 稀释比例1∶75)及IgG抗体(Bio-Rad, 美国,货号#PRABP01, 稀释比例1∶50), 4 ℃轮转过夜后,新的100 μL预处理protein A/G琼脂糖珠孵育结合, 4 ℃轮转孵育2 h, 离心并进行样品处理,最后进行WB检测。
1.10 细胞增殖实验
将对应的细胞(3×104个)接种到60 mm培养皿,培养箱中培养过夜后,更换无血清培养基培养24 h, 更换为完全培养基,并通过显微镜拍照记录后,计数该视野内的细胞数目。之后每24 h拍照记录相同视野的细胞并计数,共3次。统计不同时间点、相同视野内细胞数目以记录细胞增殖情况,绘制增殖曲线。
1.11 Tranwell侵袭和迁移实验
使用24孔Transwell小室(Corning,美国)评价食管癌细胞的侵袭能力。预冷的无血清培养基配制Matrigel, 按每个小室100 μL铺胶, 37 ℃培养箱孵育1 h。消化细胞,在无菌上室中加入200 μL的细胞悬液(3×104个),在下室中加入500 μL含有10%FBS培养基, 37 ℃培养箱中孵育12 h, 用镊子小心取出小室,用甲醇室温固定30 min, 结晶紫室温染色15~30 min, 室温晾干后显微镜下拍照并选取3个随机视野计数,统计结果。迁移实验无需铺胶,在无菌上室中加入200 μL的细胞悬液(2×104个), 在下室中加入500 μL含有10%FBS培养基, 于37 ℃培养箱中孵育8 h后,其余步骤参考侵袭实验。
1.12 统计学分析

2 结 果
2.1 SLC1A5在ESCC组织中的表达情况
通过TNM plot在线数据库(https://www.tnmplot.com/) 分析比较SLC1A5基因在ESCC组织和正常组织中的表达差异,结果显示, ESCC组织中的SLC1A5基因表达水平高于正常组织,差异有统计学意义(P<0.05), 见图1A。为进一步验证此结果,本研究提取了新鲜ESCC组织及癌旁正常组织中的总RNA(18对),采用qRT-PCR对组织中SLC1A5表达水平进行分析,结果显示, ESCC组织中SLC1A5mRNA水平高于正常组织,差异有统计学意义(P<0.01), 见图1B。此外,利用IHC分析了84例ESCC组织石蜡切片标本中SLC1A5蛋白的表达情况,结果显示, SLC1A5蛋白在癌旁组织(图2 E、2F、2G、2H)中的表达水平低于癌组织,差异有统计学意义(P<0.05)(图2 A、2B、2C、2D)。以上结果提示, SLC1A5在ESCC组织中高表达。

A: TNM plot在线数据库分析比较食管癌组织及正常组织中SLC1A5基因表达差异; B: ESCC组织和正常组织中SLC1A5 mRNA表达差异。与正常组织比较, **P< 0.01。图1 ESCC组织中SLC1A5 mRNA表达水平
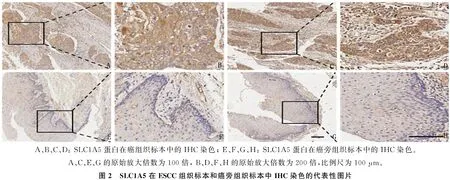
A、B、C、D: SLC1A5蛋白在癌组织标本中的IHC染色; E、F、G、H: SLC1A5蛋白在癌旁组织标本中的IHC染色。A、C、E、G的原始放大倍数为100倍, B、D、F、H的原始放大倍数为200倍,比例尺为100 μm。图2 SLC1A5在ESCC组织标本和癌旁组织标本中IHC染色的代表性图片
2.2 SLC1A5表达与临床病理资料的关系
根据上述IHC结果中SLC1A5的表达情况,将患者分为2组,即高表达组(>3分,n=60)和低表达组(≤3分,n=24), 并分析其表达情况与临床病理资料的相关性,结果显示, SLC1A5的表达与患者的临床分期(P=0.036)、淋巴结转移(P=0.029)呈正相关,与年龄、性别、吸烟史、T分型、分化程度、肿瘤直径无相关性(P>0.05), 见表2。

表2 SLC1A5表达和临床病理资料的相关性分析[n(%)]
2.3 SLC1A5表达对ESCC细胞增殖、迁移能力的影响
构建外源性SLC1A5稳定过表达的Eca109细胞(SLC1A5-OE组),利用WB验证SLC1A5过表达效率,确保稳转细胞构建成功,结果显示,与对照组细胞(Con组)相比, SLC1A5-OE组细胞SLC1A5蛋白表达水平升高,见图3A。为进一步研究SLC1A5是否与ESCC细胞增殖、迁移能力有关,细胞增殖实验分析结果显示, SLC1A5-OE组和Con组细胞增殖能力比较,差异无统计学意义(P>0.05), 见图3B; Transwell实验结果显示,与Con组相比, SLC1A5-OE组细胞迁移和侵袭能力提高,差异有统计学意义(P< 0.01), 见图3C。

A: WB验证SLC1A5在Eca-109细胞中的过表达效率; B: 细胞增殖实验检测SLC1A5过表达对Eca-109细胞增殖能力的影响; C: Transwell实验检测SLC1A5过表达对Eca-109细胞迁移及侵袭能力的影响(比例尺为50 μm)。2组比较, **P<0.01。图3 上调SLC1A5表达对ESCC细胞增殖、迁移能力的影响
2.4 SLC1A5与TM4SF1存在相互作用
本课题组在前期工作中的质谱分析发现SLC1A5是TM4SF1的潜在相互作用蛋白[7], 故本研究首先在SLC1A5过表达的Eca-109细胞中,通过IP验证了其与TM4SF1的相互作用,见图4。

图4 IP检测ESCC细胞中与SLC1A5存在相互作用的膜蛋白
2.5 SLC1A5-TM4SF1复合物促进下游哺乳动物雷帕霉素靶蛋白(mTOR)信号通路活化及ESCC细胞迁移
为进一步研究SLC1A5-TM4SF1复合物介导ESCC细胞迁移的分子机制,本研究在Con组或SLC1A5-OE组的Eca-109细胞中上调TM4SF1表达,即TM4SF1过表达细胞(TM4SF1-OE组)、SLC1A5和TM4SF1共表达细胞(SLC1A5+TM4SF1组)。WB结果显示,与Con组相比, TM4SF1-OE组细胞中p-mTOR、p-S6蛋白表达水平升高,在SLC1A5+TM4SF1组中进一步提高,见图5。对应的Transwell实验比较了各组细胞迁移能力,结果显示,与Con组相比, TM4SF1-OE组细胞迁移能力增强; 分别与SLC1A5-OE组和TM4SF1-OE组比较, SLC1A5+TM4SF1组细胞迁移能力进一步增强,差异有统计学意义(P<0.05或P<0.01), 见图6。

图5 WB检测SLC1A5-TM4SF1复合物下游关键信号通路转导分子的表达

A: Transwell实验分别检测过表达SLC1A5、TM4SF1及SLC1A5-TM4SF1复合物对Eca-109细胞迁移能力的影响(比例尺为50 μm); B: 分别过表达SLC1A5、TM4SF1及SLC1A5-TM4SF1复合物对Eca-109迁移细胞数的影响。2组比较, *P<0.05, **P<0.01。图6 Transwell实验检测SLC1A5-TM4SF1复合物介导的细胞迁移
3 讨 论
随着手术、放疗、化疗、免疫治疗、靶向治疗等技术不断发展, ESCC的病死率有所下降。但由于复发、转移和不可切除病灶的存在, ESCC患者5年生存率整体较低。因此,探索ESCC转移、复发的相关机制,有助于筛选和发掘新的生物标志物及有效的干预靶点[9]。
TNMplot是主要基于TCGA数据的在线数据库,该数据库详细记录了临床肿瘤患者正常组织、肿瘤组织及转移组织的基因差异性表达。本研究通过TNMplot在线数据库分析发现,SLC1A5基因在ESCC组织中的表达水平显著高于正常组织,并结合18对新鲜组织标本对该结果进行了进一步验证。既往研究[10]发现, SLC1A5表达的升高与多种上皮恶性肿瘤的发生发展密切相关。在肺癌中, SLC1A5转录受到MYC的直接调控,吸入高氧通过抑制MYC/SLC1A5轴驱动细胞内代谢重编程,抑制谷氨酰胺摄取及肿瘤转移。在裸鼠动物模型[5]中发现,敲除SLC1A5显著缩小了结肠腺癌和肺腺癌肿瘤的体积,表明SLC1A5是调控肿瘤生长的关键分子。此外, SLC1A5可作为微小RNA-122(miRNA-122)、miRNA-199的直接靶标,发挥促进卵巢癌、甲状腺癌细胞增殖、迁移、侵袭的作用[4, 11]。但SLC1A5在ESCC中的表达及临床意义尚不确定,其对ESCC细胞生物学功能及机制的研究报道较少。本研究首次通过数据库分析发现,SLC1A5在ESCC组织中的表达高于正常组织,后续在配对的ESCC和癌旁组织中分别检测SCL1A5mRNA及其蛋白水平表达情况,证实其在癌组织中呈现高表达。经过对84例患者的术后标本分析,发现SLC1A5高表达与临床肿瘤分期、淋巴结转移呈显著正相关(P<0.05)。上述结果提示SLC1A5在ESCC中具有促癌作用,其具有作为预测食管癌转移的可靠生物标志物的潜力。
后续的研究发现,在ESCC细胞中过表达SLC1A5可以促进细胞迁移,同时对细胞增殖能力无显著影响。作为一项延续性研究,前期课题组的质谱结果显示, SLC1A5可能是TM4SF1的相互作用蛋白,因此推测SLC1A5可能通过膜功能复合物的形式调控ESCC的转移。因此,本研究通过IP法验证了在ESCC细胞中SLC1A5与TM4SF1二者相互作用的存在,并证明了二者的协同调控在ESCC转移中具有重要作用。SLC1A5通过AP1G1与EGFR相互作用,形成SLC1A5-AP1G1-EGFR异源三聚体复合物,且该复合物在头颈部鳞状细胞癌中是西妥昔单抗的靶点。西妥昔单抗治疗后,以AP1G1依赖性方式诱导SLC1A5-EGFR复合物表达下调,降低癌细胞的谷氨酰胺摄取及细胞内谷胱甘肽水平,从而提高肿瘤细胞对药物的敏感性[6]。但TM4SF1同样作为四跨膜蛋白,既往报道[12]证实,其可以通过与不同的蛋白质相互作用,形成TEMS, 进而在调节细胞黏附、上皮-间质转化(EMT)、肿瘤血管生成、侵袭伪足生成中发挥重要作用。例如, TM4SF2与整合素β1形成功能复合物,激活FAK-Src-Ras-ERK1/2信号通路,进而诱导EMT, 增强骨肉瘤细胞侵袭和转移能力[13]。此外,本研究发现TM4SF1通过与整合素α6相互作用,以层黏连蛋白依赖性方式激活FAK/PI3K/AKT信号通路,介导ESCC细胞迁移和侵袭[7]。氨基酸转运蛋白也可以与四跨膜蛋白结合形成膜功能复合物,参与调控疾病的病理表型。研究[14-15]发现, TM4SF5可以结合胱氨酸/谷氨酸转运体(由SLC3A2和SLC7A11组成),介导肺纤维化期间细胞内谷胱甘肽和活性氧水平的调节。
mTOR信号经常在肿瘤中被激活,通过控制不同代谢途径的营养摄取和流量、基于感知细胞内的营养状态来协调代谢重编程,支持肿瘤细胞生长与增殖。研究[16]发现, SLC1A5通过与盘状结构域受体1(DDR1)相互作用,以溶酶体依赖性的方式稳定SLC1A5, 从而影响mTOR1信号通路,促进肝癌细胞增殖和细胞周期进展。相反,用GPNA(SLC1A5的选择性抑制剂)或SLC1A5小干扰RNA(SLC1A5 siRNA)处理的膀胱癌细胞中, mTORC1活性降低,且细胞的增殖和细胞活力受到显著抑制[17]。本研究通过体外实验证实,在SLC1A5和TM4SF1共表达的Eca-109细胞中, mTOR下游关键信号通路转导分子S6磷酸化增强,揭示SLC1A5与TM4SF1相互作用诱导了mTOR信号通路激活。然而, TM4SF1-SLC1A5功能复合物如何调节mTOR信号通路转导仍需进一步研究。
综上所述,本研究证实了SLC1A5在ESCC中高表达,且与患者临床分期、淋巴结转移显著相关。从分子机制层面来说,SLC1A5可能通过与TM4SF1形成膜功能复合物,激活下游的mTOR信号通路,从而促进ESCC细胞转移。这些发现可以为SLC1A5作为预测ESCC转移的潜在标志物及有效干预靶点提供理论依据。
