戊型肝炎病毒研究进展
2023-09-08李获朋胡重重田月薇陈昭慧杨忆斐刘天龙佘锐萍米荣升石蕊寒尹文娇田纪景
李获朋,胡重重,郑 宇,田月薇,陈昭慧,刘 波,杨忆斐,刘天龙,佘锐萍,米荣升,石蕊寒,尹文娇,肖 鹏,田纪景
(1.中国农业大学动物医学院,北京 100193;2.北京市房山区新农村建设服务中心,北京 102488;3.中国农业科学院上海兽医研究所,上海 200241;4.北京市农林科学院畜牧兽医研究所,北京 100097;5.中国疾病预防控制中心病毒病预防控制所,北京 102206;6.云南农业大学动物医学院,昆明 650201)
戊型肝炎病毒(Hepatitis E virus,HEV)是一种重要的人畜共患病原,也是全球范围内引起急性病毒性肝炎的主要原因。据世界卫生组织统计,全球每年约有2000万人感染HEV,其中约有330万临床病例,导致4.4~7万人死亡。HEV可感染多种家畜、家禽以及其他经济动物,对动物生产以及人类动物源食品安全造成了严重的威胁。因此,了解HEV的流行病学、病原学及其对人类和动物健康的损伤,有助于预防病毒感染以及临床治疗药物开发。
1 流行病学
1.1 HEV的全球分布及其生活史
HEV是目前已知的5种肝炎病毒之一,病毒分类学研究将其划归为戊型肝炎病毒科,其又可分为两个属,即正戊型肝炎病毒属(Orthohepevirus)和鱼戊型肝炎病毒属(Piscihepevirus)。目前研究较多的哺乳动物和禽类HEV均属于正戊型肝炎病毒属,其主要分为A-D 4个种[1],A种群可感染人、家猪、野猪、鹿类和兔等,包含至少8个基因型,HEV-1和HEV-2仅感染人类,主要流行于亚洲、非洲和拉丁美洲的热带和亚热带地区;HEV-3和HEV-4属于人兽共患病毒,在全球范围内均有流行;HEV-5和HEV-6仅在野猪中发现,HEV-7和HEV-8分别在阿拉伯单峰骆驼和中国双峰骆驼中发现[2];B为禽类HEVs,感染家禽和野生鸟类;C可感染鼠、雪貂和狐狸;D在蝙蝠、鹿和红隼中发现。HEV基因型多样性最大的地区是东南亚,而目前我国HEV流行基因型也已经从最初以HEV-1为主变成以人兽共患的HEV-4型为主(图1)。
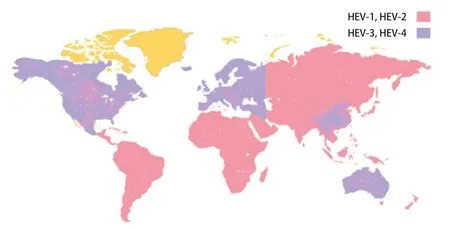
图1 HEV-4、HEV-3、HEV-1和HEV-2全球分布Fig.1 Global distribution of HEV-4,HEV-3,HEV-1 and HEV-2
目前,HEV的生活史比较模糊,其侵入细胞的过程和宿主对应受体尚不清楚。Kenney等[3]认为,无囊膜的HEV(non-enveloped HEV,neHEV)粒子与细胞表面的硫酸肝素蛋白多糖(Heparin sulfate proteoglycan,HSPGs)[4]以及热休克同源蛋白70(Heat shock homologous protein 70,HSP70)等受体结合,随即病毒粒子通过动态蛋白-2(Dynamic protein-2)、网格蛋白(Clathrin)和胆固醇(Cholesterol)介导进入细胞[5];而有囊膜的HEV(quasi-enveloped HEV,eHEV)粒子则可直接通过网格蛋白介导的信号通路进入细胞,随后在HSP90和Grp78作用下将病毒运送到释放基因组的位点。一旦释放到细胞质中,正链RNA作为信使RNA(messenger RNA,mRNA)翻译出开放阅读框(open reading frame 1,ORF1)。在粗面内质网(rough endoplasmic reticulum,RER)或RER衍生的膜小泡中[6],ORF1编码的非结构蛋白在宿主蛋白(包括延伸起始因子)和病毒蛋白(如:ORF4编码的蛋白)的参与下将正链RNA基因组转录成负链中间产物,后者翻译出ORF2和ORF3蛋白[7]。在病毒装配且在向质膜移动的过程中,ORF2与病毒基因组RNA结合并开始多聚,此时ORF3参与进来,通过ORF3蛋白与宿主空泡分选蛋白(如肿瘤抑制基因101)的相互作用,病毒颗粒进入细胞内小泡并在质膜处进行释放[8-10]。经宿主消化系统,病毒囊膜会丢失。而释放到血液中的HEV似乎保留了为了躲避宿主免疫系统的囊膜[3](图2)。
1.2 HEV对于社会生产实践的影响 HEV因其广泛的宿主适应性,不仅危害人类和动物的健康,同时也影响到动物源食品的安全。在禽类,HEV感染往往与其他病毒感染同时存在,如禽白血病病毒(Avian leukemia virus,ALV)、禽腺病毒(Avian adenovirus,FAdV)和鸡传染性贫血病毒(Avian infectious anemia virus,CIAV)[11]。我们在兽医临床中也发现HEV与猪圆环病毒(Porcine circovirus 2,PCV2)共感染的病例[12]。而近年在中国更是有人群聚集性感染HEV的相关报道,如2018年7月在山东青岛就有一起因食用了未彻底加热的猪肝而导致41人(14.5%,41/283)急性感染HEV事件,其中21人表现出临床症状,经基因组学分析确诊为HEV-4型感染[13]。因此,HEV作为一种重要的人兽共患病原,其对人类健康、畜牧兽医生产以及动物源食品安全的潜在危害不容小觑。
2 HEV病原学研究
2.1 HEV病毒粒子结构 HEV是单股正链RNA病毒,病毒基因组为7.2~7.4 kb。该病毒在无囊膜状态下直径为27~34 nm,其基因组由4个开放阅读框组成,即ORF1、ORF2、ORF3和ORF4(仅存在于HEV-1)(图3)。病毒基因组5'端是以7-甲基鸟嘌呤开头的非翻译区(具有27个核苷酸),后接ORF1编码区。ORF1是一个大的非结构蛋白,包括多个功能域,如甲基转移酶(methyltransferase)、假定的木瓜蛋白酶样半胱氨酸蛋白酶(papain-like cysteine protease,PCP)、X域、解旋酶和RNA依赖的RNA聚合酶(RNA-dependent RNA polymerase,RdRp),这些功能域决定了ORF1在HEV基因组复制方面的能力[14]。ORF2将寡聚形成二十面体衣壳,包裹病毒RNA。最近有研究报道ORF2衣壳蛋白有三种形式,即感染性/细胞内ORF2(ORF2i)、糖基化ORF2(ORF2g)和切割ORF2(ORF2c)。ORF2i蛋白使得HEV颗粒具有感染能力,而ORF2g和ORF2c蛋白与HEV颗粒的感染性无关[15]。因此,推测机体对HEV过量的免疫反应极有可能是对后两者的反应,这可能是HEV免疫逃逸的机制之一。目前普遍认为ORF3是HEV RNA的重要离子通道,其除了可以磷酸化外,N端的半胱氨酸残基还可被一种尚未确认的棕榈酰转移酶棕榈酰化,该转移酶不仅决定其膜结合位点和亚细胞定位,也是细胞释放感染性病毒过程所必需的酶[16]。ORF4可编码一个20 kDa的内质网应激蛋白,该蛋白与宿主和病毒蛋白相互作用,控制病毒遗传物质依赖的RNA聚合酶的活性[17]。因此,推测ORF1和ORF2决定了病毒的宿主特异性,ORF3与HEV感染性相关。

图3 HEV RNA模式图Fig.3 HEV RNA diagram
2.2 HEV-1型和HEV-2型 HEV-1与HEV-2仅感染人类,主要经过粪-口途径或受污染的水源传播,孕妇感染有更严重的临床症状。怀孕可能会导致HEV复制效率增高,病毒血症持续时间较长。研究发现,HEV-1可以使蜕膜和胎盘基质中的趋化因子、生长因子等分泌紊乱,从而利于HEV-1传播,同时也会导致组织损伤[18]。HEV-2感染孕妇的致死率可达25%,这可能是由于肝脏生物合成受阻、代谢紊乱等因素造成,此外也表现出早产、流产与死胎。HEV-2也通常在年轻人中引起短暂急性自限肝炎,临床症状与其他急性病毒性肝炎没有区别。
HEV-1型曾在我国新疆等地暴发过,导致数十万人感染[19]。近十年来,随着我国公共卫生环境的改善,HEV-1的感染率逐年下降。有相关文献指出,HEV感染可能已由HEV-1为主的形式转变为以HEV-4为主,并偶尔呈散发性流行或聚集性暴发[13,20]。
2.3 HEV-3型和HEV-4型 这两种基因型HEV为人兽共患病原,广泛分布于全球各地,但其主要宿主为家猪和野猪。HEV-3可在免疫功能低下的患者中呈现慢性感染;而由HEV-4导致的慢性感染也有零星报道[21]。慢性感染最显著的肝外表现包括格林-巴利综合征(Guillain-Barre syndrome,GBS)、神经性肌萎缩症(Neuralgia muscle atrophy,NA)、脑膜脑炎、多发性神经炎等的神经系统后遗症[22]以及膜增生性肾小球肾炎、冷球蛋白血症(Cryoglobulinemia)等症状的肾脏损伤[23]。日本的一项全国性调查发现,在2625名实体器官移植患者(99名心脏移植患者和2526名肾脏移植患者)中,有12名HEV阳性患者,其中42%的患者发展为慢性肝炎[24]。Sooryanarain等[25]研究指出,慢性戊型肝炎病例在接受心脏、肝脏、肺脏或肾脏移植的患者中较为常见。由此可见,HEV-3型和HEV-4型慢性感染及其所导致的肝外损伤值得特别关注。
2.4 HEV-5~HEV-8型 这几种基因型HEV主要在动物中有报道,但近年也证实了从野生环境中分离出的HEV-5可感染非人灵长类动物,充分说明其在人群中具有潜在的传播风险[26]。HEV-7和HEV-8分别在阿拉伯单峰骆驼和中国双峰骆驼体内被检测到[2],而前者已在肝移植受体患者中发现[27]。鉴于这几种类型HEV发现较晚,其在人群和动物的感染和流行情况还有待于进一步的调查研究。
3 HEV感染对机体的损伤及其致病机制
3.1 戊型肝炎临床症状及肝脏损伤 在散发HEV感染病例中,最常见的是引起黄疸、发热和腹痛,也可表现为急性或慢性肝病从而导致急性呼吸困难,腹水和出血。在发达国家,大多数老年男性感染后表现为急性、自限性疾病;若既往有肝病史的患者将会存在肝衰竭、肝硬化和慢性肝炎的风险。感染初期,谷丙转氨酶(alanine aminotransferase,ALT)和谷草转氨酶(aspartate aminotransferase,AST)明显升高;Malcolm等[28]研究显示HEV感染引起肝细胞凋亡、局灶性坏死以及细胞质胆红素沉积。Liu等[29]研究表明在HEV感染沙鼠后,沙鼠肥大细胞数目明显高于对照组,说明肥大细胞在HEV引起的肝损伤过程中发挥重要作用。
3.2 消化系统是HEV侵入机体的第一道防线 HEV作为一种可经粪-口途径传播的病毒,肠道是其侵入机体的第一道障碍。Mao等[30]研究发现,感染沙鼠的十二指肠、空肠、回肠的黏膜上皮处检测到了HEV的抗原阳性信号。Marion等[31]研究发现,HEV可在肠上皮细胞中复制,并在HEV感染患者十二指肠和回肠的深层肠隐窝中检测到ORF2蛋白。另外,胰腺炎的发生也与HEV感染有潜在联系[32]。深入研究HEV在消化道,特别是肠道黏膜上皮细胞的定植和传播,以及肠道黏膜免疫是否参与HEV感染和逃逸过程的研究,将有助于揭示HEV入侵和感染机体的分子机制。
3.3 HEV感染引起泌尿系统组织损伤 除消化系统外,肾脏也是HEV感染的潜在靶器官之一。Geng等[33]在自然感染HEV患者和人为感染HEV猴的尿液中均检测到了HEV RNA和ORF2抗原,并在猴肾脏检测到ORF2蛋白阳性以及观察到肾小管蛋白管型和间质炎性细胞浸润。Wu等[34]也在HEV感染实验兔肾脏中检测到HEV RNA阳性。HEV侵入肾脏并引起泌尿系统损伤的机制还有待于进一步研究。
3.4 HEV感染引起生殖系统损伤 妊娠期雌性生殖系统是HEV侵入机体主要攻击目标之一。尽管孕妇高死亡率的致病机制尚未完全被解析,但通常归因于宿主遗传背景、妊娠期激素水平和机体免疫力的改变。Xia等[35]利用兔模型证实,HEV是通过进入胎盘中复制并完成垂直传播的,且母乳中未检测到HEV。An等[36]研究显示猪源HEV可以感染兔并在其卵巢中复制,卵巢间质和卵泡细胞表现出分散性坏死,淋巴细胞浸润以及卵巢组织中出现细胞加速凋亡的现象,并且感染了HEV的卵子一旦受精,病毒便可以进入受精卵。
对于雄性生殖系统,HEV抗原蛋白可在睾丸间质细胞(Leydig cells,LCs)和曲细精管周围肌样细胞(Myoid cells around testicular tubule,TPC)中被检测到,此外即使血液中病毒被清除后,仍可在睾丸中长期被检测到[37]。Soomro等[38]的研究发现,HEV感染沙鼠的睾丸支持细胞排列松散,细胞核固缩,腔内生殖细胞脱落,并形成多核巨细胞,生精小管基底膜变薄。精原细胞和生精细胞排列松散、稀疏和无序,细胞发生变性、坏死,附睾内的精子密度较低,导管结构发生畸变。但目前尚未有证据表明HEV感染与男性不育有必然联系。
3.5 免疫系统参与HEV的识别及慢性感染过程 HEV感染在免疫抑制患者(如器官移植、HIV感染)中常呈现慢性,但有研究表明在有系统性红斑狼疮病的人群中也可观察到慢性HEV感染[39];与健康人相比,免疫功能正常的急性戊型肝炎患者,其外周血中NK细胞的比例略低,活化NK细胞比例却较高[44],所以推测NK细胞在病毒清除过程中起着重要的作用。另外,研究发现RIG-I信号通路参与识别HEV抗原蛋白和HEV RNA 3'端非编码区的核苷酸序列,并可进一步诱导细胞干扰素基因的转录和表达上调,从而发挥抗病毒效应[41-44]。
3.6 HEV可在神经系统中复制并引起神经症状 神经系统并发症是HEV感染最为常见的症状,也是最受人们关注的一点。Shi等[45]的研究发现,HEV可以感染沙鼠脑和脊髓组织并在其中复制,且感染沙鼠脑组织中紧密连接蛋白ZO-1(Zonula occlidens-1)表达量下降,而星形胶质细胞数量显著增加。这一结果证实HEV能够破坏血脑屏障(Blood brain barrier,BBB),并与神经系统损伤有直接关系。HEV感染引起的神经系统并发症主要有两种临床表现:第一种是有周围神经参与,最常见的表现为GBS和NA。第二种是中枢神经系统损伤,表现为脑膜炎(Meningitis)、脑炎(Encephalitis)等。虽并不是所有GBS都由HEV感染所致,但不可否认HEV确实是GBS发生的一个重要诱因,与GBS不同,已有研究证实了HEV与NA的关系,该研究结果显示在47名NA患者中,所有患者都有HEV感染病史[46],有5名(10.6%)有近期HEV感染的血清学证据。在动物模型中,HEV感染则可引起病毒性脑炎相关的病理变化,血脑屏障的破坏以及线粒体介导的神经细胞凋亡是HEV引起神经系统损伤的潜在原因[47-48]。而HEV突破血脑屏障并引起神经系统损伤的分子机制还有待于进一步深入研究。
4 细胞和动物模型研究进展
HEV体外培养和动物感染实验在近年取得了较大的进步。目前,比较常用的细胞包括HepG2、PLC/PRF/5、Huh7、A549、Caco-2、PK-15和ST等;兔、猪、沙鼠以及非人灵长类动物等也已被证实可成功感染HEV。
4.1 细胞模型 HEV细胞感染模型最常用的有PLC/PRF/5和A549等,其还可在极化的Caco-2细胞中复制,并且能从细胞顶膜释放,而HEV-1型和3型可在JEG-3细胞中复制。人原代肝细胞(Primary human hepatocytes,PHHs)和少突胶质细胞系也被用于HEV体外感染。另外,多能干细胞(Pluripotent stem cells,hESC/iPSC)诱导的肝细胞样细胞(Hepatocyte like cells,HLCs)也是一个在HEV研究中很有意义的细胞系[49]。
4.2 动物模型 HEV感染猪的动物模型不仅成功证实HEV是嗜肝病毒,并且发现它可在肝外组织中复制,如小肠、淋巴结和结肠[50]。Cao等[51]建立了在免疫抑制条件下慢性HEV感染猪的动物模型,而这种模型将有助于开发针对慢性HEV感染的治疗药物。除此之外,猪作为HEV的保存宿主亦可作为生产HEV抗体的试验动物。
兔也可作为研究HEV跨种间感染的动物模型。兔易感HEV-3型,但也可感染其他型,因此,可作为动物模型用于研究神经系统疾病和妊娠期感染。研究发现,在HEV感染的孕兔体内天冬氨酸转氨酶、谷草转氨酶、TNF-α和IFN-γ水平显著升高[52]。另外,兔也被用于戊型肝炎疫苗研究。如Chen等[53]利用HEV-4型不同的三个ORF2多肽片段完全保护了兔子免受猪源HEV感染。
啮齿类也是重要的实验动物。但直到最近,才有报道大鼠HEV毒株LA-B350能够有效的感染裸鼠[54]。然而,Schlosser等[55]研究发现Wistar大鼠似乎对HEV-1、HEV-3和HEV-4型具有一定抵抗力。具体能否作为模型还有待进一步研究。事实上,人肝嵌合鼠不乏是一种有效的动物模型。Sayed等[56]通过HEV-3感染人肝嵌合鼠模型证实了ORF2-Ag可用作活动性HEV感染的标志物,可用于评估抗病毒治疗的效果。长爪沙鼠也是研究HEV致病机制常用的实验动物,研究发现,在感染沙鼠的多个组织器官,包括肝脏、睾丸、脑和脊髓等组织均可检测到HEV RNA阳性或抗原蛋白的表达[29,38,45]。
鸡是禽HEV的宿主,HEV通过粪-口途径在鸡群间传播。鸡模型已被证明在疫苗研究中有不可磨灭的作用,Wang等[57]使用pTX8048载体构建了以ORF2为抗原基础的三种口服疫苗,可以有效控制鸡的aHEV感染。
除此之外,雪貂等已经被证明可以作为研究HEV感染和致病机制的动物模型。Wang等[58]的研究结果显示,在我国实验雪貂和养殖雪貂中均检测到不同的戊型肝炎病毒C2基因型;而Li等[59]在一篇HEV动物模型的文章中明确指出雪貂在持续性戊型肝炎研究领域的重要意义。
5 目前存在的问题以及展望
HEV在全球广泛分布和流行,对人类健康造成严重隐患。科学证据已充分证明了猪、鹿以及其他动物性食品,成为了人类感染HEV-3型或4型的重要来源。关于HEV的生活史,Kenney等[3]提出了一个相对完善的模型,但有关HEV进入细胞所依赖的具体蛋白还未完全阐明。HEV的肝外损伤成为近年的热门方向,但大多停留在现象的观察上,对于入侵途径、致病机制等问题的研究还比较欠缺。除此之外,有关HEV的病毒纯化仍存在一定困难。综上所述,HEV感染虽是以引起肝脏损伤为主,但肝外症状也受到人们越来越多的关注,完善HEV动物和细胞培养模型,将有助于揭示HEV的生活史、感染史和致病机制,以及抗病毒药物和治疗药物的开发。
