K亚群禽白血病病毒CRISPR/Cas13a检测方法的建立及初步应用
2023-10-20徐晴晴王文秀沈志强1
徐晴晴,王 峰,王文秀,莫 玲,沈志强1,
(1.山东省滨州畜牧兽医研究院 博士后科研工作站,滨州 256600;2.扬州大学 博士后科研流动站,扬州 225009;3.太仓广东温氏家禽有限公司,太仓 215488;4.山东省院士工作站,滨州 256600))
禽白血病病毒(Avian leukosis virus,ALV)属于逆转录病毒,其通过反转录酶形成cDNA,在整合酶的帮助下插入宿主的基因组中形成前病毒引起患病禽的肿瘤性疾病和免疫抑制[1]。当前主要根据gp85基因序列的同源性将ALV分为A-K共11个亚群,在无有效疫苗和药物的情况下,主要通过及时淘汰阳性鸡来建立无外源性ALV感染的种鸡群[2]。我国于2012年首次发现并分离到了K亚群禽白血病病毒(Avian leukosis virus subgroup,ALV-K)[3]。近年来,ALV-K在我国不同地区和多个地方品种鸡的检出率呈上升趋势且超过了经典的ALV-A和ALV-B[4-6]。因此,在实施ALV净化时应加强对地方品种鸡中ALV-K的调查和监测,避免重组进化出新的ALV亚群毒株而带来更加复杂的感染情况[7]。
有规律成簇间隔短回文重复序列(Clustered regularly interspaced short palindromic repeats,CRISPR)存在于绝大多数细菌和古细菌中,其转录产生的CRISPR-RNA(crRNA)与反式激活的tracr RNA(trans-activating CRISPR tracr RNA)共同构成引导RNA(guide RNA,gRNA),gRNA可引导核酸内切酶Cas蛋白(CRISPR associated protein)对噬菌体的基因片段进行切割,构成细菌的适应性免疫系统。Cas13a是一种RNA核酸内切酶,属于第2类CRISPR/Cas系统中的Ⅵ型[8],能在crRNA的引导下特异性切割靶标RNA,并在切割完成后仍保持活性,继续切割其他非靶标RNA,即具有“附带切割”能力[9]。利用Cas13识别靶序列后的附带切割效应,2017年,Gootenberg等[10]开发了特异性高灵敏度酶解报告基因解锁(specific high-sensitivity enzymatic reporter unlocking,SHERLOCK)检测系统。基于CRISPR/Cas13a的SHERLOCK反应系统在1~2 h内便可肉眼观测病原体的检测及分型结果,特别是在野外和医疗设备欠缺的地区。本研究建立了ALV-K的CRISPR/Cas13a检测体系,配合试纸条的应用使检测结果可视化,为临床病例的现场检测提供技术支撑。
1 材料与方法
1.1 病毒核酸PCR鉴定为阳性的禽白血病病毒A/B/J亚群毒株(ALV-A/B/J)、禽网状内皮组织增生症病毒(Reticuloendotheliosis virus,REV)、鸡马立克氏病病毒(Marek’s disease virus,MDV)、鸡传染性贫血病毒(Chicken infectious anemia virus,CIAV)、鸡传染性法氏囊病毒(Infectious bursal disease virus,IBDV)、鸡传染性支气管炎病毒(Avian infectious bronchitis virus,IBV)和鸡新城疫病毒(Newcastle disease virus,NDV)的病料由本实验室保存,按照AxyGen DNA/RNA提取试剂盒的说明书制备这些病毒的核酸备用。
1.2 主要试剂DNA提取试剂盒购自AxyGen公司;pMD18-T载体、DH5α感受态细胞、DL2000 DNA marker均购自宝生物工程(大连)有限公司;胶回收试剂盒、质粒提取试剂盒均购自北京全式金生物技术股份有限公司;rNTP solution mix、Murine RNase inhibitor、HiScribe T7 Quick High Yield RNA Synthesis Kit均为New England Biolabs产品购自国内代理商;TwistAmp Basic、Milenia HybriDetect 1均购自TwistDx产品。
1.3 RPA引物的设计RPA引物一般长30~35个核苷酸,引物短会影响重组酶的活性。5'端的前3个核苷酸应当避免聚鸟嘌呤,3'末端是鸟嘌呤和胞嘧啶可以提升引物的扩增性能。参照GenBank中已经发表的ALV-K全基因组序列,使用DNAStar软件寻找一段在K亚群毒株的gp85基因中比较保守,而与其他亚群ALV毒株差异性大的核酸序列作为目标区域,按照上述原则来设计RPA引物表1,在上游引物的5'端加入25 bp的T7启动子序列,使RPA扩增后的目的片段能转录为Cas13a的靶标RNA。引物由生工生物工程(上海)有限公司合成。

表1 设计的引物和crRNATable 1 Designed primers and crRNA
1.4 RPA反应条件的优化根据TwistAmp®Basic kit的说明书来优化RPA反应体系,每个RPA酶预混粉剂可以配置4个反应体系,先计算好待测样品的数量,再加上阳性对照和阴性对照来配置总的预混液,混匀后分装为9 µL/管,最后分别加入1 µL的DNA模板。测试反应体系在不同温度、引物浓度、反应时间下的扩增效果。
1.5 crRNA的设计及体外转录RPA扩增得到的目的基因片段大小一般为100~200 bp,在目的基因片段中选择与上、下游引物均不重叠的28 bp作为crRNA的靶向序列,应用NCBI BLAST进一步确定该序列的特异性。通过体外转录来产生crRNA单链的DNA序列组成为:25 bp T7启动子序列(GAAATTAATACGACTCA CTATAGGG)+36 bp与LwCas13a蛋白结合的锚定序列(GATTTAGACTACCCCAAAAACGAAGGGGACT AAAAC)+28 bp目的基因靶向序列的反向互补序列。通过引物合成后退火及T7 Quick High Yield RNA Synthesis kit转录为crRNA,得到的crRNA利用Agencourt RNAClean XP磁珠进行纯化。
1.6 LwCas13a蛋白的表达与纯化构建重组原核表达质粒pET28a-LwCas13a并转化至Rosetta(DE3)感受态细胞中,优化条件使其为可溶性表达。按照NTA-Ni柱说明书进行亲和层析纯化LwCas13a蛋白并进行透析和超滤浓缩。实验过程中利用SDSPAGE进行蛋白大小分析,确保纯化后得到的是目的蛋白。
1.7 CRISPR/Cas13a反应体系的建立先通过RPA扩增ALV-K的cDNA,再将RPA扩增产物、crRNA、LwCas13a蛋白、RNA报告分子等成分制备CRISPR/Cas13a反应体系,每个反应体系有10 µL。实际应用时需数好待测样品的数量,加上阳性对照和阴性对照来配置总的预混液,混匀后分装为9 µL/管,再分别加入1 µL的RPA扩增产物作为模板。将反应管置于水浴锅或PCR仪等能保持恒温的仪器中,37℃孵育适当时间后向各反应管中分别加入50 µL HybriDetect 1 assay buffer(来自Milenia HybriDetect 1 kit),移液器上下吹吸混匀,插入试纸条进行显色。
1.7.1 反应的特异性 分别以感染鸡的其他常见病毒ALV-A/B/J、REV、MDV、CIAV、IBDV、IBV、NDV的DNA或cDNA为模板,使用所建立的CRISPR/Cas13a方法进行检测,验证其与其他病毒是否存在交叉反应。
1.7.2 反应的敏感性 设计并合成一对PCR引物(C1/C2)扩增包含了RPA目的基因区域的一段DNA,PCR产物进行琼脂糖凝胶电泳后胶回收并克隆至pMD18-T载体,转化DH5α感受态细胞,挑单菌落活化,将PCR鉴定为阳性的质粒送测序。验证后的重组质粒pMD18-T-K作为标准品,NanoDrop2000可见光分光光度计测定其浓度为190 ng/µL,用无RNA酶的水进行10倍梯度稀释,拷贝数计算公式为:(6.02×1023)×(DNA浓度ng/µL×10-9)/(DNA长度×660)=拷贝数(copies/µL)。得到的含有不同拷贝数(107~101copies/µL)的质粒溶液作为模板进行CRISPR-Cas13a反应,检测该体系的敏感性。
1.7.3 反应的符合性 将临床上PCR检测为ALV-K阳性的15份病料组织提取DNA后,分别用建立的CRISPR/Cas13a反应体系检测,验证该方法的符合性。
2 结果
2.1 RPA反应和crRNA应用DNAStar对ALV-K的基因组进行比对分析后,针对其gp85基因设计了相应的RPA引物、标准质粒构建所需引物(C1/C2)和crRNA(表1),将设计的RPA引物进行不同的组合优化,并通过CRISPR/Cas13a反应得到了特异性好敏感性高的RPA引物对(K2F/K3R扩增产物为118 bp,表1中斜体加粗标记),优化后的RPA反应体系(10 µmol/L K2F/K3R 3 µL,TwistAmp Rehydration Buffer 30 µL,280 mmol/L醋酸镁3 µL,ddH2O 6 µL)混匀后分装为9 µL/管,最后分别加入1 µL的DNA模板,37℃孵育30 min快速扩增目的基因。
2.2 LwCas13a蛋白的表达与纯化优化后重组质粒pET28a-LwCas13a的表达条件为:0.5 mmol/L IPTG诱导,18℃摇床160 rpm,培养16 h。离心收获菌体,超声破碎后收集蛋白上清液,用0.45 μm滤膜过滤。上清液用NTA-Ni柱纯化(图1)。纯化后蛋白在透析液中(50 mmol/L Tris-HCl,600 mmol/L NaCl,5%glycerol,2 mmol/L DTT)4℃透析过夜,超滤管浓缩至终浓度为2 mg/mL,分装为5 µL/管存于-80℃备用。

图1 纯化后的LwCas13a蛋白Fig.1 Purif ied LwCas13a protein
2.3 CRISPR/Cas13a反应体系的建立优化后的CRISPR/Cas13a反应体系(ddH2O 6.25 µL,0.25 µL HEPES pH6.8 1 mol/L,0.1 µL MgCl21 mol/L,0.4 µL rNTP solution mix 25 mmol/L,1.0 µL LwaCas13a 63.3 µg/mL,0.5 µL Murine RNase inhibitor 40 U/µL,0.25 µL T7 RNA polymerase 5 U/µL,0.5 µL crRNA 10 ng/µL,0.1 µL RNA 报告分子100 µmol/L)再分别加入1 µL的待测RPA扩增产物作为模板,37℃孵育50 min来检测目的基因。RNA报告分子两端分别标记了5/6-羧基荧光素(FAM)和生物素(Biotin)。Milenia HybriDetect试纸条 上划有与Biotin结合的链霉亲和素作为对照线(C线)和用于捕获与胶体金偶联的抗FAM一抗的检测线(T线)。CRISPR/Cas13a反应产物流经纳米金标抗FAM抗体时,体系中RNA报告分子的FAM端会标记上纳米金。若样本中含有ALV-K,则crRNA、LwCas13a蛋白和RPA扩增产物转录后的RNA形成复合体激活LwCas13a蛋白的RNA酶活性,切割体系中的RN A(包括RNA报告分子)。若RNA报告分子被全部切断则其FAM端会流过C线到达T线被抗抗体捕捉而显色;当只有一部分RNA报告分子被切断时,C和T线都会显色,这两种情况都表明样本中含有ALV-K判定为阳性。若样本中无ALV-K,crRNA和LwCas13a蛋白形成的复合体则不能激活蛋白的RNA酶活性来切割RNA。RNA报告分子未被剪切时,其Biotin端会被拦截在C线上显色而T线不显色判定为阴性(图2)。
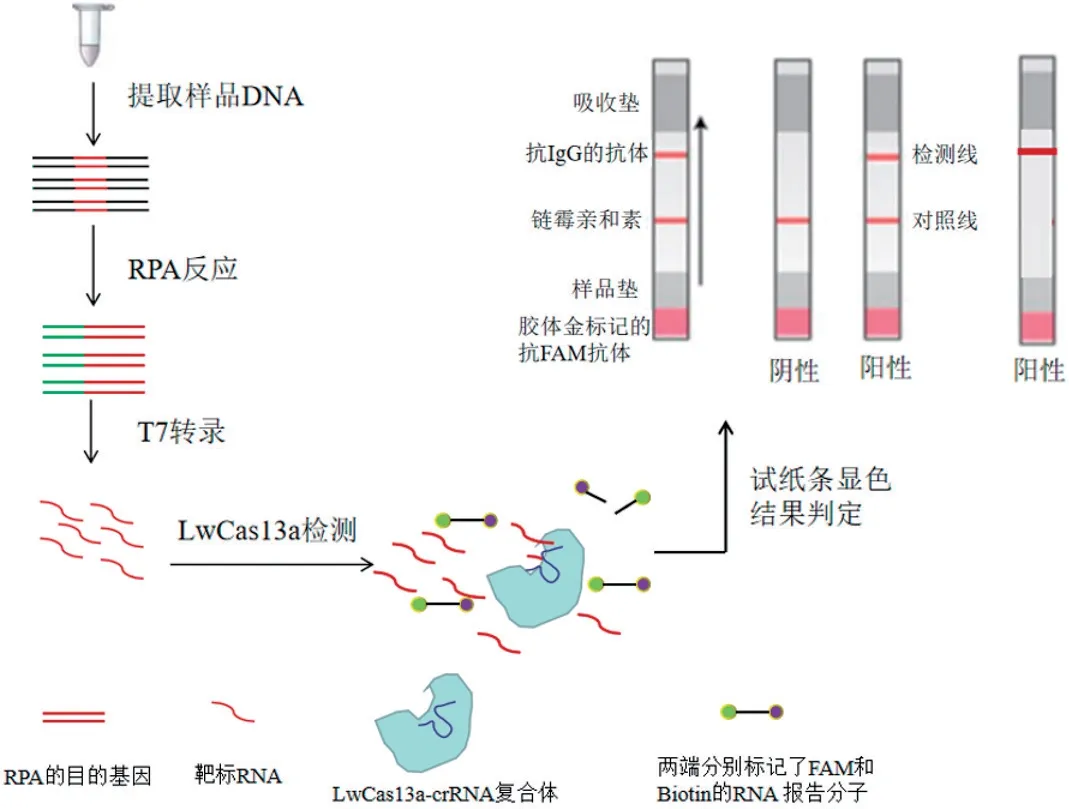
图2 CRISPR/Cas13a检测体系的反应流程Fig.2 Experimental workf low of the CRISPR/Cas13a detection system
2.4 CRISPR/Cas13a反应的特异性、敏感性和符合性用建立的ALV-K CRISPR/Cas13a体系检测样品,只有ALV-K的cDNA作为RPA反应模板的T线显色为阳性,其他的核酸检测只有C线显色为阴性(图3)。结果表明,本方法具有很高的特异性与其他感染鸡的常见病毒不存在交叉反应。应用1 µL含有不同拷贝数(107~101copies/µL)的标准品质粒溶液作为模板,按照1.4和2.1来配置RPA反应体系。再分别取1 µLRPA反应产物作为模板按照1.7和2.3的方法进行CRISPR/Cas13a检测。结果表明,该方法检测ALV-K的灵敏度为50 copies/µL(图4)。用建立的ALV-K CRISPR/Cas13a方法检测15份PCR鉴定为ALV-K核酸阳性的样品,结果显示,15份样品全部为阳性,符合率为100 %(图5)。

图3 CRISPR/Cas13a检测体系的特异性Fig.3 Specif icity of CRISPR/cas13a detection system

图4 CRISPR/Cas13a检测体系的敏感性Fig.4 Sensibility of CRISPR/cas13a detection system

图5 CRISPR/Cas13a检测体系的符合性Fig.5 Conformity of CRISPR/Cas13a detection system
3 讨论
根据传播的特征和方式,ALV可分为外源性和内源性病毒。感染鸡的内源性ALV为E亚群,主要以cDNA的形式嵌合在鸡的染色体基因组中,干扰外源性ALV的检测为该病的净化带来很大的困难[1]。感染鸡的外源性ALV包括A、B、C、D、J和K亚群,尽管ALV-K的复制能力较弱且很少引起肿瘤,但发现其与其他亚群ALV混合感染的情况时常发生,而不同亚群毒株的共感染加大了ALV的基因重组及突变[11]。因此,应加强地方品种鸡中ALV-K的调查和监测,建立特异、准确、快速的检测方法。
国内外已经建立了多种ALV-K的诊断方式,包括病毒分离、ELISA、LAMP、PCR和实时荧光定量PCR等[12-16],这些技术都有其适用性,但均存在流程繁琐,时间较长的缺点,比如病毒分离操作繁琐且周期长,ELISA敏感性低,LAMP易出现假阳性,而实时荧光定量PCR需要昂贵的设备和有一定生物技术的人员才能完成。CRISPR/Cas系统凭借其简单、高效的基因编辑能力,已被广泛应用于生物、医学等多个研究领域。自2015以来CRISPR/Cas13a系统的研究突飞猛进[17],被开发为一种快速、便携、低成本、高灵敏度的分子检测体系,在病原体检测、耐药性分析和肿瘤基因突变检测等方面取得了显著突破,具体的被应用于寨卡病毒、登革热病毒、EB病毒、H7N9禽流感病毒、埃博拉病毒、新型冠状病毒、致病细菌株及其耐药基因和SNP分型等多种靶标检测[18-22]。相比先前的研究,RPA的引入显著提高了该方法的灵敏度。同时,基于Cas13a的检测体系拥有高灵敏度和高错配敏感性,其特异性的crRNA识别目标序列时只允许一个碱基的错配,能准确的区分ALV各亚群毒株。商品化试剂盒提取样品核酸大约10 min,CRISPR/Cas13a体系检测ALV-K需要80 min左右,因此2 h内便可肉眼观测病原体的检测及分型结果。本研究建立了ALV-K的CRISPR/Cas13a检测方法,为ALV-K的早期快速诊断、流行病学调查和防控提供了技术支撑。
