鸭源新城疫病毒强毒株感染对番鸭致病性和β-防御素基因表达的影响
2023-09-08侯雨彤陈玉秋张莉莉马得莹
侯雨彤,陈玉秋,张莉莉,马得莹
(1.东北农业大学动物科学技术学院,哈尔滨 150030;2.中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室,哈尔滨 150001)
新城疫(Newcastle disease,ND)是由新城疫病毒(Newcastle disease virus,NDV)强毒株感染引发的急性、高度接触性传染病[1]。NDV又称禽Ⅰ型副黏病毒(Avian paramyxovirus type 1,APMV-1),属于副黏病毒科禽腮腺炎病毒属成员。病毒基因组为单股、负链、不分节段的RNA[2-3]。NDV具有广泛的宿主谱,目前为止,已经报道至少有鹦鹉、鸽、鸵鸟、番鸭、鸬鹚、鹅、鸭等250种鸟类能够自然或实验感染NDV[4]。各种家禽均可感染,其中鸡和鹅发病率较高。同时病禽为此病传染源,在其分泌物、排泄物中携带大量病菌,并且被病禽污染的饲料、饮水或垫料均携带病毒。若家禽接触后会通过消化道、呼吸道和眼结膜传播,进而诱发新城疫[5]。发生该病后,病禽主要表现为痢疾和神经症状,死禽主要特征为局部病灶出血,肠粘膜坏死,卵泡出血、淤血[6-7]。其中鸭感染该病毒的主要临床症状表现为食欲不振、下肢麻痹、腹泻等,与鸡感染NDV后发病症状相似[8]。如果有细菌等混合感染(主要是大肠杆菌病和传染性浆膜炎),会使死亡率升高[9]。但是,我们近期的研究发现,绍鸭感染鸭源NDV毒株后,鸭没有临床发病症状和死亡情况发生,说明NDV对不同品种鸭致病性存在差异[10]。
NDV是RNA病毒,其基因组易发生变异,导致其宿主的易感性经常发生改变,并且常规的疫苗接种对一些变异毒株不能提供理想的保护效果。因此,深入探究家禽抗感染的天然免疫调节机制,将对家禽养殖业的发展具有重要意义。禽防御素(Avian β-Defensin,AvBD)属于β-防御素的一种,是一类广泛存在于禽体内的内源性阳离子抗菌肽[11]。无论是人工合成的β-防御素还是天然β-防御素,都具有广谱抗菌、抗病毒以及免疫调节作用[12-13]。有研究发现,鸭源NDV毒株可诱导绍鸭部分AvBD的表达量上调,这些反应可能与病毒的致病性及AvBD在机体内的抗病毒作用有关,揭示了鸭源NDV毒株感染可诱导绍鸭体内产生天然免疫反应[10]。NDV还可诱导鸽β-防御素1、2、7和10基因的表达量上调,从而增加先天性免疫系统对新城疫病毒的抵御[11-13]。此外,防御素也能够激活树突状细胞和调节在抗原递呈细胞中干扰素-γ(interferon,IFN-γ)的产生,表明它们可能在获得适应性免疫的过程中也起了一定的作用[11,14]。
鸭源NDV的大多数研究集中于病毒分离和鉴定,而强毒株感染鸭后诱导机体免疫反应的研究报道较少。本试验旨在探讨鸭源NDV强毒株对番鸭的致病性,同时探究病毒感染诱导机体AvBD基因的表达,初步揭示新城疫病毒感染番鸭诱导机体的反应,同时为AvBD在抗新城疫病毒的临床应用中提供初步参考依据。
1 材料与方法
1.1 试验动物与毒株 80只15日龄SPF番鸭,由哈尔滨国生生物科技股份有限公司实验动物中心提供;1%SPF鸡外周血红细胞和9日龄SPF鸡胚均由中国农业科学院哈尔滨兽医研究所动物实验中心提供;鸭源新城疫病毒Md/CH/LGD/1/2005毒株[15]由本实验室鉴定和保存。病毒基因组序列GenBank登录号为KM885167,其鸡胚半数感染量(50% egg infectious dose,EID50)为log108.38。1日龄雏鸡脑内致病指数(intracerbral pathogenicity index,ICPI)值为1.88,鸡胚平均死亡时间(mean death time,MDT)值为50 h。
1.2 主要试剂 One Step SYBR®Prime ScriptTMRTPCR KitⅡ试剂盒Cat.RR086A、ExTaqDNA聚合酶、DL100 marker、RNAiso Plus购自Takara公司;凝胶回收试剂盒购自美国OMEGA公司;三氯甲烷、异丙醇、无水乙醇等其他试剂均为分析纯。
1.3 主要应用软件 DNA序列分析比对应用DNAMAN软件;引物设计采用Oligo 7软件。
1.4 试验设计 将80只15日龄健康SPF番鸭随机分为两组,其中试验组和对照组各40只。试验组以滴鼻点眼的方式每只鸭接种107EID50/0.2 mL NDV Md/CH/LGD/1/2005株。对照组接种同剂量的灭菌PBS。两组番鸭在接种后36 h、72 h、7 d和25 d,各取10只颈部放血处死,采集处死鸭的骨髓、脾脏、盲肠扁桃体、哈德氏腺和法氏囊五个免疫器官样品,分别标记,置于-70℃冰箱保存用于后续提取组织总RNA。同时,接种后36 h、72 h、7 d以及16 d、20 d和25 d采集两组各10只番鸭的血清,用于NDV的血凝抗体检测。
1.5 临床及病理学变化观察 人工感染番鸭NDV Md/CH/LGD/1/2005株后,持续观察临床症状25 d,对死亡番鸭进行剖检,观察病变。并采集番鸭胸腺和脾脏组织固定于4%甲醛溶液内,制备病理切片,进行病理学变化观察。死亡动物采取与实验组相同的组织器官,分组标记,置于-70℃冰箱储存备用。
1.6 样品处理及组织总RNA的提取 将采取的番鸭骨髓、脾脏、盲肠扁桃体、哈德氏腺、法氏囊冻存组织样品各称取100 μg,匀浆后按TRIzol法提取总RNA。最后用70 μL DEPC处理水溶解,-70℃冰箱保存备用。
1.7 real-time RT-PCR引物设计 番鸭18S rRNA、AvBD1、AvBD3、AvBD5、AvBD6、AvBD16、AvBD4、AvBD7和AvBD12基因引物根据已发表序列设计[16-18],均由哈尔滨博仕生物公司合成,使用前需用无菌DEPC处理水稀释备用。
1.8 real-time RT-PCR 以番鸭各组织器官的总RNA为模板,鸭18S rRNA作为内参基因,根据表1中设计的特异性引物进行real-time RT-PCR检测18S rRNA及AvBD基因表达量。将每个基因的相应质粒标准品按10倍梯度稀释后用于构建标准动力学曲线。其中,试验组和对照组样品均做10个平行,各取其平均值。引物浓度为2.5 μmol/L,荧光定量反应体系(25 μL)为:one step buffer 12.5 μL,RNA free ddH2O 7.5 μL,Prime Script one step Enzyme Mix 1 μL,上、下游引物(10 μmol/L)1 μL,Total RNA 2 μL。反应条件为:反转录42℃ 5 min,95℃预变性10 s;95℃变性5 s,60℃退火30 s,共40个循环;40℃延伸30 s。计算公式如下:基因相对表达值(校正值)=log10(目标基因的拷贝数/内参基因的拷贝数)

表1 Real-time RT-PCR 引物序列Table 1 Real-time RT-PCR primer sequences
1.9 数据的分析和处理 所有数据均以平均值对数±标准误差表示。所得数据采用SPSS Statistics 19软件进行分析。
2 结果
2.1 NDV Md/CH/LGD/1/2005株感染番鸭后临床症状及病理学组织变化 番鸭感染NDV Md/CH/LGD/1/2005毒株后,均有明显的临床症状,表现为精神沉郁、站立不稳、饮水和采食量下降,排稀便。发病率为100%,其中3只死亡(死亡率7.5%)。死亡番鸭剖检变化为肝脏淤血(图1A);腺胃肿胀,腺胃壁增厚、乳头明显水肿且有出血点(图1B);脾脏明显肿大变黑、质地变脆、出血,出现部分坏死灶,呈斑驳状病变(图1C)。病理组织学结果显示死亡番鸭脾脏实质内的淋巴细胞显著减少(图1D,图1E为对照组);胸腺间质出血(图1F,图1G为对照组)。
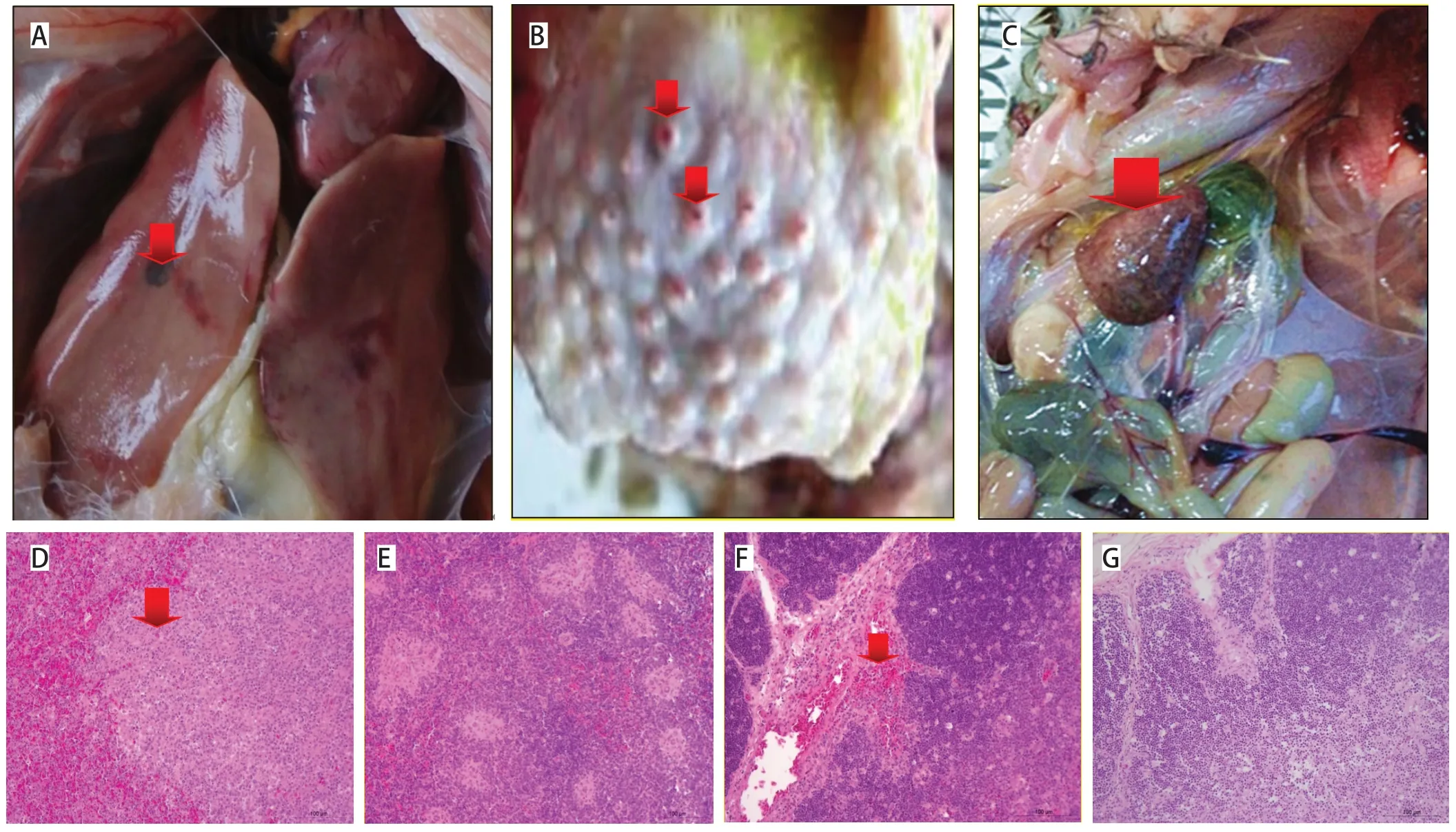
图1 番鸭感染NDV后组织剖检症状Fig.1 Organization autopsy symptoms of Muscovy ducks infected with the NDV
2.2 NDV Md/CH/LGD/1/2005株感染番鸭后血清抗体变化 Md/CH/LGD/1/2005毒株感染番鸭后能够诱导机体产生抗体。在接种后72 h时,部分番鸭产生抗体,在第7 d抗体水平达到最高峰,之后开始下降并进入抗体滴度平台期,但仍处于较高水平(图2)。

图2 番鸭感染NDV后HI血清抗体效价Fig.2 The HI titers of Muscovy duck serum antibodies infected with the NDV
2.3 NDV Md/CH/LGD/1/2005株感染后番鸭组织中AvBD基因的表达水平 在接种NDV Md/CH/LGD/1/2005强毒株后的各个时间点,番鸭的不同组织器官中AvBD表达量表现一定的差异。鸭AvBD1、2、5和10在机体内广泛分布,而在骨髓中未检测到AvBD3和AvBD9,在脾脏中未检测到AvBD6和AvBD16(图3)。
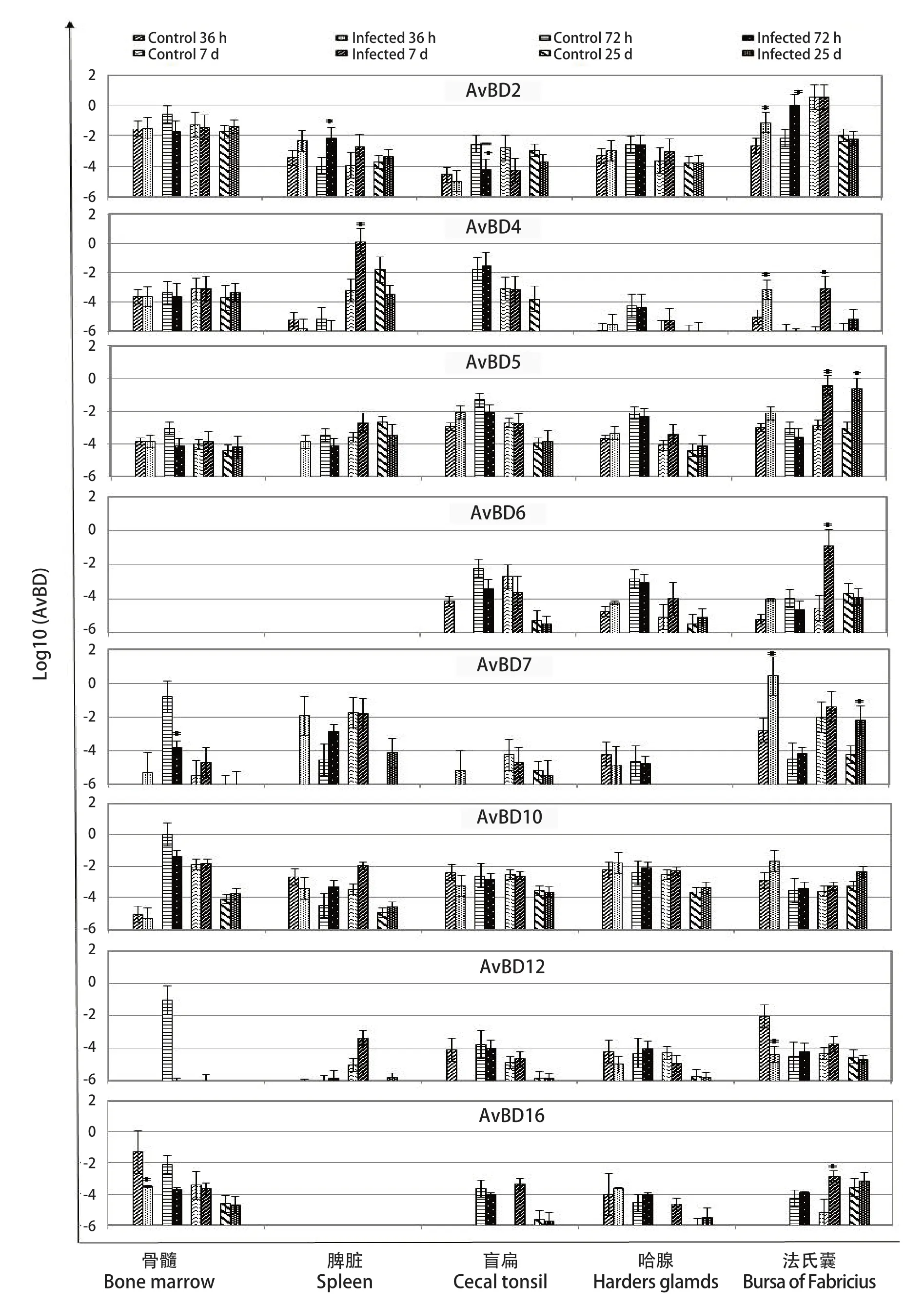
图3 感染NDV后番鸭各组织中AvBD基因表达水平变化Fig.3 The expression of AvBD mRNA in tissues of Muscovy ducks infected with the NDV
在感染后36 h,AvBD2和AvBD4在法氏囊中表达量显著增加(P<0.05);AvBD12和AvBD16分别在法氏囊和骨髓中的表达量显著降低(P<0.05)。在感染后72 h,AvBD2在脾脏、法氏囊中显著上调(P<0.05),却在盲肠扁桃体中表达量显著下降(P<0.05)。AvBD10在骨髓中表达量明显下降,在法氏囊内表达呈整体上升趋势。在感染后7 d,AvBD3、AvBD6在法氏囊中表达量显著升高(P<0.05),AvBD4在脾脏和法氏囊内显著高表达(P<0.05),AvBD5在7 d及25 d的法氏囊内显著高表达(P<0.05),AvBD16的表达在骨髓内与同组对照组相比呈降低趋势,在法氏囊内显著增加(P>0.05)。AvBD7在36 h、72 h、7 d和25 d 4个时间点的法氏囊内均呈升高趋势,且在感染后36 h和25 d差异性显著(P<0.05),却在72 h骨髓内显著降低表达(P<0.05)。
3 讨论
早期报道显示,在发病鸭和无临床症状的健康鸭体内,分离到大量毒力不等的NDV毒株,但大部分毒株仅被宿主携带而不会致鸭发病,即便是强毒力毒株也如此[19]。我们近期的研究也发现,NDV强毒对绍鸭无明显致病性[10]。然而,近年来鸭新城疫出现频率增加,且毒力也有明显增强的趋势。NDV不同致病性的复杂性状是由多个基因型决定的,最主要是取决于病毒毒力以及宿主先天免疫反应的结果。新城疫病毒可以诱导宿主的天然免疫反应[20],抗体反应和细胞介导免疫反应对阐明机体感染NDV后的一系列免疫应答是同样重要的。
本试验对番鸭利用滴鼻点眼的方式接种Md/CH/LGD/1/2005强毒株,发生个别番鸭死亡情况,有明显的组织剖检症状,并伴有组织器官不同程度的病理损伤。这一结果现象与Shi等[21]以点眼滴鼻的方式接种鸭源NDV后部分白羽番鸭出现的发病症状和死亡情况的研究结果相同。而石悦等[22]选用鸭源NDV以同样方式接种绍鸭,未见绍鸭有明显发病症状和死亡情况。以此推测这可能是由于不同品种的鸭对NDV强毒的反应和敏感性不同。而Dai[23]也证实了这一观点,通过将同一鸭源NDV分别感染北京鸭和绿头鸭发现,绿头鸭在攻毒后3~5 d全部死亡,而北京鸭无明显症状。许丽文等[10]将与本试验同一鸭源NDV毒株感染绍鸭后,鸭没有临床发病症状和死亡情况发生,且感染后鸭排毒期间在攻毒组咽喉及泄殖腔拭子中均检测到NDV。进一步说明NDV强毒株对不同鸭源致病性的差异。
番鸭感染NDV强毒后血清抗体检测显示,在感染NDV后72 h开始产生阳性抗体,此时能够抑制病毒的复制,且在第7 d抗体水平达到最高峰,在16 d左右进入抗体滴度平台期。抗体变化规律与王秋玲[16]研究结果相同。本实验中NDV在感染后72 h即能达到最高复制水平,其病毒增殖复制速度非常之快。而体液免疫应答则须在感染后3~5 d才开始产生特异性中和抗体,并在7 d时达到最高抗体水平。就实验过程中番鸭的死亡情况来看,尽管抗体产生时间相对较晚,但仍可以发挥很好的保护作用。这表明ND疫苗的初次免疫在番鸭的生产和养殖中非常重要。
大量研究表明禽β-防御素不仅具有广谱抗细菌的活性,参与机体抗菌反应[24]。同时具有免疫调节特性,可诱发炎症反应促进机体适应性免疫[25]。为了探究番鸭是否在接种NDV强毒后会诱导AvBD基因在体内组织中的表达,本试验探讨了感染该病毒后AvBDs在不同组织中的表达量。结果表明该NDV强毒感染番鸭后能够诱导AvBD的表达。Xu等[26]在鹅感染NDV 36 h和72 h后,发现在鹅的脾脏和肝脏中该病毒载量与对照组相比差异显著,且鹅AvBD4、AvBD16等AvBD基因表达量与病毒载量相关性差异显著,证明新城疫病毒可诱导鹅AvBD的产生。此研究与本试验结果一致,且与传染性支气管炎病毒(Infectious bronchitis virus,IBV)[27]和鸭肝炎病毒(Duck hepatitis virus,DHV)[28]感染绍鸭和北京鸭引起的组织中AvBD表达水平变化一致。在SPF北京鸭感染DHV后,可诱导胸腺AvBD4和骨髓AvBD7表达,并呈时间依赖性,相反,DHV感染后,盲肠扁桃体、脾脏、法氏囊和胸腺中AvBD12的表达显著降低,在某些时间点检测不到AvBD12的表达[12]。这与本试验中AvBD12的表达情况相似,但与骨髓中AvBD7的表达量恰恰相反。云骜[29]建立鸡AvBD2和AvBD6的体外表达进行抗ALV-J试验,发现鸡AvBD2和AvBD6可以协同抵抗病毒感染,证明防御素可以激活免疫反应。Liu等[30]的结果显示,NDV能显著诱导鸡胚成纤维细胞产生AvBD2,且在两个重组AvBD2蛋白中,只有在真核细胞中表达的蛋白在体外对新城疫病毒F48E9株具有直接的抗病毒活性。本试验中番鸭在接种NDV 36 h和72 h后AVBD2在多个组织中表达量显著上升,推测AVBD2可发挥重要抗病毒作用。雏鸡在感染白痢沙门菌后,可在十二指肠中检测到AvBD2、4、5、6、7、9的表达水平明显上升,其中AvBD6的升高幅度最大[31]。而本实验中检测到AvBD2、3、4、5、6、7、16显著表达的组织是在法氏囊中。以上我们可以得出:禽β-防御素在机体组织中分布具有组织特异性,且不同种禽类的在组织中的表达有明显差异,这可能是由于不同的β-防御素在抗菌、抗病毒过程中所起作用不同所造成。另有研究发现,AvBDs对FadV-4(禽腺病毒)[32]、MDA(马立克氏病病毒)[33]、ALV-J(禽肿瘤病病毒)[21]、金黄色葡萄球菌和沙氏菌[34]有抵抗作用。综上所述,实验证明AvBDs在禽类先天防御系统的抗病毒过程中发挥重要作用。
番鸭经鸭源基因Ⅶ型ND强毒株(Md/CH/LGD/1/2005)感染后出现临床发病症状和死亡现象,经血清抗体检测发现NDV能够引起番鸭机体内的免疫应答反应,通过定量检测证明组织中AvBDs表达量的显著高表达,积极的参与了番鸭抗NDV的免疫调控。揭示了该鸭源NDV毒株感染所诱导番鸭体内天然免疫反应的分子基础,为后续禽类ND的防控提供一定参考意义。
