免疫增强剂CVC1302诱导高亲和力抗体机制分析
2023-09-07杜露平鲁海燕侯立婷于晓明程海卫张元鹏郑其升
杜露平 鲁海燕 侯立婷 于晓明 程海卫 张元鹏 陈 瑾 郑其升 甘 芳
(1.南京农业大学 动物医学院,南京 210095;2.江苏省农业科学院 动物免疫工程研究所/国家兽用生物制品工程中心/江苏省食品质量安全重点实验室,南京 210014;3.兽用生物制品(泰州)国泰技术创新中心,江苏 泰州 225300)
机体在感染或者免疫后,生发中心(GC) B细胞在滤泡辅助性T细胞(Tfh)的阳性选择下,仅有高亲和力的GC B细胞可转化为浆母细胞,中亲和力GC B细胞进入下一轮增殖循环以提高亲和力,低亲和力GC B细胞则面临凋亡被巨噬细胞捕获[1]。生发中心在生理结构上分为明区和暗区2个区域。在暗区,GC B细胞密集并可迅速分裂增殖,且依赖于表达的诱导活化的胞苷脱氨酶(AID)进行体细胞高频突变(SHM),亲和力成熟[2-3]。在明区,GC B细胞识别结合滤泡树突状细胞(FDC)携带的抗原抗体复合物,处理后经由主要组织相容性复合物Ⅱ(MHCⅡ)递呈至Tfh,Tfh通过结合的抗原量区分表达高/低亲和力BCR的GC B细胞,由此筛选出高亲和力GC B细胞,分化为浆母细胞[4-6],浆细胞随着血液循环转移至骨髓,持续性分泌高亲和力抗体。AID特异性表达在外周淋巴器官GC B细胞中[7],在胞浆中表达后,转运至细胞核,使免疫球蛋白基因发生类别转换(CSR)和体细胞高频突变(SHM)[8]。其中SHM主要发生于生发中心暗区,AID使抗体可变区V(D)J发生点突变,使得BCR对抗原具有高的亲和力[9-10]。AID基因(Aicda)包含4个不同区域(Ⅰ到Ⅳ),其中区域Ⅰ为启动子区[11],研究发现TLR激动剂作用于GC B细胞,激活NF-κB通路,进而诱导HoxC4表达,通过增强AID启动子活性促进AID表达[12-13]。
免疫增强剂CVC1302由Toll样受体与NOD样受体激动剂复配组成。研究发现,免疫增强剂CVC1302配伍NP-OVA模式抗原免疫小鼠,利用BSA上载有不同比例的NP(4-羟基-3-硝基苯乙酰基)可检测机体诱导产生的高亲和力/总亲和力NP抗体水平,检测发现CVC1302可诱导小鼠产生显著提升的高亲和力NP特异性抗体水平[14-16]。
因此,本研究旨在验证CVC1302促进 AID表达提高GC B细胞的亲和力进而使得大部分GC B细胞转化为浆母细胞,从而诱导持续久、亲和力高的抗体以为机体提供体液免疫保护,为后续新型免疫增强剂的研制提供理论基础和研究思路。
1 材料与方法
1.1 试验材料
6周龄BALB/c雌性小鼠购自扬州大学比较医学中心;NP-OVA、NP1-BSA和NP15-BSA购自美国Bioscience Technologies公司;免疫增强剂CVC1302组分(单磷酰脂质A(MPLA)购自北京邦定生物医学公司;胞壁酰二肽(MDP)购自上海瀚泓科技有限公司;β-葡聚糖购自河北克隆多生物科技有限公司);MontanideTM-ISA206购自上海Seppic赛彼科特殊化学品有限公司;Trizol试剂和qPCR mix购自上海皓嘉科技发展有限公司;荧光抗体anti-B220 FITC、anti-GL-7 PE-vio770、anti-AID和rabbit anti rat IgG-APC均购自上海优宁维生物科技股份有限公司;rabbit anti rat IgG-HRP购自武汉博士德生物科技有限公司;ECL发光试剂盒购自诺唯赞生物科技有限公司。
1.2 试验方法
1.2.1免疫抗原制备
按照参照文献[14]制备方法分别制备疫苗,首先将MPLA、MDP和β-葡聚糖按照一定比例溶于蒸馏水中,制备免疫增强剂CVC1302,再与NP-OVA(4-羟基-3-硝基苯乙酰基耦联鸡卵白蛋白)按照体积比1∶50混合后得到水相,最后与ISA206按照体积比1∶1进行乳化,制备获得疫苗NP-CVC1302-ISA206,最终每100 μL免疫抗原中含有50 μg NP-OVA和1 μL CVC1302。
1.2.2小鼠免疫试验
将6周龄BALB/c雌性小鼠15只随机均分为3组,分别于后腿肌肉接种NP、NP-ISA206和NP-CVC1302-ISA206,每只100 μL。利用NP1-BSA或NP15-BSA(NP载量不同)包被的ELISA板分别检测小鼠免疫后28 d血清中高亲和力NP(NP1)及总NP(NP15)特异性抗体水平。
将6周龄BALB/c雌性小鼠21只随机分为3组,分别于后腿肌肉接种NP、NP-ISA206和NP-CVC1302-ISA206,每只100 μL。免疫后14 d,分离小鼠腹股沟淋巴结制备单个淋巴细胞,流式分选仪分选获得GC B细胞,使用Trizol试剂提取RNA,利用real-time PCR分析GC B细胞中AID和HoxC4基因转录水平。
将6周龄BALB/c雌性小鼠9只随机分为3组,分别于后腿肌肉接种NP、NP-ISA206和NP-CVC1302-ISA206,每只100 μL。免疫后14 d,分离小鼠腹股沟淋巴结制备单个淋巴细胞,流式检测NP特异性GC B细胞占B细胞比例和GC B细胞AID表达水平。
1.2.3ELISA检测小鼠NP特异性抗体水平
利用NP1-BSA或NP15-BSA包被的ELISA板分别检测小鼠免疫后28 d血清中高亲和力NP(NP1)及总NP(NP15)特异性抗体水平。检测方法参照文献[17-18]:NP1-BSA或NP15-BSA(每孔0.5 μg)包被96孔酶标板,4 ℃孵育过夜,PBST洗涤后每孔加入100 μL待检小鼠血清(1∶200稀释),37 ℃孵育60 min;PBST洗涤后每孔加入100 μL羊抗鼠HRP-IgG (1∶10 000稀释),37 ℃孵育60 min;PBST洗涤后每孔加入100 μL TMB底物显色液,37 ℃避光孵育10 min;最后每孔加入100 μL 1 mol/L H2SO4终止液终止反应,用酶标仪测定OD450值。
1.3 流式检测NP特异性GC B细胞水平
1.3.1小鼠腹股沟淋巴结单个淋巴细胞制备
免疫后14 d分别收集小鼠腹股沟淋巴结,参照文献[19],含100 U/mL青霉素和100 U/mL链霉素的预冷PBS缓冲液冲洗4~6次,用眼科剪将其剪成约1 mm3的碎块,随后利用Medimachine系统(美国BD公司)制备单个淋巴细胞。
1.3.2流式检测NP特异性GC B细胞数目
取1×106制备的小鼠腹股沟淋巴结单个淋巴细胞于1.5 mL离心管中,利用核内细胞因子染色试剂盒对细胞进行破膜固定,然后用anti-B220 APC、anti-GL-7 PE-vio770、NP-Biotion 和Streptavidin-FITC进行染色,再用BD Accuri C6流式细胞仪检测NP特异性GC B细胞,比较各组间NP特异性GC B 细胞比例,分析GC B细胞增殖水平。
1.3.3流式检测GC B细胞AID表达
取1×106制备的小鼠腹股沟淋巴结单个淋巴细胞于1.5 mL离心管中,利用核内细胞因子染色试剂盒对细胞进行破膜固定,然后用anti-B220 FITC、anti-GL-7 PE-vio770、anti-AID和rabbit anti rat IgG-APC进行染色,再用BD Accuri C6流式细胞仪检测GC B细胞AID表达水平,比较GC B细胞中AID平均荧光强度(MFI)。
1.4 Real-time PCR检测GC B细胞AID和HoxC4转录水平
取相同数目分选的GC B细胞用Trizol提取RNA,real-time PCR检测AID和HoxC4转录水平,以β-actin作为内参基因,其中β-actin、AID和HoxC4相对应引物见表1。

表1 本研究用引物对序列Table 1 Sequences of primers used in the study
1.5 统计分析
本研究中所用数据均用平均值±标准差表示。利用Graph Prism软件对数据进行处理分析,各组之间的差异性通过ANOVA分析,两组之间的差异利用t检测评估。其中P>0.05表示差异不显著,P<0.05表示差异显著,P<0.01、P<0.001和P<0.000 1表示差异极显著。
2 结果与分析
2.1 CVC1302对小鼠抗体亲和力的影响
免疫后28 d采集分离制备小鼠血清,利用NP1-BSA 或NP15-BSA包被的ELISA板分别检测小鼠高NP特异性抗体水平和总亲和力NP特异性抗体水平。由图1可知,NP-ISA206和NP-CVC1302-ISA206组小鼠血清总NP(NP15)及高亲和力NP(NP1)特异性抗体水平差异均极显著(P<0.0001,图1(a)),通过比较NP-CVC1302-ISA206和NP-ISA206两组间NP1/NP15比值,发现血清在同一稀释度下,NP-CVC1302-ISA206组中高亲和力NP(NP1)特异性抗体所占比例显著高于NP-ISA206组(P<0.01,图1(b))。结果表明,CVC1302可以诱导机体产生高亲和力的抗体,且高亲和力抗体比例显著升高。

(a)NP特异性抗体水平;(b)NP1OD450/NP15OD450。(a) Levels of NP-specific antibodies; (b) Ratio of OD450 between NP1 and NP15. *代表组间差异显著(P<0.05);**、***、****,代表组间差异极显著(P<0.01、P<0.001、P<0.000 1)。下同。* represent significant differences between groups (P<0.05), and **, ***, **** represent extremely significant differences between groups (P<0.01, P<0.001, P<0.000 1). The same as below.图1 CVC1302诱导高亲和力NP特异性抗体Fig.1 Induction of induced high-affinity NP-specific antibodies for CVC1302
2.2 CVC1302对GC B细胞增殖的影响
免疫后14 d,取腹股沟淋巴结,制备单个淋巴细胞,利用流式检测分析NP特异性GC B 细胞占B细胞比例。由图2可见,NP-CVC1302-ISA206组小鼠NP特异性GC B细胞占B细胞比例高达17.77%,与NP-ISA206组小鼠(14.2%)相比,差异显著(P<0.01)。结果表明,CVC1302可显著促进GC B细胞的增殖。
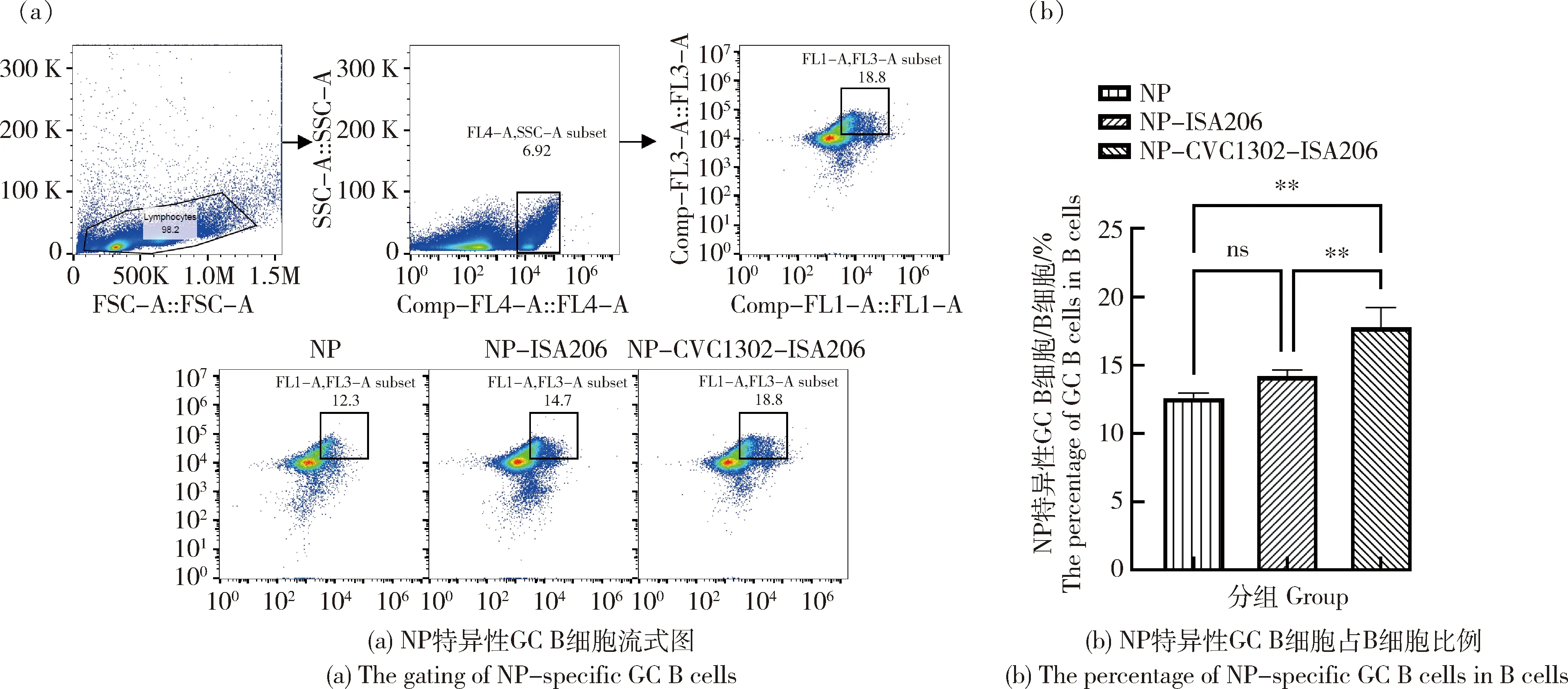
图2 CVC1302增加抗原特异性GC B细胞比例Fig.2 The enhancement of the percentage of antigen-specific GC B cells for CVC1302
2.3 CVC1302对GC B细胞中AID基因转录的影响
免疫后14 d,取腹股沟淋巴结,制备单个淋巴细胞,流式分选获得GC B细胞,取1×106个细胞利用Trizol提取RNA,real-time PCR检测各组GC B细胞AIDmRNA转录水平。由图3可见, NP-CVC1302-ISA206组GC B细胞AID基因相对转录水平为7.02,NP-ISA206组AID基因相对转录水平为3.23,2组之间差异均显著(P<0.01)。结果表明,CVC1302可显著提高GC B细胞中AID基因的转录水平。

图3 CVC1302促进GC B细胞AID基因转录Fig.3 The enhancement of the transcriptional levels of AID in GC B cells for CVC1302
2.4 CVC1302对GC B细胞中AID表达的影响
免疫后14 d,取腹股沟淋巴结,制备单个淋巴细胞,流式细胞术分析GC B细胞AID表达水平。由图4可知,NP-CVC1302-ISA206组GC B细胞AID平均荧光强度显著高于NP-ISA206组(P<0.05),CVC1302可显著提高GC B细胞中AID的表达水平。
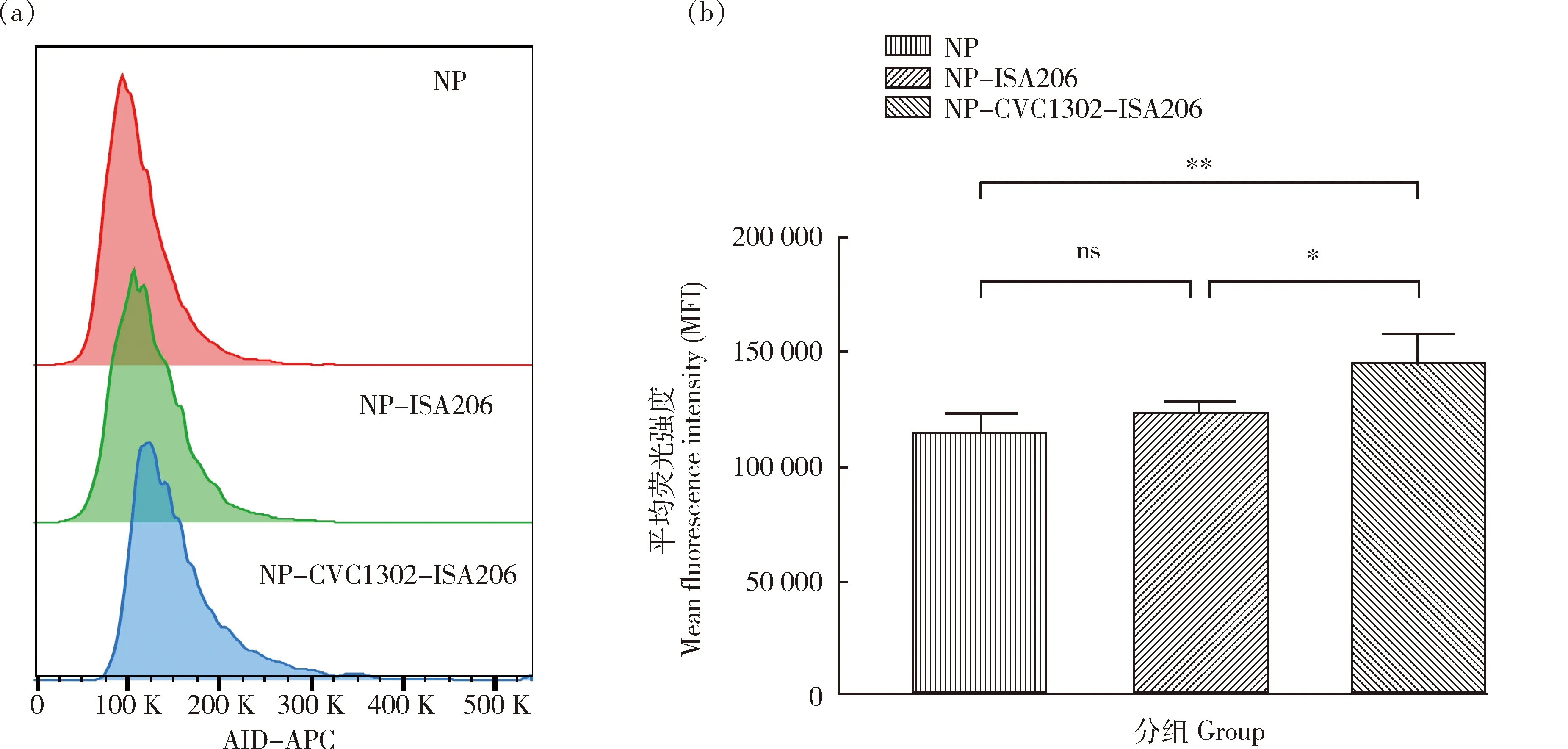
(a) GC B细胞AID MFI流式图;(b)GC B细胞AID MFI柱式图。(a) The flow diagram of MFI of AID in GC B cells; (b) The bar chart of MFI of AID in GCB cells.图4 CVC1302促进GC B细胞中AID的表达Fig.4 The enhancement of the mean fluorescence intensity of AID in GC B cells for CVC1302
2.5 CVC1302对GC B细胞中HoxC4转录的影响
免疫后14 d,取腹股沟淋巴结,制备单个淋巴细胞,流式分选获得GC B细胞,取1×106个细胞利用Trizol提取RNA,real-time PCR检测各组GC B细胞HoxC4mRNA转录水平。由图5可见,NP-CVC1302-ISA206组GC B细胞HoxC4基因相对转录水平为4.03,NP-ISA206组HoxC4基因相对转录水平为1.53,2组之间差异极显著(P<0.001)。结果表明,CVC1302可显著提高GC B细胞中HoxC4基因的转录水平。

图5 CVC1302促进GC B细胞HoxC4基因转录Fig.5 The enhancement of the transcriptional levels of HoxC4 in GC B cells for CVC1302
3 讨论与结论
抗体作为体液免疫应答的重要组成,特异性识别进而中和病原体[20]。研究发现,抗体亲和力即抗原与抗体结合能力,与其抑制病原体感染的能力显著相关[21]。抗体亲和力成熟依赖于AID介导的SHM。生发中心暗区,活化的抗原特异性B细胞在增殖过程中,SHM介导B细胞抗体基因的V区发生点突变,诱导B细胞抗体亲和力成熟,随后迁移至明区,高亲和力B细胞在Tfh的阳性选择下,分化为浆细胞,转运至骨髓分化为LLPC分泌高亲和力抗体。AID表达依赖于其基因转录过程。AID由4个顺式调控区介导其于活化B细胞中的表达,其中区域1含有可与NF-κB和 STAT6的结合位点,其被TLR激动剂激活后,增强HoxC4的表达,促进AID增强子活性,正向调控AID表达[12-13]。
研究发现,CVC1302可提高抗体亲和力[16]。鉴于此,本研究利用流式细胞术检测发现,NP-CVC1302-ISA206组小鼠显著促进NP特异性GC B细胞占B细胞的比例,比值为17.77%,显著高于NP-ISA206组小鼠,表明CVC1302可促进GC B细胞的增殖;与此同时,real-time PCR检测发现,CVC1302可促进GC B细胞中AID基因的转录水平,流式细胞术同时分析得出AID的表达水平也显著提升,NP-CVC1302-ISA206组小鼠其GC B细胞AID的MFI为147 539,而NP-ISA206组小鼠GC B细胞AID的MFI为126 005,两者差异显著。鉴于HoxC4基因于AID转录水平起到正向调控的作用,本研究利用real-time PCR对HoxC4基因的转录水平进行了检测,结果显示,以β-actin基因作为内参,NP-CVC1302-ISA206组小鼠其HoxC4基因相对转录水平为4.03,而NP-ISA206组小鼠HoxC4基因相对转录水平仅为1.53,两者差异极显著。综上, CVC1302依赖于促进HoxC正向调控AID表达,进而诱导机体产生高亲和力抗体。
兽医领域中,免疫增强剂的研制多依赖于经验,对其作用机制的研究甚少,人医领域中,研究发现TLR4激动剂协同CD40信号可依赖于NF-κB信号通路上调AID基因转录,促进AID表达,诱导高亲和力抗体[22]。TLR1/2激动剂协同BCR依赖于AKT信号通路促进USP10核移位,进而抑制AID降解,诱导高亲和力抗体[23]。本研究发现免疫增强剂CVC1302依赖于HoxC4的上调表达促进AID的表达,然而其相关信号通路仍需进一步研究分析;且多项研究检测抗体亲和力多为使用NP-OVA作为模式抗原,利用包被NP1-BSA或NP15-BSA(NP载量不同)的ELISA板,检测小鼠的总NP(NP15)或高亲和力(NP1)抗体水平,因此本研究仅使用模拟抗原检测总亲和力和高亲和力抗体水平,后续应对GC B细胞免疫球蛋白可变区VH186.2和JH等基因片段进行测序,分析其基因突变频率。本研究仅利用模式抗原NP-OVA探究CVC1302可诱导产生高亲和力抗体,后续将推广至不同病原体,检测其诱导高亲和力抗体这一效力的普遍性,扩大CVC1302应用前景。
本研究利用NP-OVA作为模式抗原,阐明CVC1302依赖于HoxC4正向调控AID诱导机体产生高亲和力抗体,为后续新型免疫增强剂的研制提供研究思路和方向。
