榆黄汤对激素依赖性皮炎豚鼠的治疗效果及可能作用机制▲
2023-09-07曹经江
熊 飞 曹经江
(三峡大学附属仁和医院皮肤科,湖北省宜昌市 443000)
激素依赖性皮炎是长期不规范局部使用糖皮质激素制剂导致用药期间皮肤疾病消失,而停药后出现皮肤损伤的一类炎症性皮肤疾病[1-2]。此类患者的临床表现主要为丘疹、红斑、痤疮样或酒糟鼻样皮疹,常伴有脱屑、干燥、灼痛、瘙痒等表现[3]。目前,临床上主要采用免疫抑制剂或激素类药物递减等方法进行治疗,但效果并不显著,部分患者短期内会出现反跳现象,且出现不同程度的副作用[4-6]。中医具有整体观和辨证论治两大特点,中医认为激素依赖性皮炎属于“中药毒”范畴,病机为风、热、毒邪阻滞面部,治疗应以清热凉血、解毒、祛风止痒为主要原则,中医药内服、中药外用、中西医结合、针灸均可改善面部皮损[7]。我院院内制剂榆黄汤由黄柏、地榆、野菊花、蒲公英、黄芩组成,具有清热利湿、解毒的功效。前期临床研究已证实榆黄汤对面部变应性接触性皮炎的疗效显著[8],但是关于其治疗激素依赖性皮炎的临床数据较少。因此,本研究使用豚鼠建立激素依赖性皮炎模型,基于体内研究探讨榆黄汤治疗激素依赖性皮炎的效果及可能机制,从而为临床上治疗激素依赖性皮炎提供相关依据。
1 材料与方法
1.1 实验动物 健康豚鼠40只,体重(300±20)g,雌雄各半,月龄3~5个月,购自湖北省实验动物中心[SCXN(鄂)2010-0041]。于无菌、温度为18 ℃~22 ℃、湿度为40%~70%的环境中饲养,自由饮食,每12 h光暗交替。
1.2 主要药物和试剂 榆黄汤汤剂由三峡大学附属仁和医院制备,汤剂组成包括地榆30 g、 黄柏30 g、 黄芩20 g、 蒲公英20 g、 野菊花20 g, 加水10 L, 武火煎煮20 min后文火煎煮40 min,过滤后得中药煎液5 L,低温保存。卤米松乳膏购自重庆华邦制药有限公司(国药准字:H20153118),他克莫司软膏购自四川明欣药业有限责任公司(国药准字:H20123430),IgE ELISA试剂盒、白细胞介素(interleukin,IL)-6 ELISA试剂盒、IL-8 ELISA试剂盒均购自上海碧云天生物科技有限公司(批号:042911、170924、092743),CD8+T淋巴细胞分选试剂盒购自北京汇智和源生物技术有限公司(批号:A001417)。
1.3 建模方法 采用随机数字表法将40只豚鼠分为药物对照组、实验组、模型组和空白对照组,每组10只。于实验前24 h给予各组豚鼠背部去毛,范围约3 cm×3 cm。空白对照组不做处理,将卤米松乳膏涂于药物对照组、实验组和模型组豚鼠背部,2次/d,连续外用15 d,构建激素依赖性皮炎模型。停药3 d后,涂药区域出现红斑、肿胀等炎症反应则表明造模成功,本研究30只豚鼠均造模成功。
1.4 干预方法 造模成功后7 d,给予药物对照组豚鼠皮损部位涂抹他克莫司软膏,早晚各1次,连续干预21 d;给予实验组豚鼠皮损部位冷敷榆黄汤纱条(浸透榆黄汤汤剂的医用纱布,大小超过背部皮损)20 min,早晚各1次,连续干预21 d;给予模型组豚鼠皮损部位冷喷生理盐水20 min,早晚各1次,连续干预21 d。空白对照组不做处理。
1.5 观察指标 (1)干预21 d后,完成其他指标检测后处死豚鼠,取背部皮损组织(空白对照组取去毛处皮肤组织),置于多聚甲醛固定液进行固定,然后依次进行冲洗、酒精梯度脱水、透明、浸蜡、包埋、切片、HE染色,在显微镜(OLYMPUS公司,型号:BH-2)下观察皮肤各层细胞变化情况,并采用VISIA®皮肤检测系统(Canfield Scientific,Inc.)测量表皮层、真皮层厚度(单位为μm)。(2)造模成功后,于干预前及干预21 d后采用生理盐水清洗豚鼠皮损处皮肤(清洗空白对照组豚鼠去毛处皮肤)并擦干,用适当力度将皮脂测试分析仪(Courega+Khazaka electronic GmbH,型号:Sebumeter®SM 815)的探头垂直于皮肤表面测量油脂含量,连续测量3次取平均值。(3)造模成功后,于干预前及干预21 d后,抽取豚鼠尾部静脉血0.5 mL(共2管)。其中,一管血标本于4℃下以3 000 r/min离心10 min后获得血清,采用ELISA检测血清IgE、IL-6、IL-8水平。另一管血标本经肝素抗凝后,取100 μL全血加入检测管中,并加入CD8+单标单克隆抗体(10 μg/mL),避光孵育20 min后,用PBS洗涤1次,再用0.5mL PBS重悬,采用流式细胞仪(Becton,Dickinson and Company,型号:FACSCantoⅡ)检测CD8+T淋巴细胞比例。
1.6 统计学分析 采用SPSS 22.0软件进行统计学分析。计量资料以(x±s)表示,多组间比较采用方差分析,进一步两两比较采用LSD-t检验,组内比较采用配对样本t检验。以P<0.05为差异具有统计学意义。
2结 果
2.1 4组豚鼠皮损组织HE染色结果的比较 HE染色结果显示,空白对照组豚鼠去毛处皮肤组织的表皮层细胞排列整齐,真皮层胶原纤维排列整齐、均一;模型组豚鼠皮损组织过度角化,表皮棘层增厚,且棘层细胞水肿,真皮层存在大量炎症细胞;药物对照组和实验组豚鼠皮损组织的角质层增厚,棘层细胞水肿情况有所减轻,真皮层炎性细胞浸润减少,两组HE染色结果无明显差异。见图1。
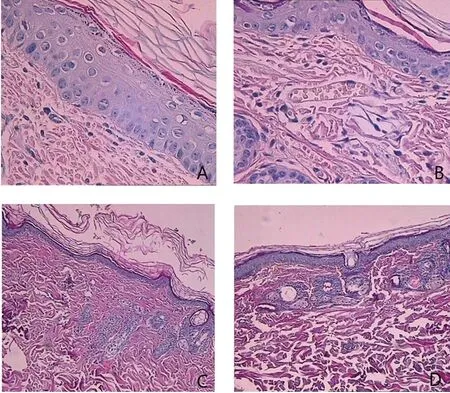
图1 HE染色结果(×400)
2.2 4组豚鼠表皮厚度及真皮厚度的比较 相较于空白对照组,模型组、药物对照组及实验组豚鼠的表皮厚度和真皮厚度更薄(均P<0.05);相较于模型组,药物对照组及实验组豚鼠的表皮厚度和真皮厚度更厚(均P<0.05);药物对照组和实验组豚鼠的表皮厚度和真皮厚度差异均无统计学意义(均P>0.05)。见表1。
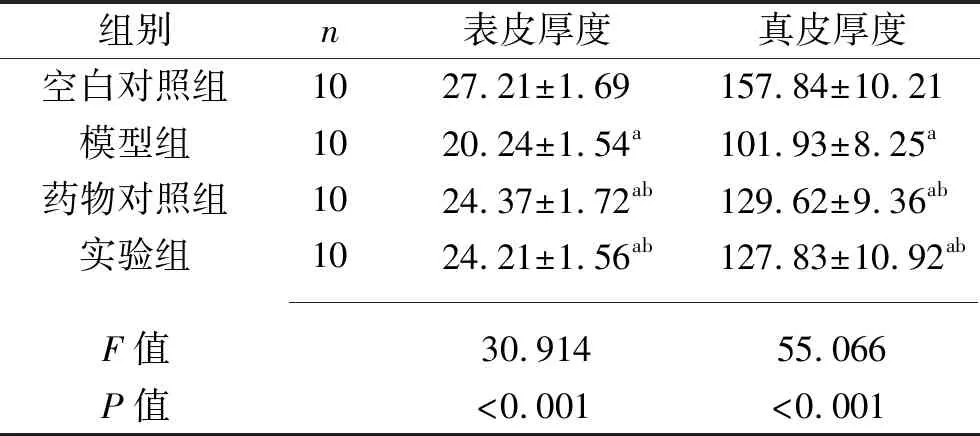
表1 4组豚鼠表皮厚度及真皮厚度的比较(x±s,μm)
2.3 干预前后4组豚鼠皮肤油脂含量的比较 干预前,相较于空白对照组,药物对照组、实验组及模型组豚鼠皮肤油脂含量均更低(均P<0.05),而药物对照组、实验组及模型组豚鼠皮肤的油脂含量差异均无统计学意义(均P>0.05)。干预21 d后,药物对照组及实验组豚鼠皮肤油脂含量均较干预前增加(均P<0.05);相较于空白对照组,药物对照组、实验组及模型组豚鼠皮肤油脂含量均更低(均P<0.05);相较于模型组,药物对照组及实验组豚鼠皮肤油脂含量均更高(均P<0.05);而药物对照组与实验组豚鼠皮肤油脂含量差异无统计学意义(P>0.05)。见表2。
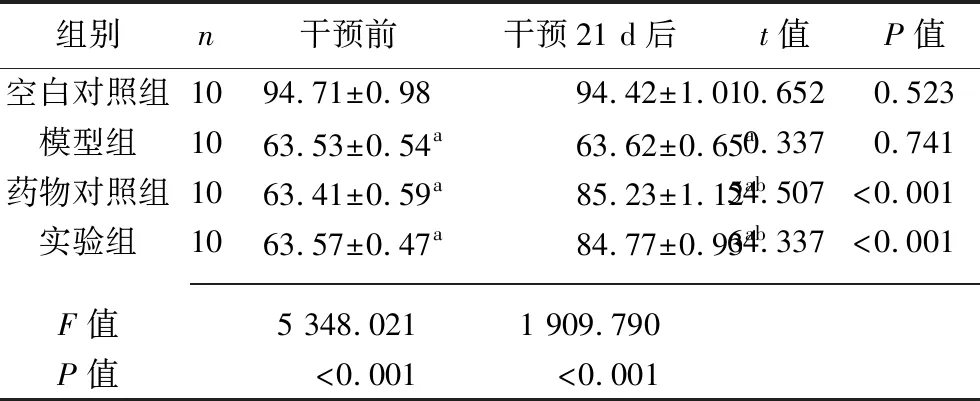
表2 干预前后4组豚鼠皮肤油脂含量的比较(x±s,μg/cm2)
2.4 干预前后4组豚鼠血清IgE水平的比较 干预前,相较于空白对照组,药物对照组、实验组及模型组豚鼠血清IgE水平均更高(均P<0.05),而药物对照组、实验组及模型组豚鼠血清IgE水平差异均无统计学意义(均P>0.05)。干预21 d后,药物对照组及实验组豚鼠血清IgE水平均较干预前下降(均P<0.05);相较于空白对照组,药物对照组、实验组及模型组豚鼠血清IgE水平均更高(均P<0.05);相较于模型组,药物对照组及实验组豚鼠血清IgE水平均更低(均P<0.05);而药物对照组与实验组豚鼠血清IgE水平差异无统计学意义(P>0.05)。见表3。
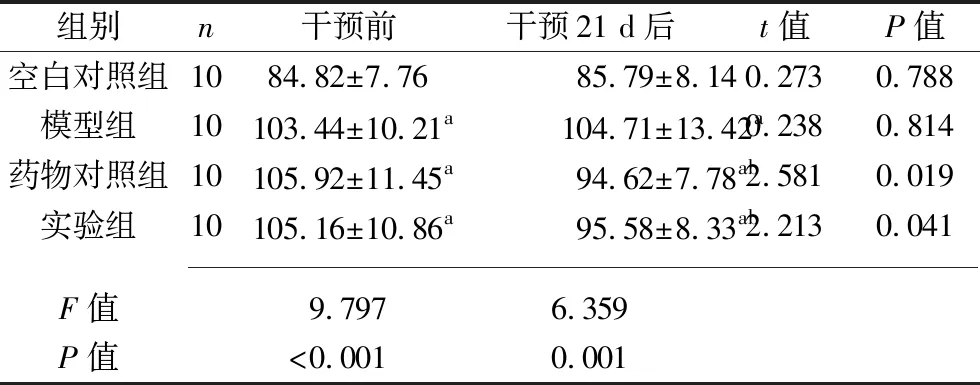
表3 干预前后4组豚鼠血清IgE水平的比较(x±s,mg/L)
2.5 干预前后4组豚鼠外周血CD8+T淋巴细胞比例的比较 干预前,相较于空白对照组,药物对照组、实验组及模型组豚鼠外周血CD8+T淋巴细胞比例均更低(均P<0.05),而药物对照组、实验组及模型组豚鼠外周血CD8+T淋巴细胞比例差异均无统计学意义(均P>0.05)。干预21 d后,药物对照组及实验组豚鼠外周血CD8+T淋巴细胞比例均较干预前上升(均P<0.05);相较于空白对照组,药物对照组、实验组及模型组豚鼠外周血CD8+T淋巴细胞比例均更低(均P<0.05);相较于模型组,药物对照组及实验组豚鼠外周血CD8+T淋巴细胞比例均更高(均P<0.05);而药物对照组与实验组豚鼠外周血CD8+T淋巴细胞比例差异无统计学意义(P>0.05)。见表4。
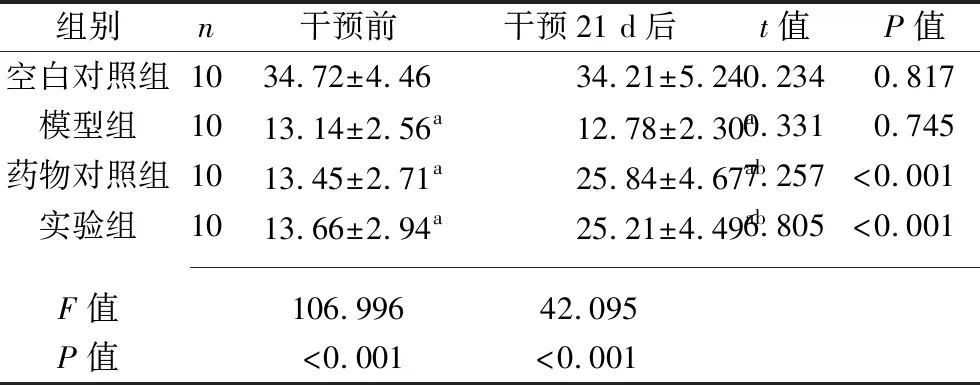
表4 干预前后4组豚鼠外周血CD8+T淋巴细胞比例的比较(x±s,%)
2.6 干预前后4组豚鼠血清IL-6、IL-8水平的比较 干预前,相较于空白对照组,药物对照组、实验组及模型组豚鼠血清IL-6、IL-8水平均更高(均P<0.05),而药物对照组、实验组及模型组豚鼠血清IL-6、IL-8水平差异均无统计学意义(均P>0.05)。干预21 d后,药物对照组及实验组豚鼠血清IL-6、IL-8水平均较干预前下降(均P<0.05);与空白对照组比较,药物对照组、实验组及模型组豚鼠血清IL-6、IL-8水平均更高(均P<0.05);相较于模型组,药物对照组及实验组豚鼠血清IL-6、IL-8水平均更低(均P<0.05);而药物对照组与实验组豚鼠血清IL-6、IL-8水平差异均无统计学意义(均P>0.05)。见表5。

表5 干预前后4组豚鼠血清IL-6、IL-8水平的比较(x±s,ng/L)
3 讨 论
激素依赖性皮炎是停用长期外用的糖皮质激素制剂后导致原有皮肤病复发或加重,迫使患者再次使用糖皮质激素制剂治疗的疾病[9-11]。激素依赖性皮炎患者的病情反复且难以痊愈,特别是面部激素依赖性皮炎可能导致毁容,不仅给患者带来巨大的经济负担,而且严重影响患者的心理健康[9,12]。
中医将激素依赖性皮炎归于“中药毒”范畴,风邪侵袭为本病的病机之一[13]。激素依赖性皮炎的皮损常见于面部,并可使得面部皮肤敏感性增加,患者表现为怕风、不耐寒热,这也进一步佐证风邪侵袭为该病病机之一。但风邪多不单独致病,常与湿热相结合。此外,激素类药物属辛燥、甘温之品,长期使用可助阳生热、伤津伤阴,以致毒热之邪侵袭[5,14]。榆黄汤为我院院内制剂,主要成分为地榆、黄柏、黄芩、野菊花、蒲公英。地榆可解毒敛疮、止血凉血,具有抗氧化、抗菌、抗炎、调节免疫功能等作用,可作为烧伤、烫伤等外伤常用药[15]。黄柏和黄芩均具有泻火解毒、清热燥湿之功效。现代药理学表明,黄柏具有局部抗炎、抗感染、清除自由基等作用,并可抑制致病菌的增殖和定植;黄芩的主要作用成分为黄芩素,具有抗氧化、增强或抑制免疫功能双向调节作用[8]。黄柏与黄芩合用可增强清热解毒的功效[16]。野菊花和蒲公英均为治疗疔疮痈肿的中药。野菊花的主要活性成分为萜类、挥发油和黄酮类化合物,具有抗病毒、抗菌、抗炎、抗肿瘤、清除氧自由基等作用[8]。蒲公英的主要成分为挥发油、黄酮类,同样具有抗肿瘤、抗炎等功效[17]。诸药合用,共奏清热解毒、祛风止痒之功。本研究结果表明,激素依赖性皮炎豚鼠的皮损组织炎症浸润明显,皮损处油脂含量减少,表皮及真皮变薄,而经榆黄汤干预后,激素依赖性皮炎豚鼠的皮损组织炎症及棘层细胞水肿、毛细血管扩张等情况明显减轻,皮损处油脂含量、表皮厚度及真皮厚度增加,且作用效果与西药他克莫司相似。这说明榆黄汤对激素依赖性皮炎具有较好的干预作用。
长期使用激素类药物可抑制表皮细胞的增殖、分化等,进而影响皮肤屏障功能,再加上外界因素的刺激,可导致皮炎复发,此时机体炎症介质过度表达,血清IgE水平显著上升[18]。此外,激素类药物还可抑制巨噬细胞功能,导致外周血CD8+T淋巴细胞比例降低,CD4+/CD8+值失衡[18]。而CD8+T淋巴细胞比例下降可诱发大量炎症因子如IL-6、IL-8等的释放,进而破坏血管内皮细胞结构、功能,促进皮炎的发生[19]。本研究结果显示,激素依赖性皮炎豚鼠的血清IgE、IL-6、IL-8水平上升,而外周血CD8+T淋巴细胞比例有所下降;经他克莫司或榆黄汤干预后,激素依赖性皮炎豚鼠的血清IgE、IL-6、IL-8水平均有所下降,而外周血CD8+T淋巴细胞比例有所上升,且两种药物效果相似。这说明榆黄汤可减轻激素依赖性豚鼠的炎症反应,并可改善其免疫功能。
综上所述,榆黄汤对激素依赖性皮炎豚鼠模型具有较好的干预作用,其机制可能与减轻机体炎症反应、改善免疫功能有关。榆黄汤的作用效果与他克莫司相似,或许可作为免疫抑制剂的替代药物,用于治疗激素依赖性皮炎。
