基于FoxP3、RORγt及相关细胞因子探讨半夏泻心汤对慢性萎缩性胃炎的干预机制▲
2023-09-07韦玉娜罗旋特张亚萍
韦玉娜 罗旋特 艾 军 游 琛 何 泉 张亚萍
(广西中医药大学基础医学院,广西南宁市 530200)
慢性萎缩性胃炎(chronic atrophic gastritis,CAG)是胃黏膜因受致病因素反复刺激而出现固有层腺体萎缩或肠上皮化生、异型增生的一种慢性消化道疾病[1],主要表现为胀满、纳呆、胃脘痛等症状[2]。CAG的发病机制尚不完全清楚,目前认为与幽门螺杆菌感染、年龄、免疫因素等有关[3]。正常胃黏膜-慢性浅表性胃炎-CAG-肠上皮化生-异型增生-胃癌是胃癌发生的主要病理通路[4]。据统计,CAG的癌变率可达10%~14%[5],亚洲是CAG 发生的主要地区,其中我国的CAG发病率最高[6],且我国2020年胃癌新发病例数在所有癌症中位居第4[7]。及时阻断CAG的进展,对于降低胃癌发病率具有重要意义。
Th17与组织炎症、自身免疫疾病的发生有着密切联系,其可分泌白细胞介素(interleukin,IL)-17、 IL-6、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)等炎症因子,其中IL-17是Th17的特异性细胞因子,可与中性粒细胞、上皮细胞等细胞的IL-17受体结合从而发挥促炎作用[8-9]。调节性T淋巴细胞(regulatory T lymphocyte,Treg)是一类能介导多种免疫效应的T淋巴细胞亚群,可通过分泌转化生长因子β(transforming growth factor β,TGF-β)、IL-10来促进自身分化,同时TGF-β、IL-10还可通过诱导免疫细胞凋亡进而抑制炎症反应[10]。Th17和Treg通过分泌细胞因子以相互作用,共同维持机体的免疫平衡[11]。Th17和Treg的分化分别受转录因子RAR相关孤儿受体γt (RAR-related orphan receptor gamma t,RORγt)和叉头框蛋白P3(forkhead box P3,FoxP3)的调控,而RORγt和FoxP3与胃癌的发生和病理变化高度相关[12-13]。
目前,西医治疗CAG的常用药物有叶酸、维酶素等[2],其中叶酸具有抑制胃黏膜炎症反应和修复胃黏膜的作用[14]。中医药治疗CAG具有整体化、个性化、副作用少的优势[15]。中药方剂半夏泻心汤出自张仲景的《伤寒杂病论》,是治疗痞满的经典方剂,全方由法半夏、党参、干姜、黄连、黄芩、炙甘草、大枣组成,具有健脾益气、解毒消痞的功效。潘小亮等[16]应用加味半夏泻心汤治疗CAG,发现总有效率达96.7%。有研究报告,黄连中的黄连素可抑制IL-17、IL-6等促炎因子的转录,促进抑炎因子TGF-β的转录[17],甘草水提物可以提高IL-10的表达[18]。由此可推测作为黄连、甘草等中药复合体的半夏泻心汤可能也具有类似作用。已有研究报告,半夏泻心汤可降低CAG患者的血清IL-6、TNF-α水平[19]。但半夏泻心汤对CAG患者机体Th17相关细胞因子(IL-17)、Treg相关细胞因子(IL-10、TGF-β)及转录因子FoxP3和RORγt是否有影响,未见相关研究报告。本研究通过观察半夏泻心汤对CAG大鼠模型临床症状、胃黏膜组织病理学变化、Th17和Treg相关细胞因子含量、FoxP3和RORγt表达的影响,阐释其对CAG的干预机制,为今后临床治疗和实验研究提供参考。
1 材料与方法
1.1 实验动物 无特定病原体级雄性SD大鼠48只,7周龄,体质量250~300 g,由湖南斯莱克景达实验动物有限公司提供[实验动物生产许可证号:SCXK(湘)2019-0004]。所购大鼠均饲养于广西中医药大学仙葫校区无特定病原体级动物实验室。饲养环境:室温(21±3)℃,湿度范围50%~70%,昼夜等分照明。喂养条件:统一提供常规大鼠饲料和灭菌水,自由饮水。
1.2 药物与试剂 半夏泻心汤组方为黄芩16 g、干姜16 g、党参16 g、炙甘草16 g、法半夏14 g、大枣10 g、黄连5 g,实验用中药材均选用农本方®浓缩中药配方颗粒[培力(香港)健康产品有限公司]。叶酸片(天津力生制药股份有限公司,国药准字H12020215,规格为5 mg/片),0.3%氨水(Sigma-Aldrich®Lab &Production Material公司,批号:SHBK0854),脱氧胆酸钠溶液(Solarbio®Life Sciences公司,货号:D8330;浓度为40 mmol/L)。大鼠IL-10、IL-17、TGF-β ELISA试剂盒(江苏晶美生物科技有限公司,批号分别为JM-01602R1、JM-01495R1、JM-01588R1),TUNEL细胞凋亡检测试剂盒-POD(博士德生物,货号:MK1011),TBS缓冲液(武汉博士德生物工程有限公司,货号:AR0031),DAB显色液(武汉博士德生物工程有限公司,货号:AR1022),TRIzol试剂(Invitrogen公司,货号:15596026),DEPC处理水 (Invitrogen公司,货号:4387937),反转录试剂(Thermo Fisher Scientific公司,货号EP0442),THUNDERBIRD®qPCR Mix试剂盒(TOYOBO公司,货号:QPS-201),引物由Invitrogen公司合成。
1.3 主要仪器 5430/R型台式高速冷冻离心机(Eppendorf公司),Infinite M200 Pro型多功能酶标仪(TECAN公司),BX53型荧光正置显微镜(OLYMPUS公司),HISTOCENTRE 3型包埋机(Thermo Fisher Scientific公司),RM2255型全自动轮转式切片机(徕卡显微系统有限公司),LightCycler®96型实时荧光定量PCR仪(Roche公司)。
1.4 动物造模、分组及给药 采用随机数字表法,从48只大鼠中选取42只作为模型制备组,余下6只设为空白组。采用脱氧胆酸钠加氨水联合造模法[20-21]制备CAG大鼠模型,即每日用40 mmol/L的脱氧胆酸钠溶液灌胃,每次灌胃量为10 mL/kg,1次/d,同时每日提供0.3%氨水(50 mL/只)供自由饮用。给予空白组大鼠灭菌水(50 mL/只)自由饮用。自造模开始第12周,每周处死2只模型制备组大鼠,剖取胃部组织经HE染色后置于光镜下观察以判断是否造模成功,到第16周时经病理科医师验证已达到CAG诊断标准[2]。造模过程中有2只大鼠死亡。
将剩余的30只模型制备组大鼠按随机数字表法分为模型组、叶酸组、半夏泻心汤低剂量组、半夏泻心汤中剂量组、半夏泻心汤高剂量组,各6只。按10 mL/kg给予空白组和模型组大鼠灌喂生理盐水,1次/d。用超纯水溶解研磨后的叶酸片,按1.35 mg/kg给予叶酸组大鼠灌喂叶酸,1次/d。按成人与大鼠剂量比换算半夏泻心汤的给药剂量,现已知中药汤剂的总克数为93 g,换算系数为6.3,假设人的体重为70 kg,则大鼠给药剂量=人给药剂量×换算系数=93/70×6.3≈8.37 g/kg,取该数值0.5倍即为低剂量组浓度,2倍即为高剂量组浓度,故给予半夏泻心汤低剂量组、半夏泻心汤中剂量组、半夏泻心汤高剂量组大鼠的灌胃剂量分别为4.185 g/kg、8.37 g/kg、16.74 g/kg,1次/d。各组均连续灌胃12周。
1.5 样本采集 给药后12周,在禁食24 h后皮下注射10%水合氯醛(3.5 mL/kg)麻醉各组大鼠后,开腹取腹主动脉全血20 mL,室温静置30~60 min,之后以2 500 r/min转速离心15 min以获得血清,用于ELISA检测。然后切取大鼠全胃组织,沿着胃小弯切开直至幽门处,剖开后用生理盐水冲洗干净,再将胃组织平均分成4份,其中一份用于HE染色进行组织病理学观察,余下3份分别用于TUNEL染色、实时荧光定量PCR检测、课题组其他实验。
1.6 观察及检测相关指标
1.6.1 大鼠一般情况:实验期间观察各组大鼠皮毛、饮食量、排泄物性质等情况,并且定期称量大鼠体质量。
1.6.2 HE染色观察胃黏膜组织病理学变化:取材后使用多聚甲醛进行标本组织固定;用乙醇和二甲苯分别进行脱水、透明处理;对样品组织进行石蜡包埋后,进行切片处理;经二甲苯脱蜡后进行常规HE染色;滴加中性树胶封片,置于显微镜下观察。
1.6.3 ELISA检测血清细胞因子含量:根据ELISA试剂盒的操作说明书,加入稀释后呈浓度梯度的标准品(IL-10、IL-17、TGF-β)50 μL,在待测样品微孔内加入稀释后的待测样品(含40 μL稀释液和10 μL待测样品)并拍匀孵育30 min,清洗5次,加入100 μL酶标试剂,封板后37 ℃孵育1 h。去除微孔内液体并用预先配制好的清洗液反复清洗5次并拍去多余液体。每个微孔依次滴加A、B显色剂各50 μL,拍匀,37 ℃避光反应15 min。加入终止液50 μL,最后通过多功能酶标仪测定450 nm吸光度,根据标准曲线计算样品中各细胞因子含量。
1.6.4 TUNEL染色观察胃黏膜细胞凋亡情况:按照1.6.2步骤制作脱蜡标本组织后,在切片上滴加用0.01 mmol/L TBS缓冲液稀释的蛋白酶K(稀释比例为1 ∶200),室温消化8 min,再用0.01 mmol/L TBS缓冲液清洗3次,加入40 μL标记缓冲液以保持湿润。取末端脱氧核苷酸转移酶和Biotin-dUTP各2 μL,加入36 μL标记缓冲液中并搅拌混匀作为标记液。甩去多余液体后加入标记液,37 ℃标记2 h,用0.01 mmol/L TBS缓冲液清洗3次。滴加封闭液,37 ℃孵育30 min。取1 mL经抗体稀释液稀释后的链霉亲和素-生物素(strept avidin-biotin complex,SABC),37 ℃孵育30 min。用DAB显色液显色,滴加苏木素复染、碱性溶液返蓝、中性树脂封片。置于显微镜下观察,细胞核显棕色则为阳性细胞。
1.6.5 实时荧光定量PCR法检测FoxP3 mRNA、RORγt mRNA相对表达水平:取样本组织20 mg,按照试剂盒说明书的步骤,利用TRIzol试剂提取总RNA,通过分光光度计检测RNA纯度与浓度后,利用反转录试剂进行反转录获得cDNA。然后进行实时荧光定量PCR检测,反应体系包含12.5 μL qPCR Mix(2×)、2.5 μmol/L基因引物(上、下游引物各1 μL)、2.0 μL反转录产物、8.5 μL ddH2O。反应步骤为95 ℃预变性1 min,95 ℃变性15 s、58 ℃退火20 s、72 ℃延伸20 s(循环40次),72 ℃末段延伸5 min。以GAPDH作为内参基因,采用2-ΔΔCt法计算目的基因的相对表达水平,引物信息见表1。

表1 引物信息
1.7 统计学分析 采用SPSS 20.0软件进行统计分析。计量资料以(x±s)表示,组间比较采用单因素方差分析,采用LSD-t检验(方差齐)或Dunnett′s T3检验(方差不齐)进行两两比较。以P<0.05为差异有统计学意义。
2 结 果
2.1 6组大鼠的一般情况 在实验期间,与空白组大鼠相比,模型组大鼠毛色泛黄且光泽度下降,饲养盒内可见较多掉落鼠毛,食盒内的食料剩余量较多,大便稀溏,肛周潮湿,体质量下降。给予药物干预后,叶酸组和半夏泻心汤各剂量组大鼠毛色光泽度有一定改善,饮食量增大,大便情况较模型组有不同程度改善,肛周毛发干燥,体质量快速增长,其中半夏泻心汤低剂量组大鼠的改善情况最好,且改善程度略优于叶酸组。
2.2 6组大鼠胃黏膜组织病理学变化 空白组大鼠胃黏膜固有层腺体数量正常、排列规则且紧密。模型组大鼠胃黏膜固有层出现淋巴细胞浸润,腺体数量减少伴囊性扩张,部分区域还可见潘式细胞。与模型组相比,叶酸组及半夏泻心汤各剂量组大鼠胃黏膜囊性扩张消失或减少,固有腺体数量不同程度增多,其中以半夏泻心汤低剂量组改善情况最为明显。见图1。
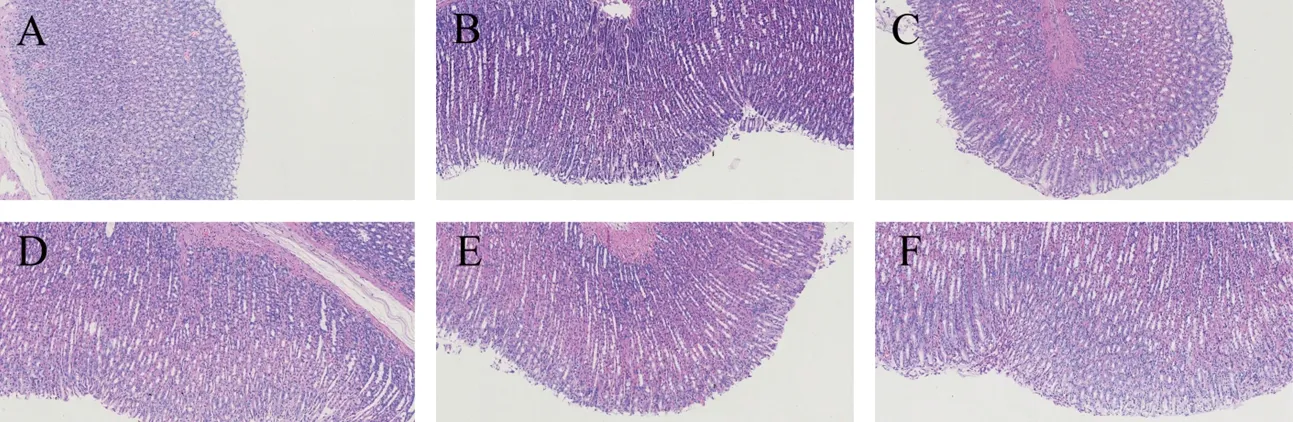
图1 6组大鼠胃黏膜组织病理学变化(HE染色,×200)
2.3 6组大鼠血清各细胞因子含量的比较 与空白组大鼠相比,模型组大鼠血清IL-10、IL-17、TGF-β含量均升高(均P<0.05);与模型组大鼠相比,半夏泻汤各剂量组和叶酸组大鼠血清IL-10、IL-17、TGF-β含量均下降(均P<0.05),其中半夏泻心汤低剂量组大鼠上述细胞因子含量最低(均P<0.05)。见表2。
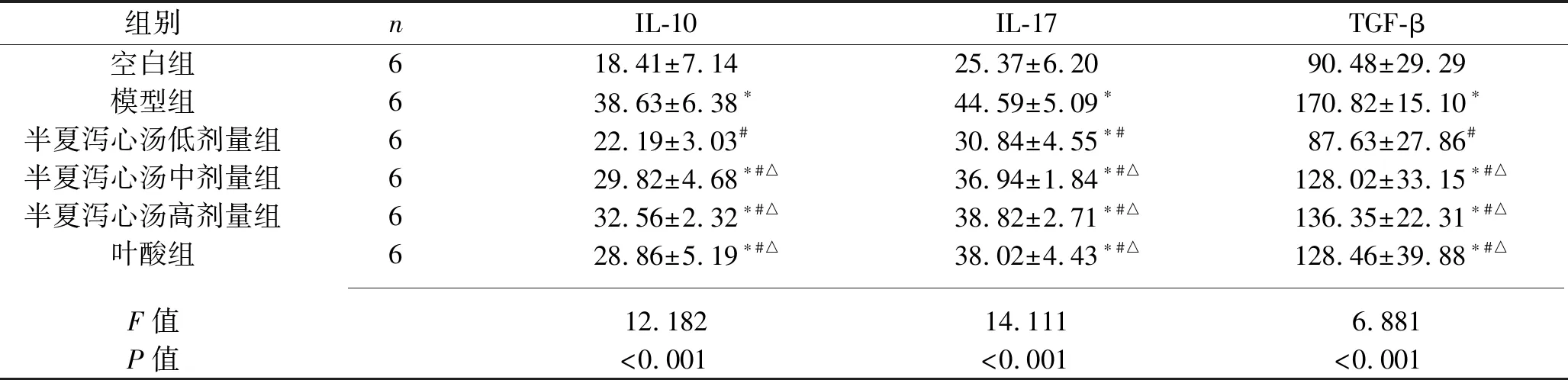
表2 6组大鼠血清IL-10、IL-17、TGF-β含量的比较(x±s,pg/mL)
2.4 6组大鼠胃黏膜细胞凋亡情况的比较 与空白组大鼠相比,模型组大鼠胃黏膜细胞TUNEL染色阳性率升高(P<0.05);与模型组大鼠相比,半夏泻心汤各剂量组和叶酸组大鼠胃黏膜细胞TUNEL染色阳性率均降低(均P<0.05),其中半夏泻心汤低剂量组大鼠的胃黏膜细胞TUNEL染色阳性率最低(均P<0.05)。见图2和表3。

图2 6组大鼠胃黏膜细胞凋亡情况(TUNEL染色,×400)
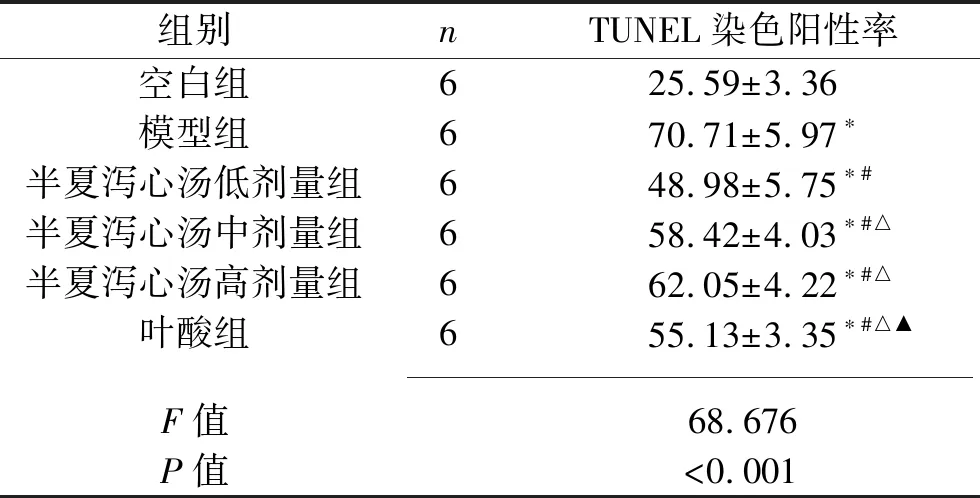
表3 6组大鼠胃黏膜细胞TUNEL染色阳性率的比较(x±s,%)
2.5 6组大鼠胃黏膜组织FoxP3 mRNA、RORγt mRNA相对表达水平的比较 与空白组相比,模型组大鼠胃黏膜组织FoxP3 mRNA、RORγt mRNA表达水平均升高(均P<0.05)。与模型组相比,半夏泻心汤各剂量组和叶酸组大鼠胃黏膜组织FoxP3 mRNA、RORγt mRNA表达水平均下降(均P<0.05),其中半夏泻心汤低剂量组大鼠胃黏膜组织FoxP3 mRNA、RORγt mRNA表达水平低于其他半夏泻心汤剂量组,FoxP3 mRNA表达水平亦低于叶酸组(均P<0.05)。见表4。
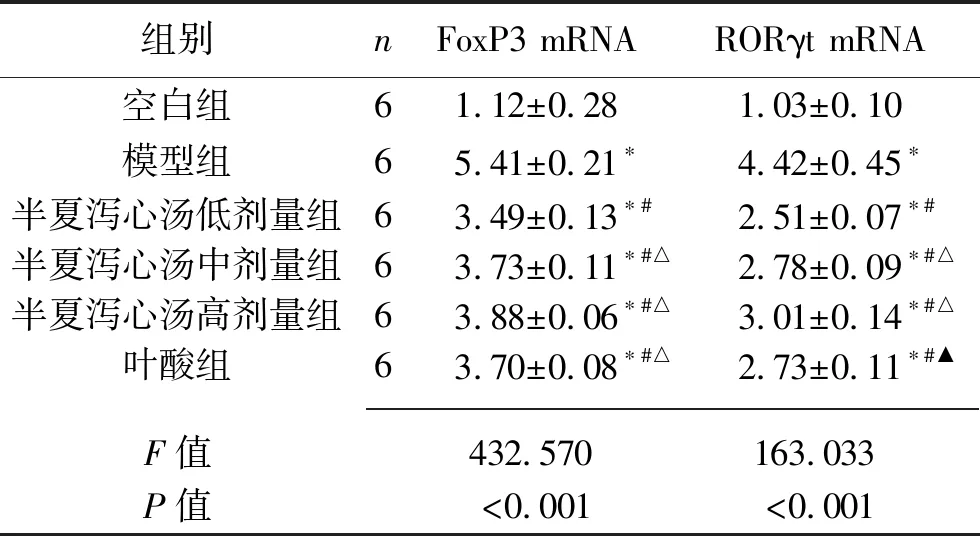
表4 6组大鼠胃黏膜组织FoxP3 mRNA、RORγt mRNA相对表达水平的比较(x±s)
3 讨 论
CAG的临床症状与我国传统医学中“痞满”的症状表现相似,故可将其归于“痞满”范畴[2]。关于“痞满”的病因,《丹溪心法·卷三》记载“痞者,与否同,不通泰也。由阴伏阳蓄,气与血不运而成。处心下,位中央,膜满痞塞者,皆土之病也……有中气虚弱,不能运化精微为痞者;有饮食痰积,不能施化为痞者;有湿热太甚为痞者”[22];《诸病源候论·卷之十八 湿病诸候(凡三论)》又有“痞者,塞也,言腑脏痞塞不宣通也。由忧恚气积,或坠堕内损所致”之说[23]。由此可见,CAG的病因复杂,自身情志、饮食失常或外感邪气侵入均可致病,一般认为该病是本虚标实之证,虚则是脾胃虚弱、胃阴亏损,实则为瘀血、痰湿、湿热等病理产物阻滞胃络经脉气血运行[2],导致脾胃升降失和、浊阴不降、清阳不升,从而出现胀满、纳呆、胃脘痛等症状。半夏泻心汤出自张仲景所著的《伤寒杂病论》,方中法半夏、干姜可降逆祛痰、温胃化饮、祛除痰湿和寒湿,黄连、黄芩可清热燥湿、祛除湿热,党参、炙甘草、大枣可补中益气,增强中焦脾胃枢机运转之力,全方寒热并用,具有健脾消痞、恢复脾胃正常升降的作用。段馨[24]运用半夏泻心汤加减治疗CAG,在缓解口干口苦、恶心呕吐、上腹痞满等症状方面均可获得较好效果。本研究结果显示,模型组大鼠毛发光泽度下降,大便稀溏,体质量下降,胃黏膜固有腺体减少;而给予药物干预后,半夏泻心汤各剂量组大鼠毛色光泽度有一定改善,大便情况较模型组有不同程度的改善,体质量快速增长,胃黏膜固有腺体数量不同程度增多。这说明半夏泻心汤可改善CAG相关临床症状和病理改变。
CAG是胃黏膜病变进展为胃癌过程中的一个重要节点,免疫系统失衡贯穿该过程[3,25]。FoxP3是Treg的关键调节因子[26],Treg通过分泌IL-10、TGF-β等细胞因子发挥免疫抑制作用。其中,IL-10具有减弱提呈细胞活性,抑制多种免疫细胞功能以达到缓解炎症反应、调节免疫的作用,这可能与IL-10可抑制哺乳动物雷帕霉素靶蛋白C1信号通路从而影响巨噬细胞代谢有关[27]。TGF-β是调控各细胞生命周期的细胞因子,其与肿瘤微环境的形成与扩张关系密切[28]。Th17的分化受到RORγt调控,该细胞分泌的IL-17是中性粒细胞浸润组织的重要驱动核心,可引发多种炎症反应,同时对肿瘤细胞的生长也有促进作用[29]。Th17与Treg可分泌相应转录因子从而相互抑制,但当Th17与Treg比例失衡时可导致机体癌前病变的发生[30]。综上,RORγt、FoxP3的表达情况与IL-10、IL-17、TGF-β的含量可在一定程度上反映机体内Th17/Treg的分化情况,以及胃黏膜病变进展至胃癌的情况。
本研究结果显示,与空白组相比,模型组大鼠胃黏膜凋亡细胞数量增加,血清IL-17、TGF-β、IL-10含量及胃黏膜组织FoxP3 mRNA、RORγt mRNA表达水平均升高(均P<0.05),提示此时CAG大鼠模型体内Th17/Treg平衡环境可能被破坏。与模型组相比,各药物组大鼠胃黏膜凋亡细胞数量减少,血清IL-17、TGF-β、IL-10含量及胃黏膜组织FoxP3 mRNA、RORγt mRNA表达水平均降低(均P<0.05),由此推测半夏泻心汤可能通过调节FoxP3 mRNA、RORγ mRNA的表达来调控Th17/Treg平衡,从而抑制胃黏膜细胞凋亡并减少炎症因子的分泌,达到治疗CAG的作用。
此外,在各剂量半夏泻心汤组中,半夏泻心汤低剂量组大鼠的病理表现改善最为明显,细胞凋亡率最低,血清中各细胞因子表达水平及胃黏膜组织FoxP3 mRNA、RORγt mRNA表达水平亦最低,表明对于CAG大鼠模型而言,4.185 g/kg(低剂量)可能是最佳的半夏泻心汤干预浓度。原因可能与黄连、黄芩等苦寒药浓度有关。有研究显示,苦寒药对机体消化系统有双向调节作用,即低浓度促进生理活动,高浓度抑制生理活动[31]。同时,较高浓度的黄连、黄芩会引起一定程度的胃黏膜损伤[32],相关炎症因子表达可能受此影响而发生紊乱,导致免疫平衡再次被破坏。但其具体机制尚待进一步研究。
综上所述,半夏泻心汤能够有效改善CAG大鼠的临床症状和病理改变,低剂量的半夏泻心汤可获得最佳的干预效果。半夏泻心汤干预CAG的作用机制可能与其下调大鼠胃黏膜FoxP3、RORγt的mRNA表达及相关细胞因子的含量有关。
