阻塞性睡眠呼吸暂停低通气综合征患儿术后阻塞性睡眠呼吸暂停残余的影响因素及列线图风险模型的建立
2023-09-07蔡小剑黄东辉
蔡小剑 黄东辉 陈 舒
(佛山市中医院耳鼻喉科,广东省佛山市 528000)
儿童阻塞性睡眠呼吸暂停(obstructive sleep apnea,OSA)是指儿童在睡眠过程中频繁发生部分或全部上呼吸道堵塞,扰乱儿童正常通气和睡眠而引发一系列病理改变的病症[1]。OSA患儿的主要临床表现为呼吸暂停、呼吸费力、睡眠憋气、睡眠障碍、注意力缺陷、多动障碍、学习困难等,严重时该病可以引起患儿生长发育及智力发育迟缓,诱发心脑血管疾病,严重影响患儿的生活和健康[2]。研究表明,我国男童和女童OSA的患病率分别为5.8%和3.8%[3],美国儿童OSA患病率为1.2%~5.7%[4]。近年来,随着儿童腺样体和/或扁桃体肥大的发生率,以及超重、肥胖人数的增加,儿童OSA发病率呈逐年上升的趋势[5]。腺样体和/或扁桃体肥大是儿童发生OSA最主要的病因,而腺样体/扁桃体切除术是目前临床上推荐的儿童OSA治疗方式[6]。虽然手术可以改善OSA患儿的大多数症状,但是不能完全治愈OSA[7]。识别OSA患儿腺样体/扁桃体切除术后不良临床结局的影响因素并及时干预,对于改善患儿预后具有重要意义。本研究探讨阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea-hypopnea syndrome,OSAHS)患儿腺样体/扁桃体切除术后OSA残余的影响因素,并构建列线图风险模型,以期为该类患儿的临床治疗提供参考。
1 资料与方法
1.1 临床资料 回顾性分析2017年1月至2021年1月佛山市中医院耳鼻喉科收治的283例OSAHS患儿的临床资料。纳入标准:(1)符合《儿童阻塞性睡眠呼吸暂停低通气综合征诊疗指南草案(乌鲁木齐)》[8]中的OSAHS诊断标准,且术前均通过多导睡眠监测仪(polysomnography,PSG)确诊,伴入睡时打鼾、张口呼吸或入睡时呼吸暂停等症状≥3个月;(2)年龄为3~13岁;(3)腺样体和/或扁桃体肥大;(4)均在佛山市中医院行腺样体/扁桃体切除术治疗,且术后至少随访12个月,临床资料完整。排除标准:(1)有腺样体、扁桃体或口咽部其他部位手术史的患儿;(2)存在先天性颅面畸形、神经肌肉遗传病、先天性心脏病、支气管哮喘的患儿;(3)存在先天性认知缺陷或智力迟钝的患儿;(4)合并严重的心、脑、肝、肾等器官疾病或内分泌疾病的患儿;(5)父母均为文盲者;(6)合并其他部位感染的患儿;(7)昏迷或精神障碍的患儿;(8)术后生命体征不平稳或出现严重的并发症的患儿。运用R语言随机抽样方法,将283例患儿按照7 ∶3的比例分为建模队列(n=198)和验证队列(n=85)。建模队列和验证队列患儿的年龄、性别、体质指数比较,差异均无统计学意义(P>0.05),见表1。
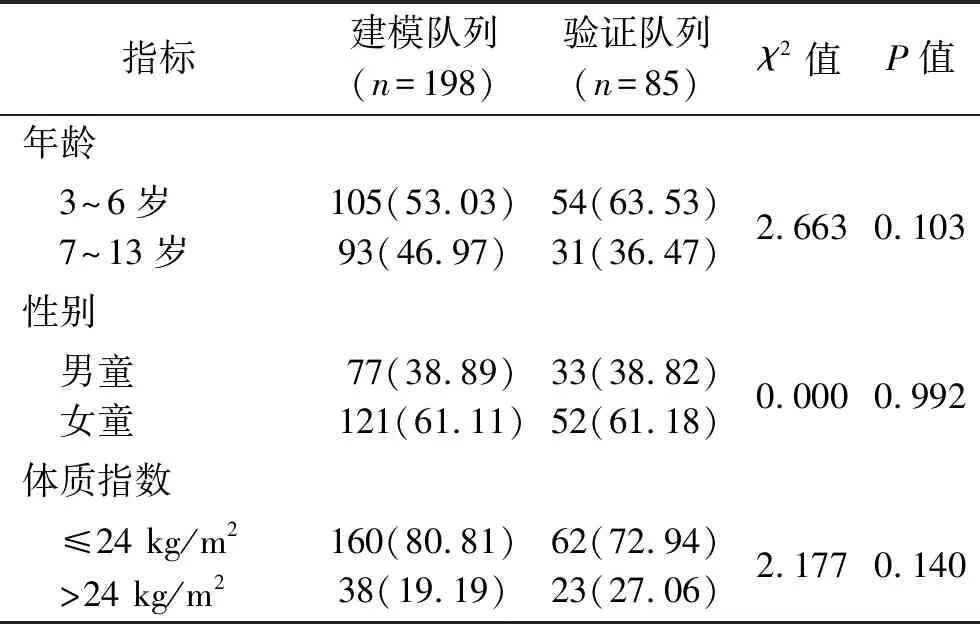
表1 建模队列和验证队列患儿一般资料的比较[n(%)]
1.2 手术方法 术前充分评估患儿的手术适应证及麻醉风险。取肩下垫枕仰卧仰头位作为手术体位,采用静脉全身麻醉,经鼻气管插管低流量给氧。(1)扁桃体切除术。常规消毒、铺巾后,用开口器显露口腔,暴露咽喉部,用低温等离子刀沿患儿左侧腭舌弓至腭咽弓处,沿着距游离缘1~2 mm处切开,然后使用扁桃体剥离器将左侧扁桃体剥离后切除,观察左侧扁桃体窝有无出血和组织残留,若存在出血的情况,先用纱布团压迫止血,出血仍不能控制则用双极电凝进行确切止血。若有组织残留则清除干净。同法切除右侧扁桃体。(2)腺样体切除术。用2根导管分别从双侧鼻孔进入口咽部后打结并牵拉软腭,将鼻内镜从口腔置入,采用低温等离子技术消融腺样体,充分保留双侧后鼻孔,扩大鼻咽腔,切除腺样体,确认口腔无活动性出血,术毕。
1.3 随访 患儿出院后均门诊定期复诊,术后前3个月每个月门诊复查1次,随后每3个月门诊复查1次,观察随访期间有无腺样体和扁桃体增生、OSA症状复发,所有患儿均随访12个月。
1.4 资料收集 采用自制的儿童睡眠呼吸暂停综合征观察表收集患儿的年龄、性别、身高、体重、既往史、个人史、家族史、术前呼吸暂停低通气指数(apnea-hypopnea index,AHI)、术前最低动脉血氧饱和度(lowest arterial oxygen saturation,LSaO2)、术前自发觉醒次数、术前腺样体和扁桃体肥大情况、术后随访情况等资料。
1.5 术后OSA残余判定标准 术后12个月,PSG提示AHI≥1次/h,或仍出现入睡时打鼾及憋气、呼吸暂停、张口呼吸、呼吸费力、睡眠不安等症状,则判定为术后OSA残余[9]。
1.6 统计学分析 采用SPSS 26.0软件和R软件进行数据整理和统计学分析。符合正态分布的计量资料以(x±s)表示,组间比较采用两独立样本t检验;计数资料以[n(%)]表示,组间比较采用χ2检验。采用Logistic回归模型分析建模队列患儿术后OSA残余的影响因素。采用R软件在建模队列患儿中构建术后OSA残余的列线图风险模型,用Bootstrap法重复抽样1 000次对模型进行内部验证,利用验证队列的数据对模型进行外部验证;分别采用受试者工作特征(receiver operating characteristic,ROC)曲线和校准曲线评价模型的区分度和校准度,利用决策曲线分析(decision curve analysis,DCA)评估模型的临床应用效果。以P<0.05为差异有统计学意义。
2 结 果
2.1 OSAHS患儿术后OSA残余的发生情况 在283例OSAHS患儿中,有75例(26.5%)患儿发生术后OSA残余。在198例建模队列患儿中,有53例(26.8%)患儿发生术后OSA 残余;在85例验证队列患儿中,有22例(25.9%)患儿发生术后OSA 残余。
2.2 OSAHS患儿术后OSA残余影响因素的单因素分析 根据术后是否存在OSA残余,将建模队列患儿分为治愈组(n=145)和术后OSA残余组(n=53)。两组患儿的年龄、体质指数、术前AHI、术前自发觉醒次数、合并哮喘比例、存在OSAHS家族史比例、术后腺样体增生比例的比较,差异均有统计学意义(均P<0.05)。见表2。
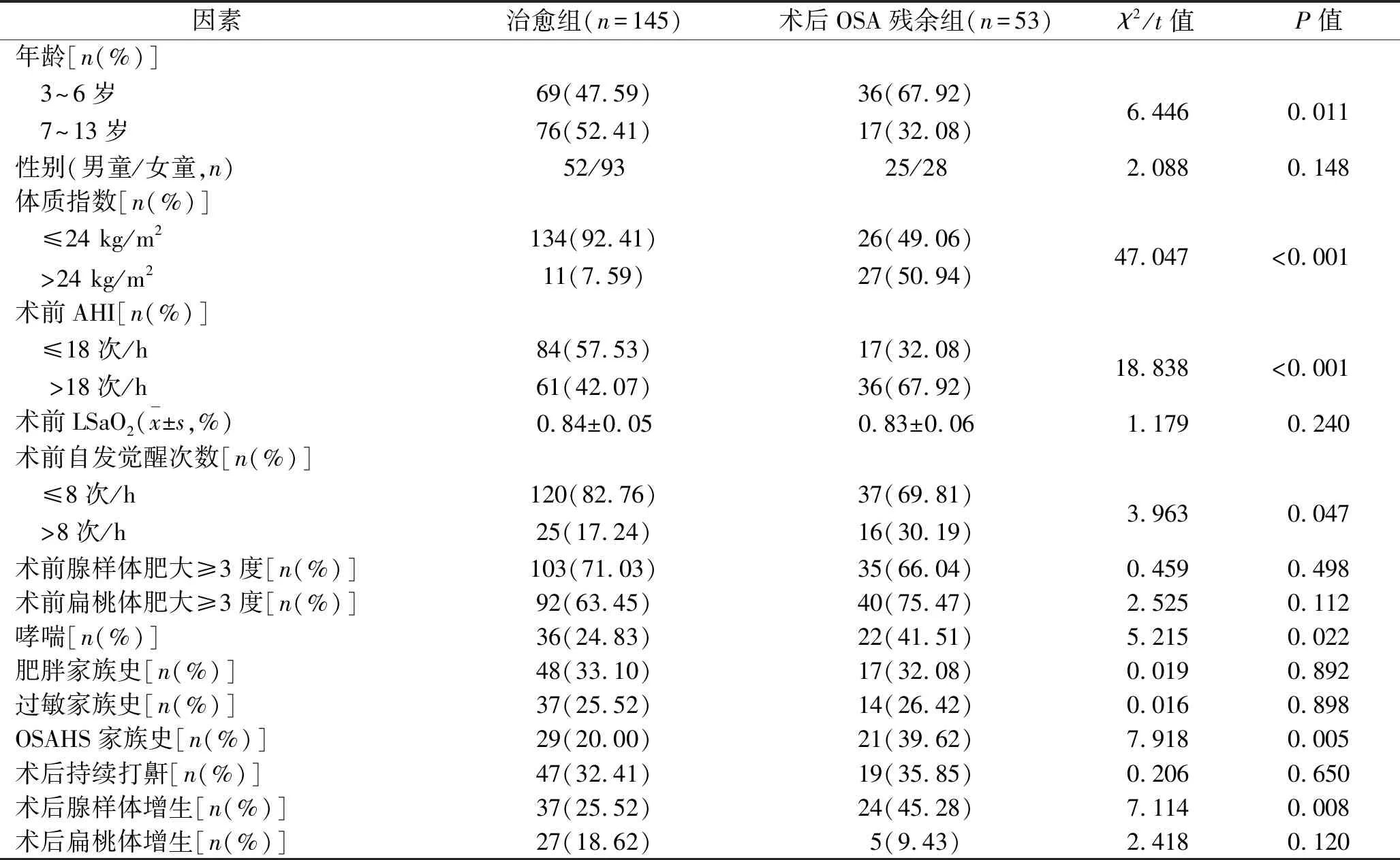
表2 单因素分析结果
2.3 OSAHS患儿术后OSA残余影响因素的多因素Logistic分析 将建模队列患儿术后12个月是否存在OSA残余(是=1,否=0)作为因变量,将年龄(3~6岁=1,7~13岁=0)、体质指数(≤24 kg/m2=0,>24 kg/m2=1)、术前AHI(≤18次/h=0,>18次/h=1)、术前自发觉醒次数(≤8次/h=0,>8次/h=1)、合并哮喘(无=0,有=1)、OSAHS家族史(无=0,有=1)、术后腺样体增生(无=0,有=1)作为自变量,纳入多因素Logistic回归模型进行分析。结果显示,体质指数>24 kg/m2、术前AHI>18次/h、术前自发觉醒次数>8次/h、合并哮喘均是OSAHS患儿术后OSA残余的独立危险因素(均P<0.05)。见表3。
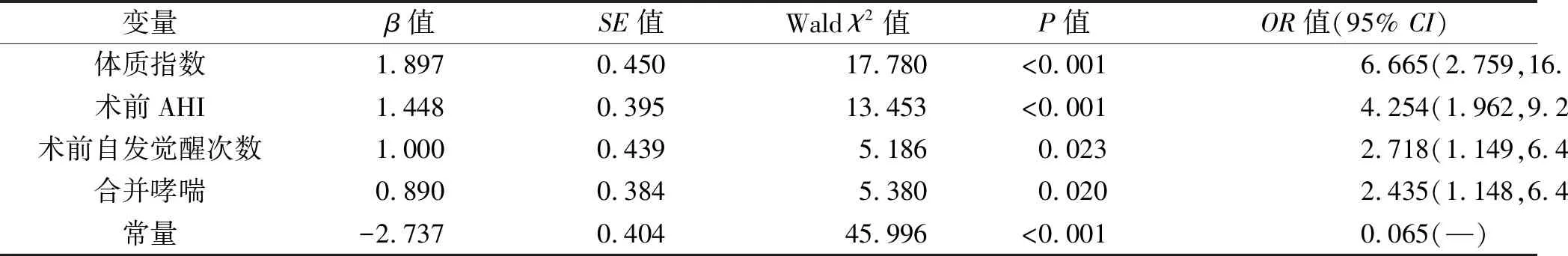
表3 多因素Logistic分析结果
2.4 OSAHS患儿术后OSA残余列线图风险模型的构建和验证 基于多因素Logistic分析结果,建立评估OSAHS患儿术后OSA残余的列线图风险模型,见图1。对模型进行内部验证,校准曲线显示实测值与预测值基本相符,模型校准度良好,一致性指数为0.753(95%CI:0.658,0.864),区分度良好,见图2;ROC曲线下面积为0.753(95%CI:0.671,0.835;P<0.001),见图3。对模型进行外部验证,校准曲线显示实测值与预测值基本相符,模型校准度良好,一致性指数为0.941(95%CI:0.823,0.982),区分度良好,见图4;ROC曲线下面积为0.906(95%CI:0.833,0.979;P<0.001),说明模型具有良好的评估能力,见图5。
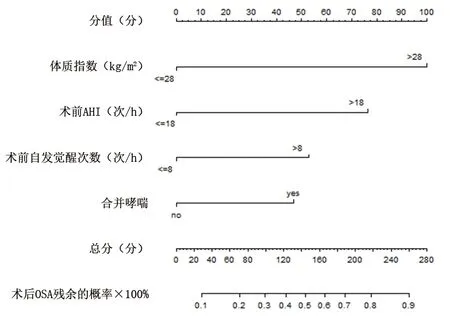
图1 OSAHS患儿术后OSA残余的列线图风险模型图
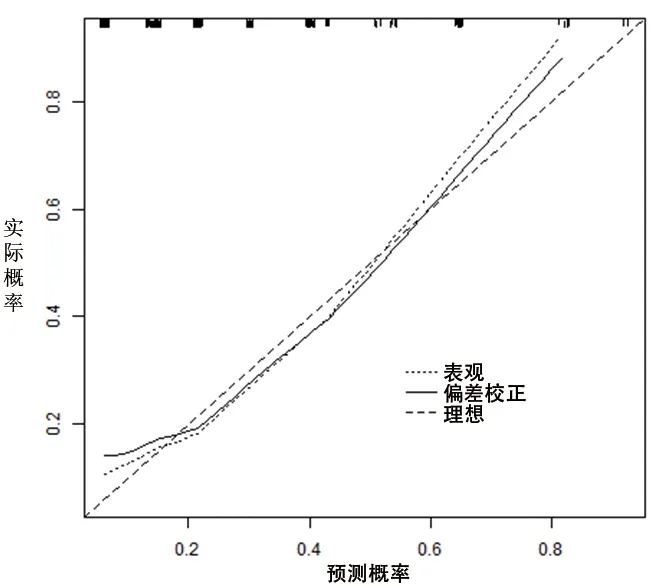
图2 内部验证的校准曲线图
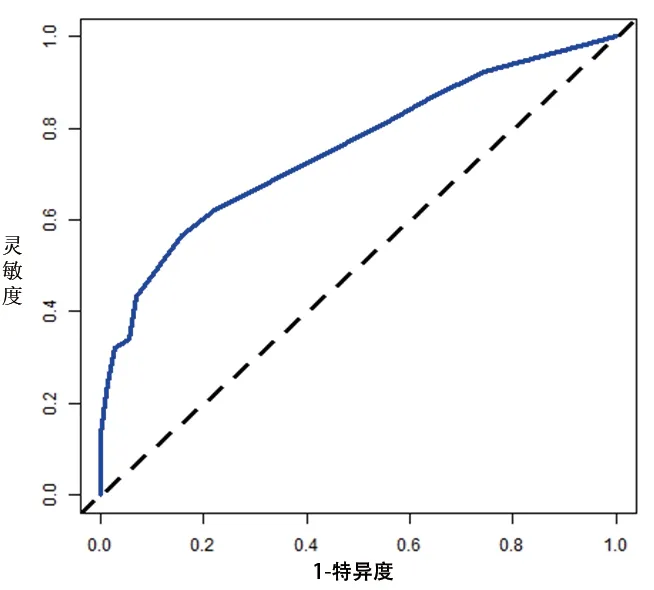
图3 内部验证的ROC曲线图
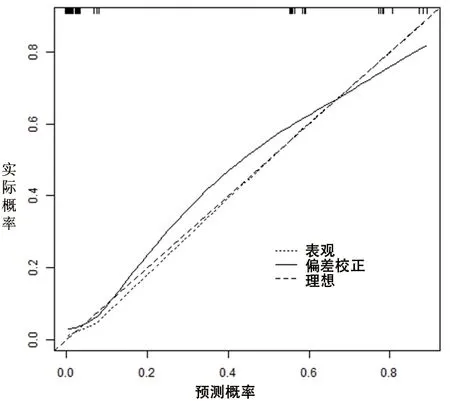
图4 外部验证的校准曲线图
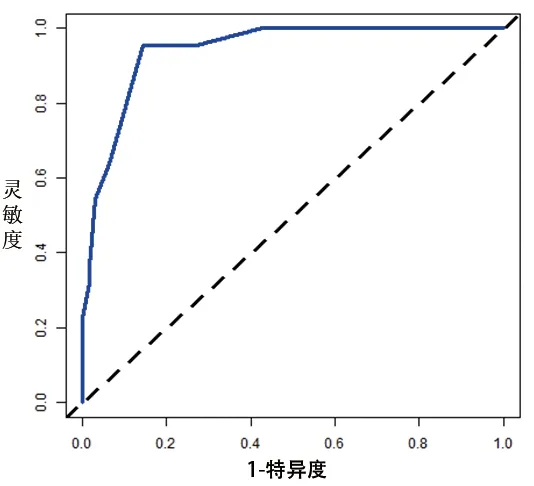
图5 外部验证的ROC曲线图
2.5 OSAHS患儿术后OSA残余列线图风险模型的临床应用 DCA曲线显示,当阈值概率≥6%时(即使用该列线图风险模型进行预测,当预测的风险≥6%时),使用该模型评估OSAHS患儿术后OSA残余发生风险会获得更多的收益。见图6、图7。
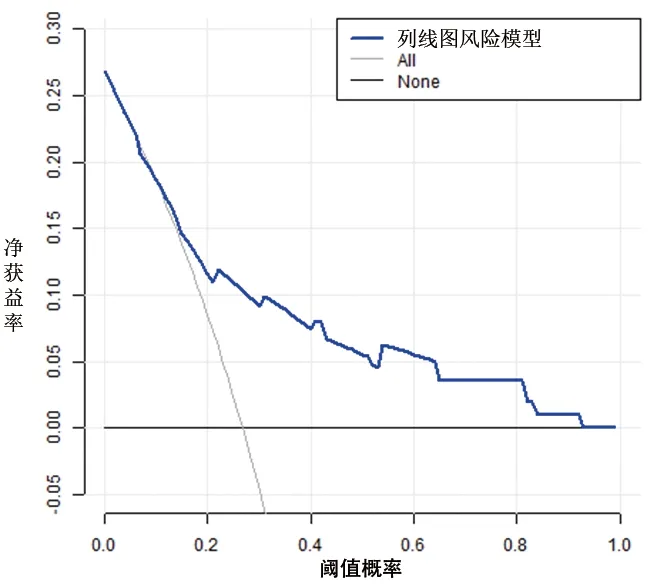
图6 建模队列的列线图风险模型DCA图
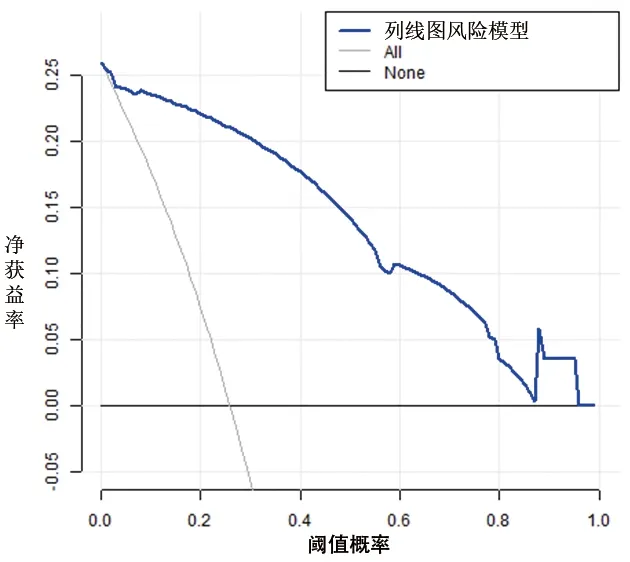
图7 验证队列的列线图风险模型DCA图
3 讨 论
虽然儿童OSA的病因多样、发病机制复杂,但最主要的病因仍是上气道狭窄和堵塞,而腺样体和/或扁桃体肥大是引起上气道狭窄和堵塞的主要原因。腺样体和/或扁桃体肥大会导致通气功能障碍,引发张口呼吸、睡眠打鼾、呼吸暂停等症状。反复的上呼吸道感染可以刺激腺样体增生,而腺样体肥大程度越严重,OSA症状越严重。有研究显示,对于轻中度非持续性OSA患儿,可以采用鼻用类固醇激素和抗过敏药物(如白三烯受体拮抗剂)进行治疗,可明显改善OSA患儿的症状[10]。但是该研究的样本量有限,结论尚待进一步证实。持续气道正压通气能有效改善OSA患儿的通气功能,但有30%~50%患儿对持续气道正压通气治疗的依从性较差,治疗效果并不理想[11]。因此,对于中重度OSA患儿而言,手术治疗仍是改善症状和提高远期疗效的重要手段,若不积极、及时进行手术治疗,OSA可引起严重的心脑血管疾病和代谢性疾病[12]。研究表明,手术治疗OSA患儿的成功率为21%~84%[13-15]。本研究的283例OSAHS患儿中,仅75例(26.5%)患儿术后12个月时仍有OSA残余,说明手术治疗OSAHS患儿的效果较好。但是手术存在一定的风险,且术后远期疗效亦存在不确定性,因此术后不良结局的影响因素已成为OSAHS领域的研究热点。
研究表明,OSAHS患儿术后OSA残余的发生率为20%~72%[16-17],不同研究中OSAHS患儿术后OSA残余发生率差异较大的原因可能与术后OSA残余的诊断标准不同有关。目前,以AHI≥1次/h作为术后OSA残余的诊断标准仍是主流观点。本研究的多因素Logistic回归分析结果显示,体质指数>24 kg/m2、术前AHI>18次/h、术前自发觉醒次数>8次/h、合并哮喘均是OSAHS患儿术后OSA残余的独立危险因素(均P<0.05)。有学者发现,亚洲肥胖OSAHS患儿术后OSA残余率高达21.4%[18];还有研究表明,肥胖OSAHS患儿术后OSA残余的发生率为49%,明显高于正常体重和低体重患儿[19]。肥胖已被证实是OSAHS患儿腺样体+扁桃体切除术后预后不良的重要影响因素,这可能是因为合并肥胖的OSAHS患儿的脂肪组织沉积在颈部和咽部周围,肥大的腺样体和/或扁桃体压迫咽喉部,导致上气道堵塞,加重患儿的通气功能障碍,使AHI升高[20]。有学者认为,初次确诊时的AHI是OSAHS患儿术后不良结局的主要影响因素,术前AHI越高,说明患儿病情越严重,术后OSA残余的可能性亦越大[21-22]。有研究结果显示,OSAHS患儿术前睡眠障碍严重程度与术后OSA残余密切相关[22]。OSAHS患儿在睡眠期间因反复发生呼吸暂停和低氧血症而频繁觉醒,因此自发觉醒程度可以反映OSAHS患儿病情的严重程度,自发觉醒次数越多,病情越严重,患儿术后OSA残余的可能性越高。哮喘与OSA密切相关,严重哮喘人群的OSA患病率是非哮喘人群的9倍,哮喘人群的OSA筛查阳性率高达50%[23]。哮喘可以导致患儿上呼吸道狭窄,引发OSA,并且反复哮喘发作还会引起OSA进一步恶化;反之,OSA亦可以影响气道免疫功能和气管高反应性,导致哮喘发作,形成恶性循环[24-25]。
列线图风险模型是一种简单、高效、个体化的风险预测模型,有助于临床医护人员早期筛查、诊断疾病和干预危险因素,从而提高疗效、改善预后和减少医患纠纷,已被广泛应用于慢性病、肿瘤等领域。本研究基于多因素Logistic回归分析结果,构建了OSAHS患儿术后OSA残余的列线图风险模型,该模型校准度、区分度良好,具有良好的预测能力。此外,DCA曲线显示,当预测的风险≥6%时,使用该模型评估OSAHS患儿术后OSA残余发生风险会获得更多的收益。该模型为医护人员评估OSAHS患儿术后OSA残余发生风险提供了较为准确且直观的方法。
本研究存在一定的局限性:首先,本研究纳入的患儿仅来自佛山市中医院,缺乏其他医院的数据,外部验证可信度不高,模型的外推性不强。其次,本研究未纳入相关实验室指标进行分析,可能降低模型的评估价值。最后,本研究为回顾性研究,结果可能存在偏倚。
综上所述,体质指数>24 kg/m2、术前AHI>18次/h、术前自发觉醒次数>8次/h、合并哮喘均是OSAHS患儿术后OSA残余的独立危险因素,基于上述因素构建的列线图风险模型有助于临床医生早期识别术后OSA残余的OSAHS患儿,从而早期采取干预措施以改善患儿的预后。
