单质硫抑制水稻植株甲基汞累积的效应与机制
2023-09-06黄英梅钟松雄朱忆雯王向琴李芳柏
黄英梅,钟松雄,朱忆雯,王向琴,李芳柏
1. 中国科学院广州地球化学研究所,广东 广州 510640;2. 中国科学院大学,北京 100049;3. 广东省科学院生态环境与土壤研究所/广东省农业环境综合治理重点实验室,广东 广州510650
汞(mercury,Hg)是一类毒性很强的重金属污染物,人类活动包括化石燃料的燃烧、有色金属的冶炼、烧碱的制造、汞矿的干馏和水泥工业是土壤中汞污染的主要来源(Feng et al.,2008a;Wang et al.,2012;Natasha et al.,2020;Liu et al.,2022)。最新全国土壤质量调查结果显示,大约1.6%的农用地土壤汞超过了II 类标准(总汞(total Hg,THg)质量分数为0.3-1.0 mg·kg−1,因此我国土壤汞污染问题十分严峻(Zhao et al.,2015a)。研究发现,在淹水的稻田土壤中,在包含hgcAB的微生物群落,如硫酸盐还原菌(sulfate-reducing bacteria,SRB)、铁还原菌(iron-reducing bacteria,FeRB)和产甲烷菌的驱动下, 无机汞可转化为甲基汞(methylmercury,MeHg)(Gilmour et al.,2013;Parks Jerry et al.,2013;Liu et al.,2014)。甲基汞是一种神经毒素,可以积累在水稻籽粒中并通过水稻摄取威胁人类的健康(Feng et al.,2008b),例如1956 年日本发生的水俣病和1971 年伊拉克因食用受甲基汞污染的小麦导致的甲基汞中毒等可怕的历史性甲基汞污染事件(Man et al.,2021)。受甲基汞污染的水稻植株不仅存在于汞矿区,也存在于化工厂、燃煤电厂、冶炼厂和氯碱厂附近的稻田中(Zhao et al.,2020)。在中国,汞污染地区的当地居民日常暴露甲基汞的来源中,水稻摄取这一途径占94%-96%(Zhang et al.,2010),并且由于农作物全球化,远离汞污染地区的居民也会由于水稻摄取暴露于甲基汞的风险下(Liu et al.,2019)。据报道,在贵州省万山汞矿区,水稻甲基汞质量分数均值高达140 μg·kg−1(Horvat et al.,2003),即使在废弃的汞矿附近,水稻中可食用部分甲基汞质量分数均值也高于100 μg·kg−1(Qiu et al.,2008)。因此,探明稻田土壤-水稻体系中甲基汞的吸收转运机制,可为稻田土壤汞污染定向控制提供理论依据。
硫(Sulfur)是一种重要的营养元素,有益于植物的生长发育(Yuan et al.,2021)。植物硫不足时也会影响叶绿素的生成和蛋白质的合成,导致作物产量和品质的降低(Singh et al.,2011;Yuan et al.,2021)。研究发现,单质硫可以有效缓解稻田土壤汞污染(Li et al.,2017;Yuan et al.,2021),同时还可以降低水稻中总汞和甲基汞的累积(Rothenberg et al.,2016)。硫可以提高水稻根系中植物螯合肽(phytochelatins,PCs)、谷胱甘肽(glutathione,GSH)、金属硫蛋白(metallothioneins,MTs)和非蛋白类硫醇(nonprotein thiols,NPTs)等硫醇分子的合成(Li et al.,2017),这些硫醇分子对重金属有很高的亲和力,可以抑制重金属向水稻地上部的转运(Li et al.,2017)。与硫的其他形态相比,单质硫(elemental sulfur,S(0))具有更高的效率、更缓慢的释放速度以及更低廉的价格,因此单质硫在农业生产中经常被用作肥料来解决硫不足的问题(Zhao et al.,2015b;Mattiello et al.,2017)。另一方面,在新汞沉积的汞污染土壤中添加单质硫不仅可以通过促进Hg(II)-硫醇复合物(RS-Hg-SR)向硫化汞(HgS)的转化,降低汞在根际土中的移动性(Li et al.,2017),还可以促进水稻根表铁膜的形成,有助于降低总汞和和甲基汞在水稻籽粒的累积(Hu et al.,2007;Li et al.,2017)。然而,在以HgS 为主要形态的汞污染土壤中添加单质硫,则会增加水稻中甲基汞的累积,并通过促进HgS 向有机结合态的汞(如Hg(GS)2)或氯化汞(HgCl2)增加汞的移动性(Li et al.,2019),这种不一致的情况可能是土壤类型不同所致。
然而,当前的研究主要集中在单质硫降低水稻甲基汞累积效应方面,缺乏单质硫对甲基汞在土壤-水稻体系中迁移转运机制影响的研究。据此,本研究通过土壤盆栽实验,研究了单质硫(100 mg·kg−1)对汞污染土壤甲基汞质量分数、水稻植株的生长以及甲基汞吸收转运的影响,进一步阐明了单质硫对土壤-水稻体系抵御重金属胁迫的关键作用,有助于制定稻田汞污染修复策略。
1 材料和方法
1.1 供试土壤和水稻
盆栽试验用土为贵州省贵阳市万山汞矿周边汞污染稻田表层土壤( 27°32′57.52″N ,109°12′47.38″E)。土壤的总汞和甲基汞的质量分数分别为 (40.3±0.950) mg·kg−1和 (7.35±1.48) μg·kg−1。土壤酸碱度(pH)、阳离子交换力(cation exchange capacity,CEC)、总碳、有机质和总硫分别为(7.33±0.20)、(26.0±0.10) cmol·kg−1、2.82%±0.02%、(31.5±2.40) g·kg−1和 (1.62±0.01) g·kg−1。供试水稻品种为日本晴(Nipponbare,Oryza sativaL.japonica)。
1.2 盆栽试验与样品采集
土壤经自然风干、去除杂物、碾碎并过0.85 mm 筛网,后用于盆栽试验。在先前的研究中,为了探究汞污染土壤中添加单质硫对水稻汞的累积和分配的影响,设置了0、50、100、500 mg·kg−1单质硫处理组进行探究。研究发现,低剂量的硫处理可以同时降低水稻中总汞和甲基汞的累积,同时发现,100 mg·kg−1单质硫处理比50 mg·kg−1单质硫处理下水稻根部总汞和甲基汞质量分数下降更明显(Li et al.,2017)。前期研究发现,单质硫处理可能有利于水稻根部对汞的固定,因此,以100 mg·kg−1为单质硫的处理浓度。本研究共设计对照(Control)和单质硫(Sulfur,100 mg·kg−1)2 个处理组,每个处理设置3 个重复。每盆装7 kg土壤,将单质硫与土壤混匀,淹水自然老化1 周后每盆栽种4 株水稻苗,整个生育期保持3 cm 深上覆水。在水稻成熟期(第105 天),采集整株水稻,并将水稻植株分为根、茎、叶、籽粒,同时收集水稻根际土壤样品,并将其分成两份,一份快速冷冻于−80 ℃超低温冰箱保存以备微生物分析,另一份与植物样品一起进行冷冻干燥(−78 ℃,10 Pa)(Alpha 2-4 LD plus,Christ,Germany)。随后,对土壤样品进行研磨,对干燥后的植物样品进行称质量、粉碎后过0.075 mm 筛网,转入自封袋中备用。
1.3 生长参数和理化指标分析
使用便携式多参数数字分析仪(HQ40d;Hach,Loveland,Colorado,USA)原位测定土壤Eh 和pH,使用刻度尺测量水稻株高,使用便携式叶绿素荧光分析仪(SPAD-502 Plus CHLOROPHYLL METER)(Konica Minolta (China) Investment Co.,Ltd.,Shanghai)测量水稻第1 叶的相对叶绿素水平。使用离子色谱检测SO42−(ICS-600,Thermo Fisher,USA)(Ontiveros-Valencia et al.,2012;Shu et al.,2016);使用总有机碳分析仪(Shimadzu,Japan)检测土壤中溶解性有机碳(dissolved organic carbon,DOC)(Chen et al.,2018;Zhang et al.,2023);使用(NH4)2S2O3试剂(0.013 5 mol·L−1,Sigma-Aldrich,USA)提取土壤中生物可利用的MeHg(Zhu et al.,2015),并分别利用CuSO4-methanol 试剂和KOH 溶剂提取土壤和植物样品中的MeHg(Man et al.,2021),随后将提取液中的MeHg 经过二氯甲烷萃取、超纯水反萃取、乙基化、捕集后,利用气相色谱冷蒸汽原子荧光(GCCVAFS,Brooks Rand model III,Seattle,USA)进行测量(USEPA,1998)。为进行质量控制,加入标准物质CC580(河口沉积物)和TORT-3(龙虾肝胰腺)与土壤和植物样品同时进行提取,MeHg 回收率分别为103%-131%和117%-129%(n=3)。重复样品的数据标准差(standard deviation,SD)在7%范围内,分析空白中MeHg 质量浓度低于1.55 ng L−1。
MeHg 生物富集因子B:
式中:
w(rice)——水稻MeHg 平均质量分数;
w(soil)——土壤MeHg 质量分数(Pandey et al.,2016;Shu et al.,2016;Buscaroli,2017)。
MeHg 转运系数T:
式中:
w(stem/leaf/grain)——水稻茎/叶/籽粒中MeHg 质量分数;
w(root/stem/leaf)——水稻根/茎/叶中MeHg 质量分数(Man et al.,2021)。
1.4 土壤微生物DNA 的提取和功能基因的定量检测
准确称量0.25 g 冷冻的土壤样品,用DNeasy PowerSoil Pro Kit(QIAGEN Inc.,USA)进行土壤微生物DNA 的提取,随后对编码异化亚硫酸盐还原酶(dsr,dissimilatory sulfite reductase)dsrA、dsrB基因进行绝对定量(Dranguet et al.,2017;Zhou et al.,2020)。实时荧光定量PCR(quantitative realtime PCR,qRT-PCR)反应体系为25 μL,2 种基因引物(表1)和qRT-PCR 反应条件参考先前报道(Zhou et al.,2020),使用CFX 384 real-Time PCR Detection System(BioRad,USA)进行扩增反应,根据浓度和阈值形成标准曲线,扩增效率为90%-115%。
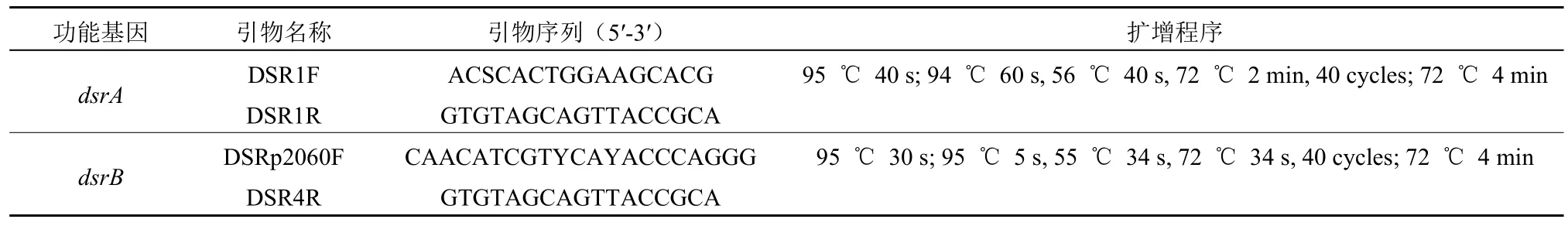
表1 实时荧光定量PCR 所用引物序列与扩增条件Table 1 Lists of primer pairs and thermal cycling parameters for qRT-PCR
1.5 统计分析
根据3个生物学重复计算数据的平均值和标准差,采用SPSS 18.0 统计软件进行单因素方差分析和t检验分析比较每个参数在各个处理间差异显著性,使用SigmaPlot 14.0 软件(Systat Software, Inc.)对试验结果进行绘图。
2 结果与讨论
2.1 单质硫对土壤和(NH4)2S2O3 提取态中甲基汞(MeHg)质量分数的影响
由图1 可知,对照土壤中MeHg 质量分数为8.21 μg·kg−1,添加单质硫处理后,土壤中MeHg 质量分数显著下降11.6%(P<0.01)。先前的研究发现,土壤中单质硫可以被还原为硫化物S2−,其可以与Hg 结合形成稳定的、不溶的HgS,难以被微生物利用,抑制汞的甲基化过程,导致MeHg 质量分数的下降(Li et al.,2017)。(NH4)2S2O3提取态MeHg 水平可以指示稻田土壤中可被植物吸收利用的MeHg 的水平(Shu et al.,2016)。如图1所示,对照土壤中(NH4)2S2O3提取态MeHg 质量分数为 0.017 6 μg·kg−1,单质硫处理组土壤中(NH4)2S2O3提取态MeHg 质量分数降低至0.013 8 μg·kg−1,显著下降了21.8%(P<0.05)。这表明单质硫可以显著降低土壤中和可被植物所利用的MeHg 质量分数,从而降低土壤中MeHg 被水稻吸收的几率。
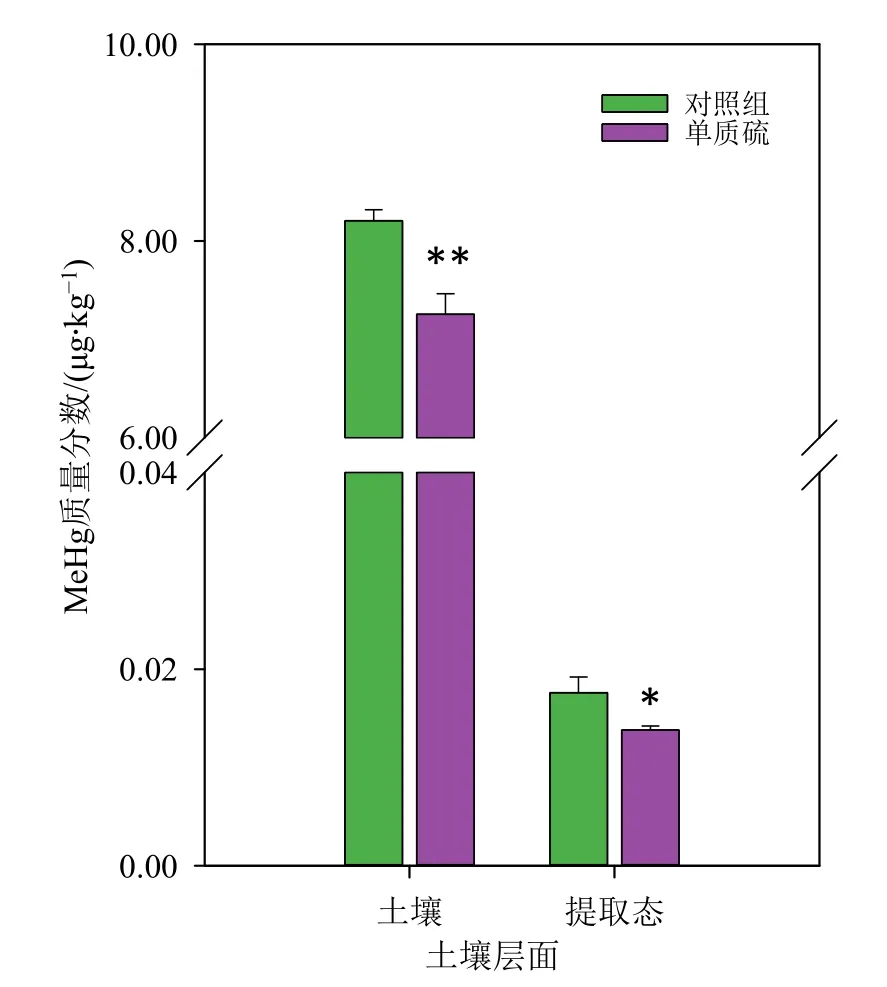
图1 对照和单质硫(100 mg∙kg−1)处理组土壤和(NH4)2S2O3提取态甲基汞质量分数Figure 1 MeHg contents in soils and (NH4)2S2O3 extract in control and S(0) (100 mg∙kg−1) treatments
2.2 单质硫对土壤性质的影响
施加单质硫,对土壤理化性质有显著影响。相比对照组,单质硫处理组中土壤Eh、pH 均下降(图2a、b),而DOC 质量分数显著提高10.0%(P<0.01)(图2c)。DOC 质量分数的提高与硫的氧化还原有关,该过程抑制DOC 的还原降解(Wang et al.,2020)。对照土壤中SO42−质量分数为27.0 mg·kg−1,单质硫处理组土壤SO42−的质量分数显著提高到60.3 mg·kg−1(提高124%,P<0.01)(图2d)。此外,qRT-PCR 结果显示,单质硫处理组中dsrA和dsrB基因拷贝数相比于对照组分别提高80.8%(P<0.01)和28.1%(P<0.05)(图2e)。dsrA和dsrB基因编码异化亚硫酸盐还原酶,它可以在硫酸盐还原过程中催化亚硫酸盐转化为硫化物,因此可作为硫酸盐还原菌的标志(Gao et al.,2022)。硫酸盐还原菌具有双重效应,即在甲基汞的产生和去甲基化过程中起重要作用(Zhou et al.,2020)。具体而言,一方面,淹水稻田土壤形成的厌氧环境有利于硫酸盐还原菌、铁还原菌、产甲烷菌等包含hgcAB的微生物群落驱动无机汞的甲基化过程(Gilmour et al.,2013;Parks Jerry et al.,2013;Liu et al.,2014),导致水稻中MeHg 的大量累积(Zhang et al.,2010),另一方面,稻田土壤中也同时发生MeHg 的去甲基化过程(Zhou et al.,2020),在相对较低的Hg 浓度下,硫酸盐还原菌、产甲烷菌和好氧甲烷氧化菌驱动了氧化去甲基化过程(Oremland Ronald et al.,1991;Kronberg et al.,2018)。因此,结果表明单质硫处理提高了土壤中SO42−的质量分数,刺激了硫酸盐还原菌的活性,而硫酸盐还原菌可能在参与汞甲基化过程的同时,参与了去甲基化过程,在一定程度上促进了MeHg 的降解,进而影响土壤中MeHg 质量分数,但具体的机制需要进一步研究。

图2 对照和单质硫(100 mg·kg−1)处理组土壤理化性质和功能基因拷贝数的检测Figure 2 Determination of physicochemical properties and functional gene copies of soils in control and S(0) (100 mg∙kg−1) treatments
2.3 单质硫对水稻植株生长的影响
与对照相比,单质硫处理组中水稻株高显著增加(P<0.05)(图3a),水稻根、茎、叶和籽粒的生物量分别提高26.8%、64.7%(P<0.01)、40.0%和40.4%(P<0.01)(图3b)。相似地,有研究发现,在汞污染的水培液中添加单质硫(100 mg·L−1)可以提高水稻植株的株高、根长和鲜物质质量(Huang et al.,2024),并且发现添加硫也能改善汞胁迫下生菜和欧洲油菜的生长(Najafi et al.,2020;Yuan et al.,2021)。与对照相比,单质硫处理组中水稻叶片的相对叶绿素水平(SPAD)显著提高27.4%(P<0.01)(图3c),表明汞胁迫下添加单质硫可以促进水稻植株的光合作用能力,促进植株的生长。亦有研究发现,植物缺硫会导致水稻光合作用器官合成叶绿素的水平急剧下降(Lunde et al.,2008),这进一步证实单质硫在汞污染稻田土壤-水稻体系中具有促进水稻生长的作用。
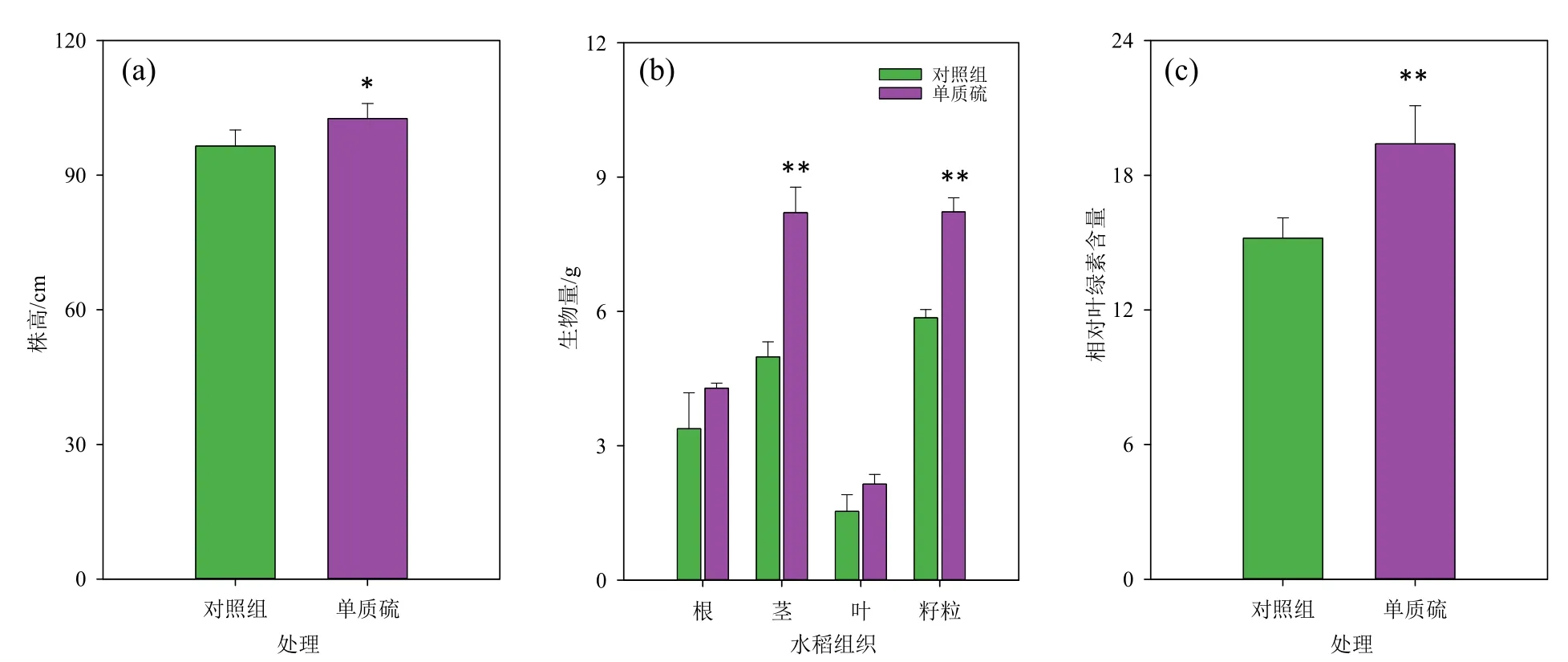
图3 对照和单质硫(100 mg∙kg−1)处理组水稻生长指标的检测Figure 3 Determination of rice growth parameters in control and S(0) (100 mg∙kg−1) treatments
2.4 单质硫对植株中甲基汞质量分数的影响
对照组中整株水稻和籽粒中MeHg 质量分数分别为16.9 μg·kg−1和39.2 μg·kg−1,而单质硫处理组中整株水稻和籽粒中MeHg 质量分数分别下降至13.9 μg·kg−1和33.5 μg·kg−1,下降率为17.8%(P<0.01)和14.7%(P<0.05)(图4a)。与对照组相比,单质硫处理组中水稻叶片和茎的MeHg 质量分数分别下降8.05%和6.05%,而根部MeHg 质量分数增加了16.9%(图4a)。此外,对照组中水稻籽粒中MeHg 质量的比例为86.4%,而单质硫处理组中水稻籽粒中MeHg 质量的比例降低至83.1%,但根和茎中MeHg 质量的比例与对照组相比,分别提高了20.9%和25.7%(图4b),表明添加单质硫后降低了水稻籽粒中MeHg 的分配,可能与单质硫提高了MeHg 在水稻根部和茎部的分配有关。对照组中水稻植株MeHg 的富集因子为2.06,而单质硫处理组中水稻植株MeHg 的富集因子显著下降至1.91(P<0.01)(图4c),表明添加单质硫能抑制水稻从土壤中吸收MeHg,可能与添加单质硫后土壤MeHg 质量分数的降低有关(Li et al.,2017)。与对照组相比,单质硫处理降低了水稻根部到茎、叶片MeHg 的转运(表2),这可以用来解释添加单质硫后水稻叶片和茎中MeHg 质量分数下降,而根部MeHg 质量分数升高。此外,单质硫处理组中根、茎和叶到籽粒MeHg 的转运系数下降,表明单质硫处理抑制了其他部位到水稻籽粒MeHg 的转运,导致水稻籽粒MeHg 质量分数下降(图4a)。

表2 对照和单质硫(100 mg∙kg−1)处理组水稻植株甲基汞的转运系数Table 2 The translocation factor of MeHg of rice plants in control and S(0) (100 mg∙kg−1) treatments

图4 对照和单质硫(100 mg∙kg−1)处理组水稻不同组织的甲基汞质量分数和分配及甲基汞的生物富集因子Figure 4 The contents and distribution of MeHg in different tissues of rice plants and bioaccumulation factors of MeHg in control and S(0) (100 mg∙kg−1) treatments
水稻籽粒中MeHg 的生物积累被认为主要通过水稻根部从土壤中吸收MeHg(Strickman et al.,2017),MeHg 进入水稻根细胞后,可以与巯基结合形成甲基汞-半胱氨酸复合物(MeHg-cysteine),随后以一种类似于营养物质的形式在植物体内被转运,并最终分配至水稻籽粒中累积(Tang et al.,2020)。本结果表明,单质硫处理组水稻籽粒MeHg累积的下降,可能与单质硫处理降低了土壤MeHg的质量分数、抑制了水稻植株从土壤中吸收MeHg和MeHg 在水稻植株内的转运过程有关。
2.5 相关性分析
相关性分析表明,整株水稻MeHg 质量分数、水稻籽粒中MeHg 质量分数与土壤(NH4)2S2O3提取态MeHg 质量分数之间均具有显著正相关关系(图5a、b)。土壤(NH4)2S2O3提取态MeHg 可被水稻直接吸收利用,其质量分数的降低可以导致水稻籽粒中MeHg 质量分数的下降。同时,我们发现土壤中DOC 质量分数、SO42−质量分数与土壤(NH4)2S2O3提取态MeHg 质量分数之间均具有显著负相关关系(图5c、d)。在之前研究中发现,DOC 通过将二价汞还原成零价汞降低Hg 的生物有效性,从而减少MeHg 的产生(Tang et al.,2020),而在汞污染土壤中添加硫酸盐可以通过促进土壤中有机结合态(RS-Hg-SR)向残渣态(HgS)的转化,同时促进水稻根表铁膜的形成,降低水稻植株中MeHg的累积(Li et al.,2017)。
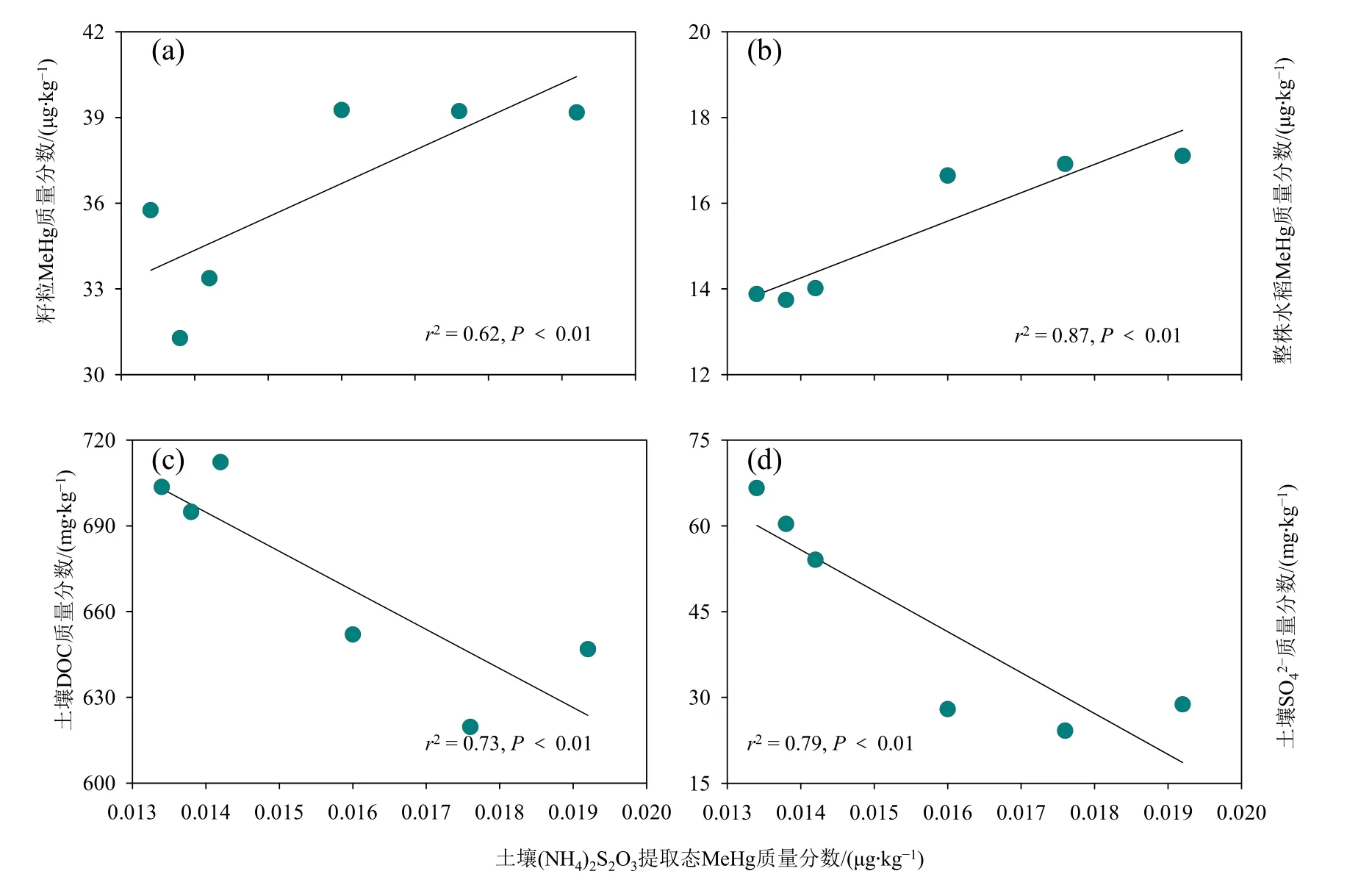
图5 水稻甲基汞质量分数和土壤理化指标与土壤(NH4)2S2O3提取态甲基汞质量分数之间的相关性分析Figure 5 Correlations analysis between MeHg contents in rice plants and physicochemical properties in soils and MeHg contents in (NH4)2S2O3 extract
3 结论
在汞污染土壤中添加单质硫降低了土壤和(NH4)2S2O3提取态中MeHg 的质量分数,刺激了硫酸盐还原菌的活性,其可能在参与汞甲基化过程的同时参与厌氧环境下去甲基化过程,在一定程度上促进了MeHg 的降解。单质硫处理可以提高水稻光合作用能力,从而促进水稻植株的生长。此外,单质硫处理抑制了水稻植株从土壤中吸收MeHg 的过程以及MeHg 在水稻植株内的转运过程,尤其是其它部位到水稻籽粒的转运,从而导致水稻籽粒中MeHg 累积的下降。本研究为降低汞污染地区水稻植株中MeHg 的生物累积以及稻田MeHg 污染修复提供了理论支持。
