近江牡蛎受精过程、胚胎及早期幼虫发育特征
2023-09-06葛广玉孙秀俊周丽青刘志鸿
王 岩,吴 彪,葛广玉,4,陈 夕,孙秀俊,周丽青,刘志鸿
(1.农业农村部海洋渔业可持续发展重点实验室,中国水产科学研究院黄海水产研究所,山东青岛 266071;2.青岛海洋科学与技术试点国家实验室,海洋渔业科学与食物产出过程功能实验室,山东青岛 266071;3.水产科学国家级实验教学示范中心,上海海洋大学,上海 201306;4.国家海洋设施养殖工程技术研究中心,浙江海洋大学,浙江舟山 316022)
近江牡蛎(Crassostreaariakensis)隶属于双壳纲(Bivalvia),牡蛎科(Ostreidae),巨牡蛎属,是广温、广盐性贝类,自然种群多栖息于河口区,在我国南北方均有分布。近江牡蛎是我国重要的牡蛎养殖品种之一,具有较高的营养价值,也是构成牡蛎礁的主要种类,在滤除水体污染物、维持生物多样性等方面发挥重要的生态功能,素有“生态系统工程师”之美誉[1-6]。近年来,因海洋环境变化、过度捕捞、人工苗种补充有限等因素影响,我国沿海地区,尤其是北方海区近江牡蛎自然资源量不断衰减[7-9]。开展人工苗种规模化繁育可为补充自然苗种和资源增殖提供支撑和保障,同时也是进行种质改良的必要前提。
受精及早期胚胎发育过程是水产经济动物苗种繁育、遗传育种领域的重要研究内容。充分了解养殖对象的受精和胚胎发育特点,可为人工苗种培育、细胞工程育种等工作提供重要参考。采用普通光学显微镜和荧光显微观察技术进行观察具有简便、清晰、直观等优点,已在多种经济贝类受精过程的核行为变化和胚胎早期发育观察相关研究中应用。例如,有国外学者利用荧光显微观察技术对合浦珠母贝(Pinctada martensii)、侏儒蛤(Mulinialateralis)等经济贝类在受精过程中的核相变化进行了详细的观察研究[10-11]。已报道的对贝类受精和早期卵裂过程进行观察研究的品种还包括文蛤(Meretrix meretrix)、毛蚶(Scapharcasubcrenata)、斧文蛤(M.lamarkii)、缢蛏(Sinonovaulaconstricta)、青蛤(Cyclina sinensi)、管角螺(Hemifusus tuba)等[12-17],这些研究为贝类人工苗种繁育提供了重要参考。本研究以近江牡蛎北方群体作为亲本,在温度22~24℃、盐度20~22的条件下进行人工授精,利用普通光学显微镜和荧光显微观察技术对其受精及早期胚胎发育过程进行了观察研究,以期为近江牡蛎的苗种繁育、遗传育种等研究提供基础资料。
1 材料与方法
1.1 实验材料
实验用近江牡蛎亲贝采自山东省丁字湾海域(36°37′N、120°51′E),平均壳长(21.73±4.01)cm。将亲贝冲洗干净后,在温度22~24℃、盐度20~22的充气水体中暂养2 d,繁养期间每4 h 投喂小新月菱形藻(Nitzschia closteriumf.minutissima)1次,饵料的单次投喂量为每1 mL水体中投喂1×105个。
1.2 实验设计
1.2.1 近江牡蛎性腺切片观察
选用性腺饱满的近江牡蛎亲本进行解剖。解剖后,从性腺部位取少量样品涂于载玻片通过显微镜判断性别,并取一部分性腺组织置于Bouin氏液(Solarbio公司)中固定24 h后,用于后续切片制作,以进一步确定亲贝的性腺发育状况。切片参考芮菊生等[18]组织切片方法进行,分别取雌、雄近江牡蛎1 cm2性腺组织置于Bouin氏液中固定24 h,之后更换为70%酒精,酒精每日更换,共更换2~3次,样品经梯度脱水、浸蜡包埋、切片、苏木素-伊红(H.E)染色后,使用LEICA DM4000光学显微镜观察并拍照。
1.2.2 人工授精、早期胚胎材料固定及显微观察
确定雌、雄性别后,取性腺发育良好的个体,用干净海水分别将精、卵冲洗收集至盛有砂滤水(盐度20)的烧杯中浸泡20 min,以激活卵子和精子。利用300目筛绢过滤多余组织块后进行人工授精,保持显微镜视野下1个卵子周围有5~8个精子,精、卵混合后需不断搅拌使其均匀分布,并在受精完成后转入100 L的塑料桶中进行充气孵化。
受精后,分别于20、40、60、80、100 min和2、3、6、9、12、18、24 h取样。取样时,过滤掉多余海水,将样品转入1.5 mL的离心管中(每个时间点取3管平行),加入4%多聚甲醛溶液(pH 7.4、0.1 mol·L-1PBS配制)固定,每隔2 h更换1次固定液,更换2次后,置于4℃冰箱内保存备用。
用于普通光学显微镜观察的样品直接滴在载玻片上,加盖玻片后,于LEICA DM4000光学显微镜下观察并拍照。用于荧光观察的样品在镜检前用0.1 mol·L-1PBS(pH 7.4)冲洗3次,再用Hoechst 33258荧光染料(江苏碧云天生物技术研究所)在黑暗环境下染色15 min后,用PBS冲洗3次,然后滴于载玻片上,滴加抗荧光淬灭剂后,用盖玻片封片,在LEICA DM4000荧光显微镜下观察、拍照。
1.2.3 胚胎早期发育
胚胎发育至D形幼虫时,停止曝气1 h,用300目筛绢选取上浮幼虫进行培养。幼虫培育环境条件为:水温22~24℃,盐度20~22,pH 8.3~8.4,每天换水2次,每次换水量50%,并投喂球等鞭金藻(Isochrysisgalbana),每4 h投喂1次,单次投喂量为每1 mL水体中投喂5×103个。在此期间,跟踪幼虫的生长和发育情况,方法如下:用筛绢筛取幼虫,用一次性滴管吸取样品置于透明载玻片上,于LEICA DM4000光学显微镜下拍照,并通过显微镜自带软件Toupview 3.7测量幼虫的壳长,用于幼虫日平均生长率的计算与分析,幼虫日平均生长率=(平均壳长增长量/发育天数)×100%。
2 结果与分析
2.1 近江牡蛎亲本性腺外观及切片观察
本实验获取的近江牡蛎性腺饱满,整个内脏团被乳白色性腺包围着,内脏团周围性腺厚度较厚,解剖刀刺破性腺表面,有白色、粘稠状液体流出,表明性腺已发育成熟(图1)。组织学观察结果表明,性腺滤泡体积大,滤泡中的大多数生殖细胞处于成熟期。雄性个体滤泡内存在大量成熟精子,排列紧密,滤泡壁周围有精原细胞出现,此时期的生殖带清晰可见,成熟的精子位于生殖带上(图2-A)。雌性个体的滤泡相互挤压,相互之间基本无空隙,滤泡呈多边形,其中排满大量成熟卵子(图2-B)。结合外观和组织切片观察,繁育用牡蛎性腺已达到成熟期。
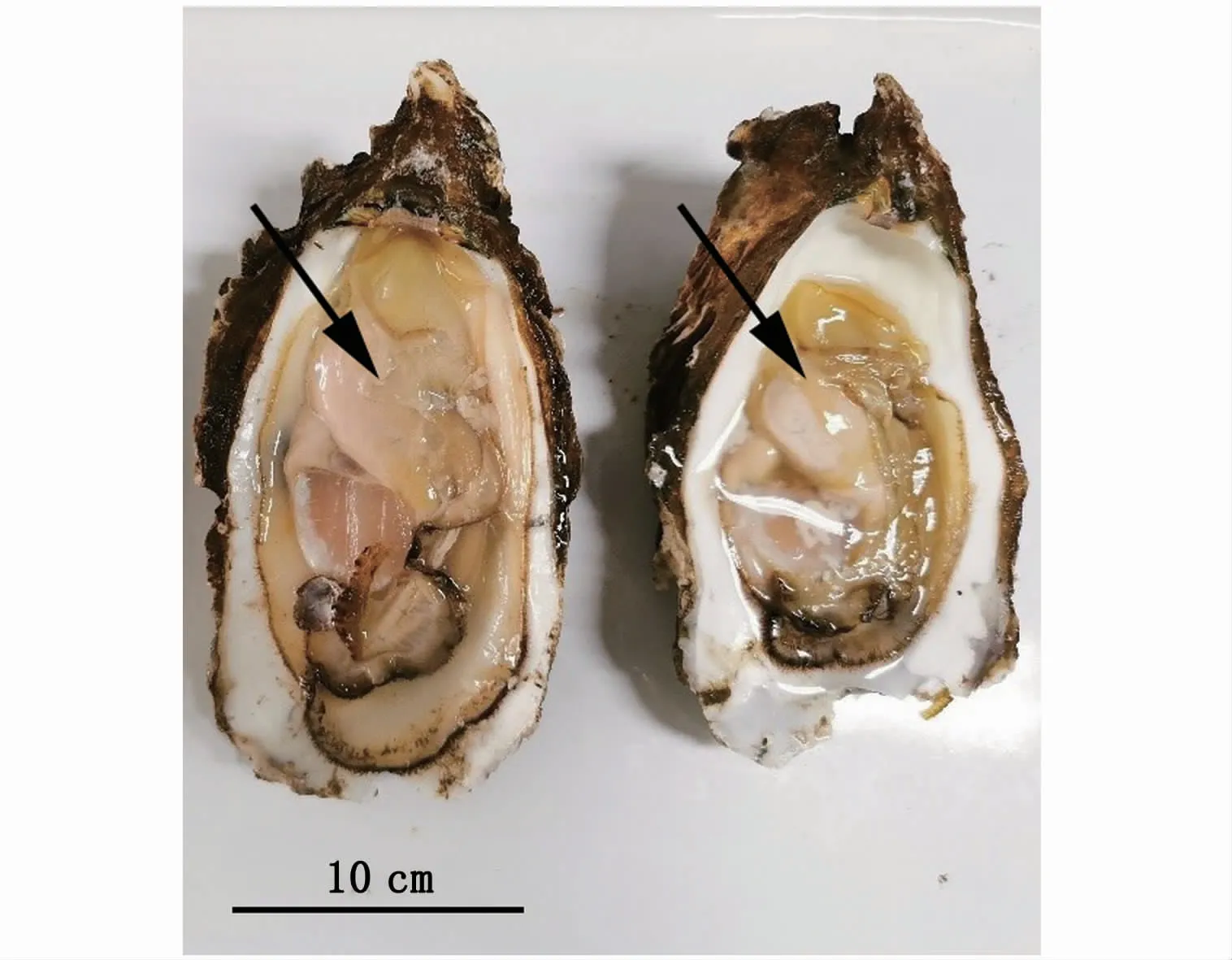
图1 近江牡蛎亲本性腺外观(×20)Fig.1 Appearance of gonads in parents of C.ariakensis(×20)
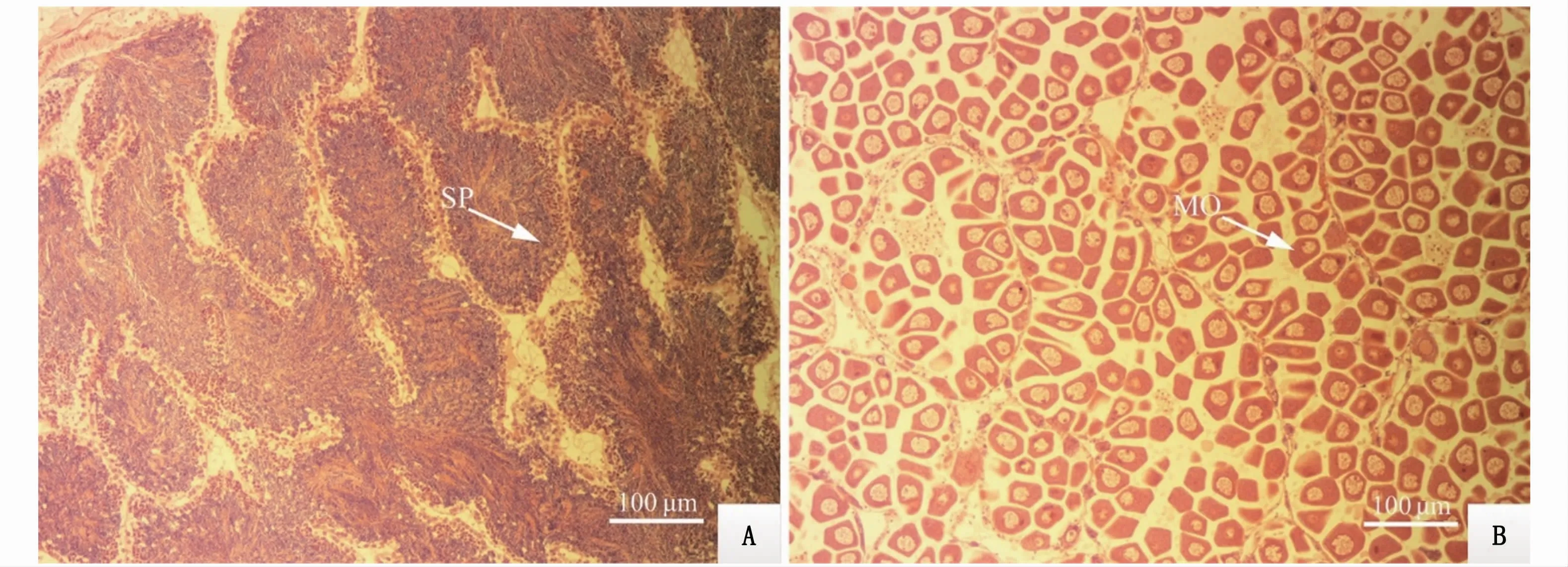
图2 近江牡蛎育苗亲本性腺切片显微观察(×10)Fig.2 Gonad section of parent C.ariakensis under m icroscope(×10)
2.2 近江牡蛎受精和早期发育过程
表1为近江牡蛎受精和早期发育过程中各个阶段的时间。

表1 近江牡蛎受精和早期发育过程中各个阶段的时间Tab.1 Time of insem ination and stages of early development for C.ariakensis
2.2.1 受精和早期卵裂过程
2.2.1.1 精子入卵过程
未受精的成熟卵细胞在未激活状态下呈卵圆形或梨形,卵径为50μm左右(图3-A)。在荧光显微镜下可以看到,成熟卵细胞染色体呈亮蓝色,卵质则为浅蓝色,染色体整齐地排列在赤道板上(图3-B);成熟精子头部的染色质呈亮蓝色荧光(图3-C)。精子在和卵细胞混合后摆动尾巴至卵子周围,通过顶体吸附在卵子表面(图3-D)。受精后5~10 min,精子头部在进入卵子细胞质后膨大成直径为4~5μm的圆球形精核,此时第一次成熟分裂开始(图3-E)。
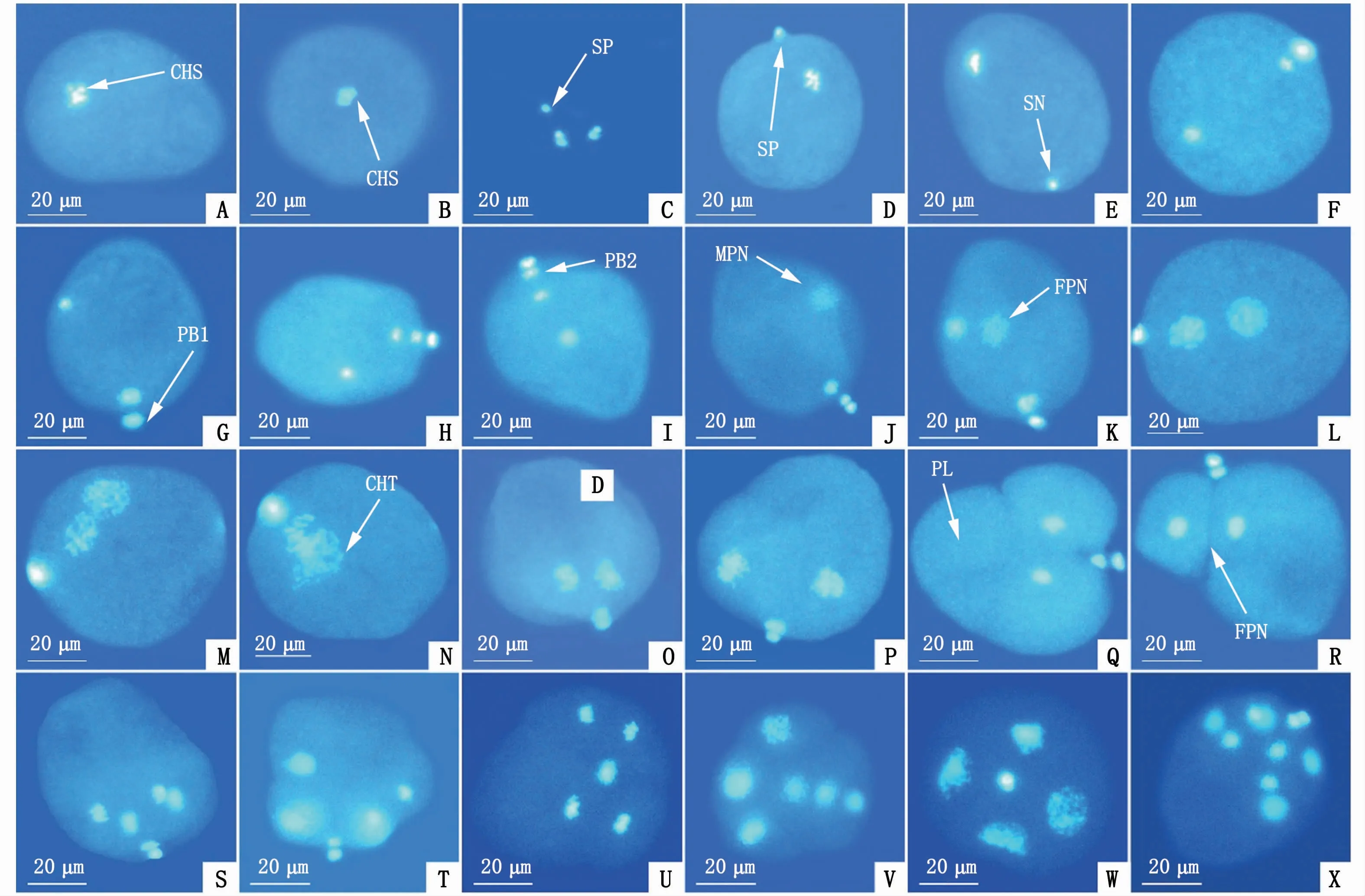
图3 近江牡蛎受精和早期卵裂过程核行为的荧光显微镜观察(×20)Fig.3 Nuclear behavior of fertilization and early cleavage in C.ariakensis under fluorescentm icroscope(×20)
2.2.1.2 两次成熟分裂过程
卵子在受精后10~15 min,其内位于赤道板上的同源染色体会在两侧纺锤丝的牵引下向卵膜移动,此时处于第一次成熟分裂后期(图3-F);受精后15~20 min,靠近卵膜一侧的染色体组不断向卵膜处移动,最终使卵膜拱起,第一极体形成并排出卵膜外,第一次成熟分裂完成(图3-G)。受精后20~25 min,在卵子赤道板上出现新排列的染色体组,染色体组在纺锤丝的牵引下向卵膜和反方向移动,第二次成熟分裂启动;受精后25~30 min,姐妹染色体分离后,卵膜一侧的染色体组浓缩形成第二极体,并向卵外排出,完成第二次成熟分裂,该过程产生的核相变化如图3-H,I所示。在整个过程中,精核位置、大小变化不明显。
2.2.1.3 雌、雄原核的形成
近江牡蛎卵细胞在受精后30 min左右,精核开始膨胀,最终形成松散的团状核物质,即雄原核,且雄原核体积远大于精核(图3-J)。核相卵子中的另一组染色体也开始膨胀形成松散的团状核物质,即雌原核(图3-K)。雌原核的位置靠近极体,它的形成要晚于雄原核。
2.2.1.4 第一次卵裂
受精后45 min左右,雌、雄原核相互靠近(图3-L),并向卵子中间位置移动(图3-M),但不融合,雌、雄原核染色丝凝集,呈现出两个独立的染色体组,并在赤道板上以染色体联合的方式结合,此时处于第一次卵裂中期(图3-N)。
然后,排列于赤道板上的染色体组在纺锤丝的牵引下向受精卵两极移动,此时受精卵处于第一次卵裂后期(图3-O)。与此同时,受精卵形状也发生显著变化,细胞向两极横向拉伸,极叶伸出(图3-P),随着染色体继续分离,极叶突出,染色体处于两个卵裂沟内,受精卵呈三叶状,进入三叶期(图3-Q)。
受精后60 min,极叶收缩,卵细胞自极体生成处形成一大一小2个卵裂球,其中大卵裂球上还可以看到未完全缩回的极叶,最终极叶全部回缩消失,卵裂沟清晰可见(图3-R),此时第一次卵裂完成,受精卵处于2细胞时期(图3-R)。
2.2.1.5 第二、三次卵裂
受精后75 min,2个卵裂球开始分裂(图3-S),染色体组向两极移动,至第二次卵裂中期分裂相形成(图3-T),各自分裂出一大一小的卵裂球(图3-U)。受精后1.5 h,卵裂球分裂基本结束,最终形成4个卵裂球,卵裂沟明显,此时进入4细胞时期(图3-V)。4个卵裂球内染色体逐渐变成染色质,并形成新的核膜,为第三次卵裂做准备。
2.2.1.6 多精入卵现象
在近江牡蛎受精发育过程中,观察到一些多精入卵现象。在多精受精的卵子中,入卵精子数多在2~5个,甚至更多。当2~3个精子同时进入卵细胞,大多不影响后续的成熟分裂过程,但后期发育无法进行。而当入卵精子数目较多时,分裂就会被抑制。多个精子入卵后会形成精核,精核膨胀为雄原核,多个雄原核各自形成染色体组,同时与雌性原核进行染色体联合,最终导致多个染色体组因无法平均分到两个子细胞中,发生染色体分离紊乱,该现象被称为多极分离(图3-W,S)。
2.2.2 早期胚胎发育光学显微镜观察
2.2.2.1 桑葚期、囊胚期和原肠期阶段
在受精后6 h左右,受精卵经过多次有丝分裂进入桑葚期(图4-E),此时细胞界限相较于2细胞期、4细胞期较为模糊,胚胎内部无空腔。受精后的8~10 h,胚胎发育进入囊胚期(图4-F),胚胎上开始逐渐出现微小的纤毛,纤毛摆动时胚胎会有小幅的运动现象。随后进入原肠期(图4-G),胚胎的植物极细胞内陷,胚胎仅能作小范围的顺时针旋转运动。
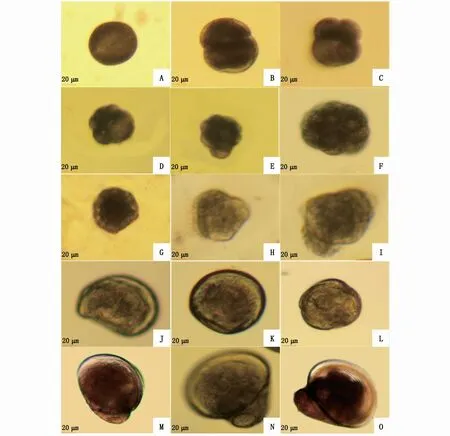
图4 近江牡蛎早期胚胎和幼体发育普通光学显微镜观察(×20)Fig.4 Development of early embryos and larvae of C.ariakensis under ordinary opticalm icroscope(×20)
2.2.2.2 担轮幼虫
受精后12~15 h,胚胎发育成担轮幼虫,担轮幼虫前期形状近圆形,一侧纤毛增多,通过纤毛摆动做回旋运动(图4-H),随后顶板逐渐变为椭圆形,生出的壳腺分泌物质形成壳,包裹在幼虫外(图4-I)。
2.2.2.3 D形幼虫
受精后27~30 h,进入到D形幼虫阶段(图4-J)。
2.2.2.4 壳顶幼虫
经过5 d左右的发育,幼虫发育至壳顶幼虫阶段,此时壳长达(82.40±4.48)μm。壳顶幼虫前期,壳顶稍微突起(图4-K),开始长出纤毛。当发育到壳顶幼虫中期时,壳顶突出明显,纤毛多而密;受精15 d左右进入壳顶幼虫后期,此时幼虫的壳顶突出更明显,壳长已达到(143.20±5.11)μm(图5),两壳形状大小不对称,一侧稍大于另一侧(图4-L)。
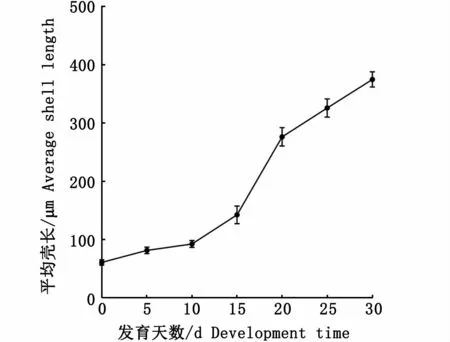
图5 近江牡蛎幼虫壳长生长情况Fig 5 Grow th in shell length of C.ariakensis larvae
2.2.2.5 眼点幼虫
受精后17 d左右,部分幼虫开始出现眼点,此时幼虫发育至眼点幼虫时期(图4-M)。受精后20 d左右的眼点幼虫壳长为(276.60±15.70)μm(图5)。
2.2.2.6 附着幼虫及稚贝
受精后22 d左右,胚胎发育至附着幼虫时期,个体基本成型,开始营底栖爬行生活(图4-N)。底栖后,附着幼虫很快变态为附着稚贝(图4-O)。到受精后的33 d时,幼虫已大多变态为稚贝,壳长达(374.80±12.99)μm。
2.2.2.7 幼虫壳长生长状况
近江牡蛎幼虫壳长在前10 d变化较小,10日龄幼虫平均壳长为93.4μm,该时期的日平均生长率为3.16μm·d-1(图5)。10~20 d幼虫快速生长,其中15~20 d壳长变化最快,日平均增长率达26.68μm·d-1。20日龄的眼点幼虫的平均壳长为276.60μm。20~30日龄幼虫壳长增速放缓,日平均增长率为9.82μm·d-1。
3 讨论
3.1 近江牡蛎受精细胞学特点
在双壳贝类的受精过程中,根据受精发生时卵细胞所处的状态,可将其大致分为两类:第一类是,排放的卵子处于第一次成熟分裂前期或中期,受精后卵细胞的生发泡消失,而后再进行减数分裂,属于该种受精方式的有大西洋浪蛤(Spisula solidissima)、宽壳全海笋(Barnea dilatata)、长牡蛎(C.gigas)等[19-21];另一类则是受精发生在第一次减数分裂中期,生发泡已破裂,精子入卵后减数分裂过程重新启动,属于这一类的有泥蚶(Tegillarcagranosa)、文蛤(Meretrix meretrix)、栉孔扇贝(Chlamysfarreri)、皱纹盘鲍(Haliotisdiscushannai)、紫贻贝(Mytilusedulis)、合浦珠母贝(Pinctada martensii)和毛蚶(Scapharcasubcrenata)等[12,15,22-25]。本研究观察发现,近江牡蛎属于第一种类型,其未受精成熟卵子呈梨形,核相处于第一次成熟分裂中期,生发泡破裂发生在受精后,精子入卵前生发泡完整,精子入卵后分裂启动。近江牡蛎精子入卵无固定位置,其是通过顶体反应在卵表面随机入卵。实验中还观察到,近江牡蛎的卵子为均黄卵,在受精后才能区分具体的动植物极。
雌、雄原核形成的先后顺序在不同双壳贝类中存在一定的差异。在栉孔扇贝、合浦珠母贝、毛蚶中,雄原核的形成要早于雌原核,而太平洋牡蛎(Crassostreagigas)的雌、雄原核几乎是同时形成的[26]。本研究中,近江牡蛎的雄性原核形成早于雌性原核且比雌性原核的体积要大一些。双壳贝类的雌、雄原核的结合方式也可分为两种,一种是原核联合的结合方式,另一种为原核融合的结合方式。本研究发现,近江牡蛎受精卵细胞雌、雄原核形成于第二次成熟分裂后期,两原核相互靠拢时,有核膜存在,因此推断其雌、雄原核结合方式为原核联合。
3.2 多精入卵现象
虽然近江牡蛎本身具有防止多精入卵的机制,即精子入卵后,卵子会阻止其他精子附着,但本研究发现,近江牡蛎北方群体在温度22~24℃、盐度20~22的环境下进行人工授精的过程中,仍存在少数多精入卵的现象。多个精子进入卵子后,受精卵中的雄原核与雌原核会发生多个原核联合,此时多个染色体组共存,细胞内同时形成多级纺锤体,导致卵细胞不能正常分裂,最终造成胚胎发育畸形乃至死亡。研究表明,双壳贝类多精入卵现象与精卵质量、精卵浓度以及外界的受精环境因素等有很大关系[12]。近江牡蛎作为广温广盐性经济贝类,人工育苗正处在温度和盐度变化较大的时期,因此开展温度、盐度对近江牡蛎影响的研究可以推动其人工繁育技术的发展。
3.3 近江牡蛎胚胎发育阶段特点
在适宜温度范围内,不同品种的牡蛎幼虫发育速度存在一定的差异。近江牡蛎在水温22~24℃、盐度20~22的环境条件下,受精卵经27~30 h发育到D形幼虫,比太平洋牡蛎(22~23 h,20~22℃)、熊本牡蛎(C.sikamea)(17 h,27~28℃)、葡萄牙牡蛎(C.angulata)(16 h,25.3℃)、岩牡蛎(C.nippona)(18~20 h,22℃)发育到D形幼虫所需的时间长[26-29]。在其他双壳贝类中,幼虫发育速度也不同,如缢蛏和小刀蛏(Phaxasattenuatus)在水温为24~26℃环境中,经过24 h发育至D形幼虫时期[30-31];青蛤在水温28℃时,经16 h发育成D形幼虫[30]。综上所述,近江牡蛎的幼虫发育速度低于大多数双壳贝类。
眼点幼虫作为幼虫发育和附着变态的关键时期,因其生活水体环境复杂,可能受温度、盐度和饵料等因素的影响。如长牡蛎在20~22℃的条件下,经18 d幼虫出现眼点,壳长为270~320 μm[24];熊本牡蛎在温度26~27℃、盐度28~30条件下,发育到16 d时,壳长达到320~330μm,有个别幼虫出现眼点[27];岩牡蛎幼体在25℃下发育到14~16 d,壳长达到290~320μm,开始出现眼点[29];葡萄牙牡蛎幼虫培育14~21 d,壳长达到310~330μm,开始出现眼点[28]。在本研究中,近江牡蛎在水温22~24℃、盐度20~22的环境条件下,经17 d左右幼虫开始出现眼点,与上述贝类相似。推测贝类发育时间可能与育苗的温度和盐度有一定的关系。已有研究证明,盐度和温度均会影响牡蛎幼虫的存活与生长,幼虫存活率随盐度的升高而降低,而高温会造成幼虫的大量死亡,低温则会影响幼虫的生长[33-35]。在本研究中,近江牡蛎幼虫培育前期较后期生长缓慢,这与吕晓燕[27]和刘鲁雷[36]的研究结果类似,说明近江牡蛎在发育至眼点幼虫时期后进入快速生长阶段。
